Similar presentations:
Растворы. Лекция №4
1.
ГОУ ВПО «Донбасская Национальная академия строительства иархитектуры»,
кафедра «Прикладная химия»
Курс лекций по дисциплине «Химия»
для студентов 1 курса
Направление подготовки – 08.03.01 Строительство
Составил:
Ташкинов Ю.А.
Макеевка, 2019
1
2.
23.
34.
Способы выражения концентраций4
5.
Способы выражения концентраций5
6.
Способы выражения концентраций6
7.
Способы выражения концентраций7
8.
Коллигативные свойства растворов8
9.
Якоб Хендрик Вант-Гофф(нидерл. Jacobus Henricus (Henry)
van 't Hoff; 30 августа 1852,
Роттердам — 1 марта 1911,
Берлин) — голландский химик,
первый лауреат Нобелевской
премии по химии (1901 год) «В
знак признания огромной
важности открытия законов
химической динамики и
осмотического давления в
растворах».
9
10.
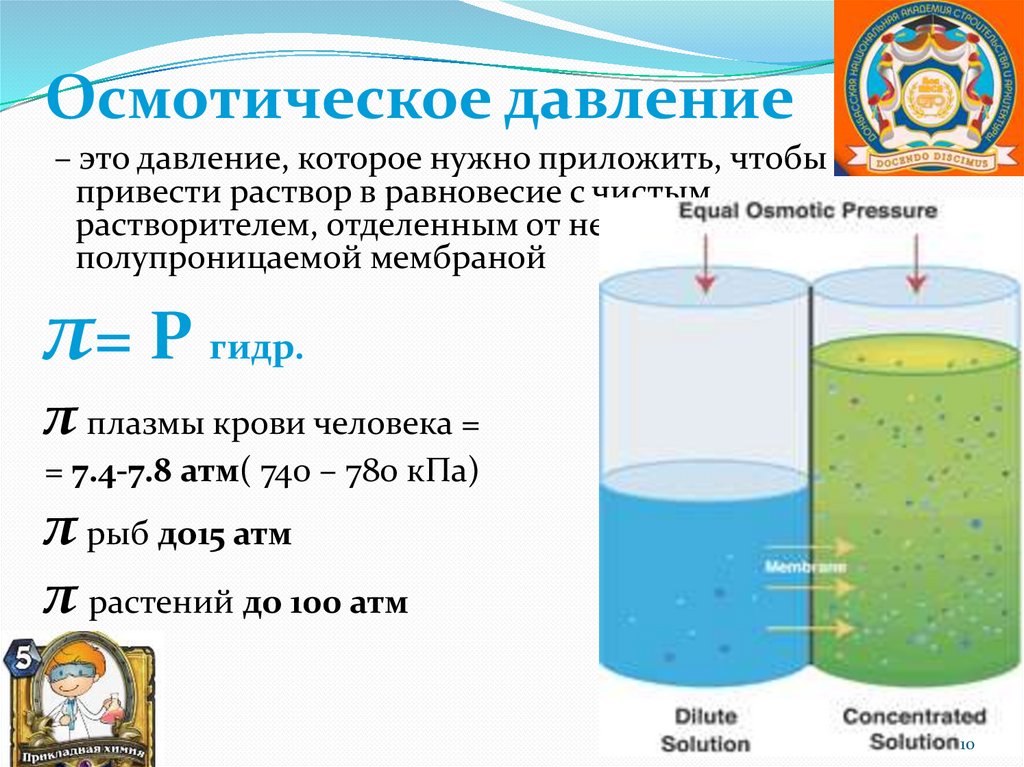
Осмотическое давление– это давление, которое нужно приложить, чтобы
привести раствор в равновесие с чистым
растворителем, отделенным от него
полупроницаемой мембраной
π= Р гидр.
π плазмы крови человека =
= 7.4-7.8 атм( 740 – 780 кПа)
π рыб до15 атм
π растений до 100 атм
10
11.
Закон Вант – Гоффаπ = См R T
П – осмотическое давление (кПа)
R – универсальная газовая постоянная
8,31 (л*кПа/моль*К)
T - абсолютная температура (К)
См – молярная концентрация (моль/л)
P = n/V RT или PV = nRT
11
12.
Изотонический коэффициентi
(коэффициент Вант - Гоффа )
i показывает, во сколько раз истинная
концентрация кинетически активных частиц в
растворе электролита больше, чем в растворе
неэлектролита с той же концентрацией
π = iСм R T
i = 1 для НЕЭЛЕТРОЛИТов
i = n для сильных электролитов
NaCl
Na+ + Cl- i = 2
i = 1 + α(n-1) для слабых электролитов
Cэл эл.
t зам. эл.
tкип. эл.
i
Cнеэл неэл. t зам. неэл. tкип. неэл.
12
13.
Франсуа Мари Рауль (фр. François-MarieRaoult; 10 мая 1830, Фурн-ан-Веп, Нор, — 1
апреля 1901, Гренобль) — французский
химик и физик, член-корреспондент
Парижской академии наук (1890).
С 1867 — в Гренобльском университете
(профессор с 1870). Член-корреспондент
Петербургской АН (1899). Исследуя в 1882—
88 понижение температуры кристаллизации,
а также понижение давления пара (или
повышение температуры кипения)
растворителя при введении в него
растворённого вещества, открыл закон Рауля,
применяемый для определения
молекулярных масс веществ в растворённом
состоянии.
13
14.
Закон Рауля(1886)
Относительное понижение давления
насыщенного пара растворителя над раствором
нелетучего неэлектролита пропорционально мольной доле
растворенного вещества
P0 - давление насыщенного пара над чистым растворителем, Па
P – давление насыщенного пара растворителя над раствором , Па
N2 - мольная доля растворенного вещества
a
0
A
A
a
b
p p
N раств.в ва
0
p
n
N
, N NB 1
n n
14
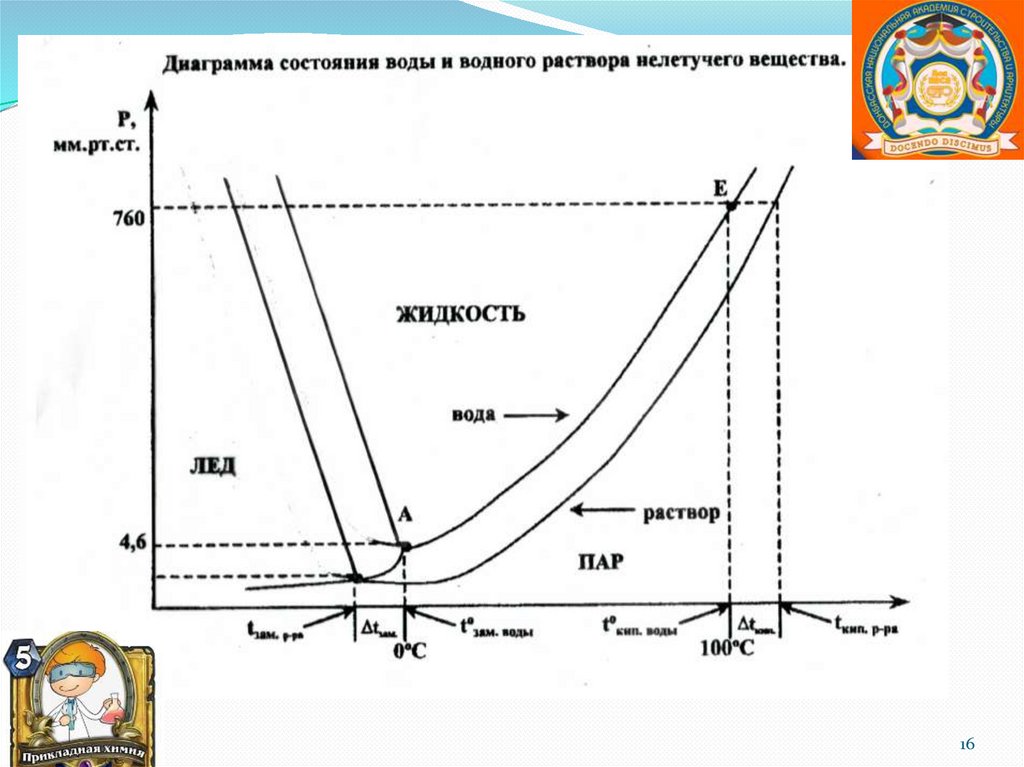
15.
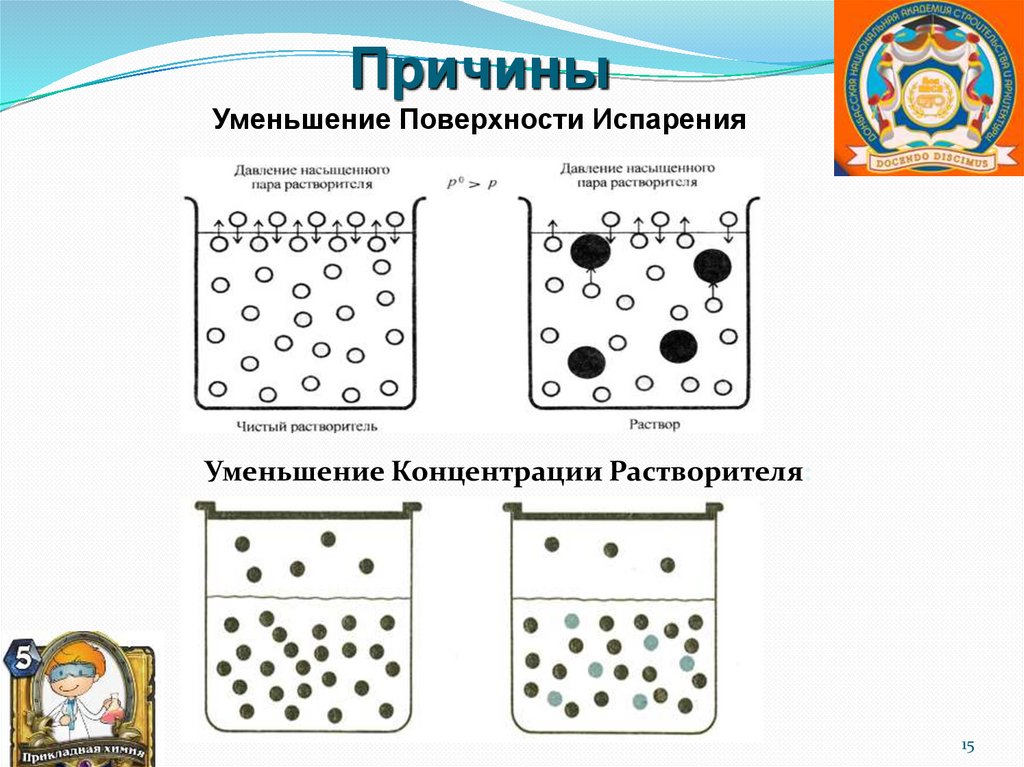
ПричиныУменьшение Поверхности Испарения
Уменьшение Концентрации Растворителя:
15
16.
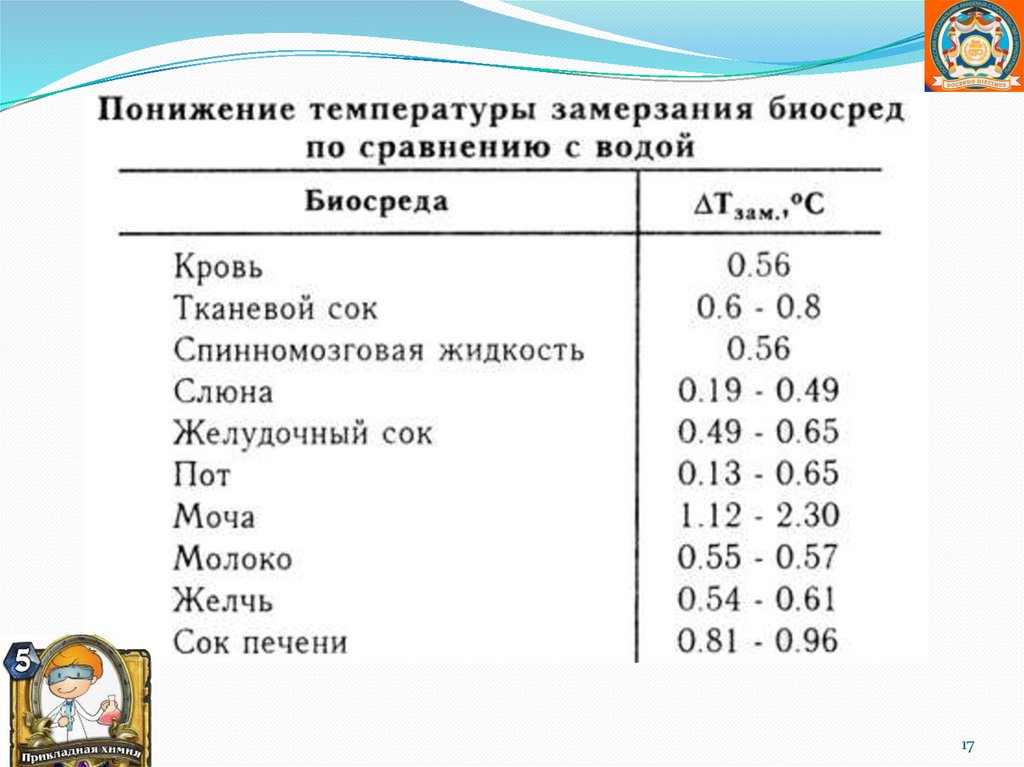
1617.
1718.
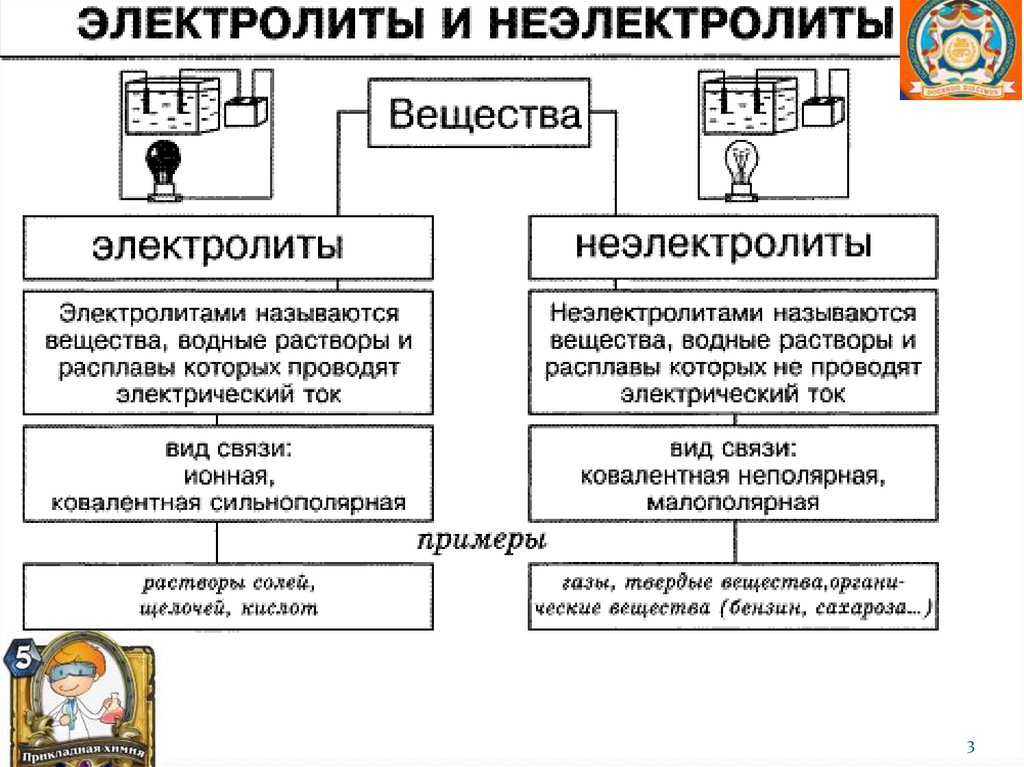
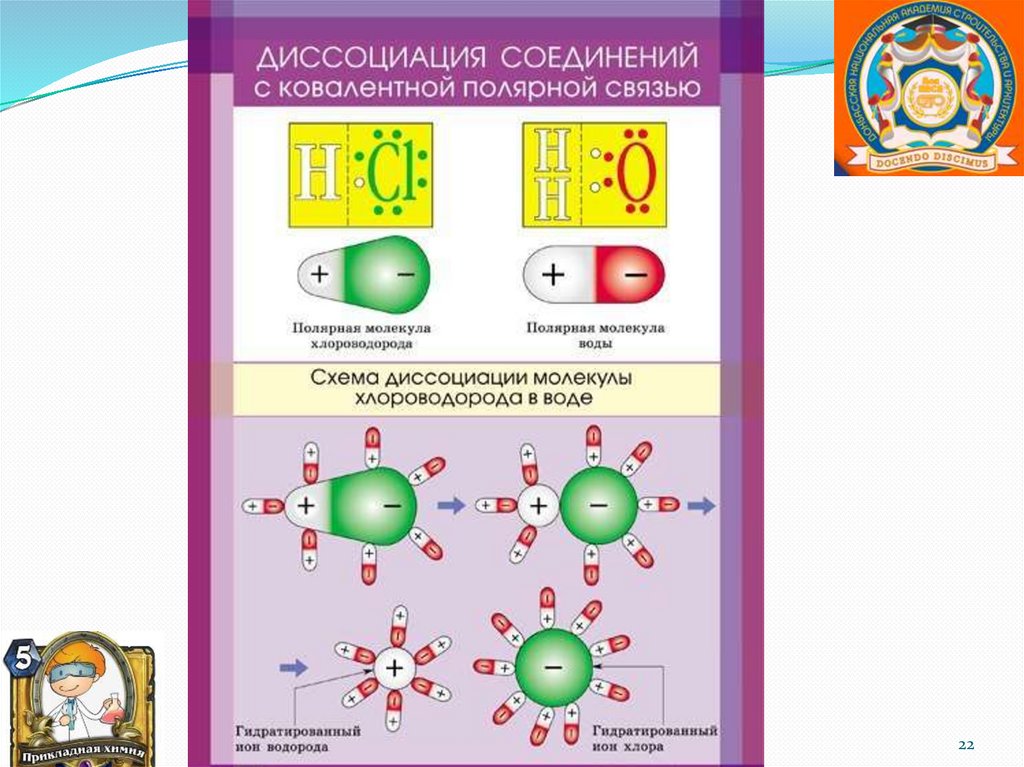
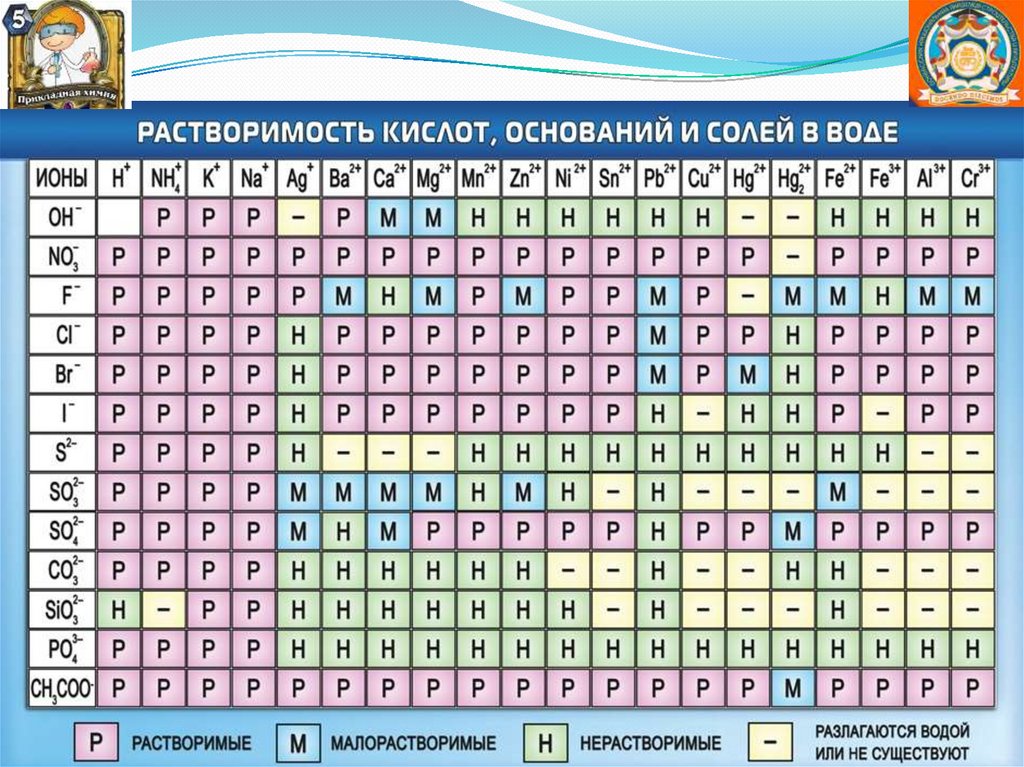
Электролиты – это вещества, способные врастворах и расплавах диссоциировать на
ионы. К ним относятся соединения с
ионным и ковалентным полярным типом
связи: соли, кислоты, основания, вода.
Самопроизвольный распад электролитов на
ионы, протекающий под воздействием
растворителя, называется
электролитической диссоциацией, теория
которой была создана в 1884-1887 г.г.
шведским ученым С. Аррениусом.
19.
Шведский физикохимик, основныеработы которого
посвящены учению о
растворах
электролитов и
кинетике
химических
реакций. Лауреат
Нобелевской премии
Сванте
Аррениус
(1903)
(1859-1927)
19
20.
=C продиссоциированных
_________________
C всех молекул
Степень диссоциации
α зависит от:
- Природы растворителя и растворенного
вещества
- Температуры
- Концентрации раствора
- Наличия в растворе одноименных ионов
20
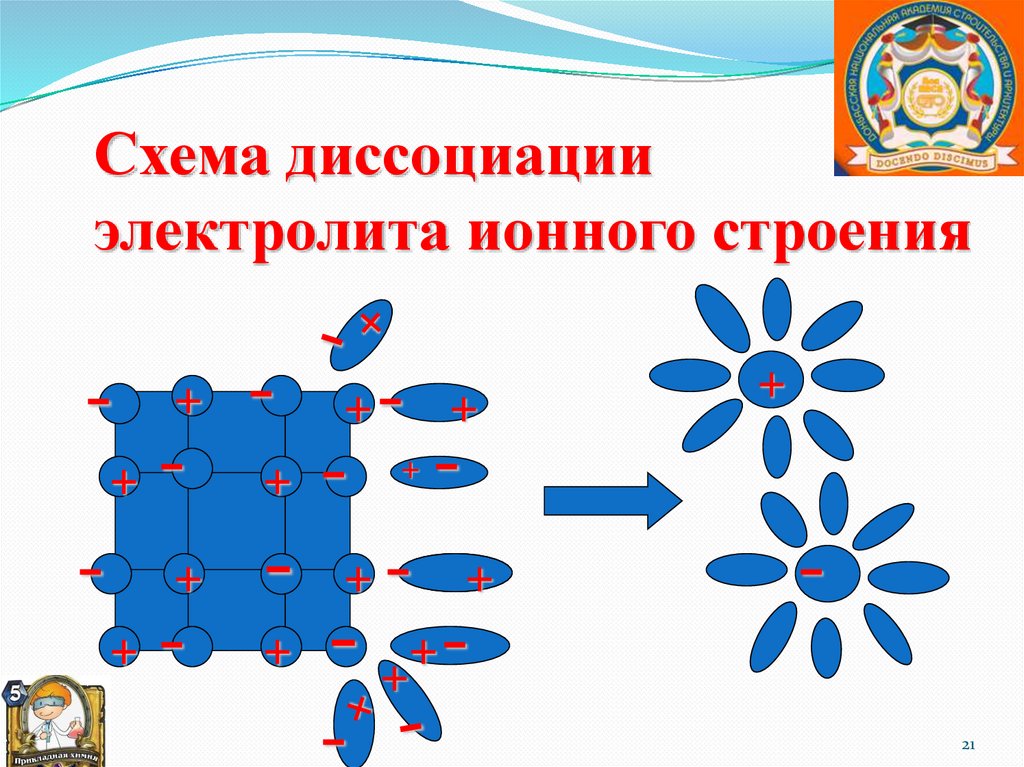
21.
Схема диссоциацииэлектролита ионного строения
+
-
+
+
+
-
+
+
+- +
-
+
-
+- +
++
-
+
21
22.
2223.
Условия протеканияреакции
образование осадка
образование газообразного продукта реакции
образование более слабого электролита, чем
исходные вещества: например, воды
23
24.
2425.
2526.
Теория слабых электролитовК слабым электролитам относятся ковалентные
соединения, обратимо (частично) диссоциирующие
в водных растворах.
К ним относятся:
а) почти все органические и многие неорганические
кислоты: H2S, H2SO3, HNO2, HCN, и др;
б)труднорастворимыи основания, а также NH4OH
в) некоторые соли HgCl2, Fe(CNS)3;
г) вода.
26
27.
Классификация кислотСильные кислоты
иодоводород
HI
ная
бромоводоро
HBr
дная
HCl
соляная
H2SO
серная
Их соли
йодид
бромид
хлорид
сульфат
4
HNO3
Азотная
(сильный
окислитель!)
нитрат
Слабые кислоты
Их соли
фтороводор
HF
фторид
одная
(орто)фосф (орто)фосф
H3PO4
орная
ат
H2SO3
сернистая
сульфит
сероводоро
H2S
сульфид
дная
H2CO3
угольная
карбонат
H2SiO3
кремниевая
силикат
HNO2
CH3COOH
азотистая
Уксусная
нитрит
ацетат
27
28.
Н2О =+
Н
+
ОН
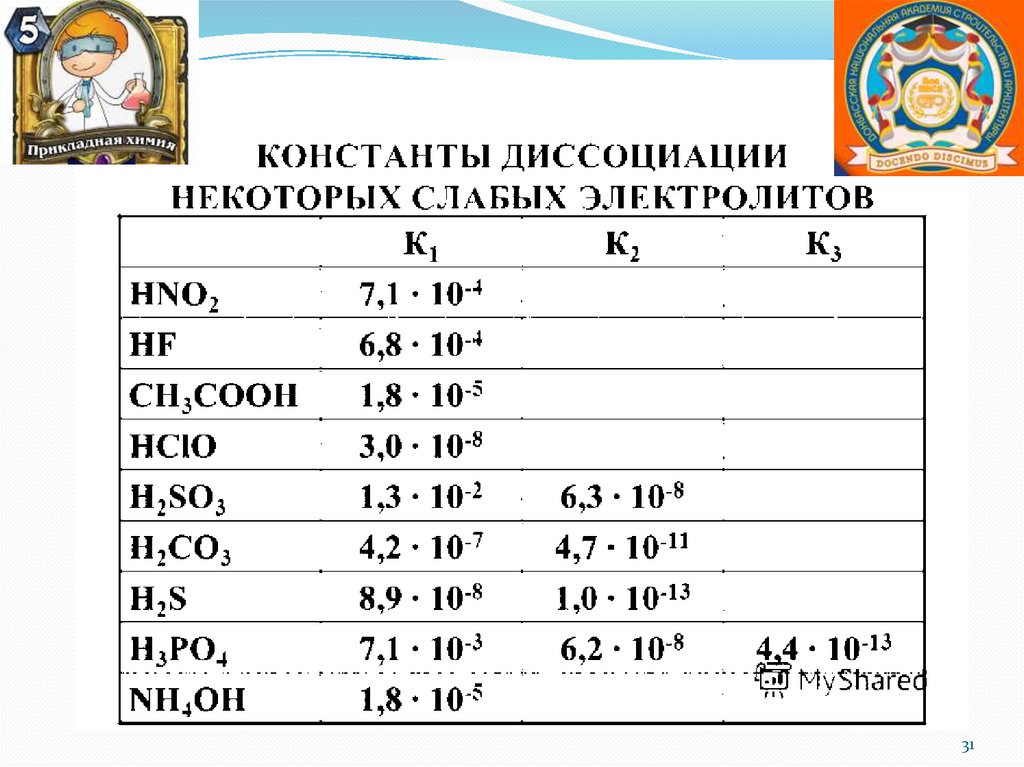
Константа диссоциации –
константа равновесия
к
Н2О =
Константа диссоциации К зависит
от:
природы электролита
температуры
28
29.
Слабые электролитыподчиняются закону
разбавления
Оствальда,
получившего
Нобелевскую премию
в 1909 за работы в
области химического
равновесия.
Ф.В.Оствальд
(1853-1932)
29
30.
Вывод закона разбавленияОствальда
C
С С
-
C
CH 3COOH
CH 3COO H
[CH3COO ][H ] C C C
Кд
[CH3COOH]
C C 1
При <<1
2
К д C·α2
α К д /С
30























 chemistry
chemistry








