Тұздар гидролизі
1.
Тұздар гидролизі2.
Тұздар гидролизі- тұздың қүрамындағыиондары мен су молекулаларының арасында
жүретін , нәтижесінде әлсіз электролит
молекуласы не иондары түзілетін
реакциялар.
Тұздардың гидролизге ұшырауы және
олардың судағы ерітіндісіндегі ортасы
тұздың құрамындағы иондардың
қасиеттеріне тәуелді.
3.
Тұздар гидролизі4.
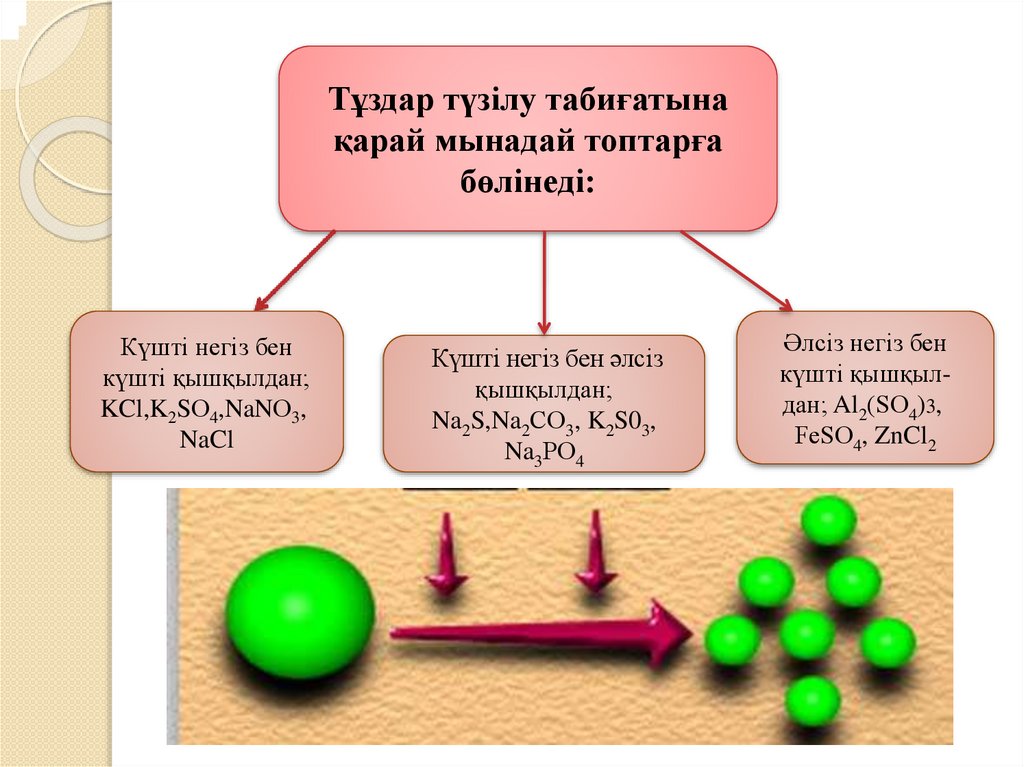
;Тұздар түзілу табиғатына
қарай мынадай топтарға
бөлінеді:
Күшті негіз бен
күшті қышқылдан;
KCl,K2SО4,NaNО3,
NaCl
Күшті негіз бен әлсіз
қышқылдан;
Na2S,Na2CО3, K2S03,
Na3PО4
Әлсіз негіз бен
күшті қышқылдан; Al2(SО4)3,
FeSО4, ZnCl2
5.
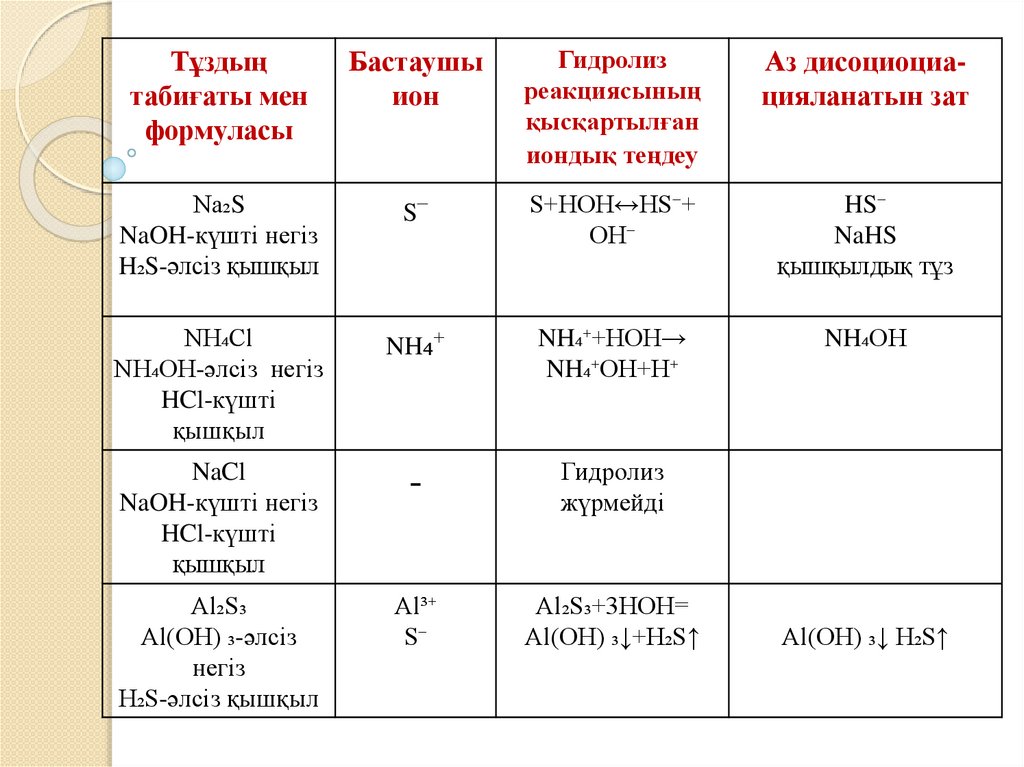
Тұздыңтабиғаты мен
формуласы
Бастаушы
ион
Гидролиз
реакциясының
қысқартылған
иондық теңдеу
Аз дисоциоциацияланатын зат
Na₂S
NaOH-күшті негіз
H₂S-әлсіз қышқыл
S⁻
S+HOH↔HS⁻+
OH⁻
HS⁻
NaHS
қышқылдық тұз
NH₄Cl
NH₄OH-әлсіз негіз
HCl-күшті
қышқыл
NH₄⁺
NH₄⁺+HOH→
NH₄⁺OH+H⁺
NH₄OH
NaCl
NaOH-күшті негіз
HCl-күшті
қышқыл
-
Гидролиз
жүрмейді
Al₂S₃
Al(OH) ₃-әлсіз
негіз
H₂S-әлсіз қышқыл
Al³⁺
S⁻
Al₂S₃+3HOH=
Al(OH) ₃↓+H₂S↑
Al(OH) ₃↓ H₂S↑
6.
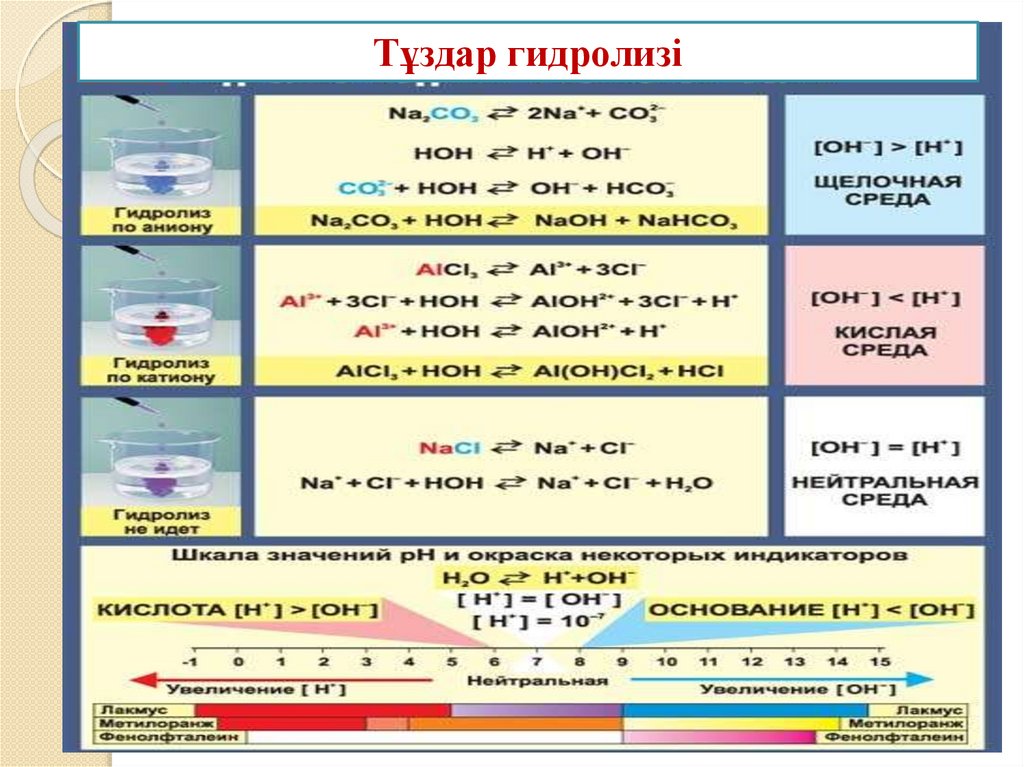
1. Әлсіз негізбен күшті қышқылдан түзілген тұздаргидролизденеді.
NH4CI + HOH ↔ NH4OH + HCI қайтымды процесс.
NH4+ + CI- + HOH ↔ NH4OH + H+ + CINH4+ + HOH ↔ NH4OH + H+
орта қышқылдық
Ортаның өзгеруі тұз ионының сумен әрекеттесуінің нәтижесінде
пайда болады.
2. Күшті негізбен әлсіз қышқылдан түзілген тұздар
гидролизденеді
Na2 CO3 + HOH ↔ NaHCO3 + NaOH
2Na + + CO32- + HOH ↔ Na+ + HCO3- + Na + + OHCO32- + HOH ↔ HCO32- + OHОрта сілтілік
3. Әлсіз негізбен әлсіз қышқылдан түзілген тұздар
гидролизденеді.
Бұл жағдайда гидролиз реакциясы соңына дейін жүріп, қышқыл
мен негіз түзіледі. Яғни гидролиз реакциясы қайтымсыз болады:
AI2S3 + 6H2O → 2AI(OH)3↓ + 3H2S↑ орта бейтарап.
4. Күшті қышқылмен күшті негізден түзілген тұздар гидролизге
ұшырамайды.
7.
Кез келген ерітіндінің ортасының қышқылдығын,сілтілігін, нейтралдығын анықтайтын құрал қолданылады.
Сутектік көрсеткіш дегеніміз теріс таңбамен алынған
сутегі иондарының концентрациясының ондық
логарифмін айтады.
pH = - lg [ H+] Сутектік көрсеткіш түсінігін
1909 жылы дат химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы былай
сипатталады:
нейрал рН = 7, қышқыл рН < 7, сілті рН > 7
8.
9.
ҚорытындыКүшті негіз бен күшті қышқылдан түзілген тұз сумен
әрекеттеспейді (гидролизге ұшырамайды). Орта
бейтарап қалпын сақтайды.
Әлсіз негіз және күшті қышқылдан түзілген тұз
құрамындағы металл катионы гидроксид ОН-ионымен
байланысатындықтан, ерітіндіге Н+ иондары жиналып
қышқылдық орта береді.
Күшті негіз бен әлсіз қышқылдан түзілген тұз
анионы сутек катионымен Н+ байланысатындықтан,
ерітіндіге ОН- иондары жиналып сілтілік орта береді.
Әлсіз негіз бен әлсіз қышқылдан түзілген тұз
құрамындағы иондар Н+ және ОН- иондарымен
байланысатындықтан, гидролиздену реакциясы соңына
дейін жүреді.
10.
ТапсырмаБерілген тұздардың:
Na2SO4, Cu(NO3)2, K2S, ZnSO4, Na2СO3
ортасын анықтап, гидролиз реакциясының
теңдеуін жаз
11.
Кім жылдам?1. Су молекулалары әсерінен әлсіз
электролит иондары не молекулалары түзіле
жүретін реакциялар
2. Гидролизге ұшырамайтын тұздар
3. Толығымен гидролизденетін тұздар
4. Гидролездену нәтижесінде қышқылдық
орта беретін тұздар
5. Гидролездену нәтижесінде негіздік орта
беретін тұздар
6. Күшті қышқыл және күшті негіз
арасындағы алмасу реакциясы
12.
Жауаптары1. Тұздар гидролизі
2. Күшті негіз және күшті қышқыл
тұздары
3. Әлсіз қышқыл мен әлсіз негіз
тұздары
4. Күшті қышқыл мен әлсіз негіз тұзы
5. Күшті негіз және әлсіз қышқыл тұзы
6. Бейтараптану реакциясы









 chemistry
chemistry