Similar presentations:
Тұздар гидролизі
1. Тұздар гидролизі
2.
Кейбіртұздардың
суда
диссоциацияланғанда
түзілген
гидраттанған катиондары немесе
аниондарының су молекуласымен
сәйкесінше
қышқылды
немесе
сілтілі
орта
түзе
әрекеттесуі
тұздардың гидролизі деп аталады.
3.
Сандықжағынан гидролизді
гидролиздену дәрежесі (h) арқылы
өрнектейді
h=гидролизденген молекулар саны
молекулалардың жалпы саны
Температураны
арттырып және ерітінді
сұйылту арқылы гидролиздену
дәрежесін өсіруге болады.
4.
Гидролиз процесіне құрамында әлсіз қышқылнемесе әлсіз негіздің иондары бар тұздар
ғана түседі. Ал күшті қышқылдар мен күшті
негіздердің әрекеттесуінен түзілген тұздар
(NaCl,
KNO3,
BaCl2
және
т.б.)
гидролизденбейді.
Себебі,
олардың
гидраттанған иондары су молекуласымен
әрекеттеспейді және нәтижесінде әлсіз
электролит түзілмейді.
5.
Тұздардың табиғатына байланысты үш түрлігидролиздену реакциясы болады:
1. Күшті қышқыл мен әлсіз негіздің әрекеттесуінен түзілген тұздардың CuCl2, NH4Cl,
Al2(SO4)3 және т.б. гидролизі. Бұл жағдайда гидролиз реакциясына, яғни тұздың
құрамындағы гидраттанған катион мен су молекуласы әрекеттеседі де, нәтижесінде түзілген
оксоний ионына байланысты ерітінді қышқылды (рН < 7) болады. Мысалы AlCl3 тұзы суда
ерігенде диссоциацияланып, иондарға толық ыдырайды:
Диссоциациялану теңдеуі:
AlCl3 → Al3+ + 3ClHOH → H+ + OH
Al3+ + 3Cl- + HOH → Al(OH)2+ + H+ + 3ClГидролиз реакциясының иондық теңдеуі:
Al3+ + 3Cl- + HOH → Al(OH)2+ + H+ + 3ClГидролиз реакциясының молекулалық теңдеуі:
AlCl3 + H2O → Al(OH)Cl2 + HCl
Ерітіндіде Al3+ ионы су молекуласынан гидроксид-ионды OH- оңай қосып алып, өте нашар
диссоциацияланатын (Al(OH)3-ке қарағанда) Al(OH)2+ ионына ауысады. Мұның нәтижесінде
судың келесі молекуласы диссоциацияланады. Сонымен, ерітіндіде сутегі иондарының
көбеюіне әсер етеді.
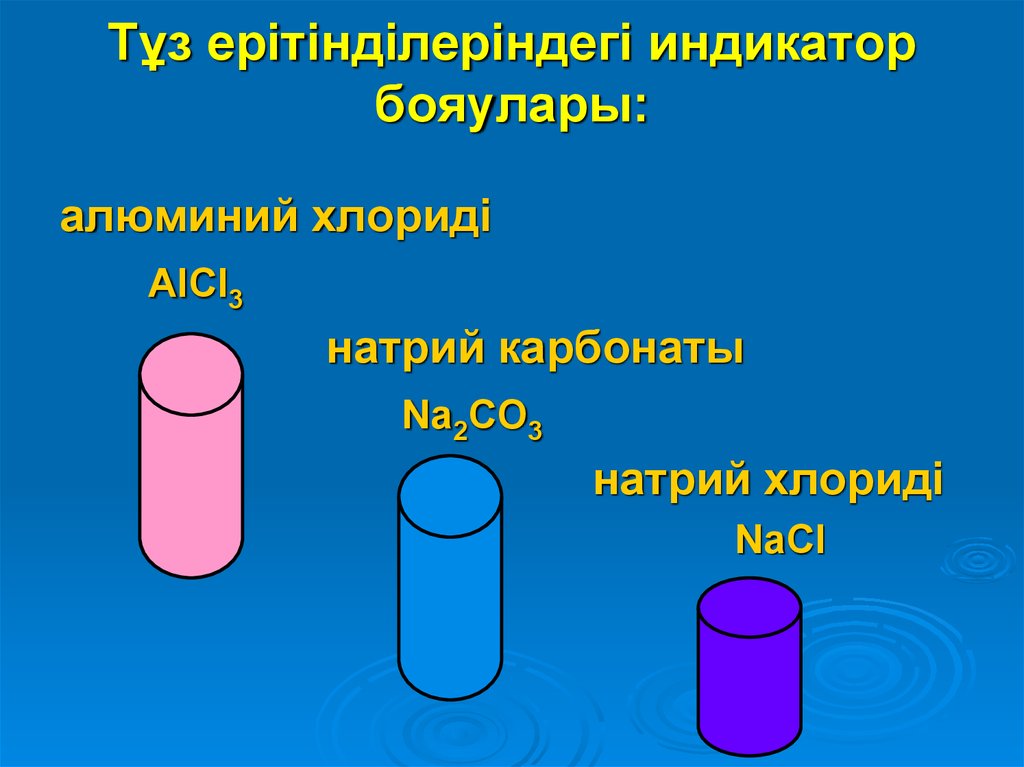
6. Тұз ерітінділеріндегі индикатор бояулары:
алюминий хлоридіAlCl3
натрий карбонаты
Na2CO3
натрий хлориді
NaCl
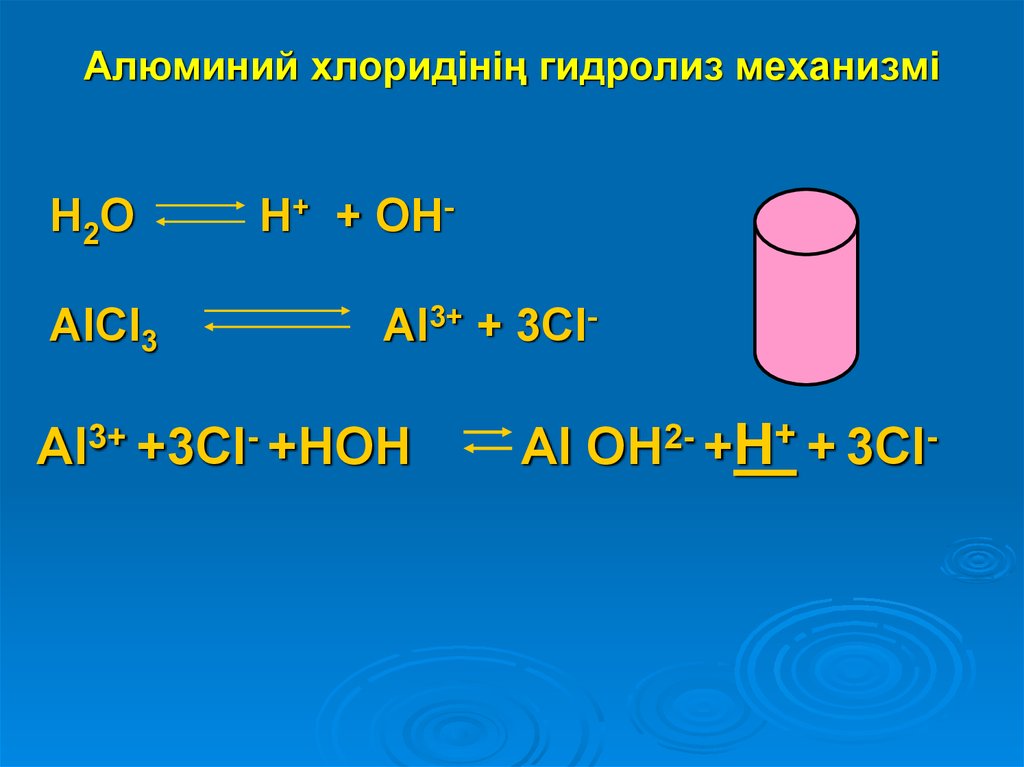
7. Алюминий хлоридінің гидролиз механизмі
H2OAlCl3
H+ + OHAl3+ + 3Cl-
Al3+ +3Cl- +HOH
Al OH2- +H+ + 3Cl-
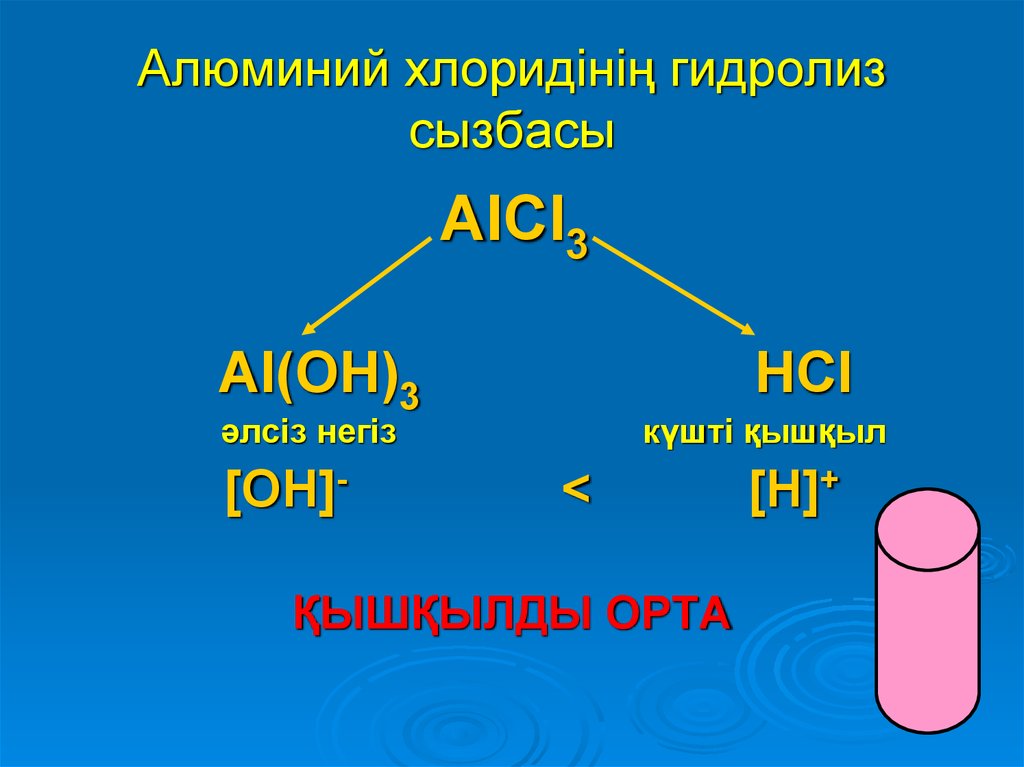
8. Алюминий хлоридінің гидролиз сызбасы
AlCl3Al(OH)3
әлсіз негіз
[OH]-
HCl
<
күшті қышқыл
[H]+
ҚЫШҚЫЛДЫ ОРТА
9.
2. Әлсіз қышқыл мен күшті негіздердің әрекеттесуінен түзілген тұздардыңCH3COONa, Na2CO3, KCN, Na2SO3, KNO2 және т.б. гидролизі. Бұл жағдайда
гидролиз реакциясына тұздың құрамындағы әлсіз қышқылдың қалдығы болып
саналатын гидраттанған анион түседі де, нәтижесінде ерітінді сілтілі (рН > 7)
болады.
Диссоциациялану теңдеуі:
Na2CO3 ⇄ 2Na+ + CO32H2O ⇄ H+ + OH2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OHГидролиз реакциясының иондық теңдеуі:
2Na+ + CO32- + HOH ⇄ 2Na+ + HCO3- + OHГидролиз реакциясының молекулалық теңдеуі:
Na2CO3 + H2O ⇄ NaOH + NaHCO3
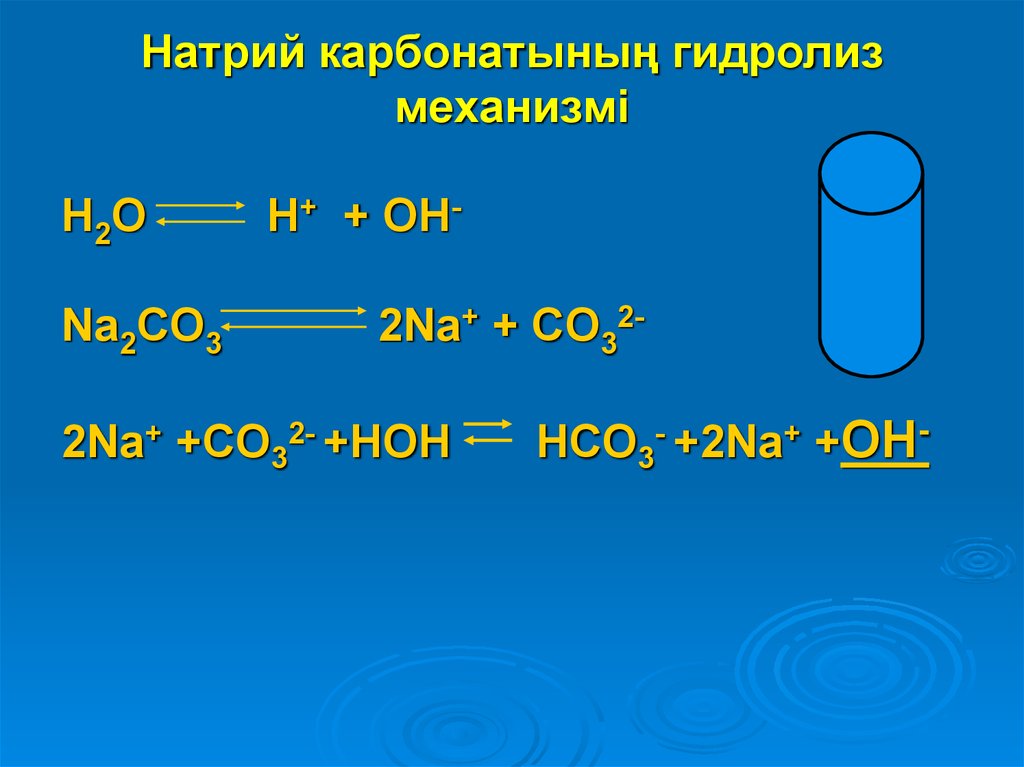
10. Натрий карбонатының гидролиз механизмі
H2ONa2CO3
H+ + OH2Na+ + CO32-
2Na+ +CO32- +HOH
HCO3- +2Na+ +OH-
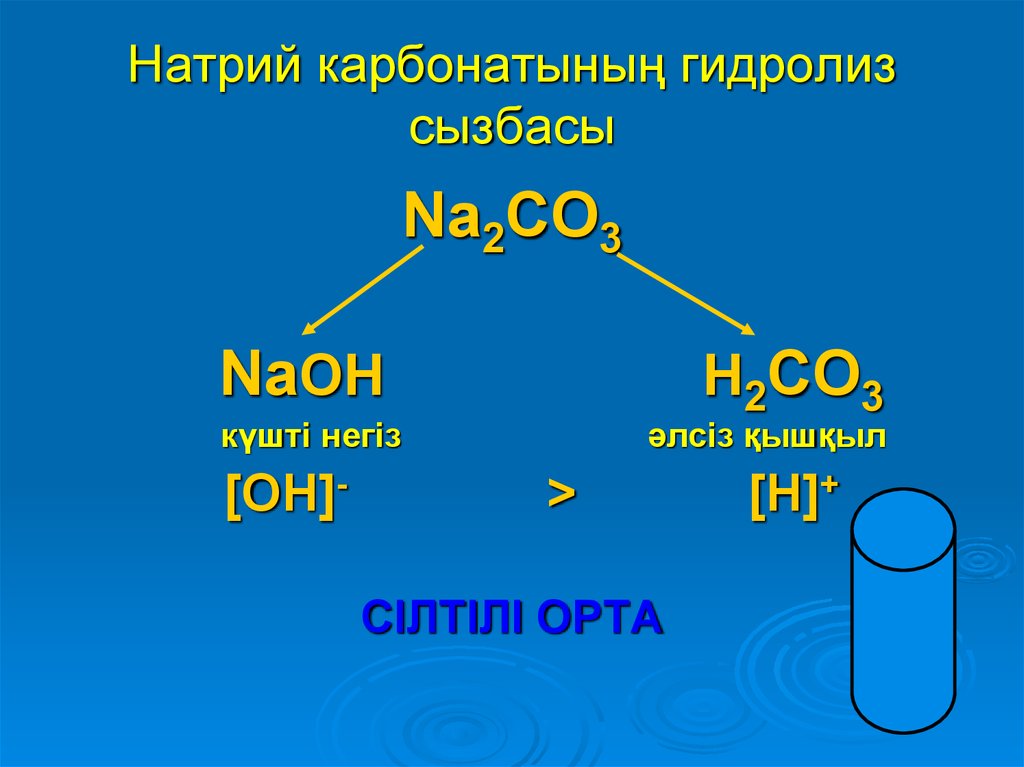
11. Натрий карбонатының гидролиз сызбасы
Na2CO3NaOH
күшті негіз
[OH]-
H2CO3
>
әлсіз қышқыл
[H]+
СІЛТІЛІ ОРТА
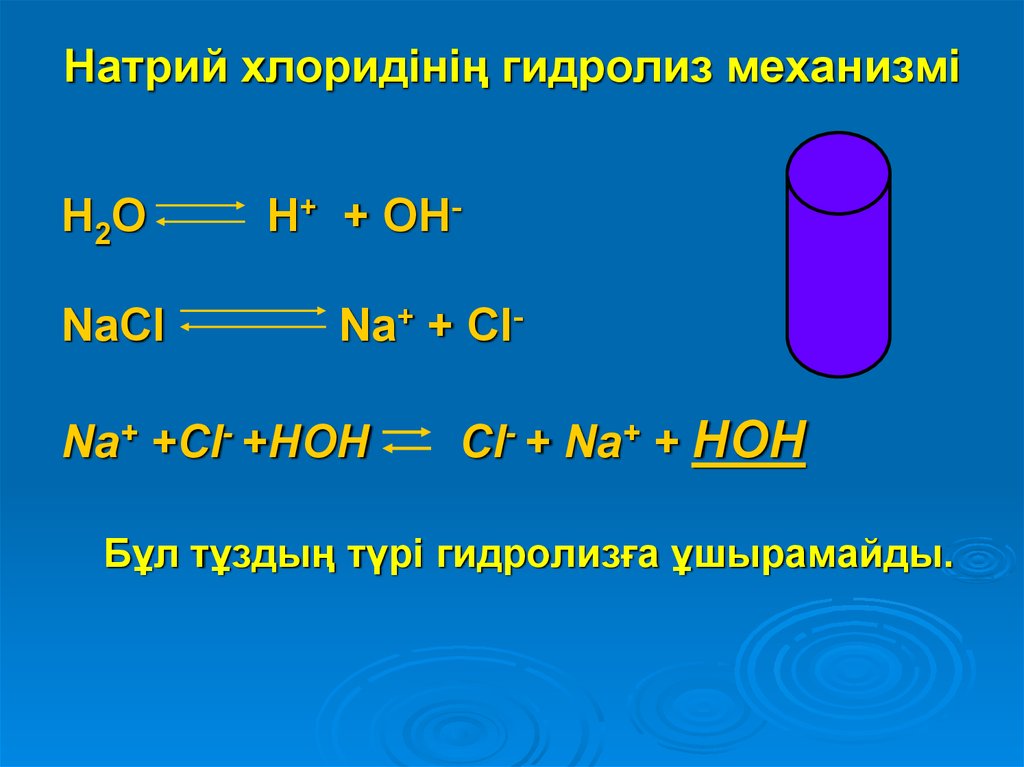
12. Натрий хлоридінің гидролиз механизмі
H2ONaСl
H+ + OHNa+ + Cl-
Na+ +Cl- +HOH
Cl- + Na+ + HOH
Бұл тұздың түрі гидролизға ұшырамайды.
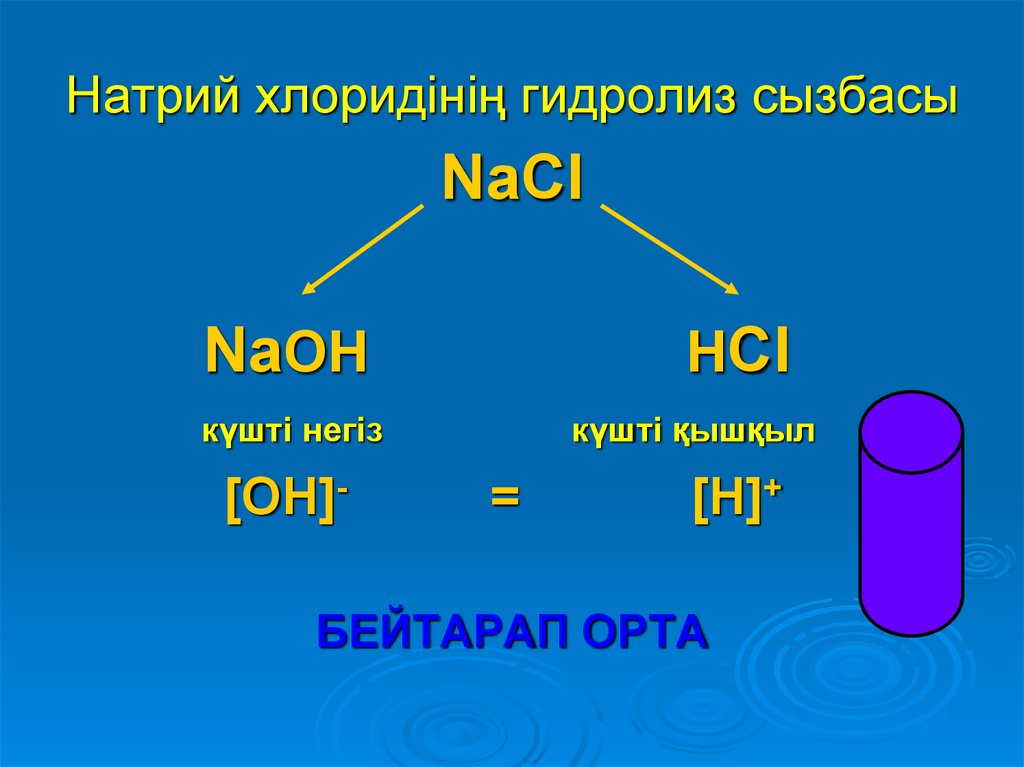
13. Натрий хлоридінің гидролиз сызбасы
NaClNaOH
HCl
күшті негіз
[OH]-
күшті қышқыл
=
[H]+
БЕЙТАРАП ОРТА
14.
3. Әлсіз негіз бен әлсіз қышқылдан түзілген тұздар дагидролизге ұшырайды. Бұл жағдайда гидролиздену
процесі соңына дейін жүріп, қышқыл мен негіз
түзіледі. Мысалы, алюминий сульфиді Al2S3 сумен
әрекеттескенде алюминий гидроксиді Al(OH)3 мен
күкіртсутек H2S түзіліп, гидролиздену реакциясы
қайтымсыз болады:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Олай болса, тұздардың гидролизге ұшырауы,
олардың иондарының құрамы мен мен қасиетіне
байланысты.
15. Гидролиздің қоғамдық өмірдегі мәні
Шикі бағалы өнімдерді даярлау (қағаз, сабын,спирт, глюкоза, ақуыздық ашытқылар)
Өндірістік ағыс және ішімдік суларды тазалау
(алюминий сульфаты + алюминий
гидроксиді)
Маталарды бояуға даярлау
16. Гидролиздің күнделікті адам өміріндегі рөлі
Кіржуу
Ыдыс-аяқ жуу
Сабынмен жуыну
Ас қорыту процессі










 chemistry
chemistry








