Similar presentations:
Химиялық элемент алюминий
1. Алюминий
Сабиров Алихан9F
2. Алюминий туралы мәлімет
Алюминий (лат.Aluminium),– ашудас, Al –
элементтердің периодтық
жүйесінің ІІІ тобындағы
химиялық элемент, рет
нөмірі 13, атомдық
массасы 26,9815. Бір
тұрақты изотопы бар.
Жер қыртысында
таралуы бойынша
элементтер арасында 4,
металдар арасында 1-ші
орында. Табиғатта
жүздеген минералдары
кездеседі, оның көпшілігі
– алюмосиликаттар
болып келеді.
3. Алюминий ашылуы
Алюминий алғашқы рет1825 ж. Даниялық физик
Ханс Оерстедпен
алюминий хлоридіндегі
калий амальгамымен
әрекеттесіп, содан кейін
сынаптың
дистилденуімен алынды.
Алюминийді өндірудің
индустриялық
электролиттік әдісін
әзірлеуден бұрын, бұл
металл алтыннан қымбат
болды.
4. Алынуы
Алюминий өндірісінде, шикізат ретінде көбінесебокситтер Al2O3 *xH2O жиі қолданылады.
Қақтағанда,олар суын жоғалтып ,алюминий оксидіне
айналады.
Электролиз кезінде катода алюминий, ал анодта
оттек бөлінеді.Электролиз реакциясының жалпы
теңдеуі:
2Al2O3
→
4Al+3O2
*Елімізде Павлодар қаласында Торғай кен орнындағы
бокситтен электролиздік әдіс арқылы алюминийді алу
үшін глинозем өндіретін алюминий зауыты жұмыс
істейді. Металл күйіндегі алюминий алынатын
электролиз цехтары салынып, 2007 жылдан өнім
бере бастады.
5. Физикалық қасиеттері
Алюминий күмістей ақтүсті жеңіл металл.
Алюминийдің иілгіштік
қасиеті жоғары,ол оңай
фольга болып жайылады
және сым түріне
созылады. Алюминий
электрөткізгіштігі мен
жылуөткізгіштігі жоғары
металл.
6. Химиялық қасиеттері
Ауада алюминий оттекпен әрекеттесіп,оны қорғайтыноксидтік қабықша түзеді.Қабықшасы алынған алюминий
өте белсенді.Сынаппен алюминий құймасы амальгама
түзеді
Алюминий ұнтағын қыздырғанда тұтанады және оксидін
түзіп, жарық жалынымен жанады
4Al+3O2=2Al2O3
H= -3350кДж
Алюминий мен оттектің байланысы өте жоғары
беріктілікпен ерекшеленеді.Сондықтан алюминий көптеген
металл оксидтерін (темір,марганец,хром) оттекті тартып
алады. Металл оксидтерін алюминиймен
тотықсыздандыру үшін алюмотермия деп аталады.
Мысалы,егер алюминий ұнтағын темір оксидімен Fe3O4
немесе FeO*Fe2O3
араластырып қоспаны жақса, онда
өте қарқынды реакция жүреді:
8Al+3FeO* Fe2O3=4Al2O3+9Fe
H=3240кДж
7. Химиялық қасиеттері
Алюминийгалогендермен тікелей
әрекеттесіп,
галогенидтер түзеді:
2Al+3Br2=2AlBr3
8.
Егер қорғағыш қабықшаны химиялық әдіспен аластатса(мысалы,сілті ерітіндісімен),онда металл сумен сутекті
бөліп,қарқынды әрекеттеседі:
2Al+6H2O=2Al(OH)3+3H2
Сұйылтылған тұз және күкірт қышқылдары оксид қабықшасын
бұзып,сутекті ығыстырып, алюминийді оңай ерітеді:
2Al+6HCl=2AlCl3+3H2
Екідайлы болғандықтан алюминий сілті ерітінділерімен де оңай
әрекеттеседі:
2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2
Сұйылтылған азот қышқылы алюминиймен әректтесіп азот (II)
оксидіне дейін тотықсызданады:
2Al+4HNO3=Al(NO3)3+NO +2H2O
Суықта концентірлі азот және күкірт қыщқылдарында алюминий
қорғағыш қабықша түзілу нәтежесінде енжарланады.Сондықтан
азот қышқылын алюминий ыдыстарында сақтайды және
тасымалдайды.
9. Алюминий оксиді
Al2O3 қиын балқитын, ақтүсті қатты зат. Табиғатта
корунд минералы түрінде
кездеседі. Алюминий оксиді
суда ерімейді, бірақ
қышқылда жақсы ериді;
Al2O3 + 6HCl=2AlCl3+3H2O
Сілті ерітінділерімен
гидроксоалюминаттар түзеді:
Al2O3+2NaOH+3H2O=2Na[Al
(OH)4]
ал құрғақ сілтілермен
балқытқанда,
метаалюминаттар береді
Al2O3+2NaOH=2NaAlO2+H2
O
Алюминий гидроксидінің Al
(OH)3 екі түрлі түрөзгерісі
болуы мүмкін:кристалдық
немесе аморфтық.
10.
Алюминий гидроксидінің Al (OH)3 екі түрлі түрөзгерісіболуы мүмкін:кристалдық немесе аморфтық.
Алюминий гидроксдін алюминий тұздары
ертінділеріне сілтімен әсер ету арқылы алынады :
AlCl3+3NaOH = Al(OH)3 +3NaCl
Жаңа тұнған Al(OH)3 ақ қоймалжың тұнба, суда
мүлдем ерімейді және типтік екідайлы гирдоксид
болып табылады:
Al(OH)3+3HCl=АlCl3+3H2O
Al(OH) 3+NaOH=Na[Al(OH)4]
Алюминий тұздары сулы ерітінділерде жоғары
дәрежеде гидролизге ұшырайды:
AlCl3+HOH
→
Al(OH)Cl2+HCl
Алюминийдің әлсіз қышқылдармен түзетін тұздары
сулы ертінділерде толық гидролизге ұшырайды:
Al2S3+6HOH=2Al(OH)3 +3H2S
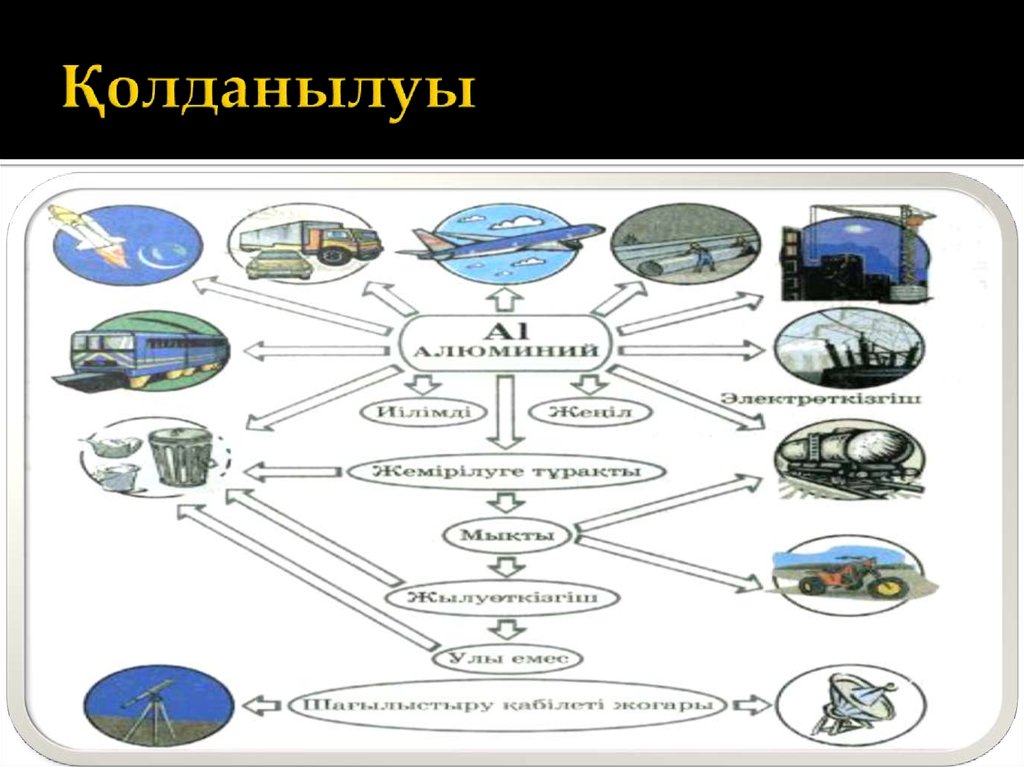
11. Қолданылуы
12. Қолданылуы
Алюминий техникада және тұрмыста кеңіненқолданады. Жеңіл және бағалы қасиеттері бар
құймалар алынатындықтан,оның авиациялық
өнеркәсіпте, автокөлікте ,электротехникада электр
сымдарын жасауда маңызы өте зор.
Корунд Al2 О3 – зергерлік өнеркәсіпте мойын тіректер
мен тіректер, қоспалар әсерінен әртүрлі бағалы
тастар (рубин сапфир және аметист)
Алюминий хлориді AlCl3 органикалық синтезде
өршіткі ретінде.
Алюминий сульфаты (Al2(SO4)3) - суды тазарту, қағаз
өндіру.
Алюминий кристаллогидраты Al2(SO4)3 18H2O –
мақта маталарды бояуға . Алюмокали ашудасы
KAl(SO4)2 12H2O –тері ,аяқкиім өнеркәсібінде тері
илегенде және маталарды бояуда.











 chemistry
chemistry