Similar presentations:
Тұздар гидролизі №2 зертханалық тәжірибе «Тұздар гидролизі»
1.
Тақырыбы: Тұздар гидролизі№2 зертханалық тәжірибе «Тұздар гидролизі»
9- сынып
2.
Оқу мақсаты:9.3.4.3-орта тұз ерітіндісінің ортасын тәжірибе жүзінде анықтау
9.3.4.4 -орта тұз гидролизінің теңдеуін молекулалық және иондық түрде
құрастыру
9.3.4.5 -орта тұз ерітіндіcінің реакция ортасын болжау
Бағалау критерийлері
орта тұз ерітіндісінің ортасын тәжірибе жүзінде анықтайды
орта тұз гидролизінің теңдеуін молекулалық және иондық түрде
құрастырады
орта тұз ерітіндіcінің реакция ортасын болжайды
2
3.
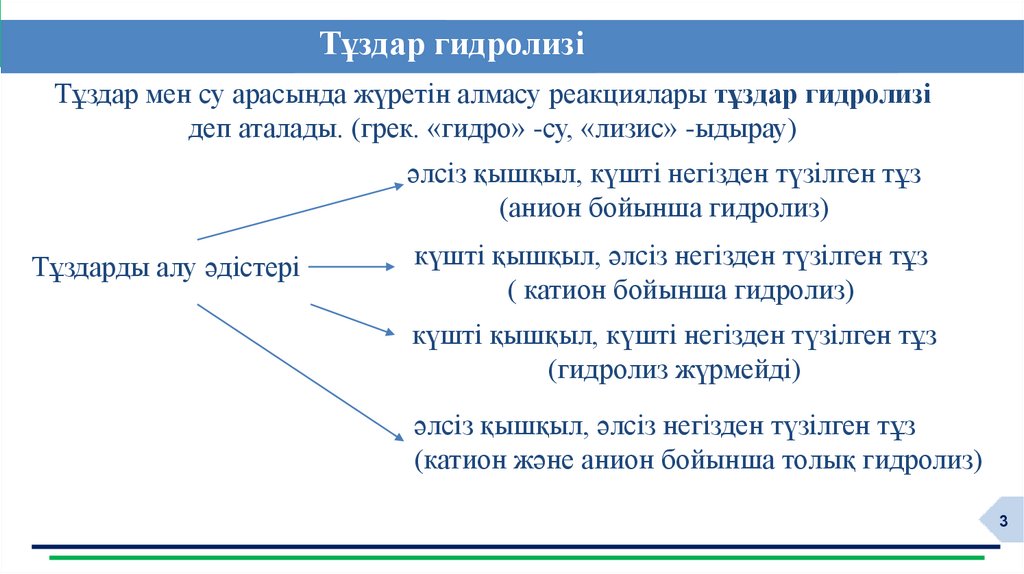
Тұздар гидролизіТұздар мен су арасында жүретін алмасу реакциялары тұздар гидролизі
деп аталады. (грек. «гидро» -су, «лизис» -ыдырау)
әлсіз қышқыл, күшті негізден түзілген тұз
(анион бойынша гидролиз)
Тұздарды алу әдістері
күшті қышқыл, әлсіз негізден түзілген тұз
( катион бойынша гидролиз)
күшті қышқыл, күшті негізден түзілген тұз
(гидролиз жүрмейді)
әлсіз қышқыл, әлсіз негізден түзілген тұз
(катион және анион бойынша толық гидролиз)
3
4.
Күшті негіз бен әлсіз қышқылдан түзілген тұзNa2CO3 ↔2Na+ + CO32HOH ↔H+ + OH CO32- + HOH ↔ OH- + HCO32гидролиздену реакциясының иондық теңдеуі
Na2CO3 + HOH ↔ NaOH + NaHCO3
гидролиздену реакциясының молекулалық теңдеуі
РН >7 негіздік (сілтілік) болады
анион бойынша гидролиз
[OH-]>[H+]
күшті негіз бен
әлсіз қышқылдың тұзы
гидролизденгенде
тұз құрамындағы қышқыл
қалдығы анионы
су құрамынан сутек
катионын қосып алып,
ерітіндіде гидроксид ионы
босап шығады
5.
Күшті қышқыл, әлсіз негізден түзілген тұзAICI3↔AI3+ + 3CIAI3 + 3CI- + HOH ↔AIOH2+ +3CI- + H+
AI3 + HOH ↔AIOH2+ + H+
гидролиздену реакциясының иондық теңдеуі
AICI3 + HOH ↔ AI(OH)CI2 +HCI
гидролиздену реакциясының молекулалық теңдеуі
РН<7 қышқылдық орта
катион бойынша гидролиз
[OH-] < [H+]
күшті қышқыл мен
әлсіз негіздің тұзы
гидролизденгенде
тұз құрамындағы металл
катионы
су құрамынан гидроксид
иондарын қосып алып,
ерітіндіде сутек иондары
босап шығады
5
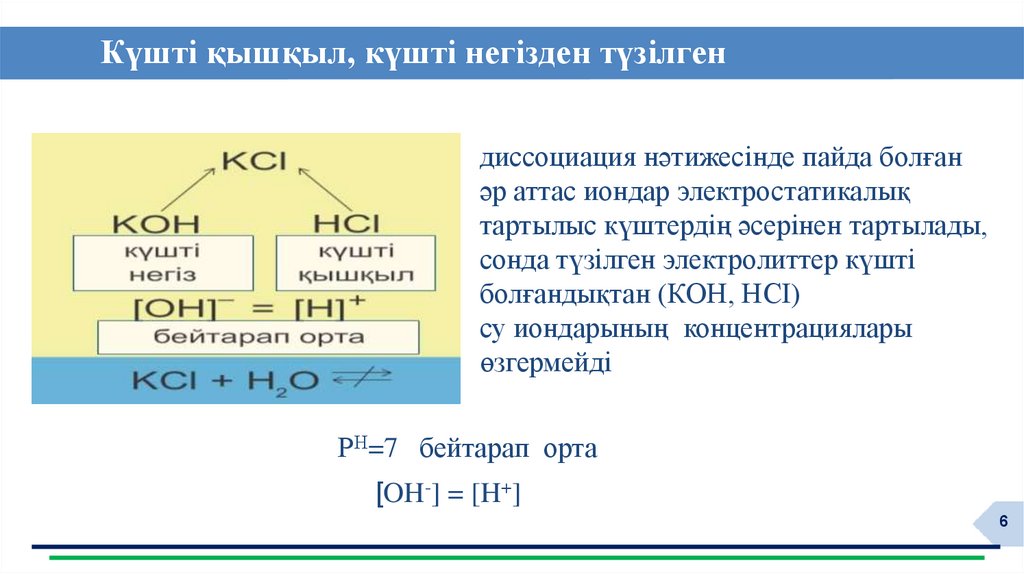
6. Күшті қышқыл, күшті негізден түзілген тұз
диссоциация нәтижесінде пайда болғанәр аттас иондар электростатикалық
тартылыс күштердің әсерінен тартылады,
сонда түзілген электролиттер күшті
болғандықтан (КOH, HCI)
су иондарының концентрациялары
өзгермейді
РН=7 бейтарап орта
[OH-] = [H+]
6
7. Әлсіз қышқыл, әлсіз негізден түзілген тұздар
Алюминий сульфидін суға саламыз.Тұз сумен толық әрекеттесіп,
ақ тұнба ↓АI(OH)3 және шіріген жұмыртқа иістес
газ H2S↑ түзіп ыдырайды.
Альюминий сульфидінің толық гидролиздену
теңдеуі
AI2S3+6HOH=2AI(OH)3+3H2S↑
https://cdn4.bilimland.kz/upload/content/platform_lessons/L_11700/40.mp4
8. Ерітінділердің рН өлшеу
Сулы ерітінділерді сипаттау үшін ортаның ерекше көрсеткіші рН қолданылады.(лат.потенц-көрсеткіш). рН мәні 0 –мен 14-тің арасында болады.
келесі бейнематериалына назар аударыңыз
https://cdn4.bilimland.kz/upload/content/platform_lessons/L_11700/32.mp4
9. Бекіту тапсырмасы
1- тапсырма№2-Зертханалық жұмыс
Реактивтер: NaCI, FeCI2, Na2CO3 тұздарының ерітінділер, әмбебап индикатор
Жұмыстың орындалуы: Үш сынауыққа 3-4 мл берілген тұз ерітінділері құйылған.
Әмбебап индикатордың көмегімен әр сынауықтағы тұз ерітінділерін және олардың
рН ортасын тәжірибе жүзінде анықта. Тәжірибенің нәтижесін кестеге жазыңдар
(төмендегі суретті пайдаланыңыз)
Дескриптор:
орта тұз ерітіндісінің ортасын тәжірибе жүзінде анықтайды
9
10. Бекіту тапсырмасы
1- тапсырма№2-Зертханалық жұмыс
Тұз
формуласы
NaCI
FeCI2
Na2CO3
Негіздің типі
(күшті, әлсіз)
Қышқылдың типі
(күшті, әлсіз)
Гидролиз
жүре ме?
рН
Дескриптор:
орта тұз ерітіндісінің ортасын тәжірибе жүзінде анықтайды
10
11. Дұрыс жауап
1 - тапсырмаТұз формуласы
Негіздің типі
(күшті, әлсіз)
Қышқылдың
Гидролиз
типі(күшті, әлсіз) жүре ме?
рН
NaCI
NaOH күшті
HCI күшті
жүрмейді
рН=7
FeCI2
Fe(OH)2 әлсіз
HCI күшті
жүреді
рН<7
Na2CO3
NaOH күшті
H2CO3 әлсіз
жүреді
рН>7
11
12. Бекіту тапсырмасы
2- тапсырмаNa2S- орта тұз гидролизінің теңдеуін молекулалық және иондық түрде
құрастырыңыз
Дескриптор:
орта тұз гидролизінің теңдеуін молекулалық және иондық түрде құрастырады
12
13. Дұрыс жауап
2- тапсырмаNa2S- орта тұз гидролизінің теңдеуін молекулалық және иондық түрде
құрастырыңыз
Na2S – NaOH; H2S
Na2S↔2Na+ + S2HOH↔H++ OHГидролиздену реакциясының иондық теңдеуі
S2- +HOH↔HS- + OHГидролиздену реакциясының молекулалық теңдеуі
Na2S+HOH↔ NaHS+NaOH
Дескриптор:
орта тұз гидролизінің теңдеуін молекулалық және иондық түрде құрастырады
13
14. Бекіту тапсырмасы
3 тапсырмаКелесі заттардың реакция ортасын анықтаңыз:
K2SO4 – калий сульфаты
ZnCІ2 – мырыш хлориді
K2S – калий сульфиді
Дескриптор:
орта тұз ерітіндісінің реакция ортасын болжайды
14
15. Дұрыс жауап
3- тапсырмаКелесі заттардың реакция ортасын анықтаңыз:
K2SO4 – калий сульфаты күшті қышқыл мен күшті негіздің тұзы
рН =7 бейтарап орта
ZnCІ2 – мырыш хлориді әлсіз негіз бен күшті қышқылдың тұзы
рН < 7 қышқылдық орта
K2S – калий сульфиді,
күшті негіз бен әлсіз қышқылдың тұзы
рН > 7 негіздік(сілтілік) орта
Дескриптор:
орта тұз ерітіндісінің реакция ортасын болжайды
15
16.
Оқу тапсырмасырН көрсеткішінің мәні бойынша мына ерітінділердің ортасын анықтаңдар:
асқазан сөлі
рН =1
көз жасы
pH=7
сода ерітіндісі
pH=10
сабын ерітіндісі pH=11
дистильденген су pH=7
16
17.
ҚорытындыБүгінгі сабақта:
орта тұз ерітіндісінің ортасын тәжірибе жүзінде анықтадым
орта тұз гидролизінің теңдеуін молекулалық және иондық түрде
құрастыра аламын
орта тұз ерітіндіcінің реакция ортасын болжауды үйрендім
17
18.
Қосымша ресурстарМ.Қ.Оспанова
Қ.С. Аухадиева Т.Г.Белоусова
Химия 9 сынып 1-бөлім
-https://bilimland.kz/kk/subject/ximiya/9
18
















 chemistry
chemistry








