Судың диссоциациясы
1.
ҚАЗАҚСТАНРЕСПУБЛИКАСЫНЫҢ
ДЕНСАУЛЫҚ САҚТАУ
МИНИСТРЛІГІ
Астана Медициналық
Университеті
Судың иондық көбейтіндісі
Сутектік көрсеткіш (рН)
Орындаған: Даулетов Ж
Кенжебаев А
Тобы: 202 ОЗ
Қабылдаған: Султанова Н.А.
Нур-Султан 2020ж
2.
Судың диссоциациясыН2О Н+ + ОН
[ H ] [OH ]
16
Кд
1,8 10
[ H 2 O]
const
0
(25 C )
3.
(Н2О) =1,8 10-9 , бұл дегеніміз судың 50 000 000молекуласынан - 1 молекула диссоциацияланады:
m
1000
[ H 2 O]
55,56 моль / л
M 18 г / моль
(t 25 C и Р 1 атм.)
0
К д [ H 2 O] [ H ] [OH ] K H 2O const
Судың иондық көбейтіндісі
K W ( Н 2О ) [ H ] [OH ] 1,8 10
16
55,56 10
14
4.
КН2О = Н+ ОН- == 1,8 10-16 55,56 = 10-14
Н+ * ОН- =10-14
Сонда таза суда:
[ H ] [OH ] K H 2O 10
14
7
10 ìîëü / ë
5.
1909 жылы Зеренсон терминдер енгіздісутектік көрсеткіш (рН)
және гидроксильді көрсеткіш (рОН)
рН lg [ H ];
рН lg a H
рОН lg [OH ]; рОН lg аОН
[ H ] [OH ] 10 14
СУДА:
ОН ДА:
pH pOH 14
6.
Сутектік көрсеткішН+
рН – сутектік көрсеткіш
рОН = - lg ОН-
рОН – гидроксидтік көрсеткіш
рН + рОН = 14
рН = - lg
7.
рН = 7 нейтралды орта7
[ H ] [OH ] 10 моль / л
рН 7
[ H ] [OH ],
рН 7
[ H ] [OH ],
қышқыл орта
7
[ H ] 10 моль / л
сілтілі орта
7
[ H ] 10 моль / л
8.
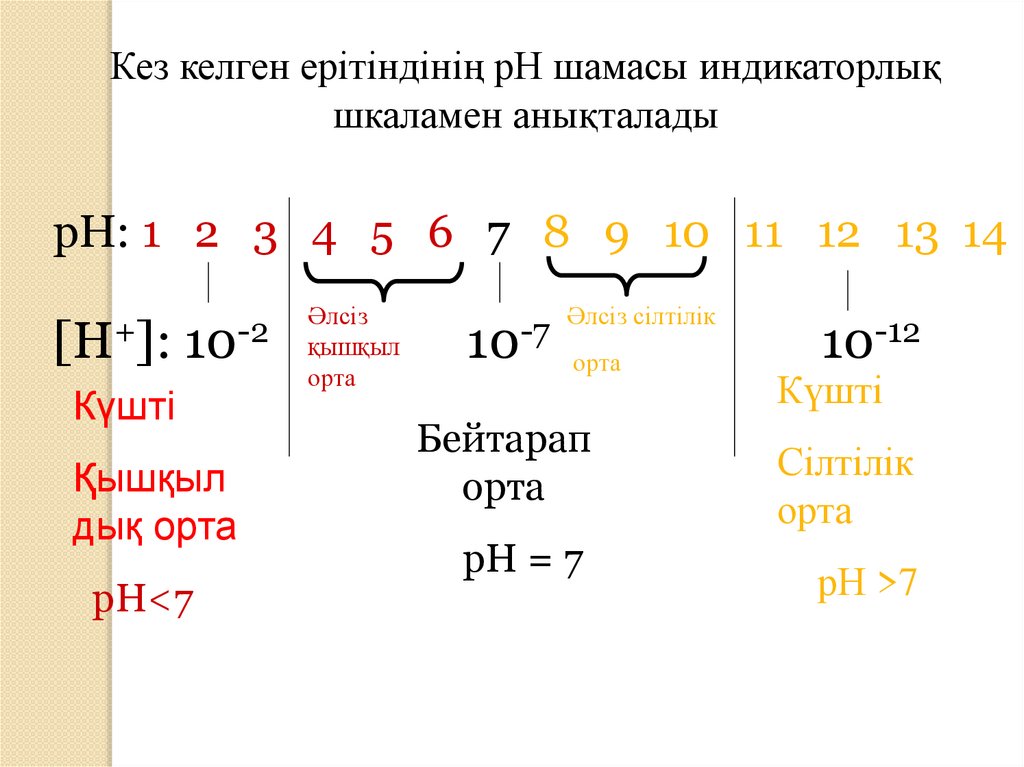
Кез келген ерітіндінің рН шамасы индикаторлықшкаламен анықталады
рН: 1 2 3 4 5 6 7 8 9 10 11 12 13 14
[H+]:
10-2
Күшті
Қышқыл
дық орта
рН<7
Әлсіз
қышқыл
орта
10-7
Әлсіз сілтілік
орта
Бейтарап
орта
рН = 7
10-12
Күшті
Сілтілік
орта
рН >7
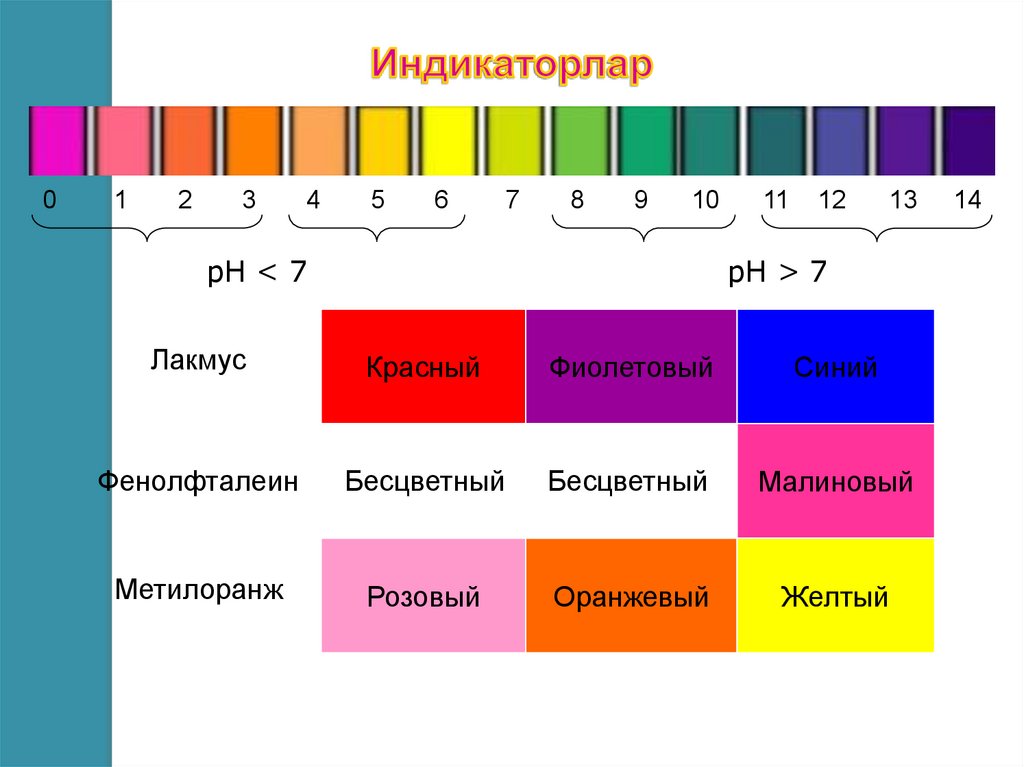
9.
01
2
3
4
5
6
7
8
9
10
рН < 7
11
12
13
рН > 7
Лакмус
Красный
Фиолетовый
Синий
Фенолфталеин
Бесцветный
Бесцветный
Малиновый
Метилоранж
Розовый
Оранжевый
Желтый
14
10.
ГИДРОЛИЗДІҢ ИОНДЫҚ ТЕНДЕУІ1)
CH3COONa + HOH CH3COOН + NaOH
әлсіз
күшті
қышқыл
негіз
2) CH3COO- + Na+ + HOH CH3COOH + Na+ + OH3) CH3COO- + HOH CH3COOH + OHрН 7
сілтілік орта
11.
Гидролиз типтері1) әлсіз қышқыл және күшті негізден түзілген тұз гидролизі
анион бойынша жүреді (орта сілтілік болады, рН>7)
1 сатыда: Na3PO4 + HOН = Na2HPO4 + NaOH;
қышқылды
тұз
күшті
негіз
2 сатыда: Na2HPO4 + HOН = NaH2PO4 + NaOH;
3 сатыда: NaH2PO4 + HOН = H3PO4 + NaOH
әлсіз
қышқыл
күшті
негіз
12.
2) Әлсіз негіз,ty және күшті қышқылдан түзілгентұз катион бойынша гидролизденеді (орта
қышқылдық, рН<7)
CuCl2 + 2HOH = Cu(OH)2 + 2HCl
әлсіз
негіз
күшті
қышқыл
Cu2+ + 2Cl- + 2HOH = Cu(OH)2 + 2H+ + 2ClCu2+ + 2HOH = Cu(OH)2 + 2H+
катион
гидролизге
түседі
рН < 7
қышқылдық
орта
13.
3) Әлсіз негізбен әлсіз қышқылдан түзілген тұз катион және анионбойынша гидролизденеді (орта бейтарап болады, рН =7)
Al2S3 + 3H2O = 2Al(OH)3 + 3H2S
әлсіз қышқыл
әлсіз негіз
4) Күшті негізбен күшті қышқылдан түзілген тұз
гидролизденбейеді (орта бейтарап болады, рН =7)
NaCl + H2O = NaOH + HСl
күшті негіз
НОН = H+ + OH-
күшті қышқыл
14.
Күшті қышқыл ерітіндісінің рН анықтау[Н+]=Сқышқыл
15.
Әлсіз қышқыл ерітіндісінің рН анықтауН
Кд С
16.
Күшті негіз ерітіндісінің рН анықтау[ОН-] =Снегіз
рОН = -lg [ОН-]
17.
Әлсіз негіз ерітіндісінің рН анықтауОН
Кд С















 chemistry
chemistry