Similar presentations:
Практическое занятие: Решение задач. Классификация химических реакций
1.
Шпилевая Юлия Сергеевна,преподаватель химии и биологии
2.
A+B ->CC -> A+B
AB+C -> CB+A
AB+CD -> AD+ CB
3.
Практическое занятие: Решениезадач. Классификация
химических реакций
4.
Цели урока.Образовательная:
обобщить и закрепить
знания и умения
обучающихся по теме
«Классификация
химических реакций
»
5.
Самостоятельная работапо вариантам
6.
Взаимопроверка7.
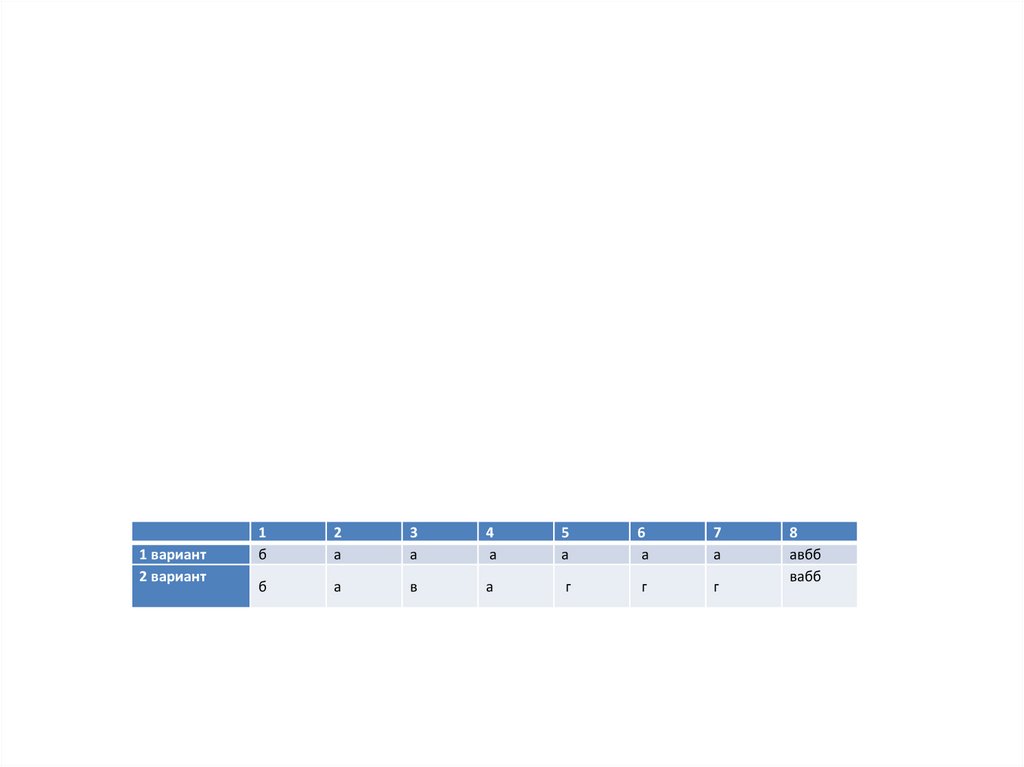
1 вариант2 вариант
1
б
2
а
3
а
4
а
5
а
6
а
7
а
б
а
в
а
г
г
г
8
авбб
вабб
8.
Критерии оценивания:Кол-во
правильных
ответов
3
4
5
6
7
8
9
10
Оценка
2
2
3
3
3
4
4
5
9.
1. Определить типы химическихреакций:
- изменению числа и состава реагентов и
продуктов реакции
-по тепловому эффекту химической реакции;
- по участию катализатора;
- по обратимости реакции;
- по изменению степеней окисления
элементов соединений в реакции;
- по агрегатному состоянию
10.
2.Расставить степени окисления элементов в
соединениях:
11.
3. Составить уравнения диссоциации электролитов:12.
-Физ. минутка:Вы отвечаете на вопрос – является
ли реакция окислительно –
восстановительной?
При ответе «Да» - встаете, справа от
стула и поднимаете руки вверх три
раза
При ответе «Нет» -встаете, слева от
стула и поворачиваете головой три
раза влево-вправо
13.
2KCl + H2SO4 → K2SO 4 + 2HCl14.
Cu + 4HNO 3 → Cu(NO 3) 2 + 2NO 2 + 2H 2O15.
N 2 + O2 ↔ 2NO 216.
2KI + Pb(NO 3) 2 → 2KNO 3 + PbI 2↓17.
4.Составить уравнения реакций вионно – молекулярном виде
между:
а) карбонатом натрия и хлоридом
кальция;
б) серной кислотой и нитратом
бария;
в) хлоридом бария и сульфатом
меди (II) .
18.
5. Выполнение задания устно:К каким типам можно отнести
реакции:
19.
6. Самостоятельная работа20.
1. C + O2 = CO2 + 412 кДж ,реакция соединения, ОВ,
экзотермическая, некаталитическая,
гомогенная, необратимая
2. CaO + H2O → Ca(OH)2 ,
реакция соединения, неОВ,
экзотермическая, некаталитическая,
гетерогенная, необратимая
21.
7. Домашнее задание: задание втетради: расставить коэффициенты
при помощи электронного баланса,
указать окислитель и
восстановитель реакции: FeCl3 +
H2S = FeCl2 + S + HCl

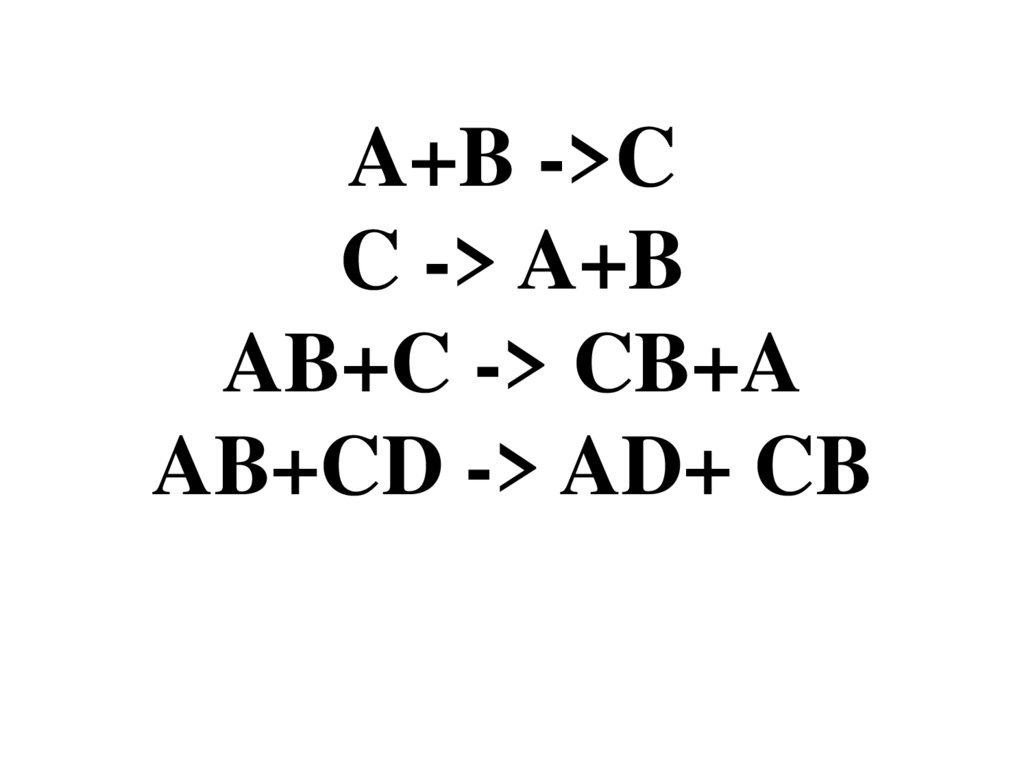









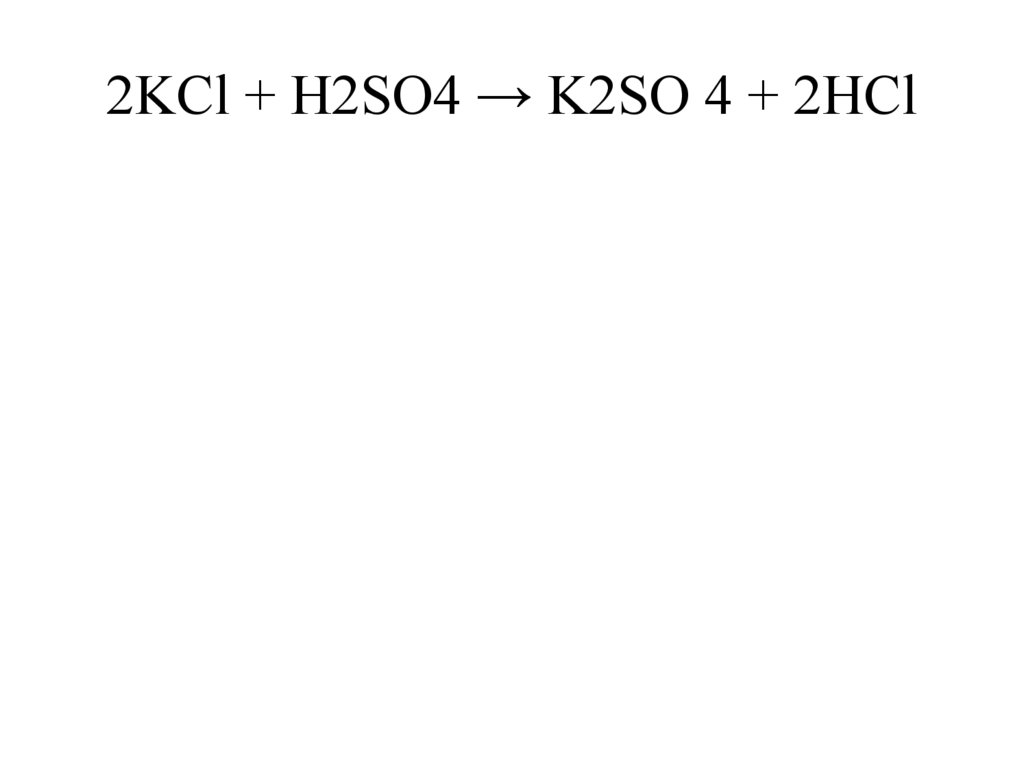










 chemistry
chemistry








