Similar presentations:
Классификация химических реакций в неорганической химии
1.
Классификацияхимических реакций
в неорганической химии
Учитель химии
Ломакина Галина Алексеевна
2.
«Химическое превращение,химическая реакция есть
главный предмет химии».
Н.Н.Семёнов
Русский и советский физикохимик и педагог,
один из основоположников химической физики.
Внёс существенный вклад в развитие химической кинетики.
Академик АН СССР, единственный советский лауреат
Нобелевской премии по химии.
3.
Цель:продолжить развитие представлений о
химической реакции, изучить основные типы
химических реакций в неорганической химии.
4.
Классификация – это понятие в науке,обозначающее распределение объектов согласно
группам подобия и различия между ними
(например, химических элементов).
Систематизация мыслительная деятельность,
в ходе которой исследуемые
объекты организуются в
некую систему на базе
выбранного принципа.
Классификация –
один из основных видов
систематизации.
5.
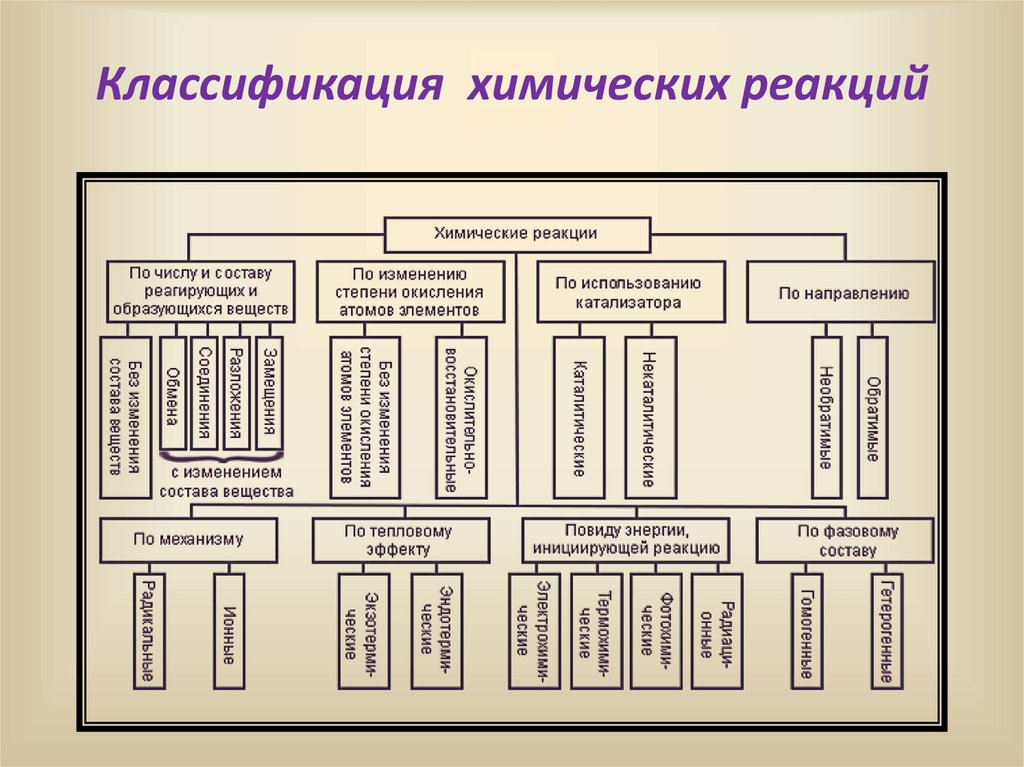
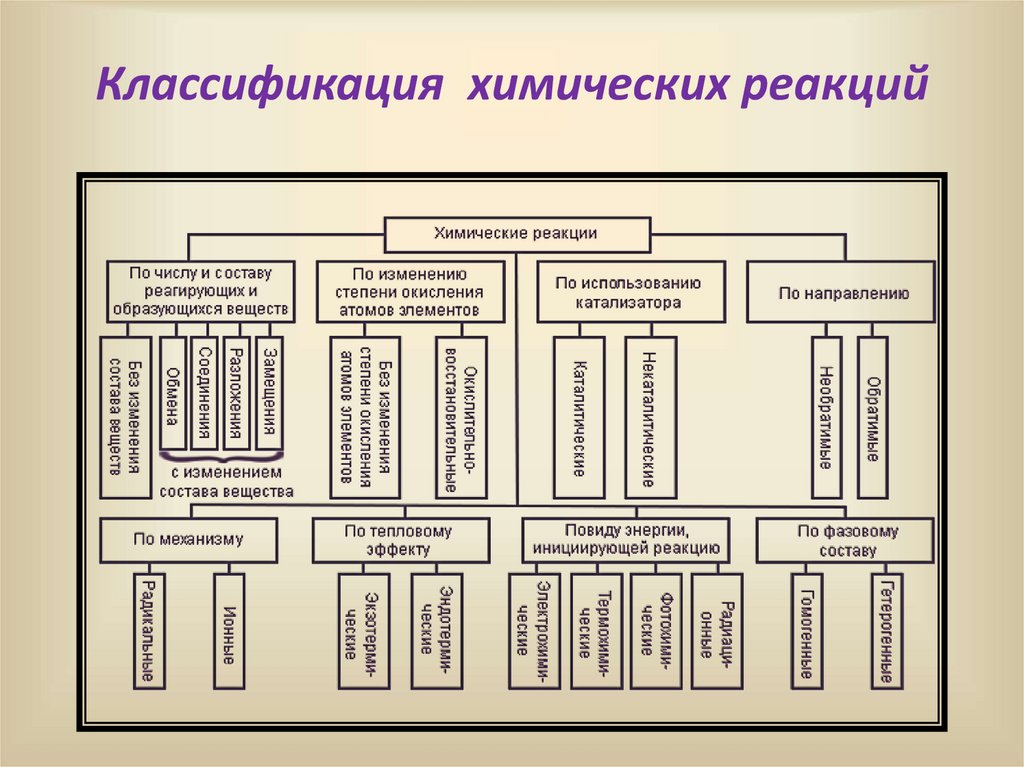
Классификация химических реакций6.
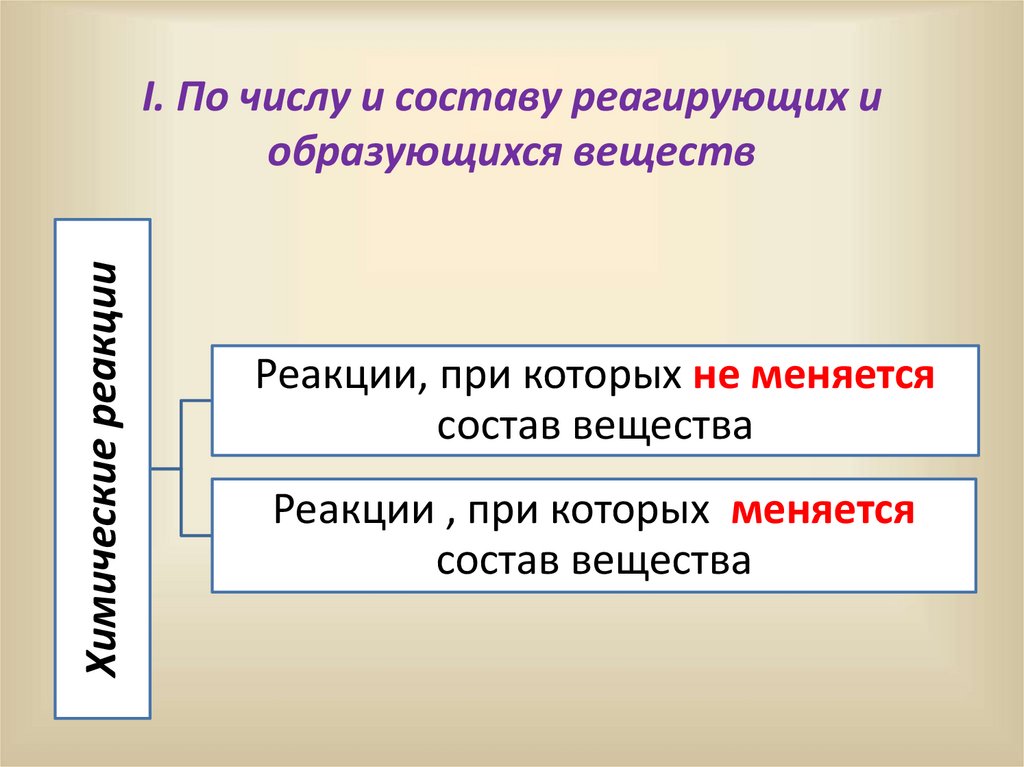
Химические реакцииI. По числу и составу реагирующих и
образующихся веществ
Реакции, при которых не меняется
состав вещества
Реакции , при которых меняется
состав вещества
7.
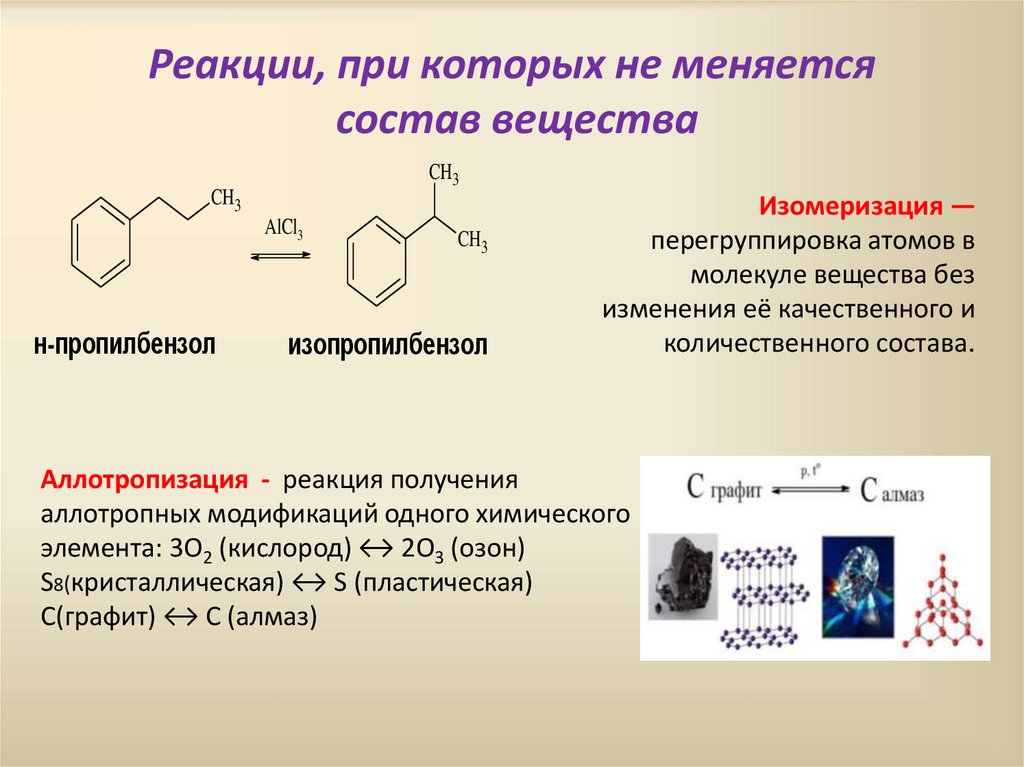
Реакции, при которых не меняетсясостав вещества
CH3
CH3
AlCl3
н-пропилбензол
CH3
изопропилбензол
Изомеризация —
перегруппировка атомов в
молекуле вещества без
изменения её качественного и
количественного состава.
Аллотропизация - реакция получения
аллотропных модификаций одного химического
элемента: 3O2 (кислород) ↔ 2O3 (озон)
S8(кристаллическая) ↔ S (пластическая)
C(графит) ↔ C (алмаз)
8.
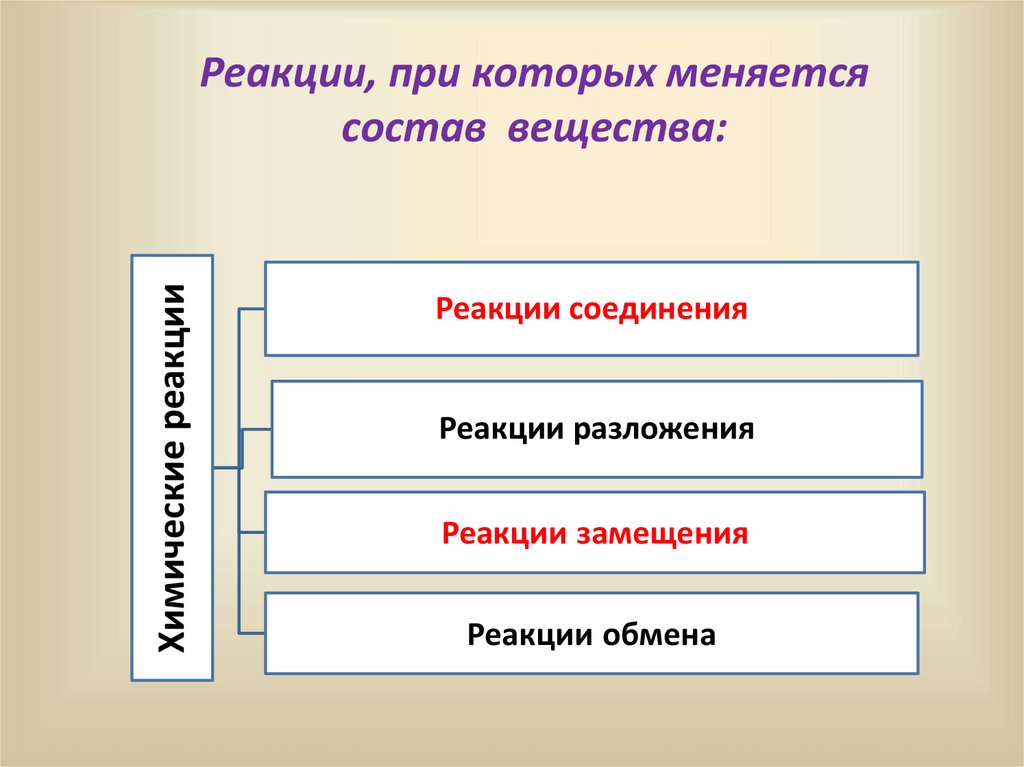
Химические реакцииРеакции, при которых меняется
состав вещества:
Реакции соединения
Реакции разложения
Реакции замещения
Реакции обмена
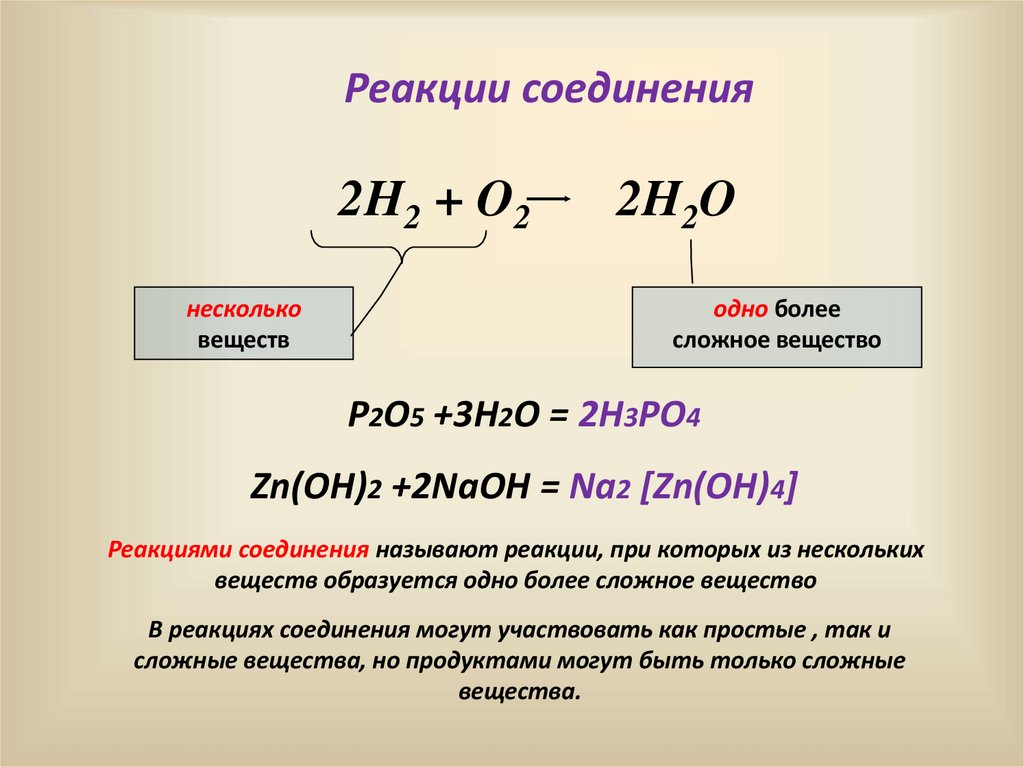
9.
Реакции соединения2H2 + O2
несколько
веществ
2H2O
одно более
сложное вещество
P2O5 +3H2O = 2H3PO4
Zn(OH)2 +2NaOH = Na2 [Zn(OH)4]
Реакциями соединения называют реакции, при которых из нескольких
веществ образуется одно более сложное вещество
В реакциях соединения могут участвовать как простые , так и
сложные вещества, но продуктами могут быть только сложные
вещества.
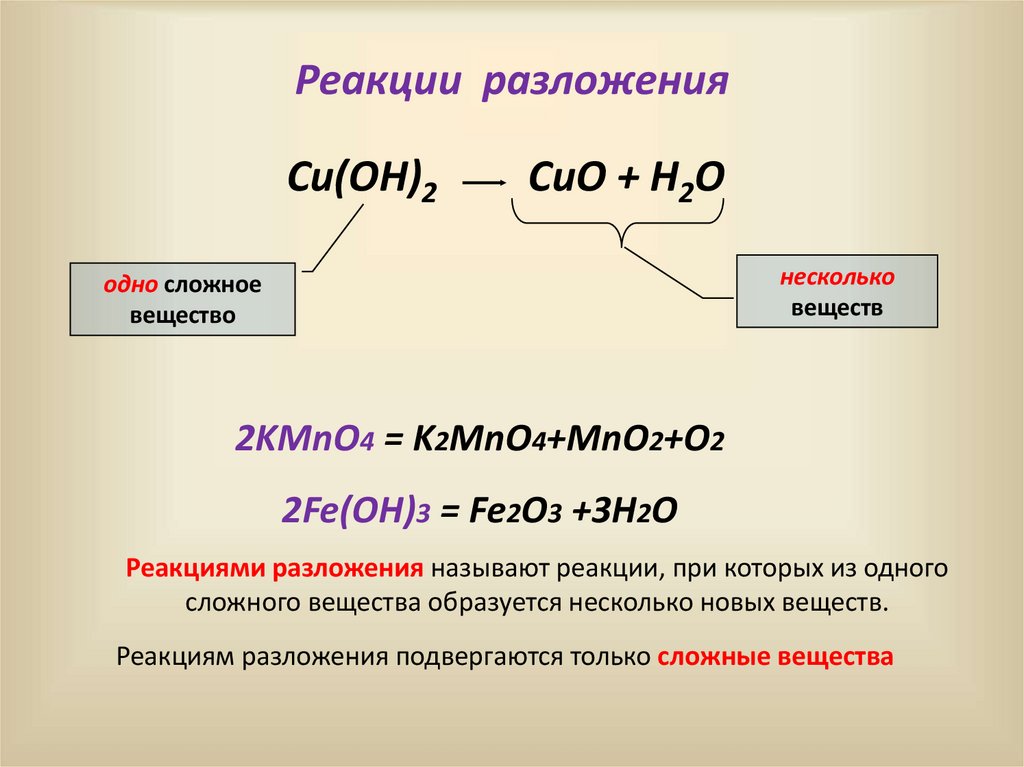
10.
Реакции разложенияCu(OH)2
CuO + H2O
несколько
веществ
одно сложное
вещество
2KMnO4 = K2MnO4+MnO2+O2
2Fe(OH)3 = Fe2O3 +3H2O
Реакциями разложения называют реакции, при которых из одного
сложного вещества образуется несколько новых веществ.
Реакциям разложения подвергаются только сложные вещества
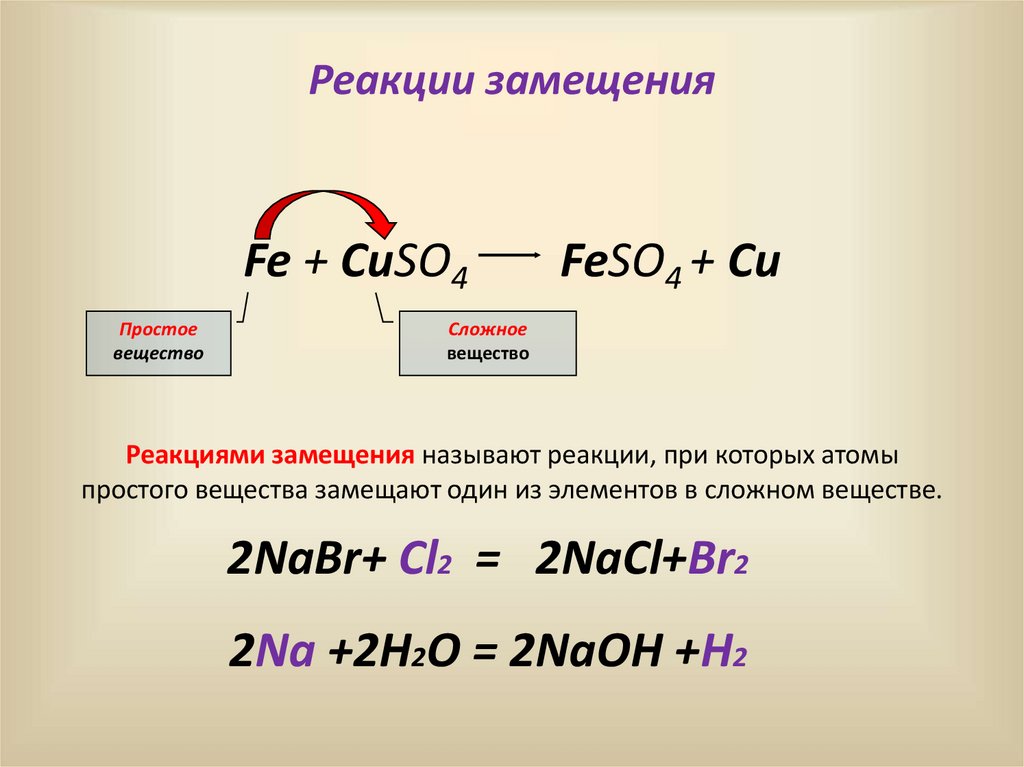
11.
Реакции замещенияFe + CuSO4
Простое
вещество
FeSO4 + Cu
Сложное
вещество
Реакциями замещения называют реакции, при которых атомы
простого вещества замещают один из элементов в сложном веществе.
2NaBr+ Cl2 = 2NaCl+Br2
2Na +2H2O = 2NaOH +H2
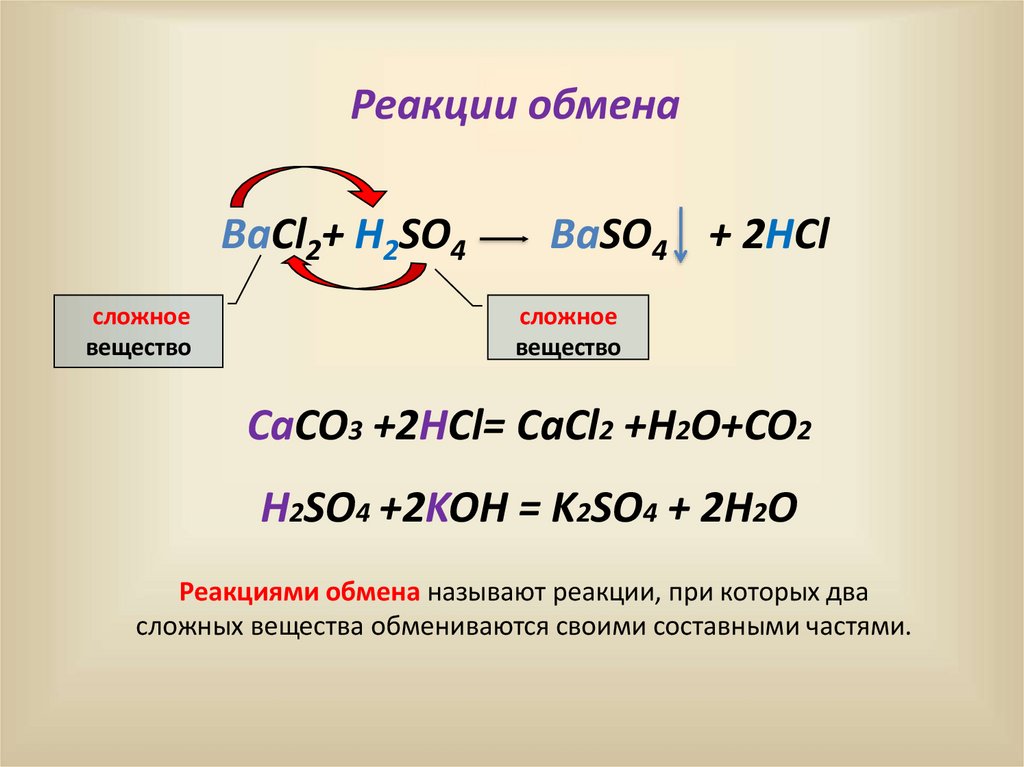
12.
Реакции обменаBaCl2+ H2SO4
сложное
вещество
BaSO4 + 2HCl
cложное
вещество
CaCO3 +2HCl= CaCl2 +H2O+CO2
H2SO4 +2KOH = K2SO4 + 2H2O
Реакциями обмена называют реакции, при которых два
сложных вещества обмениваются своими составными частями.
13.
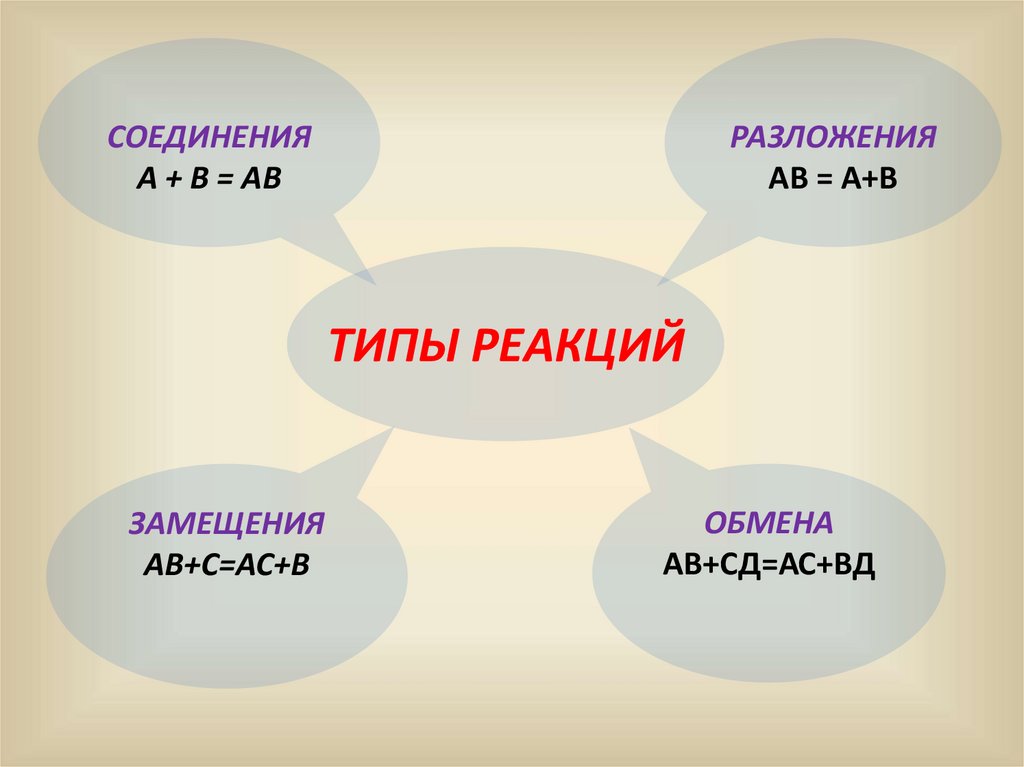
СОЕДИНЕНИЯА + В = АВ
РАЗЛОЖЕНИЯ
АВ = А+В
ТИПЫ РЕАКЦИЙ
ЗАМЕЩЕНИЯ
АВ+С=АС+В
ОБМЕНА
АВ+СД=АС+ВД
14.
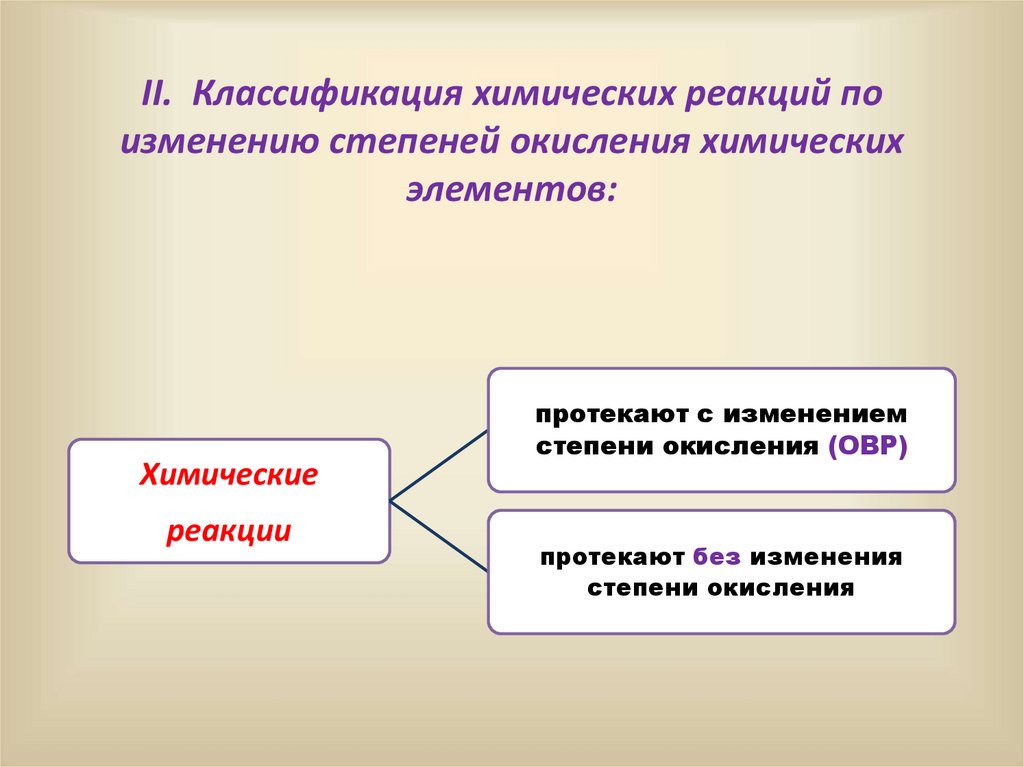
II. Классификация химических реакций поизменению степеней окисления химических
элементов:
Химические
реакции
протекают с изменением
степени окисления (ОВР)
протекают без изменения
степени окисления
15.
• Окислительно-восстановительные реакции – этореакции, идущие с изменением степеней окисления
элементов
• (все реакции замещения, а также реакции соединения и
разложения, в которых участвует хотя бы одно простое
вещество).
2H2S +3O2 = 2H2O +2SO2
2Al + 3Br2 = 2AlBr3
Mg + H2SO4 = MgSO4 + H2
16.
Реакции, которые протекают без изменениястепени окисления элементов
CaO + 2 HCl = CaCl2 + H2O
KOH + HCl = KCl + Н2О
(реакция нейтрализации)
Na2O + H2O = 2NaOH
Na2CO3 + CO2 + H2O = 2Na(HCO3)2
17.
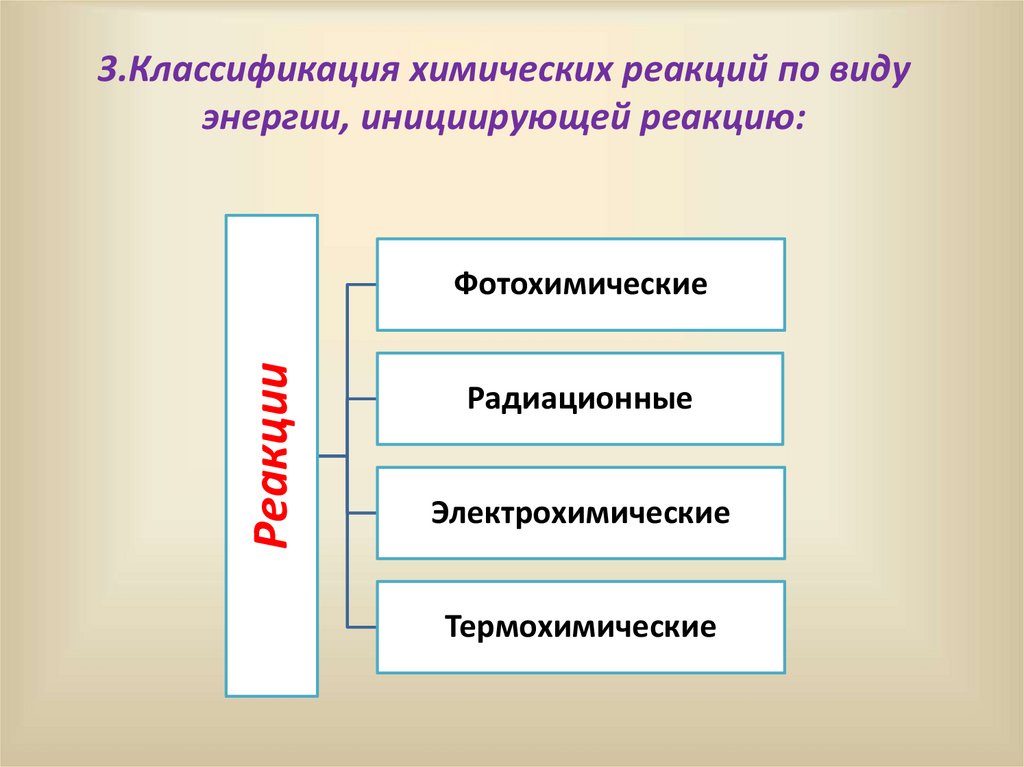
3.Классификация химических реакций по видуэнергии, инициирующей реакцию:
Реакции
Фотохимические
Радиационные
Электрохимические
Термохимические
18.
ФОТОХИМИЧЕСКИЕ РЕАКЦИИ – химические превращения,протекающие под действием света в видимой и
ультрафиолетовой области спектра.
1. Фотодиссоциация (фотолиз) приводит к разложению
исходного вещества, поглотившего световую энергию.
фотолиз паров ацетона CH3CO CH3 → CO + другие продукты.
2. Фотосинтез приводит к образованию более сложных
соединений. фотосинтез озона O2 → O + O , O2 + O → O3
3. Фотохромизм обратимое изменение пространственного
или электронного строения молекул под действием света,
сопровождающееся изменением окраски вещества.
19.
Природные фотохромыСодалит меняет цвет от фиолетового (на
свежем разломе) до бледно-желтого, бледнозеленого или бесцветного (после облучения
поверхностей солнечным светом).
Содалит
Na4(Si3Al3)O12Cl
Тугтупит или олений камень способен
менять цвет от белого или бледнорозового до ярко-розового.
Тугтупит
Na4[BeAlSi4O12]Cl
20.
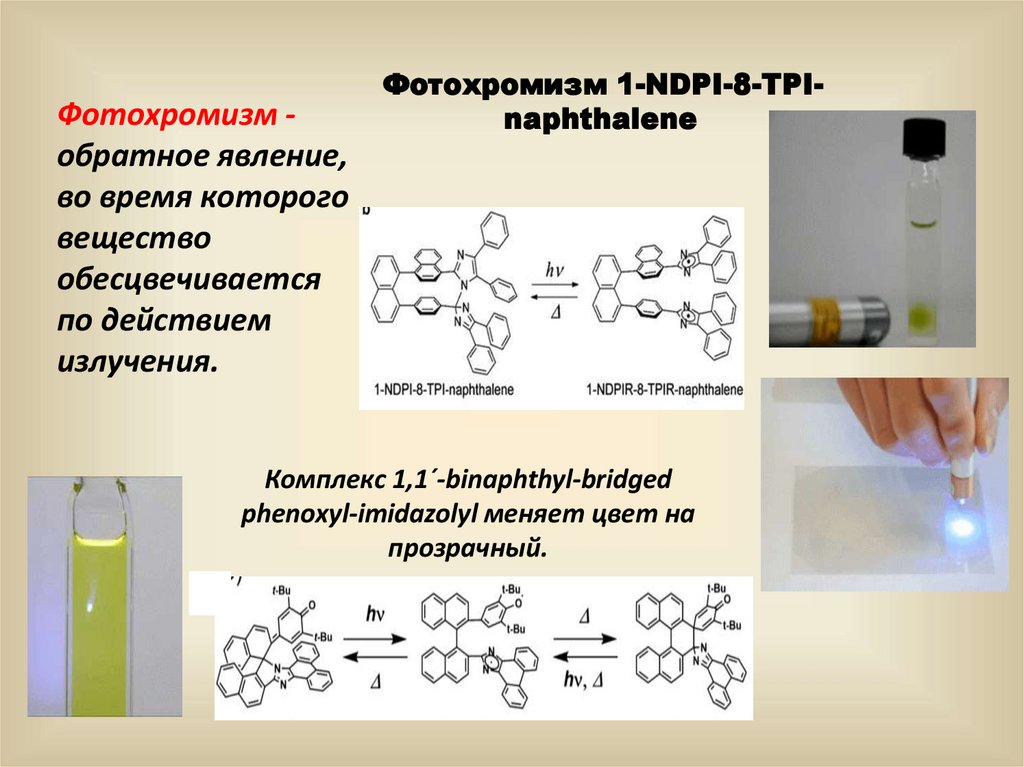
Фотохромизм обратное явление,во время которого
вещество
обесцвечивается
по действием
излучения.
Фотохромизм 1-NDPI-8-TPInaphthalene
Комплекс 1,1´-binaphthyl-bridged
phenoxyl-imidazolyl меняет цвет на
прозрачный.
21.
4. Классификация химических реакций потепловому эффекту:
экзотермические
Химические
реакции
эндотермические
22.
А) Экзотермические реакции – это реакции, протекающиес выделением энергии (теплоты).
Горение этилового спирта
C2H5OH + 3O2 = 2CO2 + 3H2O + Q кДж
Б) Эндотермические реакции – это реакции, протекающие с
поглощением энергии (теплоты).
Горение азота в атмосфере кислорода
N2 + O2 = 2NO – Q кДж
23.
5. Классификация химических реакций понаправлению протекания:
обратимые
Химические
реакции
необратимые
24.
• Обратимые – реакции, которые идут во взаимнопротивоположных направлениях.
N2 + 3H2
2SO2 + O2
Kat. P
Kat. P
2NH3 + Q
2SO3 + Q
• Небратимые – реакции, которые идут до полного израсходования
реагирующих веществ, в одном направлении
2H2S + 3O2
2H2O + 2SO2
AgNO3 + NaCl
AgCl + NaNO3
NaHCO3 + HCl
NaCl + CO2 + H2O
25.
6. Классификация химических реакций поусловиям проведения
каталитические
Химические
реакции
некаталитические
26.
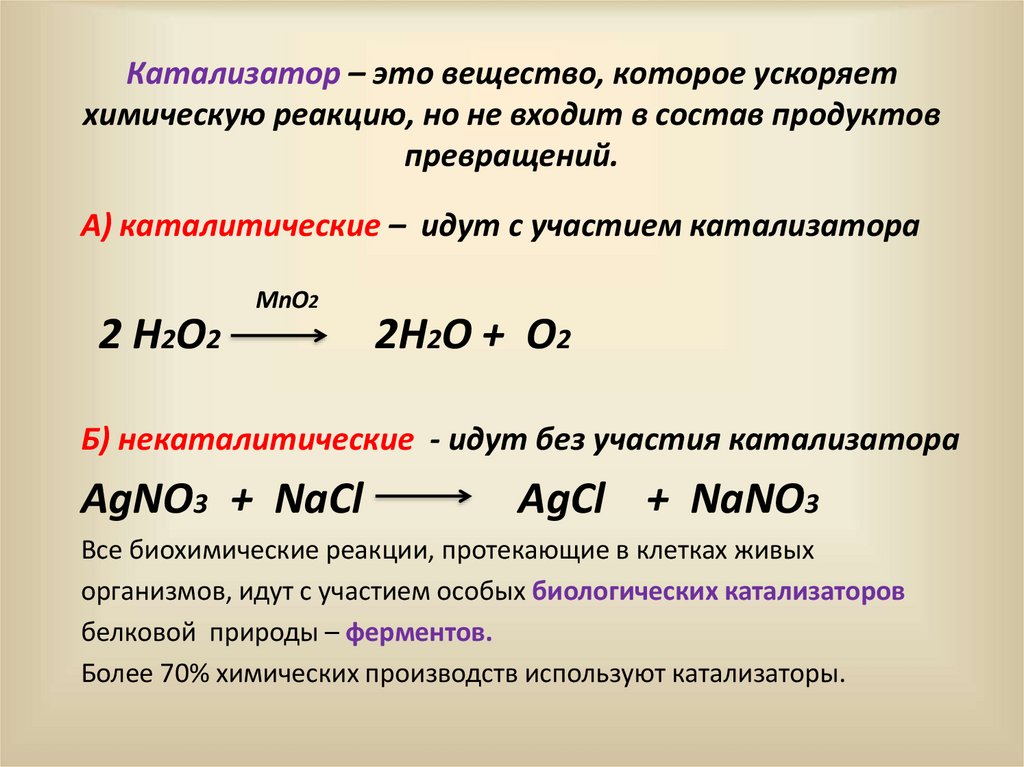
Катализатор – это вещество, которое ускоряетхимическую реакцию, но не входит в состав продуктов
превращений.
А) каталитические – идут с участием катализатора
2 H2O2
MnO2
2H2O + O2
Б) некаталитические - идут без участия катализатора
AgNO3 + NaCl
AgCl + NaNO3
Все биохимические реакции, протекающие в клетках живых
организмов, идут с участием особых биологических катализаторов
белковой природы – ферментов.
Более 70% химических производств используют катализаторы.
27.
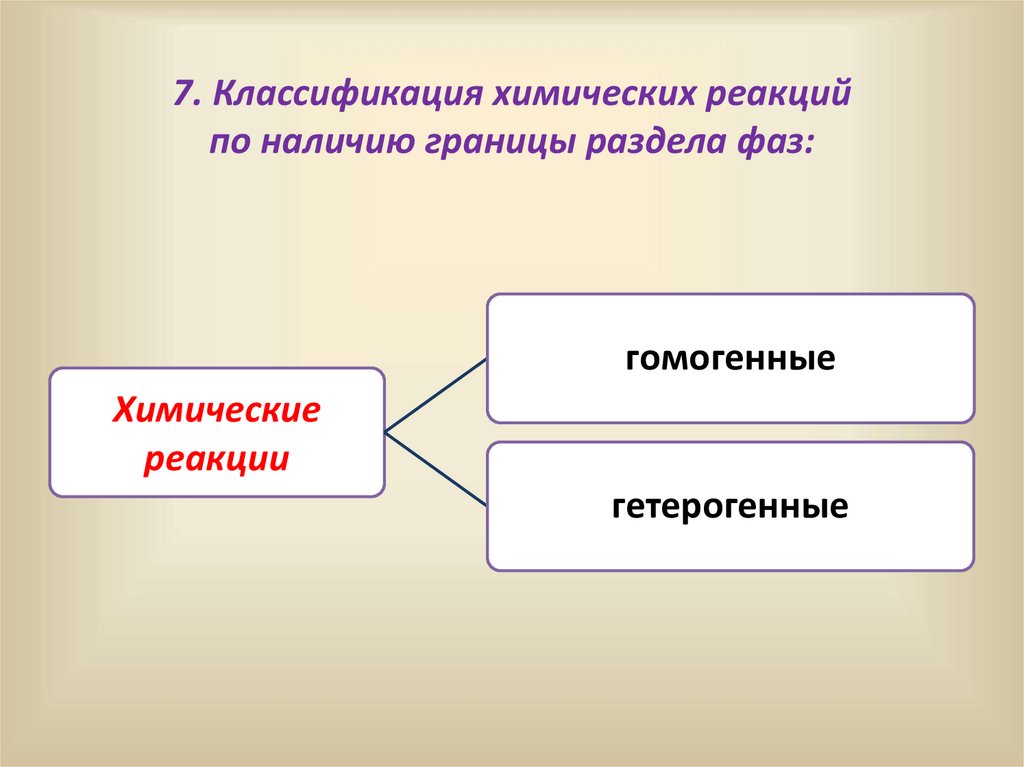
7. Классификация химических реакцийпо наличию границы раздела фаз:
гомогенные
Химические
реакции
гетерогенные
28.
А) Гомогенные – химические реакции, протекающие вовсем объеме однородной реакционной среды
(например в смеси газов, в растворе двух солей в воде).
2 СO (г) + O2 (г) = 2 CO2 (г)
Б) Гетерогенные – реакции, протекающие на поверхности
соприкосновения разных веществ в неоднородной среде.
Fe (тв.) + CuSO4 (ж.) = FeSO4 (ж.) + Cu (тв.)
29.
Задание 1 :• Дать характеристику реакции по всем возможным типам
Kat. P
классификации:
N2 + 3H2
2NH3 + Q
№ п/п Признак классификации
Тип реакции
1.
По числу и составу веществ
соединения
2.
По изменению степени
окисления
окислительновосстановительная
3.
По тепловому эффекту
экзотермическая
4.
По обратимости
обратимая
5.
По протеканию в различных
фазах
гомогенная
6.
По участию катализатора
каталитическая
30.
Готовимся к ЕГЭ. Задание № 17Из предложенного перечня выберите все типы
реакций, к которым относится взаимодействие магния
с раствором серной кислоты.
1) соединения
2) окислительно-восстановительная
3) обмена
4) необратимая
5) гомогенная
3апишите номepa выбранных ответов.
Ответ : 2, 4
31.
Готовимся к ЕГЭ. Задание № 17Из предложенного перечня выберите все типы реакций,
к которым можно отнести реакцию, протекающую при
нагревании хлорида аммония.
1) Экзотермическая
2) Окислительно-восстановительная
3) Необратимая
4) Разложения
5) Обратимая
Ответ : 4, 5
32.
Готовимся к ЕГЭ. Задание № 17Из предложенного перечня выберите все типы реакций, к которым
относится реакция протекающая при нагревании (Сu OH)2 CO3
1) замещения
2) эндотермическая
3) соединения
4) разложения
5) окислительно-восстановительная
3апишите номepa выбранных ответов.
(CuOH)2CO3 → 2 CuO + CO2 + H2O
Ответ : 2, 4
33.
Готовимся к ЕГЭ. Задание №17Из предложенного перечня выберите все реакции, которые
не являются окислительно-восстановительными.
1) Взаимодействие бромоводородной кислоты с оксидом марганца (IV)
4HBr(конц.) + MnO2 → MnBr2 + Br2 + 2H2O
2) Разложение дихромата аммония
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
3) Взаимодействие соляной кислоты с нитридом магния
Mg3N2 + 8 HCl → 3 MgCl2 + 2 NH4Cl
4) Взаимодействие сульфида цинка с кислородом
2ZnS + 3O2 → 2ZnO + 2SO2
5) Разложение гидрофосфата аммония при нагревании.
(NH4)2HPO4 →
H3PO4 +
Запишите номера выбранных ответов.
Ответ :
3, 5
2NH3
34.
Готовимся к ЕГЭ. Задание № 17Из предложенного перечня выберите все пары веществ,
взаимодействие которых между собой является
реакцией обмена:
1)
2)
3)
4)
5)
Этилен и вода
Соляная кислота и гидроксид магния
Ацетилен и бром (р-р)
Уксусная кислота и гидроксид меди (II)
Сульфат натрия (р-р) + хлорид бария раствор (р-р)
Запишите номера выбранных ответов.
Ответ : 2, 4, 5
35.
Готовимся к ЕГЭ. Задание № 17Из предложенного перечня выберите все вещества ,взаимодействие которых с
концентрированной серной кислотой является окислительно-восстановительной
реакцией:
1) оксид железа(II)
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
2) оксид цинка
ZnO + H2SO4 → ZnSO4 + H2O
3) бромид калия
2KВr+ 2H2SO4 → K2SO4+ SO2 + Br2 + 2H2O
4) сульфид меди(II)
4H2SO4 + CuS → CuSO4+ 4SO2 + 4H2O
5) иодид калия
Запишите номера
выбранных ответов.
1) Ответ: ____1345
8KI + 5H2SO4 → 4K2SO4 + 4I2+ H2S + 4H2O
36.
Классификация химических реакций37.
Источникиинформации:
• https://fipi.ru/ege/demoversii-specifikacii-kodifikatory
• https://ru.wikipedia.org/wiki
• https://vk.com/doc264481613_613610305
https://drive.google.com/file/d/1n5s7Tc-1X9h2_hA5yoTF..
https://disk.yandex.ru/i/_HwCbiVG4QyPow
• https://vk.com/club193731091




















 chemistry
chemistry








