Similar presentations:
Классификация химических реакций
1.
примечание2.
Химические реакции – химические процессы, врезультате которых из одних веществ
образуются другие отличающиеся от них по
составу и (или) строению.
При химических реакциях обязательно
происходит изменение веществ, при котором
рвутся старые и образуются новые связи между
атомами.
В
В
Е
Д
ЕПризнаки химических реакций:
Н1) Выделяется газ
2) Выпадет осадок
И3) Происходит изменение окраски веществ
4) Выделяется или поглощается тепло, свет
Е
Рассмотрим классификацию химических реакций по различным
признакам.
3.
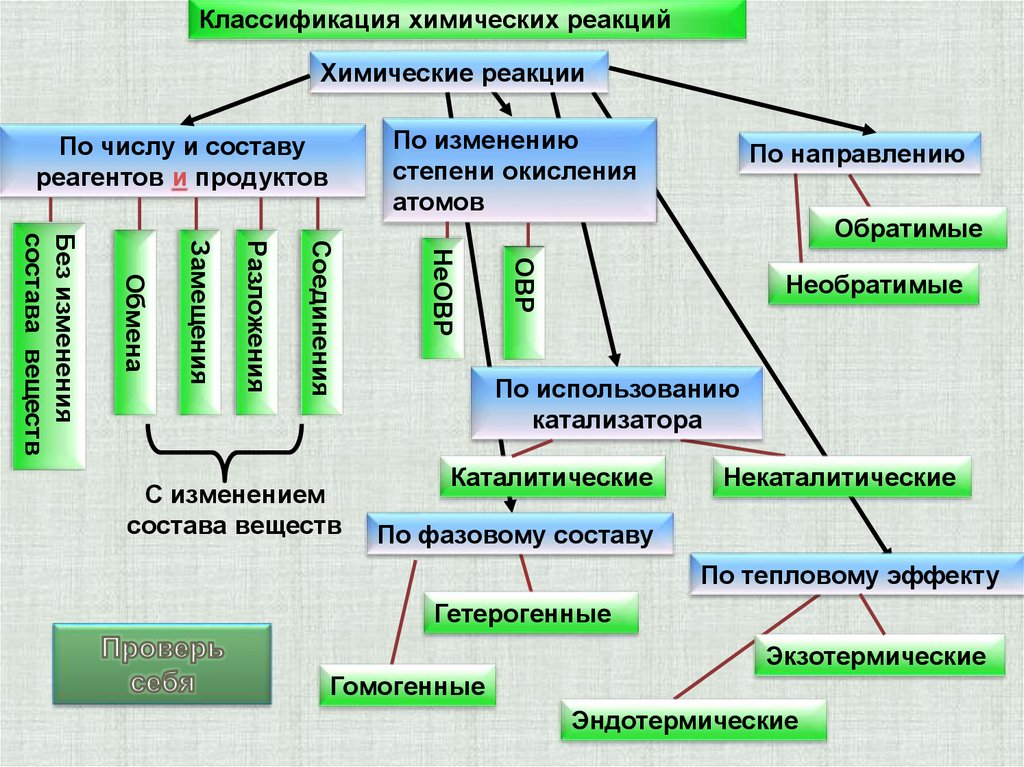
Классификация химических реакцийХимические реакции
По изменению
степени окисления
атомов
По числу и составу
реагентов и продуктов
Обратимые
ОВР
НеОВР
Соединения
Разложения
Замещения
Обмена
Без изменения
состава веществ
С изменением
состава веществ
По направлению
Необратимые
По использованию
катализатора
Каталитические
Некаталитические
По фазовому составу
По тепловому эффекту
Гетерогенные
Экзотермические
Гомогенные
Эндотермические
4.
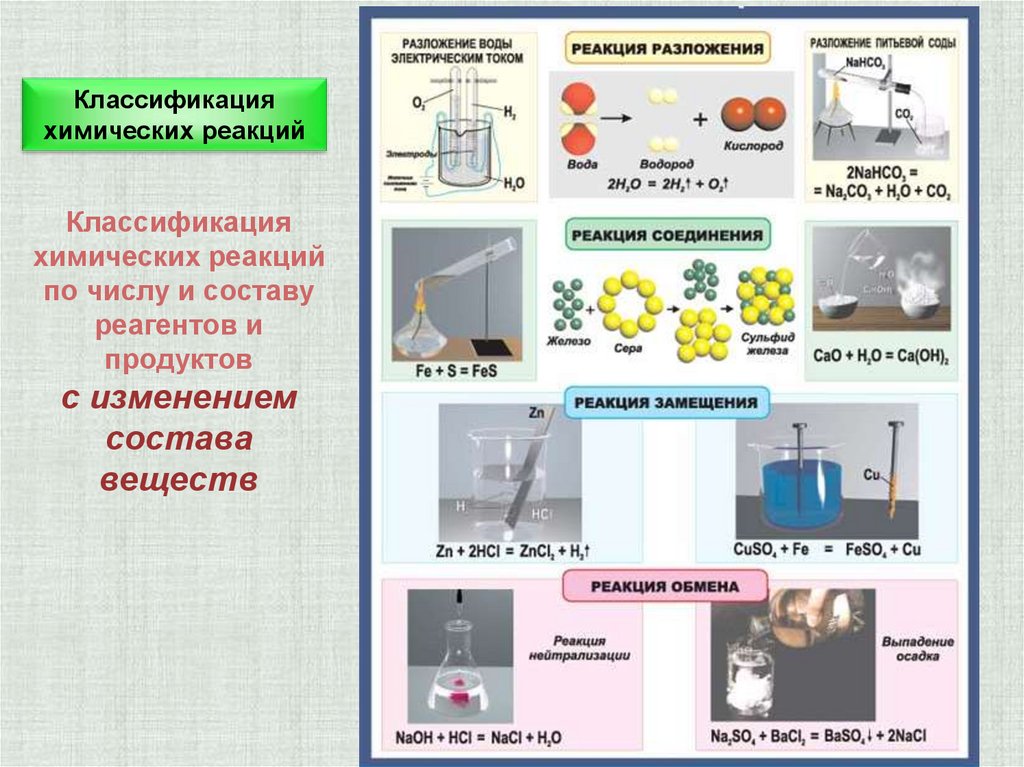
Классификацияхимических реакций
Классификация
химических реакций
по числу и составу
реагентов и
продуктов
с изменением
состава
веществ
5.
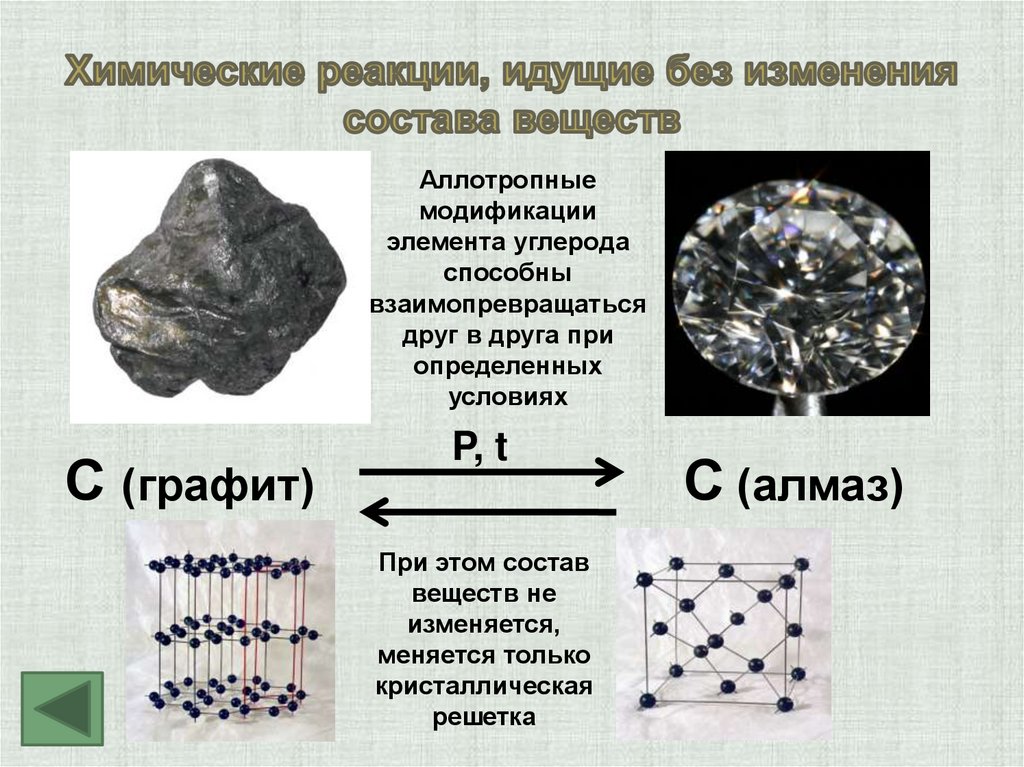
Аллотропныемодификации
элемента углерода
способны
взаимопревращаться
друг в друга при
определенных
условиях
С (графит)
P, t
При этом состав
веществ не
изменяется,
меняется только
кристаллическая
решетка
С (алмаз)
6.
Классификация по тепловому эффектуГорение парафина
Cu(OH)2 = CuO + H2O - Q
Определите тип химической реакции:
1) CH4 + O2 = CO2 + H2O +Q;
2) N2 + O2
2NO – Q;
3) CaCO3 = CaO + CO2 - Q;
*4) 2H2 + O2 = 2H2O + Q;
7.
Классификация химических реакций по участию катализаторакаталитические
В реакции горения сахара пепел
выполняет роль катализатора
Некаталитические
Горение меди в хлоре
Какие реакции являются каталитическими? Некаталитическими?
Cat (Fe)
1) N2 + 3H2
2NH3 + Q
3) NaOH + HCl = NaCl + H2O + Q
K (V2O5)
2) N2 + O2
2 NO - Q
*4) 2SO2 + O2
2SO3 + Q
8.
Классификация химических реакций по протеканию водинаковых или разных фазах
Гомогенные
(между веществами нет
поверхности раздела фаз)
CuSO4 +2 NaOH = Cu(OH)2 + Na2SO4
Гетерогенные
(реакция идет на поверхности
раздела фаз)
Взаимодействие соляной кислоты с
металлами
Определите тип химической реакции по данной классификации:
1) СuO (тв.) + Н2 (г.) = Сu(тв.) + H2O(ж.)
3) NaOH (p.) + HCl (p.) = NaCl (p.) + H2O (ж.)
2) Fe (тв.) + Н2SO4 (ж.) = FeSO4 (p.) + H2O (ж.)
*4) 2СО (г.) + О2 (г.) = 2СО2 (г.)
9.
Дать характеристику реакции c позиции разныхклассификаций:
Kат.
N2(г.) + 3H2(г.)
2NH3(г.) + Q
• Реакция соединения;
• Каталитическая;
• Гомогенная;
• Экзотермическая;
• Обратимая;
Выполните
самостоятельно:
• • ОВР;
1) NaOH (p.) + HCl (p.) = NaCl (p.) + H2O (ж.) + Q
2) С (тв.) + О2 (г.) = СО2 (г.)
*3) Mg (тв.) + НСl (p.) = MgCl2 (p.) + H2 (г.) + Q
10.
Анализ окислительно-восстановительнойреакции взаимодействия алюминия с иодом
11.
Классификация по изменению степени окисленияПроанализируйте самостоятельно:
1) NaOH (p.) + HCl (p.) = NaCl (p.) + H2O (ж.) + Q
2) С (тв.) + О2 (г.) = СО2 (г.)
*3) Mg (тв.) + НСl (p.) = MgCl2 (p.) + H2 (г.) + Q
12.
Реакции, протекающие одновременно в двух противоположныхнаправлениях, называются обратимыми.
↔
Знак
обратимости
Необратимые реакции идут только в одном направлении
Условия: образование осадка или слабого электролита (Н2О),
выделение газа, выделение большого количества теплоты









 chemistry
chemistry








