Similar presentations:
Типы химических реакций. Реакции обмена
1. Типы химических реакций
Реакции обменаУчитель химии
Андреева Татьяна Геннадьевна
МОУ № 10 городского поселения
«Рабочий поселок Чегдомын»
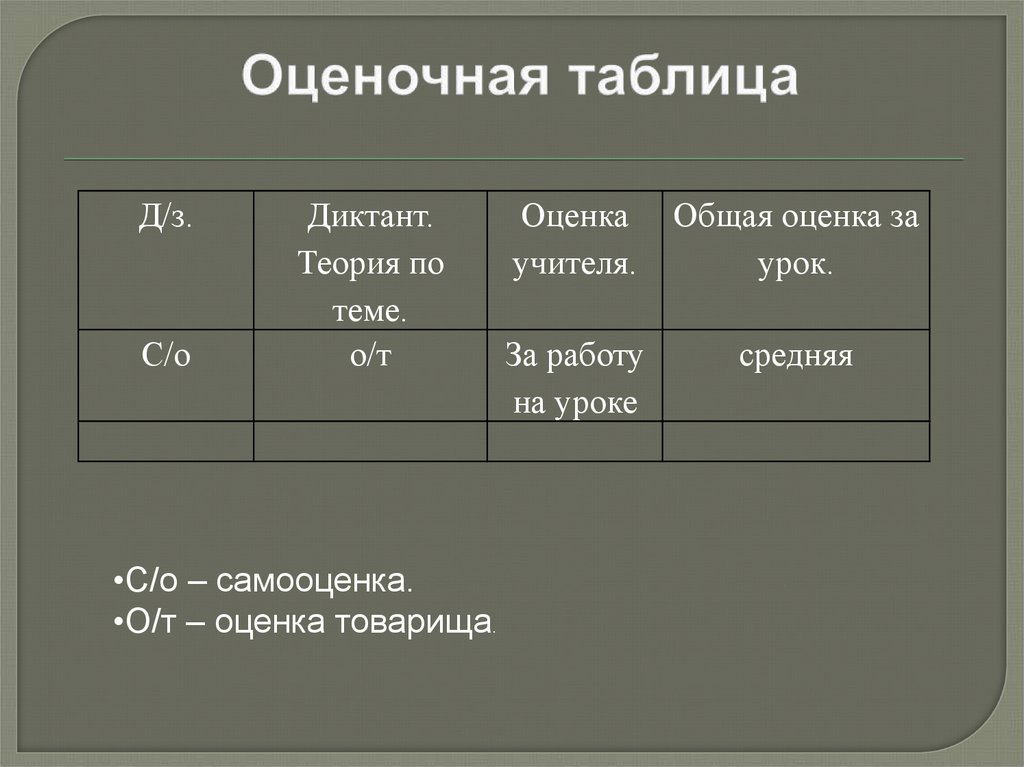
2. Оценочная таблица
Д/з.С/о
Диктант.
Теория по
теме.
о/т
•С/о – самооценка.
•О/т – оценка товарища.
Оценка
учителя.
Общая оценка за
урок.
За работу
на уроке
средняя
3. Домашнее задание
Упражнение 2: Запишите уравненияследующих реакций замещения:
а)оксид железа(III) + Алюминий → …..
Ответ: Fe2O3 + 2Al→2Fe + Al2O3
Б)оксид железа(III) + водород→ …..
Ответ: Fe2O3 + 3H2 →3H2O + 2Fe
Нет ошибок – отметка «5»
1 ошибка – отметка «4»
2 ошибки – отметка «3»
4. Правильные ответы:
3CuCl2+2Al = 2AlCl3+3Cu2. Ca+2HCl = CaCl2 + H2
3. 2Al + H2SO4→Al2(SO4)3+H2
4. 4P+5O2→P2O5
5. Разложения
6. Соединения
Нет ошибок – отметка «5»
1 ошибка – отметка «4»
2 ошибки – отметка «3»
1.
5. Чем отличаются эти реакции?
1.2.
3.
4.
Fe+Cl2=FeCl2
2HgO 2Hg+O2
Fe+CuSO4=FeSO4+Cu
CaCO3 + 2HCl = CaCl2 +
H2CO3
6. Цели урока
Наурок пришли мы дружно
Что же здесь узнать нам нужно?
Суть реакции обмена
Всем умело объяснять!
Уметь писать все уравнения
И предвидеть, что писать!
7.
Реакцииобмена - это такие реакции, в
результате которых два сложных
вещества обмениваются своими
составными частями.
AB+CD = AC+BD
Fe(NO3)3
+ 3NaOH=
FeCl3 + NaOH =
Например
2NaI+Pb(NO3)2 = PbI2↓ + 2NaNO3
8.
Два сложных вещества в реакциювступают
В ходе которой, свои составные
части меняют.
Вот такой процесс взаимозамены
Называют реакцией обмена
9.
2NaOH+ CuCl2 = Cu(OH)2 ↓+ 2NaCl
10.
Реакциинейтрализации – это
реакции обмена между кислотами и
щелочами.
H2SO4 = K2SO4 + H2O
NaOH + HCl =
KOH+
11. Na2CO3 + 2HCl = 2NaCl + H2CO3
H2CO3= H2O + CO2↑
Поэтому уравнение реакции
следует записать так:
Na2CO3
+ 2HCl =2NaCl+H2O+CO2↑
12.
Реакцииобмена, протекающие в
растворах, идут до конца только в
том случае, если в результате их
образуется осадок, газ или вода
13.
Если выделится газ - Это раз;И получится вода - Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок" - говорим мы.
Это третий важный пункт.
Химик правила обмена
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок - Вот тогда - порядок!
14.
Еслик раствору хлорида натрия прилить
раствор гидроксида калия, то никаких
признаков реакции не будет – реакция не
идет, так как в результате ее не
образуется ни осадка, ни газа, ни воды:
NaCl + KOH = NaOH+KCL
15.
16.
Какие из реакций обмена будут протекатьдо конца?
• BaCl2 + AgNO3→
• Cu(NO3)2 + NaCl→
• Pb(NO3)2 + K2S→
17. Какие из реакций обмена будут протекать до конца?
MgCl2 + K2SO4→
HNO3 + ZnSO4→
Ca(NO3)2 + H3PO4→
Ba(NO3)2 + Na2SO4→
18. Допишите уравнения химических реакций и укажите их тип:
K2O+ N2O5 = KNO3
Fe2O3 + C = Fe + CO2
Fe2O3 + HCl =
Fe(OH)3 = Fe2O3 + H2O
Al(OH)3+ H2SO4 =
N2O5 + H2O = HNO3
NH4Cl = NH3 + HCl
Al + H2SO4 =
19. Итоги урока
сегодняна уроке мы с вами изучили
новый тип реакции – реакции обмена.
Провели лабораторную работу.
Сформулировали правило, согласно
которому протекают реакции обмена
между растворами веществ.
20. Домашнее задание
обязательное: прочитать§32, задание
№ 1 на стр. 167;
дополнительное: задание № 2 на стр.
168;
творческое: создать презентацию на
тему «Реакции обмена».
21.
Сейчас прозвенит долгожданный звонок.Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши, надеюсь привычно
Что будут они «хорошо» и «отлично»
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!
22.
Литература:•Габриелян О.С. химия 8 класс. – М.: Дрофа, 2008.
•Габриелян О.С., Березкин П.Н., Ушакова А.А. химия.
8 класс: контрольные и проверочные работы к
учебнику Габриелян О.С., химия 8 класс. – М.: Дрофа,
2007 .
•Габриелян О.С., Воскобойников Н.П., Яшукова А.В.
химия 8 класс. Настольная книга учителя. – М.:
Дрофа, 2007 .
•Учебное электронное издание химия (8 – 11 класс).
Виртуальная лаборатория.




















 chemistry
chemistry








