Similar presentations:
Типы химических реакций. Реакции обмена
1.
Типы химическихреакций.Реакции
обмена
2.
Мы – умные, мы – дружные,Мы – внимательные, мы –
старательные,
Мы отлично учимся, всё у нас
получится!
3.
1.Вставьте пропущенное слово:Реакции, в результате которых сложное вещество
разлагается на несколько других, более простых
веществ называются реакциями ….
Реакции между простым и сложным веществом,
в результате которых атомы простого вещества
замещают атомы одного из элементов сложного
вещества, называются реакциями ….
Реакции, в которых из нескольких простых или
сложных
веществ образуется одно более
сложное вещество, называются реакциями….
4.
2.Соотнесите типы химических реакций и схемы реакций:Напишите уравнения реакций и расставьте коэффициенты.
1 вариант
2 вариант
1. соединения
А. Fe + O2 → FeO
1. соединения А. CuO + Al → Al2O3 + Cu
2. разложения
Б. PbCl2 + Zn→ Pb +ZnCl2 2. разложения Б. N2 + O2 → NO
3. замещения
В. Fe + HCl → FeCl2 +H2
3. замещения В. MgCO3 → MgO + CO2
Г. H2O → H2 + O2
Г. Li + N2 → Li3N
Д. SO2 + H2O → H2SO3
Д. Zn + HCl → ZnCl2 + H2
Е. KNO3 → KNO2 + O2
Е. Al(OH)3 →Al2O3 + H2O
5.
3.Запишите уравнения следующихреакций
Хлорид меди(II) +алюминий→хлорид
алюминия +медь
Кальций + кислород→ оксид кальция
Гидроксид алюминия → оксид
алюминия + вода
Расставьте коэффициенты
6.
1) 2HgO = 2Hg + O22) CaCO3 = CaO + CO2
3) CuSO4 + Fe = Cu + FeSO4
4) CuO + H2 = Cu + H2O
5) 2H2 + O2 = 2H2O
6) H2SO4 + 2KOH = K2SO4 +2H2O
7) BaO + SO2 = BaSO3
7.
Не спеши хватать пробирку,А инструкцию читай.
Убедись, что ты все понял,
Вот тогда и начинай.
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад.
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Всякое в опыте может случиться,
Внимательным будь и не оплошай.
Тебе всегда поможет учитель,
Паники только не допускай!
8.
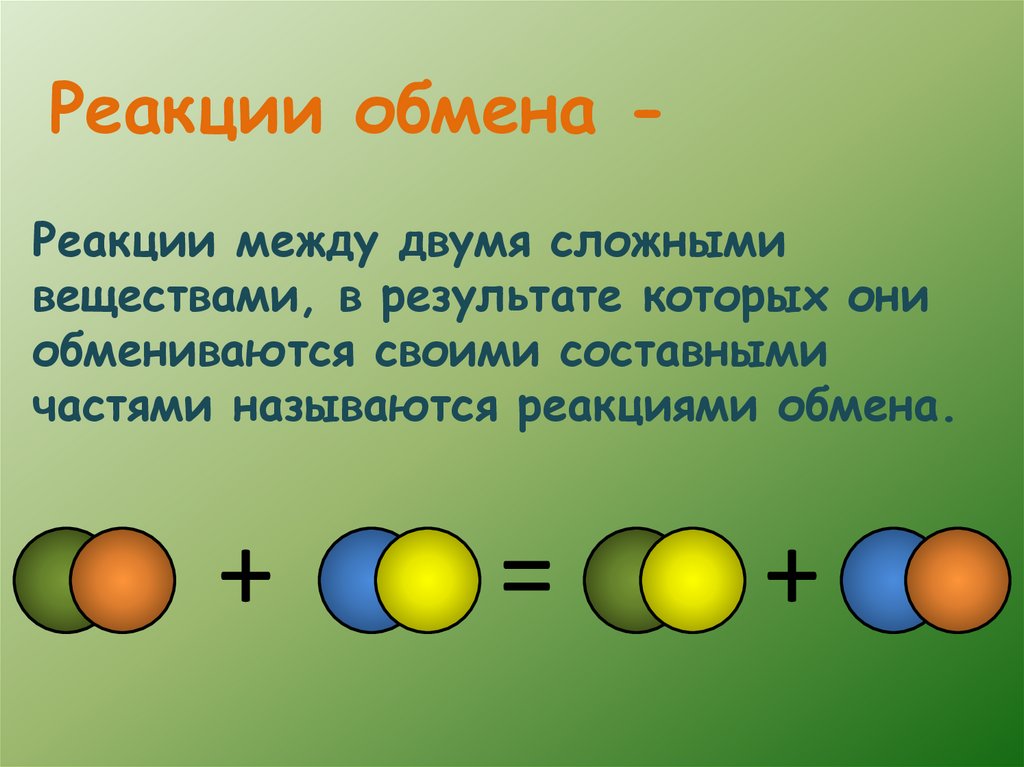
Реакции обмена Реакции между двумя сложнымивеществами, в результате которых они
обмениваются своими составными
частями называются реакциями обмена.
+
=
+
9.
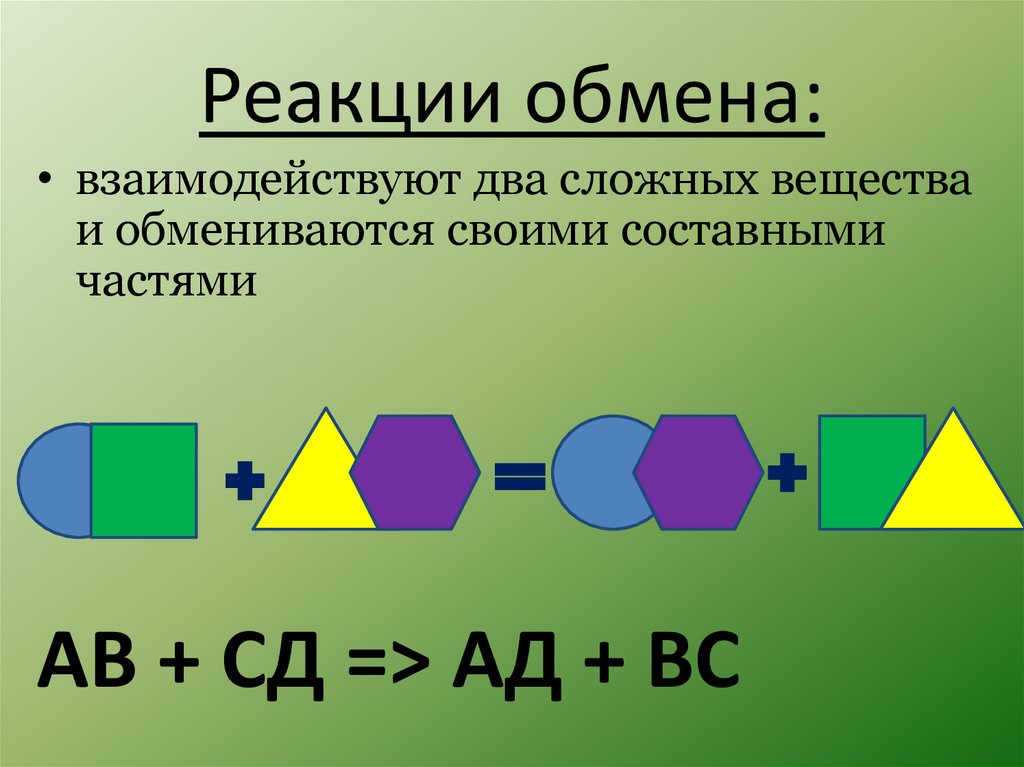
Реакции обмена:• взаимодействуют два сложных вещества
и обмениваются своими составными
частями
АВ + СД => АД + ВС
10.
CuO +2 HCl – CuCl2 + H2OMgO + H2SO4 – MgSO4 + H2O
AgNO3 + HCl – AgCl + HNO3
11.
•Реакции обмена в быту•Разрыхлители теста.
•Определение качества воды.
•Устранение жесткости воды.
•Определение качества
продуктов питания.
12.
ФизкультминуткаЕсли выделится газЭто раз;
И получится вода Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
13.
По числу вступивших в реакциювеществ
Реакции
соединения
Реакции
разложения
Реакции
замещения
Реакции
обмена
Из нескольких
веществ
получается одно
новое
Из одного вещества
получается несколько
новых
Атомы простого
вещества
замещают атомы
одного из
элементов в
составе сложного
Два сложных
вещества
обмениваются
своими составными
частями
S + O2 = SO2
2H2O = 2H2 + O2
Zn + 2HCl =
ZnCl2 + H2
NaOH + HCl =
NaCl + H2O
14.
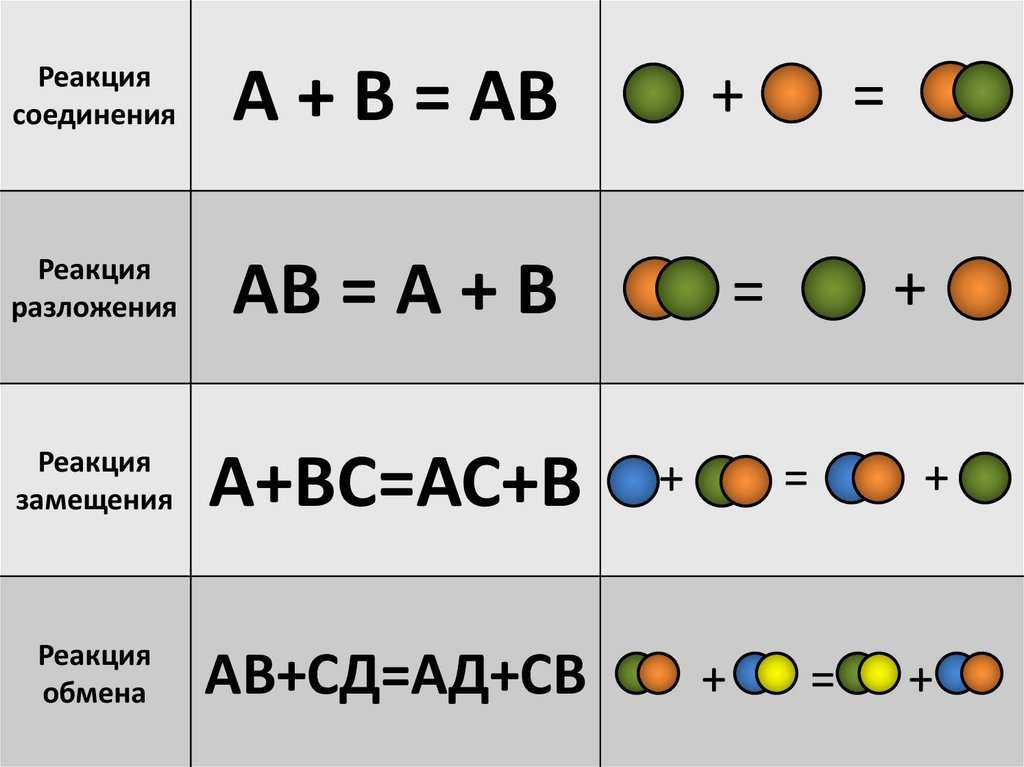
Реакциясоединения
А + В = АВ
Реакция
разложения
АВ = А + В
Реакция
замещения
А+ВС=АС+В
Реакция
обмена
АВ+СД=АД+СВ
+
=
+
=
=
+
+
+
=
+
15.
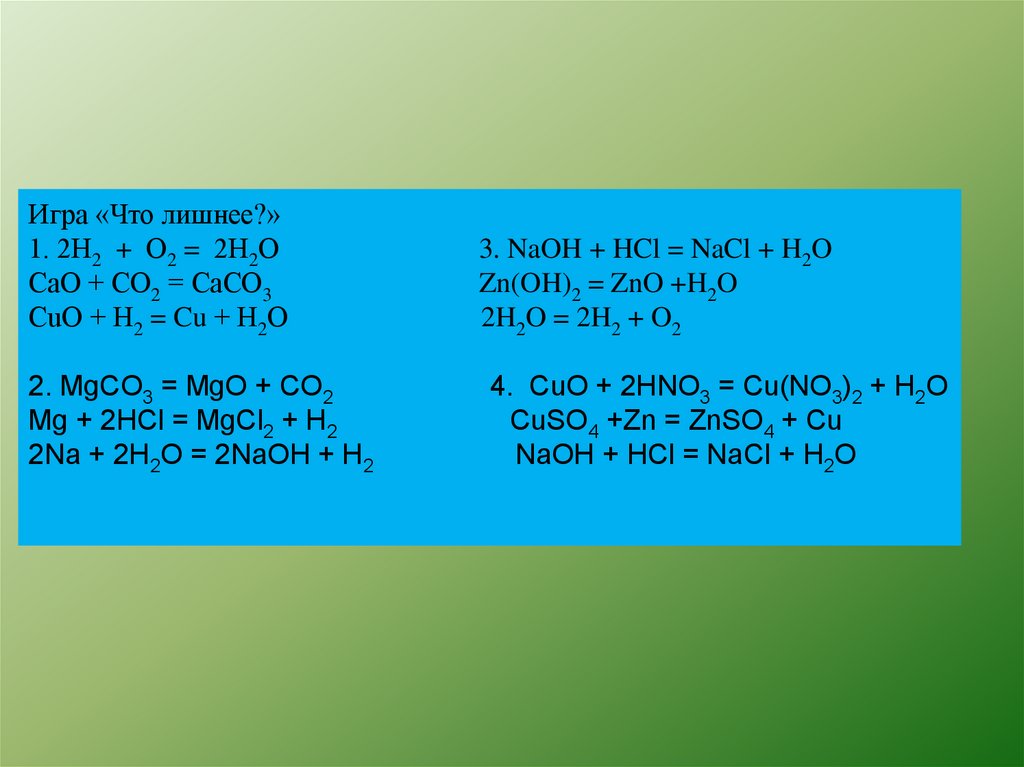
Игра «Что лишнее?»1. 2Н2 + О2 = 2Н2О
СаО + СО2 = СаСО3
СuО + Н2 = Cu + Н2О
2. MgCO3 = MgO + CO2
Mg + 2HCl = MgCl2 + H2
2Na + 2H2O = 2NaOH + H2
3. NaOH + HCl = NaCl + H2O
Zn(OH)2 = ZnO +H2O
2H2O = 2H2 + O2
4. CuO + 2HNO3 = Cu(NO3)2 + H2O
CuSO4 +Zn = ZnSO4 + Cu
NaOH + HCl = NaCl + H2O
16.
Задание «Крестики-нолики». Ктобыстрее найдёт выигрышный путь,
состоящий из уравнений реакций
замещения
Fe2O3 + 3H2 = 3H2O + 2Fe 4NO2 + 2H2O + O2 = 4HNO3
Cl2 + 2KI = 2KCl + I2
4AgNO3 = 2Ag2O + 4NO2 + O2
Na2SO4 + BaCl2 = BaSO4 +2NaCl 2Zn + O2 = 2ZnO
2Al + 6HCl = 2AlCl3 + 3H2 Cu(OH)2 = CuO + H2O
2HCl + Zn = ZnCl2 + H2
17.
Домашнее задание•обязательное: прочитать §32, задание № 1 на
стр. 167;
•дополнительное: задание № 2 на стр. 168;
•творческое: подготовить сообщение или
презентацию на тему «Реакции обмена в быту».





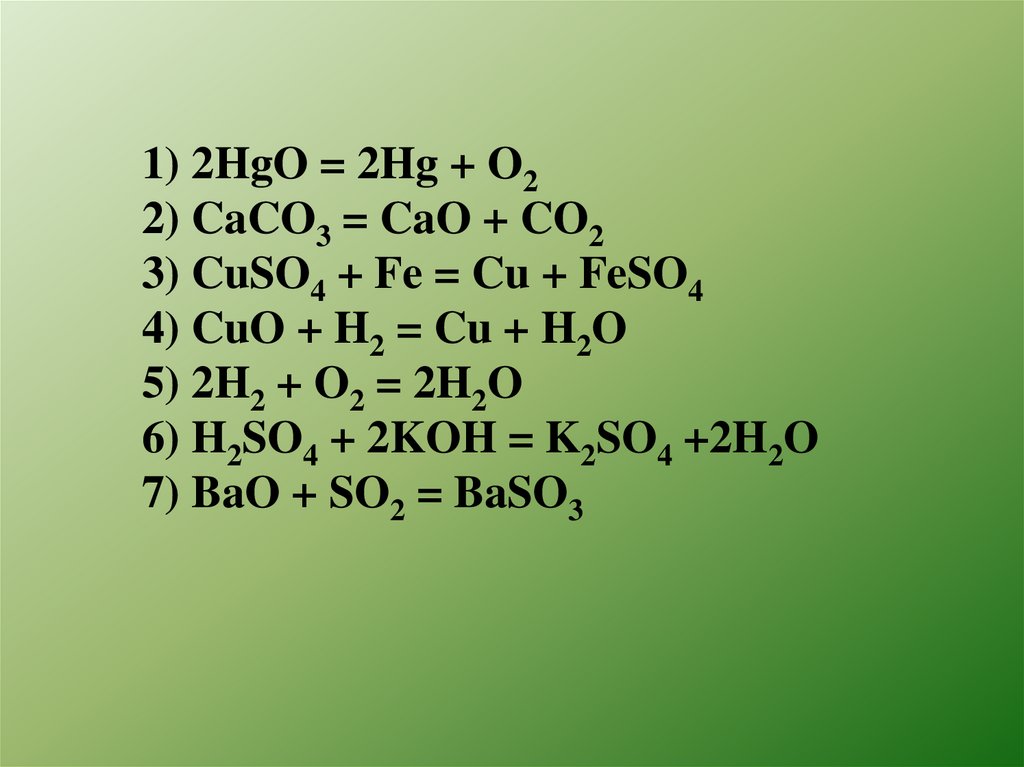







 chemistry
chemistry








