Similar presentations:
Очистка поверхности медного сплава
1. Тема: «Очистка поверхности медного сплава»
1Авторы презентации:
Отрубянникова Алина
Ушакова Елизавета
Руководитель работы:
Заичко Галина Николаевна
учитель химии, к.т.н.
ГБОУ СОШ № 1900
2.
23.
34.
45.
56.
67. Разработка методики качественного определения катионов меди и никеля в растворах (в пробирках)
№пп
Добавляемый реактив
1
Исходные растворы
2
Раствор аммиака 10 % к образцу № 1
3
Раствор желтой кровяной соли
К4[Fe(CN)6] к образцу № 1
4
Раствор аммиака 10 % к образцу № 3
5
Раствор красной кровяной соли
К3[Fe(CN)6] к образцу № 1
6
Раствор аммиака 10 % к образцу № 5
Результаты опытов c модельными
растворами
Ni2+
1
2
3
Cu2+
4
1
2
3
4
7
8. Получение гексацианоферрата(II) меди(II) из тетраамминмеди(II)
1 – исходный 10 % раствор сульфата меди(II);2 – гидроксид тетраамминмеди(II);
3 – к раствору 2 добавлена соляная кислота;
4 – к раствору 3 добавлен гексацианоферрат(II) калия
8
9. Образование гексацианоферратов и аммиакатов в смесях модельных растворов СuSO4 и NiSO4
№образца
Добавляемый реактив
Отношение объемов растворов
СuSO4 и NiSO4
5:1
1
1:1
Раствор аммиака 10 %
2
Раствор желтой кровяной соли
К4[Fe(CN)6]
3
Раствор аммиака 10 %
к образцу № 2
9
10. Разработка методики качественного определения катионов меди и никеля в растворах (капельный метод анализа)
Пояснения к фотографиямНанесенный на бумагу модельный
раствор
СuSO4
NiSO4
Образование
гексацианоферратов(II) на бумаге
Растворение гексацианоферратов(II)
при добавлении капли раствора
аммиака
Образование гексацианоферрата(II)
на бумаге и его взаимодействие с
NH3*H2O (цифра – номер
модельного раствора СuSO4)
1
3
2
4
10
11. Анализ состава поверхности «грязного» мельхиора последовательной обработкой его реактивами: NaOH, HCl (разб.), H2SO4(разб),
HNO3 (конц)Анализ отработанного
раствора реактива
Реактив
Исходный
раствор
и после
добавления
NH3*H2O
На
фильтровальной
бумаге с
К4[Fe(CN)6]
1
2
3
Ложки после
обработки
реактивом
Состав
загрязнений
4
5
До
обработки
HCl (разб.)
CuO, Cu2O, NiO,
(СuOH)2CO3
Возможно NiS
11
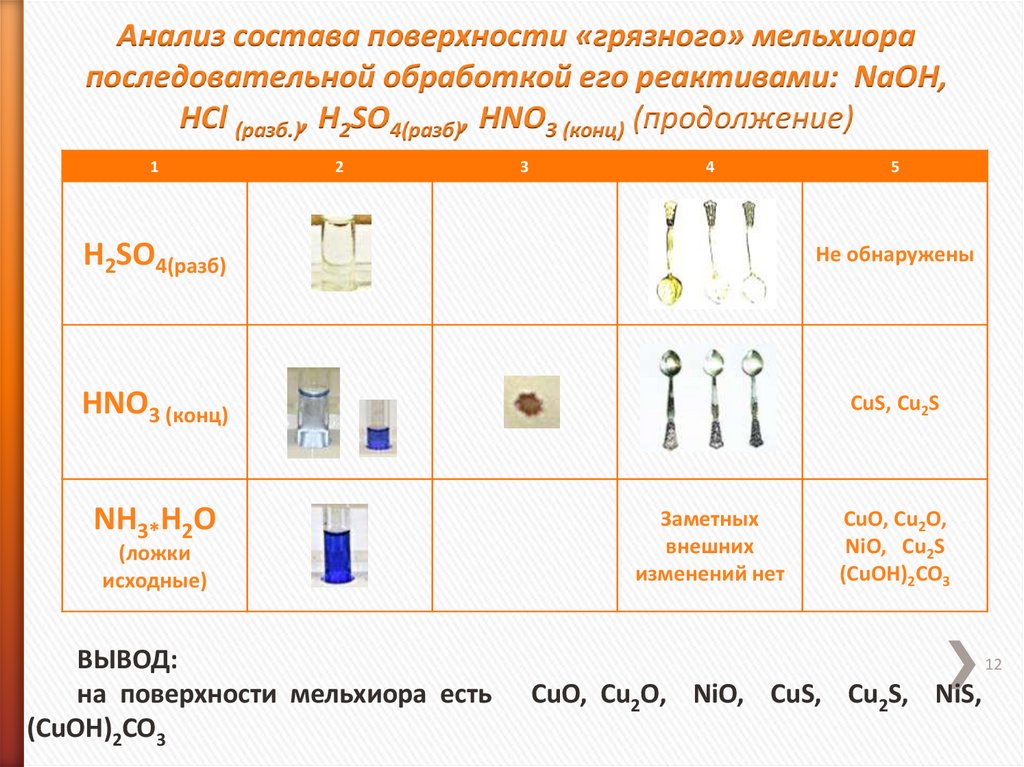
12. Анализ состава поверхности «грязного» мельхиора последовательной обработкой его реактивами: NaOH, HCl (разб.), H2SO4(разб),
HNO3 (конц) (продолжение)1
2
3
4
5
H2SO4(разб)
Не обнаружены
HNO3 (конц)
CuS, Cu2S
NH3*H2O
(ложки
исходные)
ВЫВОД:
на поверхности мельхиора есть
(СuOH)2CO3
Заметных
внешних
изменений нет
CuO, Cu2O,
NiO, Cu2S
(СuOH)2CO3
12
СuO, Cu2O, NiO, CuS, Cu2S, NiS,
13. Способ очистки мельхиора:
«прокипятитьизделие 15-20 минут
в
алюминиевой посуде с раствором питьевой
соды
(вариант
—
соды
и поваренной соли). Можно дно обычной
посуды выстлать фольгой, на которую
уложить
очищаемый
мельхиор.
Содержание солей в литре раствора — 2-3
столовые ложки на 1 литр воды»
13
14. Очистка мельхиора кипячением в растворе соды с добавлением алюминиевой фольги
Опыт 1. Взаимодействие алюминиевой фольги с раствором содыК раствору после кипячения добавили
Условия опыта
Al(OH)3
(AlCl3+ NH3*H2O)
NH3*H2O
Al(OH)3 + NaOH
HCl, затем NH3*H2O
Al(OH)3 + HCl
Без кипячения
Кипячение 15 мин
Кипячение 45 мин
2Al + 2Na2СO3 + 8H2O = 2Na[Al(OH)4] + 2NaHCO3 + 3H2↑
60 – 200 0С
2NaHCO3
=
Na2СO3 + Н2О + СО2↑
Na[Al(OH)4] + СО2 = Al(OH)3↓ + NaHCO3
14
15. Очистка мельхиора кипячением.
Сравнение результатов: а) до опыта и б) после опыта1.Вид раствора
2.Контакт ложки
и фольги
1. Раствор соды
2. Контакта нет
1. Раствор соды
2. Контакт есть
1. Раствор соли
2. Контакта нет
1. Раствор соли
2. Контакт есть
Лакмусовая
бумага
Ложки
а
Алюминиевая фольга
Al3+ в растворе
б
а
б
а
б
а
б
а
б
а
а
б
а
Раствор соли
Катод (сплав):
Н2О + 2ē → Н2 + 2ОНАнод (алюминий): Al0 - 3ē → Al3+
б
б
Раствор соды
Катод (сплав):
Н2О + 2ē → Н2↑ + 2ОНАнод (алюминий): Al0 - 3ē → Al3+
15
- связывание ионов Al3+ + 3ОН- = Al(OH)3↓
t
- разложение гидроксида алюминия 2Al(OH)3 = Al2O3 + 3Н2О
16. Выводы:
Медные сплавы обладают набором уникальных свойств, позволяющихшироко использовать их в народном хозяйстве. Мельхиор при хранении
покрывается темным налетом, который нужно удалять.
Сделан вывод о составе загрязнений. Загрязнения представлены
соединениями: CuO, Cu2O, NiO, CuS, Cu2S, NiS, (СuOH)2CO3 .
Разработана и использована методика качественного метода определения
катионов Cu2+ и Ni2+ в растворах с использованием желтой кровяной
соли и гидрата аммиака.
Изучен наименее трудоемкий способ очистки мельхиора – кипячение
в растворе соды в присутствии алюминия (электрохимический процесс).
Предложено объяснение химических процессов, протекающих при его
16
использовании. Способ рекомендуется для применения на свежем
воздухе или в проветриваемом помещении, так как возможно выделение
сероводорода.
17.
В результате проделанной работы мы приобрелиопыт по выявлению проблемы, постановке
задач исследования, их решения с
привлечением литературных данных,
организации эксперимента и его выполнения
СПАСИБО ЗА ВНИМАНИЕ!
17
















 chemistry
chemistry








