Similar presentations:
Химический метод. Качественный анализ
1. Лекция на тему:
«Химический метод. Качественныйанализ»
2.
Аналитическая химия подразделяется на2 раздела:
- качественный анализ;
- количественный анализ.
3.
Задачакачественного
анализа
–
установить
качественный
состав
исследуемого
вещества
(из
каких
компонентов (ионов) состоит).
Задача
количественного
анализа
–
установить количественное соотношение
составных частей в веществе (измеряется
величина аналитического сигнала – масса
осадка, сила тока, интенсивность линии
спектра).
Качественный анализ всегда предшествует
количественному.
4.
Химические методы анализа основаны нахимических реакциях.
Основные типы реакций:
-реакции осаждения;
-кислотно-основные реакции (реакция нейтрализации);
-реакции комплексообразования;
-ОВР.
К химическим методам относят:
- гравиметрический (весовой) анализ - основан на
измерении массы определяемого вещества;
- титриметрический (объемный) анализ - основан
на измерении объема реагента.
5. Качественный анализ
В основе качественного анализа лежаткачественные реакции (аналитические реакции или
реакции открытия).
Вещество, вызывающее эту реакцию – реагент
А (иссл.в-во) + В (реагент) = АВ (продукт реакции)
В случае необходимости обнаружения какого-либо
компонента обычно фиксируют аналитический
сигнал (появление осадка, окраски, линии в спектре
и т.д.)
6. Требования, предъявляемые к химическим аналитическим реакциям
1. Реакция должна сопровождаться характерным внешнимпризнаком (эффектом).
2. Должна быть легко выполнима.
3. Должна быть специфической (избирательной), т.е.
проходит только с обнаруживаемым веществом и приводит к
образованию характерных только для нее продуктов.
Специфичные реакции предназначены для того, чтобы
обнаружить вещество в присутствии других веществ. Если
вещество не обладает характерными свойствами, с ним
проводят аналитическую реакцию.
7. Требования, предъявляемые к химическим аналитическим реакциям
4. Реакция должна быть чувствительной (должна открыватьмалые количества определяемого компонента).
Чувствительность аналитической реакции зависит от
интенсивности регистрируемого аналитического свойства.
Наиболее чувствительны реакции,
протекающие с
образованием осадка и изменением цвета.
Чувствительность реакции характеризуется открываемым
минимумом или минимальной концентрацией.
8.
Открываемым минимумом называют наименьшееколичество вещества (в мг), которое можно обнаружить
данной реакцией.
Минимальное разбавление – минимальная концентрация
раствора, при которой протекает реакция, выражают в виде
соотношения массы вещества к объему раствора (1: 250000
– 1 г вещества в 250000 см3 раствора). Величина, обратная
минимальному разбавлению, называется предельным
разбавлением.
5. Реакция должна быть необратимой.
6. Реакция должна протекать с высокой скоростью.
7.Реакция
должна
протекать
стехиометрическому уравнению.
строго
по
9. Способы выполнения химических аналитических реакций
1. «Мокрый» метод- реакции в растворах электролитов2. «Сухой» метод предполагает использование исходных
веществ для реакций в твердом состоянии:
- по окрашиванию пламени (К+ - фиолетовый, Na+ желтый, Ва2+ - зеленый, Са2+ - кирпично-красный);
- растирание сухого вещества и реактива (метод
применяется в случае, когда при растирании твердых веществ
образуется
окрашенное
соединение
или
выделяются
газообразные вещества):
CoSO4 + 4NH4SCN = (NH4)2[Co(SNC)4] + (NH4)2SO4
ярко-синее
розовые светло-желтые
кристаллы
соединение
кристаллы
10.
3. Дробный анализ – обнаружение ионов с помощьюспецифических реакций в отдельных порциях
анализируемого раствора, производимых в любой
последовательности. Дробный анализ применяют в
тех случаях, когда состав исследуемого образца
известен и требуется только проверить
отсутствие некоторых примесей.
4. Систематический анализ заключается в
определенной
последовательности
выполнения
реакций, при которой к обнаружению определенного
иона приступают лишь после того, как все другие ионы,
мешающие его обнаружению, будут предварительно
обнаружены и удалены из раствора.
11. При систематическом ходе анализа ионов выделяют отдельные группы, которые с определённым реактивом при определённых условиях
дают тождественные химическиереакции.
Реактив, позволяющий выделить из раствора группу ионов,
называется групповым реактивом, дающим одинаковый
эффект с несколькими ионами (группой ионов).
Например, при взаимодействии с раствором H2SO4 катионы
кальция, стронция и бария образуют белые осадки их
сульфатов:
Ca2++SO4 2- CaSO4 ,
Sr2++SO4 2- SrSO4 ,
Ba2++SO4 2- BaSO4 .
H2SO4 - групповой реагент на данные ионы.
12. Требования, предъявляемые к групповым реактивам 1. Количественное осаждение ионов всей группы (это значит, что те количества,
которые останутся в растворебудут
очень
малы
≤
10-5
моль/л.
2. Осадки, образующиеся под действием используемого
группового реагента должны хорошо растворяться в
определенных
условиях.
3. Избыток группового реагента должен легко удаляться и не
мешать
проведению
дальнейших
определений.
13. 4. Четкость разделений – групповой реактив должен обеспечивать количественное осаждение элементов одной группы, но никаких
ионов другой группы, т.е. не должнопроисходить
соосаждения.
5. Групповые реагенты должны быть дешевы и доступны,
неядовиты, не обладать сильным запахом и т.д.
Анализ катионов всегда предшествует анализу анионов.
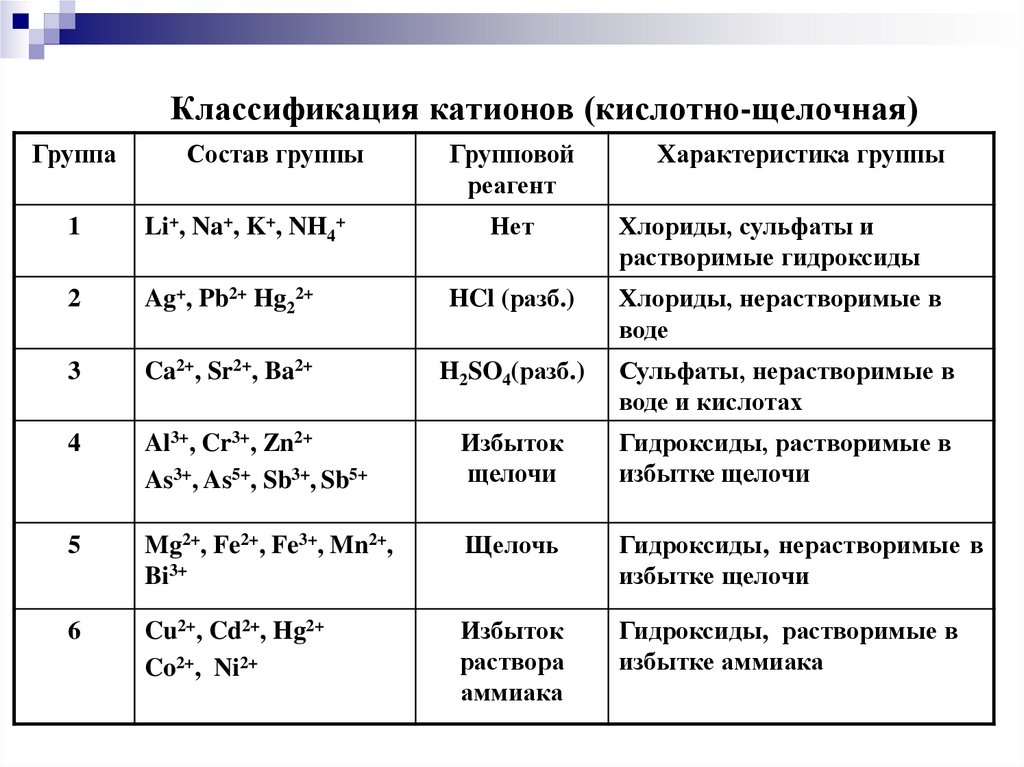
14. Классификация катионов (кислотно-щелочная)
ГруппаСостав группы
Групповой
реагент
Характеристика группы
1
Li+, Na+, K+, NH4+
Нет
Хлориды, сульфаты и
растворимые гидроксиды
2
Ag+, Pb2+ Hg22+
HCl (разб.)
Хлориды, нерастворимые в
воде
3
Ca2+, Sr2+, Ba2+
H2SO4(разб.)
Сульфаты, нерастворимые в
воде и кислотах
4
Al3+, Cr3+, Zn2+
As3+, As5+, Sb3+, Sb5+
Избыток
щелочи
Гидроксиды, растворимые в
избытке щелочи
5
Mg2+, Fe2+, Fe3+, Mn2+,
Bi3+
Щелочь
Гидроксиды, нерастворимые в
избытке щелочи
6
Cu2+, Cd2+, Hg2+
Co2+, Ni2+
Избыток
раствора
аммиака
Гидроксиды, растворимые в
избытке аммиака
15. Аналитическая классификация анионов
ГруппаСостав
группы
Групповой
реагент
Характеристика
группы
1
SO42-, SO32-,
PO43-, S2O32-,
CO32-, C2O42-
Соли бария не
растворимы в воде
2
Cl-, Br- , I-,
CN-, S2-
3
NO3-, NO2-,
CH3COO-
BaCl2 в
нейтральной
или
слабощелочной
среде
AgNO3
в присутствии
НNO3
Нет
Соли серебра не
растворимы в воде
Соли бария и
серебра
растворимы в воде
16. Реакции обнаружения катионов 1 группы K+
2КСl + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2NaClгексанитрокобальтат (III)
натрия
гексанитрокобальтат (III)
калия-натрия
(желтый кристаллический)
2К+ + Na+ + [Co(NO2)6]3- = K2Na[Co(NO2)6]
Реакцию проводят в нейтральном и слабокислом растворах.
17. Na+
NaCI + К[Sb(ОН)6]= Na[Sb(OH)6] + КСl
гексагидроксостибиат (V) гексагидроксостибиата (V)
калия
натрия
(белый кристаллический)
Na+ + [Sb(OH)6]- = Na[Sb(OH)6]
Реакцию проводят в нейтральном или слабощелочном
растворе, на холоду.
18. NH4+
Гидроксиды щелочных металлов выделяют израстворов солей аммония газообразный аммиак,
который окрашивает влажную красную лакмусовую
бумагу в синий цвет (фенолфталеиновую - в
красный):
NH4C1 + NaOH = NH3 + NaCI + Н2O
19. Реакции обнаружения катионов 2 группы (Ag+, Pb2+ Hg22+) Ag+
Групповой реагент - НСl образует с растворами солей Ag+нерастворимый в воде белый осадок:
Ag+ + Cl- = AgCl
Обнаружение Ag+
Осадок AgCl растворяется в избытке раствора NH4OН с
образованием растворимой в воде комплексной соли, которая
разрушается при действии HNO3 :
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2Н2О
хлорид диамминсеребра (I)
[Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3
20. Рb2+
Групповой реагент - НСl образует с растворами солейРb2+ белый осадок хлорида свинца, растворяющийся при
нагревании в воде:
Рb(NО3)2 + 2НС1 = PbCl2 + 2HNO3
Рb2+ + 2С1- = РbСl2
Обнаружение Рb2+
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
Рb2+ + 2I- = РbI2
йодид свинца
(желтый)
21. Реакции обнаружения катионов 3 группы (Ca2+, Sr2+, Ba2+) Са2+
Групповой реагент - разбавленная H2SO4 образует скатионами кальция белый кристаллический осадок:
Ca2+ +SO42- = СаSО4
Осадок не растворяется в щелочах и кислотах.
Реакция обнаружения
Оксалат аммония (NH4)2C2O4 образует с раствором соли
кальция белый кристаллический осадок, растворимый в
соляной, но не растворимый в уксусной кислоте:
CaCl2 + (NH4)2C2O4 = СаС2O4 + 2NH4C1
Ca2+ + С2O42- = СаС2O4
22. Ва2+
Ва2+Групповой реагент - H2SO4(разб.) образует с Вa2+ белый
кристаллический осадок, нерастворимый в щелочах и
кислотах:
Вa2+ +SO42- = ВаSО4
BaCl2
Реакция обнаружения
+ К2Сг2O7 + Н2O = 2ВаСгO4 + 2HCl + 2КCl
дихромат калия
хромат бария
(желтый)
2Ba2+ + Сг2O72- + Н2O = 2ВаСгO4 + 2H+
Осадок не растворяется в уксусной кислоте.
23. Реакции обнаружения катионов 4 группы: Al3+, Cr3+, Zn2+,As3+, As5+, Sb3+, Sb5+
Al3+Групповой реагент - едкие щелочи (не в избытке) осаждают
Al3+ в виде белого амфотерного осадка гидроксида алюминия,
легко растворимого в избытке щелочи: Al3+ + 3 ОН- = Аl(ОН)3
Аl(ОН)3 + ОН- = АlО2- + 2Н2О
Реакция обнаружения-действие NaOHизб. +NH4Cl
АlС13 + 6NaOH = Na3[Al(OH)6] + 3NaCl
Na3[Al(OH)6]+ 3NH4C1 = А1(ОН)3 +3NaCl+3NH3+ ЗН2О
24. Сr3+
Действие группового реагента - едкие щелочи (не визбытке) осаждают из растворов солей хрома катион хрома
СгЗ+ в виде серо-зеленого амфотерного осадка гидроксида
хрома Сг(ОН)3, легко растворимого в избытке щелочи:
Сг3+ + 3 ОН- = Сг(ОН)3
Сг(ОН)3 + ОН- = СгО2- + 2Н2О
Реакция обнаружения
Избыток NaOH растворяет осадок Сг(ОН)3 с образованием
изумрудно-зеленого
раствора
комплексной
соли
гексагидроксохромата (III) натрия:
Сг(ОН)3 +3NaOH= Na3[Сг(ОН)6]
25. Zn2+
Групповой реагент - едкие щелочи осаждает катион Zn2+ ввиде белого амфотерного осадка гидроксида Zn(OH)2, легко
растворимого в избытке щелочи:
Zn2+ + 2 ОН- = Zn(OH)2
Zn(OH)2 + 2ОН- = ZnО2- + 2Н2О
Реакция обнаружения
3 ZnCl2 + 2 К3[Fe(CN)6] = Zn3[Fe(CN)6]2 + 6 КСl
гексацианоферрат (III)
калия
гексацианоферрат (III)
цинка
(желто-коричневый)
3 Zn2+ + 2[Fe(CN)6]3- = Zn3[Fe(CN)6]2
26. Реакции обнаружения катионов 5 группы -Fe3+
Действие группового реагента - едкие щелочи образуют срастворами солей Fe3+ (имеют желтую окраску) осадок
гидроксида железа (III), практически не обладающего
амфотерными свойствами: Fe3+ + 3ОН- = Fe(ОН)3
(красно-бурый)
1)
Реакция обнаружения
4 FеС13 +3 К4[Fе(СN)6] = Fe4[Fe(CN)6]3 + 12 КСl
гексацианоферрат (II)
калия
гексацианоферрат (II)
железа (III),
берлинская лазурь
(темно-синий)
4 Fе+3 + 3 [Fе(СN)6]4- = Fe4[Fe(CN)6]3
2)
FеС13 + КNCS
тиоцианат
калия
=
[Fe(NCS)]Сl2 + КСl
хлорид тиоцианатожелеза (III)
(кроваво-красный раствор)
Fe3+ + NCS- = [Fe(NCS)]2+
27. Fe2+ (5 группа)
Действие группового реагента (едкие щелочи):Fe2+ + 2ОН- = Fe(ОН)2
(зеленоватый)
4Fe(OH)2 + О2 + 2H2O = 4Fе(ОН)3
(бурый)
Реакция обнаружения
3 FeSO4 +2 К3[Fe(CN)6] = Fe3[Fe(CN)6]2 + 3К2 SO4
гексацианоферрат (III)
калия
гексацианоферрат (III)
железа (II), турнбулева синь
(синий)
3 Fe2+ +2 [Fe(CN)6]3- = Fe3[Fe(CN)6]2
28. Мn2+ (5 группа)
Действие группового реагентаЕдкие щелочи образуют с растворами солей Mn2+ осадок
бледно-розового цвета (на воздухе буреет, окисляясь до
Mn(ОН)4):
Mn2+ + 2ОН- = Mn(ОН)2
2Mn(ОН)2 + О2 + 2H2O = 2Mn(ОН)4
Реакция обнаружения
Кристаллический висмутат натрия в азотно-кислой среде с
растворами солей Mn2+ образуют раствор малинового цвета:
2MnCl2+5NaBiO3+16HNO3 =
=2HMnO4+5Bi(NO3)3+4NaCl+NaNO3 + 7H2O
29. Mg2+ (5 группа)
Действие группового реагентаЕдкие щелочи образуют с растворами солей Mg2+ осадок
белого цвета:
Mg2+ + 2ОН- = Mg(ОН)2
Реакция обнаружения
При действии на растворы солей магния смеси
(NH4Cl+ Na2HPO4 + NH4OH) выпадает осадок :
MgCl2 + Na2HPO4 + NH4OH = MgNH4PO4 + 2NaCl + Н2О
фосфат аммония-магния
(белый кристаллический)
Mg2+ + HPO4- + NH4OH = MgNH4PO4 + Н2О
30. Реакции обнаружения катионов 6 группы (Cu2+, Cd2+, Hg2+ Co2+, Ni2+) Со2+
Действие группового реагента NH4ОН:CoCl2 + NH4ОН = CoОНСl + NH4C1
(синий)
CoОНСl + NH4C1 + 3NH4ОН(изб.) = [Со(NH3)4]C12 + 4Н2О
хлорид тетраамминкобальта (II)
(грязно-желтый раствор
с красным оттенком)
Реакция обнаружения:
2NH4NCS + CoCl2 =тиоцианат
Co(NCS)2 + 2NH4Cl
тиоцианат
аммония
кобальта
(синий)
Cо2+ + 2NCS- = Cо(NCS)2
31. Ni2+
Действие группового реагента NH4ОН:NiCl2 + NH4ОН = NiОНСl + NH4C1
хлорид гидроксокобальта
(зеленый)
NiОНСl + NH4C1 + 3NH4ОН (изб.) = [Ni(NH3)4]C1 + 4Н2О
хлорид тетраамминникеля (II)
(интенсивно-синий растворр)
Реакция обнаружения:
2NH4NCS + NiCl2 = Ni (NCS)2 + 2NH4Cl
тиоцианат
аммония
тиоцианат никеля
(светло-зеленый раствор)
Ni 2+ +2NCS- = Ni(NCS)2
32. Сu2+
Действие группового реагента NH4ОН:CuCI2 + NH4ОН = CuОНСI + NH4CI
хлорид гидроксомеди
(сине-зеленый)
CuОНСI + NH4CI + 3NH4ОН (изб.) = [Cu(NH3)4]CI2 +4 H2O
хлорид тетраамминмеди (II)
(лазурно-синий р-р)
Реакция обнаружения:
1) CuCI2 +2NH4NCS = Cu(NCS)2 + 2NH4CI
(тиоцианат меди
черный)
Cu2+ + 2NCS- = Cu(NCS)2
33.
2) 2 CuCI2 + К4[Fe(CN)6] = Cu2[Fe(CN)6] + 4 КСIгексацианоферрат (II) меди
(красно-коричневый)
2 Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6]
34. Реакция обнаружения анионов 1 группы: SO42-, SO32-, PO43-, S2O32-, CO32-, C2O42-
Сульфат-ионы SO42Групповой реагент - BaCl2 образует с растворами,содержащими сульфат-ионы, белый осадок BaSO4,
практически нерастворимый в кислотах:
BaCl2 + Na2SO4 BaSO4 + 2NaCl
BaSO4 + НСl осадок не растворяется
35. Карбонат-ионы СО32-
Карбонат-ионы СО32Действие группового реагента BaCl2Групповой реагент - BaCl2 при действии на ионы СО32образуется белый осадок карбоната бария:
Na2CO3 + BaCl2 ВаСО3 + 2NaCl
СО32- + Ва2+ ВаСО3
Реакция обнаружения - действие соляной кислоты НСl
Белый осадок карбоната бария растворяется с бурным
выделением углекислого газа:
Н2O
ВaCO3 + 2НС1 2NaCl + Н2CO3
CO2 ↑
36.
Дигидрофосфат-ионы Н2РО4- , гидрофосфат-ионы НРО42- ,фосфат-ионы РО43Действие группового реагента:
ВаСl2 + Na2HPO4 = ВаНРO4 + 2NaCl
(белый)
Осадок растворяется в кислотах (кроме H2SO4).
В присутствии щелочей или аммиака, ионы НРO42превращаются в РО43- , и осаждается средняя соль.
Обнаружение:
Действие магнезиальной смеси (MgCl2+ NH4OH+NH4Cl)
на раствор гидрофосфата или фосфата вызывает образование
белого осадка:
Na2HPO4+MgCl2+NH4OH = MgNH4HPO4 + H2O + 2NaCl
гидрофосфат
аммония-магния
(белый)
37. Реакции обнаружения анионов 2 группы: Cl-, Br- , I-, CN-, S2-
Реакции обнаружения анионов 2 группы: Cl-, Br- , I-, CN-, S2Хлорид-ионы СlГрупповой реагент АgNО3 (рН=7) образует с анионами Сlв присутствии НNO3(разб.) практически нерастворимый в водебелый осадок AgCl:
AgNO3 + NaCI = AgCl + NaNO3
Реакция обнаружения
AgCl не растворяется в кислотах, но хорошо растворяется в
избытке раствора NH4OH с образованием растворимой в воде
комплексной соли серебра [Ag(NH3)2]Cl, которая при
последующем действии НNO3 разрушается и AgCl снова
выпадает в осадок:
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
[Ag(NH3)2]Cl + 2HNO3 = AgCl + 2NH4NO3
38. Бромид-ионы Вr-
Бромид-ионы ВrДействие группового реагента AgNO3При действии нитрата серебра на бромид-ион образуется
желтоватый осадок бромида серебра:
NaBr + AgNO3 = AgBr + NaNO3
Вr - + Ag+ = AgBr
Действие хлорной воды
Хлорная вода при взаимодействии с растворами
бромидов окисляет бромид-ион в молекулярный бром,
который окрашивает органический растворитель (бензол,
хлоро- форм) в желто-оранжевый цвет:
2NaBr + С12 = Br2 + NaCl
39. Йодид-ионы I-
Йодид-ионы IДействие группового реагента AgNO3При действии нитрата серебра на йодид-ион образуется
светло-желтый осадок йодида серебра:
KI + AgNO3 = AgI + KNO3
I- + Ag+ = AgI
Действие хлорной воды
Хлорная вода при взаимодействии с растворами йодидов
окисляет йодид-ион в молекулярный йод, который
окрашивает
органический
растворитель
(бензол,
хлороформ) в розово-фиолетовый цвет:
2KI + Cl2 = I2 + 2KCl
40. Сульфид-ионы S2-
Сульфид-ионы S2Действие группового реагента AgNO3При действии нитрата серебра на сульфид-ион образуется
черный осадок сульфида серебра:
Na2S + 2AgNO3 = Ag2S + 2NaNO3
S2- + 2Ag+ = Ag2S
Действие кислот (НСl, Н2SO4)
Кислоты (НСl, H2SO4) выделяют из сульфидов свободный
сероводород с характерным запахом тухлых яиц:
Na2S + H2SO4 = H2S + Na2SO4.
41. Реакция обнаружения анионов 3 группы NO3-, NO2-, CH3COO- Нитрат-ионы NO3-
Реакция обнаружения анионов 3 группыNO3-, NO2-, CH3COO-
Нитрат-ионы NO3Раствор дифениламина (C6H5)2NH в концентрированной
серной кислоте дает с нитрат-ионом интенсивно-синее
окрашивание
вследствие
окисления
дифениламина
образующейся азотной кислотой.
42. Нитрит-ионы NO2-
Нитрит-ионы NO2Действие серной кислоты Н2SO4Сильные кислоты вытесняют из нитритов слабую
азотистую кислоту, которая из-за свой неустойчивости сразу
разлагается на воду и оксиды азота (NO2 - бурого цвета):
2NaNO2 + H2SO4 = Na2SO4 + NO2 + NO + Н2O
Действие окислителей
Перманганат
калия
КМnO4
в
присутствии
разбавленной серной кислоты обесцвечивается солями
азотистой кислоты:
5KNO2 + 2КМnO4 + 3H2SO4=5КNO3 + 2MnSO4 + K2SO4 + ЗН2O









































 chemistry
chemistry








