Similar presentations:
Металлы d-семейства
1. Металлы d-семейства
Автор: к.х.н., доцентМартынова Т.В.
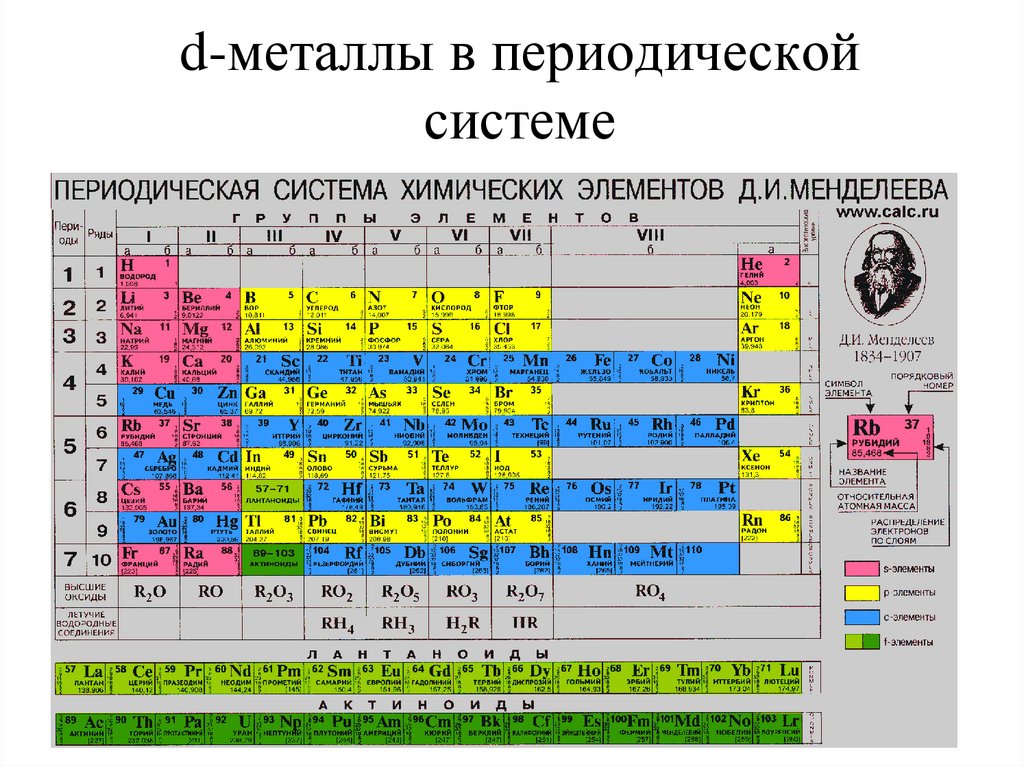
2. d-металлы в периодической системе
3.
4. Валентность d-металлов
• Высшая валентность повышается от 3 уSc до 7 у Mn, и понижается до 2 у Zn .
• Т.к. количество не спаренных е- сначала
увеличивается от элемента к элементу, а
затем уменьшается.
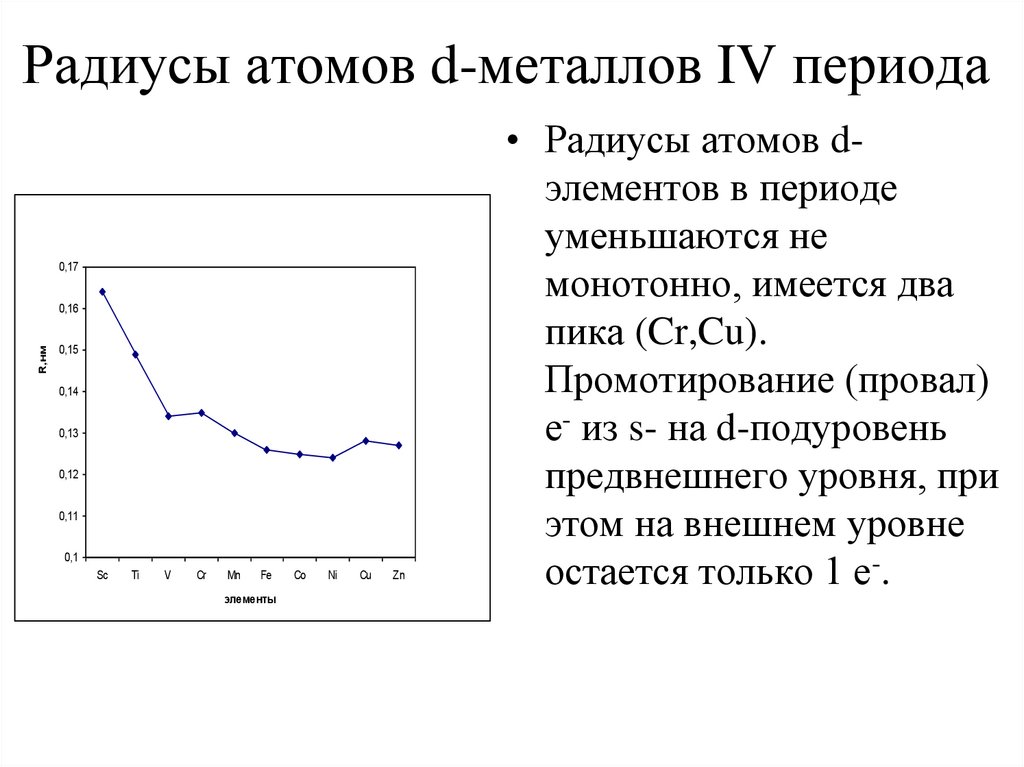
5. Радиусы атомов d-металлов IV периода
0,17R,нм
0,16
0,15
0,14
0,13
0,12
0,11
0,1
Sc
Ti
V
Cr
Mn
Fe
элементы
Co
Ni
Cu
Zn
• Радиусы атомов dэлементов в периоде
уменьшаются не
монотонно, имеется два
пика (Cr,Cu).
Промотирование (провал)
е- из s- на d-подуровень
предвнешнего уровня, при
этом на внешнем уровне
остается только 1 е-.
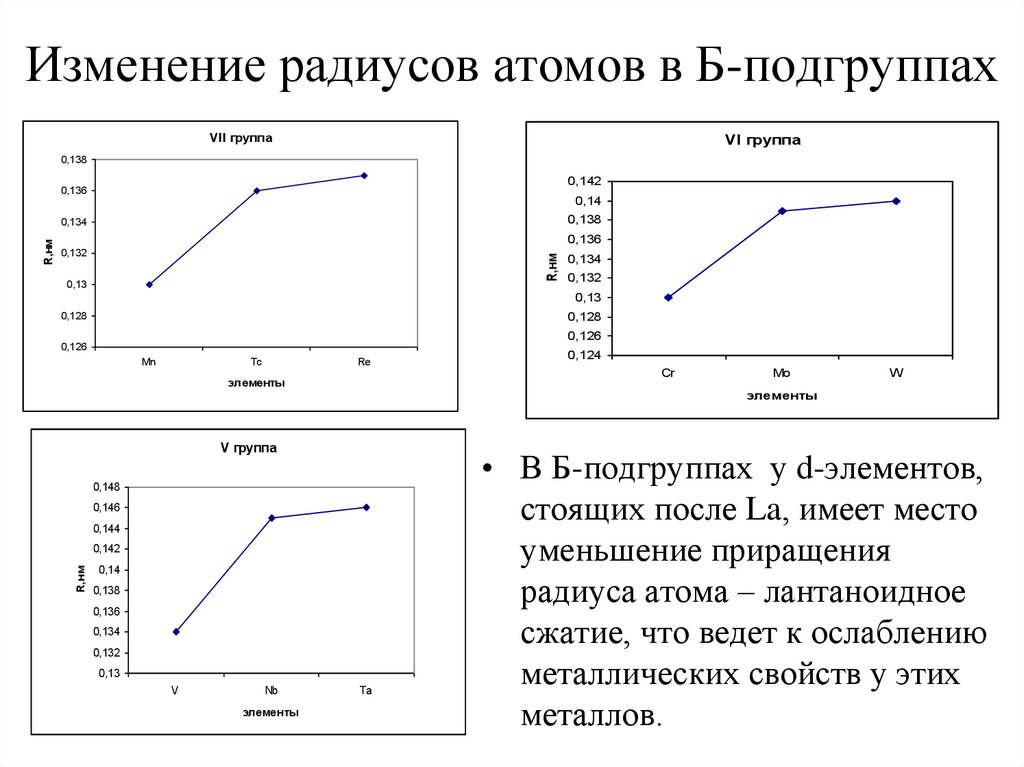
6. Изменение радиусов атомов в Б-подгруппах
VII группаVI группа
0,138
0,142
0,136
0,14
0,138
0,136
R,нм
0,132
0,13
0,134
0,132
0,13
0,128
0,128
0,126
0,126
Mn
Tc
Re
элементы
0,124
Cr
Mo
W
элементы
V группа
0,148
0,146
0,144
0,142
R,нм
R,нм
0,134
0,14
0,138
0,136
0,134
0,132
0,13
V
Nb
элементы
Ta
• В Б-подгруппах у d-элементов,
стоящих после La, имеет место
уменьшение приращения
радиуса атома – лантаноидное
сжатие, что ведет к ослаблению
металлических свойств у этих
металлов.
7. Изменение энергии ионизации d-металлов IV периода
109,5
9
энергияионизации, эВ
• Энергия ионизации
резко возрастает у
Mn и Zn, что
говорит об
устойчивости
наполовину или
полностью
заполненных
электронами
подуровней.
8,5
8
7,5
7
6,5
6
5,5
5
Sc
Ti
V
Cr
Mn
Fe
элементы
Co
Ni
Cu
Zn
8. Физические свойства
• В основном это тугоплавкие металлы (кромеZn, Cd, Hg, Ag) с tпл 1000оС (W - 3410oC).
• С плотность 5 г/см3 (кроме Sc, Y, Ti).
• Многие покрыты тонкой оксидной пленкой,
поэтому обладают высокой химической и
коррозионной стойкостью.
9. Химические свойства соединений
• d-металлы проявляют переменную валентность.• С повышением С.О. кислотно-основной характер
соединений меняется от основного к кислотному через
амфотерный
• Примеры соединений хрома в различной степени
окисления
+2
+3
CrO- основной
Cr2O3 – амфотерный
оксид
оксид
Cr(OH)2 - основание Cr(OH)3 – амфотерный
гидроксид
Cr2(SO4)3,
CrCl2
Na3[Cr(OH)6]
+6
CrO3 – кислотный
оксид
H2CrO4, H2Cr2O7кислоты
K2CrO4, K2Cr2O7
10. Окислительно-восстановительные свойства соединений
зависят от степени окисления:• +2 – преобладание восстановительных свойств
4CrCl2+4HCl+O2=4CrCl3+2H2O ,
• +3 – окислительные(а) и восстановительные(б)
a)Cr2O3+Al=Al2O3+Cr ,
б)Cr2(SO4)3+10NaOH+3H2O2=2Na2CrO4+3Na2SO4+8H2O
• +6 – только окислительные
K2Cr2O7+7H2SO4+6KI=3I2 +4K2SO4+Cr2(SO4)3+7H2O .
11. Изменение свойств соединений металлов в Б-подгруппах
• В подгруппе устойчивость соединений d-Ме свысшей С.О. возрастает:
Cr(Mo,W)+Cl2 CrCl3(MoCl5,WCl6)
• В реакциях с более слабыми окислителями (HCl)
Cr, Fe окисляются до низшей СО +2:
Cr+2HCl=CrCl2+H2
12. Свойства некоторых d-металлов и их соединений
Автор: к.х.н., доцентМартынова Т.В.
13. Медь, серебро, золото (IБ группа)
Валентная электронная конфигурация: (n-1)d10ns1
Устойчивые СО: +1 (Ag), +2 (Cu), +3 (Au).
Химическая активность Cu ← Au
Электродные потенциалы: +0,34 В, +0,79 В, +1,56В
Химические свойства
С О2 – только Cu:
2Cu+O2=2CuO (t<400o)
Cu+O2=Cu2O (t>400o)
С Hal2:
Cu(Ag,Au)+Cl2→CuCl2 (AgCl, AuCl3)
Атмосферная коррозия:
2Cu+O2+H2O+CO2=(CuOH)2CO3
4Ag+O2+2H2S=2Ag2S+2H2O
14. С кислотами-окислителями:
H2SO4(к)→CuSO4, Ag2SO4+H2O+SO2↑Cu, Ag +HNO3(к)→Cu(NO3)2, AgNO3+H2O+NO2↑
HNO3(р)→Cu(NO3)2, AgNO3+H2O+NO↑
С «царской водкой»:
Au+3HCl+HNO3=AuCl3+NO+2H2O
Комплексообразование:
4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH
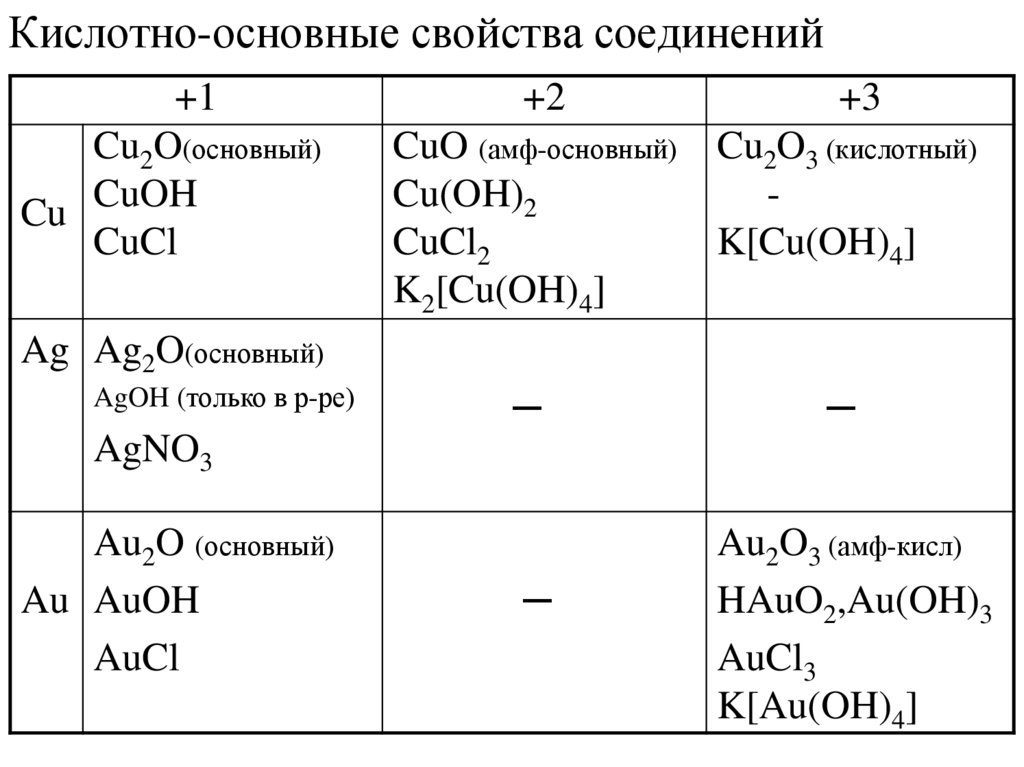
15.
Кислотно-основные свойства соединений+1
Cu2O(основный)
Cu CuOH
CuCl
+2
+3
CuO (амф-основный) Cu2O3 (кислотный)
Cu(OH)2
CuCl2
K[Cu(OH)4]
K2[Cu(OH)4]
Ag Ag2O(основный)
AgOH (только в р-ре)
─
─
AgNO3
Au2O (основный)
Au AuOH
AuCl
─
Au2O3 (амф-кисл)
HAuO2,Au(OH)3
AuCl3
K[Au(OH)4]
16. Окислительно-восстановительные свойства соединений
• +1Ag2O+CH3CHO→Ag+CH3COOH (р-ция серебряного зеркала)
2Ag2O =t 4Ag + O2
2Cu2O+O2 = 4CuO
• +2
CuO+H2= Cu +H2O
CuO+CH3CHO = Cu+CH3COOH (медное зеркало)
2Cu(OH)2+KClO = Cu2O3+ KCl+2H2O
• +3
2Au2O3=t 4Au+3O2
Cu2O3+6HCl=Cl2+2CuCl2+3H2O
17. Соли и комплексные соединения
• Соли Ме+1 нерастворимы кроме AgNO3, AgClO4AgNO3+NaCl = AgCl↓+NaNO3
(качественная р-ция на галогенид-ионы)
• Соли Ме+2 и Ме+3 растворимы и гидролизуются:
CuCl2+H2O=CuOHCl+HCl
Cu2++HOH=CuOH++H+
• Комплексообразование дает возможность
растворить нерастворимые основания и соли:
AgCl+2NH3=[Ag(NH3)2]Cl
Cu(OH)2+4NH3=[Cu(NH3)4](OH)2
18. Сплавы меди
Латуни – до 45% Zn + Fe, Al, Sn, Si (судостроение, трубырадиаторов, часовые механизмы).
Мельхиоры – 20-30% Ni+Fe, Mn.
Нейзильберы – 5-35% Ni + 13-45% Zn (энергетика,
судостроение, дистилляционные установки для опреснения морской воды)
Константан – 40% Ni +1,5% Mn
Манганин – 3% Ni + 12% Mn (магазины сопротивлений)
Копель – 43% Ni +0,5% Mn (термопары)
Бронзы – оловянные
алюминиевые
кремнистые
бериллиевые (машиностроение, пружины)
Все сплавы обладают высокой устойчивостью к атмосферной
коррозии.
19. Цинк, кадмий, ртуть (IIB группа)
Валентная электронная конфигурация: (n-1)d10ns2
Устойчивые С.О.: +1 (Hg2+), +2.
Химическая активность Zn ← Hg
Электродные потенциалы: -0,76 В, -0,40 В, +0,85 В
Химические свойства
+ О2 только при ↑t с образованием ZnO, CdO, HgO:
2Me+O2=t MeO
S + Zn и Cd при ↑t, Hg при обычной t:
Hg+S=HgS
Все Hal2:
Me+Hal2 = MeHal2
+ H2O ǂ (Zn,Cd-оксидные пленки,)(Hg–Е0=+0,85 В).
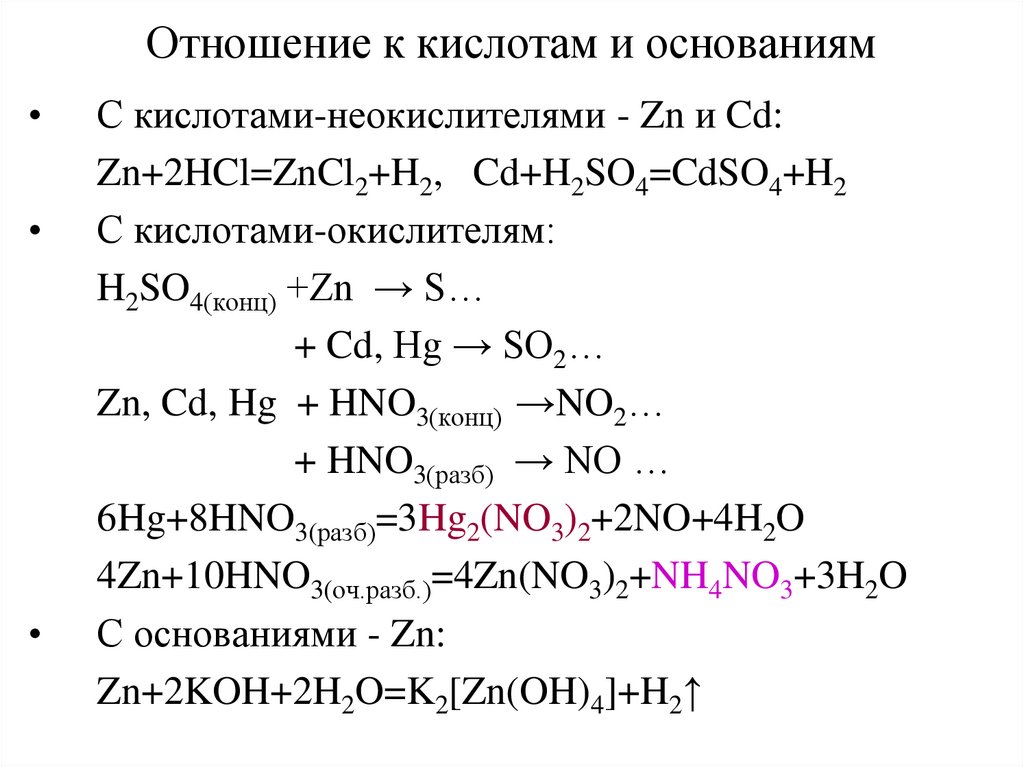
20. Отношение к кислотам и основаниям
С кислотами-неокислителями - Zn и Cd:
Zn+2HCl=ZnCl2+H2, Cd+H2SO4=CdSO4+H2
С кислотами-окислителям:
H2SO4(конц) +Zn → S…
+ Cd, Hg → SO2…
Zn, Cd, Hg + HNO3(конц) →NO2…
+ HNO3(разб) → NO …
6Hg+8HNO3(разб)=3Hg2(NO3)2+2NO+4H2O
4Zn+10HNO3(оч.разб.)=4Zn(NO3)2+NH4NO3+3H2O
С основаниями - Zn:
Zn+2KOH+2H2O=K2[Zn(OH)4]+H2↑
21. Оксиды цинка, кадмия, ртути
1.
2.
3.
4.
5.
Получение оксидов:
2Hg+O2=2HgO
CdCO3=t CdO+CO2
Zn(OH)2=t ZnO +H2O
2Cd(NO3)2=t 2CdO+4NO2 +O2
Hg(NO3)2+2NaOH=HgO↓+2NaNO3+H2O
ZnO – амфотер: ZnO+2HCl=ZnCl2+H2O
ZnO+2KOH+H2O=K2[Zn(OH)4]
CdO, HgO – основные оксиды:
HgO+2HCl=HgCl2+H2O
Термически непрочный: 2HgO=t 2Hg + O2
22. Гидроксиды и соли
• Zn(OH)2 – амфотер: Zn(OH)2+H2SO4=ZnSO4+2H2OZn(OH)2+2KOH=K2[Zn(OH)4]
• Cd(OH)2 - основный гидроксид
Cd(OH)2+2HNO3=Cd(NO3)2+2H2O
• Гидроксидов ртути не существует.
• Нитраты, сульфаты, хлораты, перхлораты - Р
• карбонаты, фосфаты, сульфиды – Н
• HgCl2 – сулема ЯД, малорастворима, сублимирует, не
диссоциирует в воде.
• Обнаружение ионов в р-ре по окраске сульфидов: ZnS –
белый, CdS – желтый, CuS – черный.
23. Железо, кобальт, никель
• Валентные электронные конфигурации:Fe – 3d64s2, Co - 3d74s2, Ni - 3d84s2 .
• Устойчивые степени окисления: +2, +3.
• Электродные потенциалы: -0,44В, -0,29В, -0,25В
Химические свойства
• Химическая активность: Fe ← Co ← Ni
Оксидная пленка экранирует поверхность
металла от окружающей среды, поэтому реакции
с простыми в-вами идут только при высокой tо.
24. Реакции с простыми веществами
• О2 при 300-400oC до Fe2O3, CoO, NiO:4Fe+3O2=2Fe2O3
• Hal при ↑to до Fe(III), Co(II), Ni(II):
2Fe+3Cl2=2FeCl3, Ni+Cl2=NiCl2
• S, N2, P, C при ↑to :
сульфиды – FeS, Fe2S3
нестехиометрические нитриды – Fe3N, Fe2N
фосфиды – Fe2P, Fe3P
карбиды – Fe2C…
• С Н2 образуют твердые р-ры (особенно Ni).
25. Взаимодействие со сложными веществами
• С H2O при ↑to: 3Fe +4H2O= Fe3O4+4H2При обычной to – коррозия:
4Fe+nH2O+3O2=2Fe2O3·nH2O
• С кислотами-неокислителями:
Fe+2HCl=FeCl2+H2, Co+H2SO4=t CoSO4+H2
• С кислотами-окислителями: Fe на холоду
пассивируется конц. HNO3, H2SO4.
• При ↑to→Fe(III), Co, Ni (II):
2Fe+6H2SO4(конц)=t Fe2(SO4)3+3SO2+6H2O
Ni+4HNO3(конц)=t Ni(NO3)2+2NO2+2H2O
• С разбавленными к-тами-окислителями:
Fe+4HNO3(разб)=Fe(NO2)3+NO+2H2O
26. Свойства соединений в С.О. +2
• Оксиды, гидроксиды Fe2+, Ni2+- основные, Co2+-амф.FeO+2HCl=FeCl2+H2O
Co(OH)2+H2SO4=CoSO4+H2O
• Соединения Fe2+ легко окисляются:
4Fe(OH)2+O2+H2O=4Fe(OH)3↓
Соединения Co2+и Ni2+- окисляются труднее:
2Ni(OH)2+Cl2+2KOH=2Ni(OH)3↓+2KCl
• Растворимые соли слабых оснований гидролизуются:
Fe2+(Co2+,Ni2+)+HOH↔FeOH+(CoOH+,NiOH+) +H+
27. Свойства соединений в С.О. +3
• Fe2O3, Fe(OH)3 – амфотеры с преобладаниемосновных св-в:
Fe2O3+3HCl=FeCl3+3H2O
Fe(OH)3+KOH=KFeO2+2H2O (сплавление)
• Оксиды и гидроксиды Co3+ и Ni3+ - основные.
• Получают: FeCl3 +3NaOH=Fe(OH)3+3NaCl,
Co(NO3)3+3KOH=Co(OH)3+3KNO3
• Соединения Co3+ и Ni3+-сильные окислители:
Co(OH)3+6HCl(конц) =CoCl2+Cl2↑+H2O
• Качественная р-ция: Fe3++3SCN-=Fe(SCN)3
28. Степень окисления +6
• Ферраты – соединения Fe+6 образуются при сплавлениис окислителем и щелочью солей Fe+3:
2FeCl3+3KNO3+10KOH=t2K2FeO4+3KNO2 +6KCl+5H2O
• Качественная р-ция на FeO42- :
K2FeO4+BaCl2=BaFeO4↓+2KCl
краснофиолетовый
Комплексные соединения
• Fe(CN)3+3KCN= K3[Fe(CN)6] – красная кровяная соль, реактив
на ионы Fe2+
• 3Fe2+ +2[Fe(CN)6]3- =Fe3[Fe(CN)6]2 - турнбулева синь
• K4[Fe(CN)6] +FeCl3= KFe [Fe(CN)6] + 3KCl
• желтая кровяная соль
берлинская лазурь
29. Железо в природе
Магнитный железняк – F3O4;
Красный железняк – Fe2O3;
Бурый железняк – 2Fe2O3 · 3H2O;
Шпатовый железняк - FeCO3;
Железный колчедан - FeS2.
Сырье для черной металлургии.
30. Сплавы железа
• Fe растворяет многие элементы, γжелезо растворяет лучше, р-рустойчив в широком интервале to.
• Р-р С в ɑ-железе – феррит.
• Р-р С в γ-железе аустенит.
• Цементит – карбид железа Fe3C р-р 6,67% С (tпл=1600оС, хрупкий,
твердость близка к алмазной).
• Сплавы с содержанием С <2,14% стали, > 2,14% - чугуны.
• Углеродистые стали состоят из
феррита и цементита. Повышение
содержания С повышает твердость.
• Легированные – содержат Cr, Ni,
Mn, Si, V, Mo, изменяющие
структуру и св-ва стали.

























 chemistry
chemistry








