Similar presentations:
Некоторые d-элементы
1. Некоторые d-элементы
Лёвкин А.Н.Некоторые d-элементы
2.
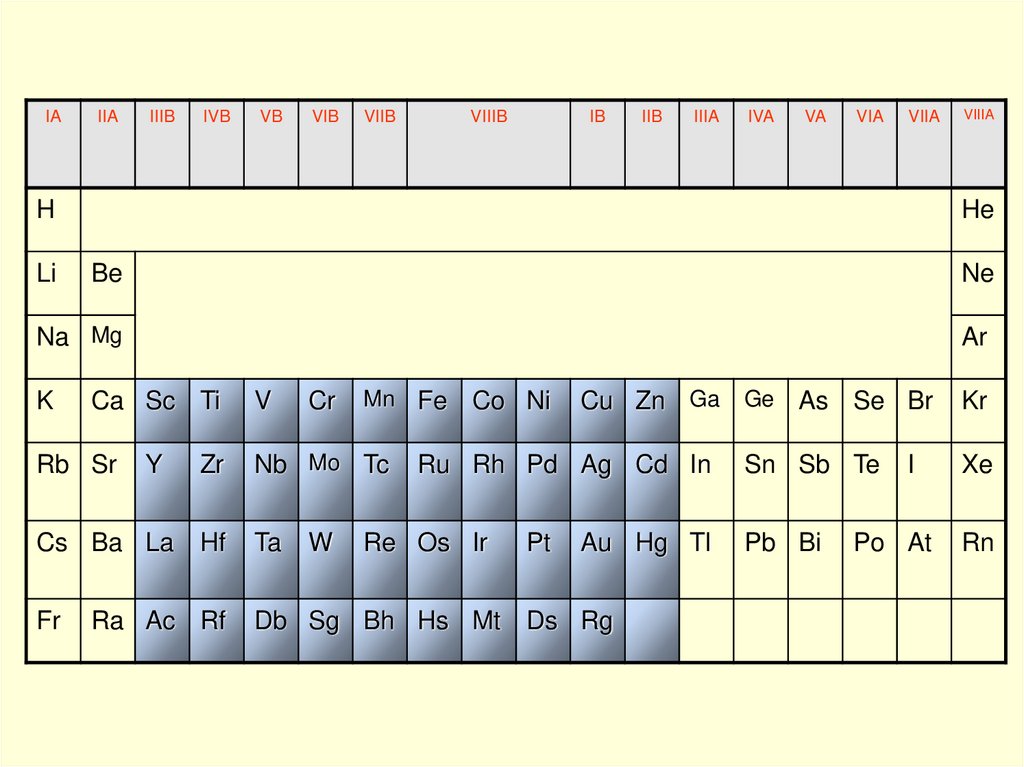
IAIIA
IIIB
IVB
VB
VIB
VIIB
VIIIB
IB
IIB
IIIA
IVA
VA
VIA
VIIA
H
Li
VIIIA
He
Be
Ne
Na Mg
Ar
K
Ca Sc Ti
Rb Sr
Y
Cs Ba La
Fr
V
Cr
Mn Fe
Zr
Nb Mo Tc
Hf
Ta
Ra Ac Rf
W
Co Ni
Cu Zn Ga Ge As Se Br
Ru Rh Pd Ag Cd In
Re Os Ir
Db Sg Bh Hs Mt
Pt
Au Hg Tl
Ds Rg
Sn Sb Te
Pb Bi
I
Po At
Kr
Xe
Rn
3. d-Элементы
ScTi
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
3d 1
4s 2
3d 2
4s 2
3d 3
4s 2
3d 5
4s 1
3d 5
4s 2
3d 6
4s 2
3d 7
4s 2
3d 8
4s 2
3d 10
4s 1
3d 10
4s 2
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
4d 1
5s 2
4d 2
5s 2
4d 4
5s 1
4d 5
5s 1
4d 5
5s 2
4d 7
5s 1
4d 8
5s 1
4d 10
5s 0
4d 10
5s 1
4d 10
5s 2
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
5d 1
6s 2
5d 2
6s 2
5d 3
6s 2
5d 4
6s 2
5d 5
6s 2
5d 6
6s 2
5d 7
6s 2
5d 9
6s 1
5d 10
6s 1
5d 10
6s 2
Ac
Rf
Db
Sg
Bh
Hs
Mt
Ds
Rg
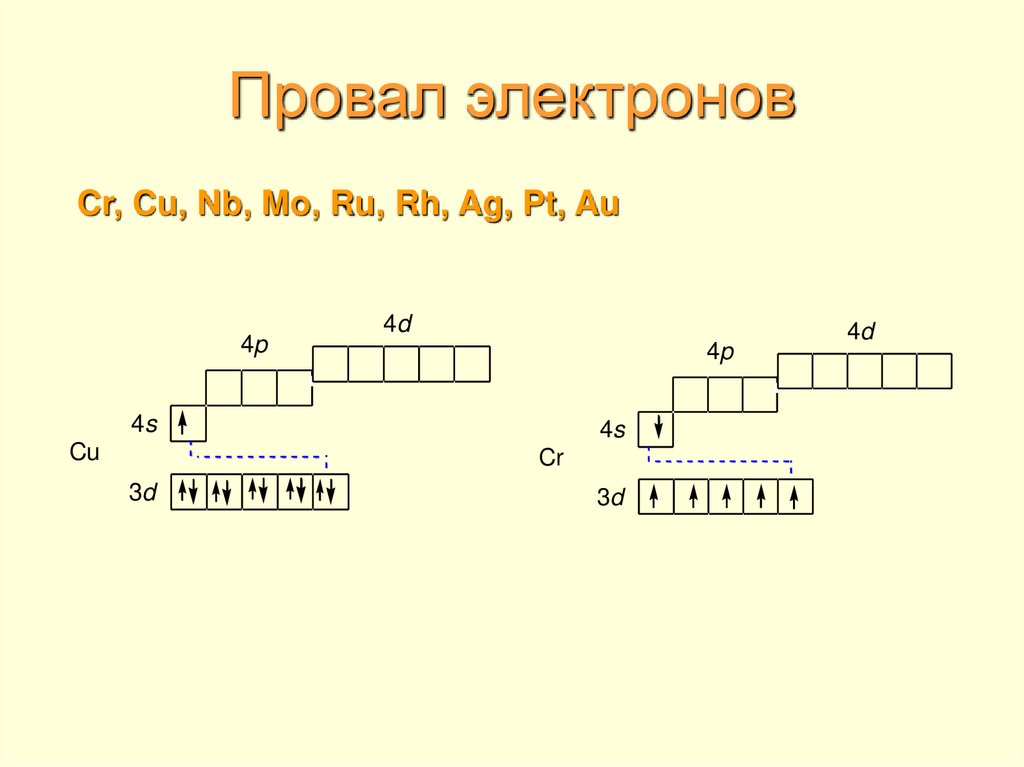
4. Провал электронов
Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au4p
4d
4p
4s
Cu
4s
Cr
3d
3d
4d
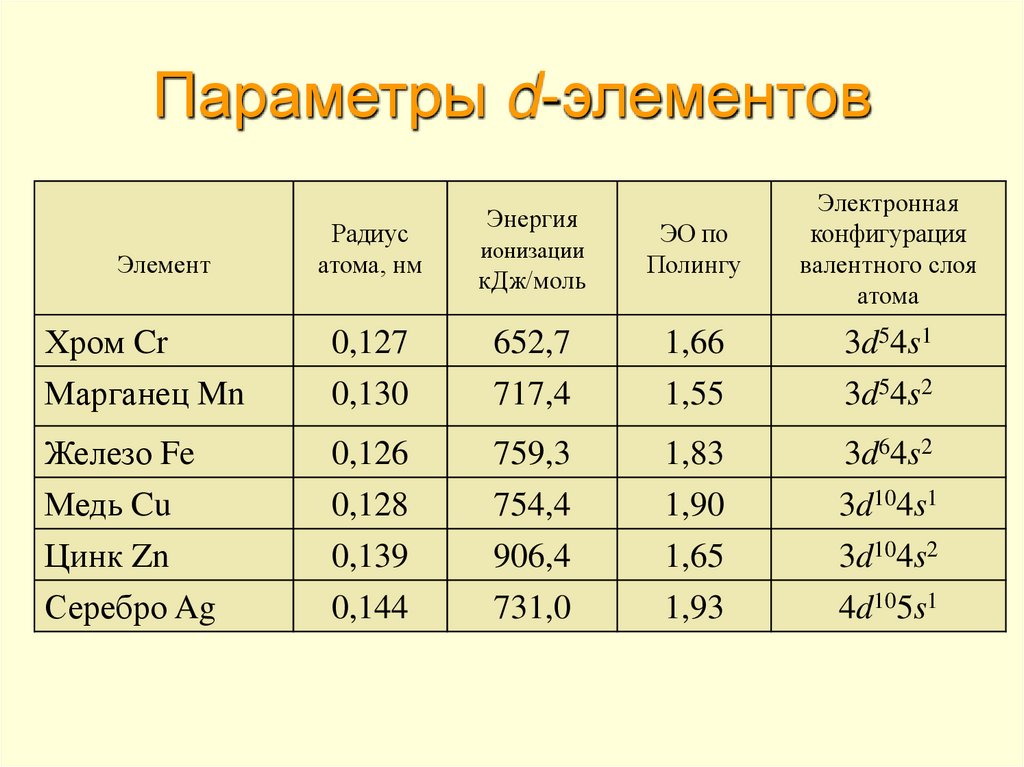
5. Параметры d-элементов
ЭлементРадиус
атома, нм
Энергия
ионизации
кДж/моль
ЭО по
Полингу
Электронная
конфигурация
валентного слоя
атома
Хром Cr
Марганец Mn
0,127
0,130
652,7
717,4
1,66
1,55
3d54s1
3d54s2
Железо Fe
Медь Cu
Цинк Zn
0,126
0,128
0,139
759,3
754,4
906,4
1,83
1,90
1,65
3d64s2
3d104s1
3d104s2
Серебро Ag
0,144
731,0
1,93
4d105s1
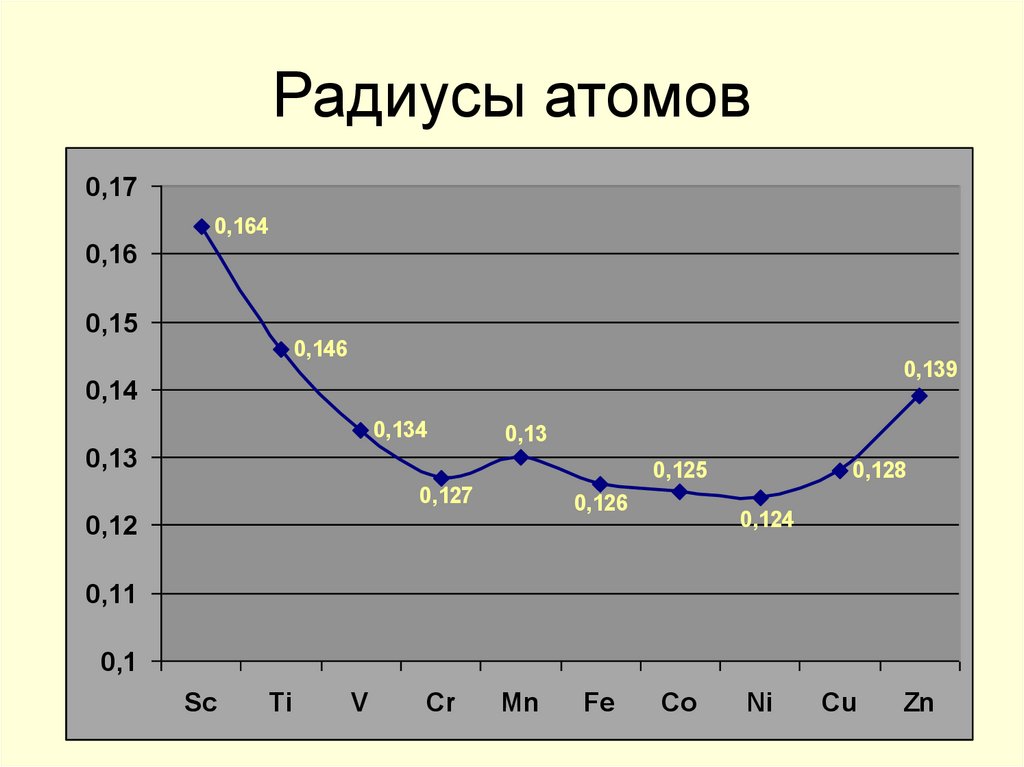
6. Радиусы атомов
0,170,164
0,16
0,15
0,146
0,139
0,14
0,134
0,13
0,13
0,125
0,127
0,126
0,12
0,128
0,124
0,11
0,1
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
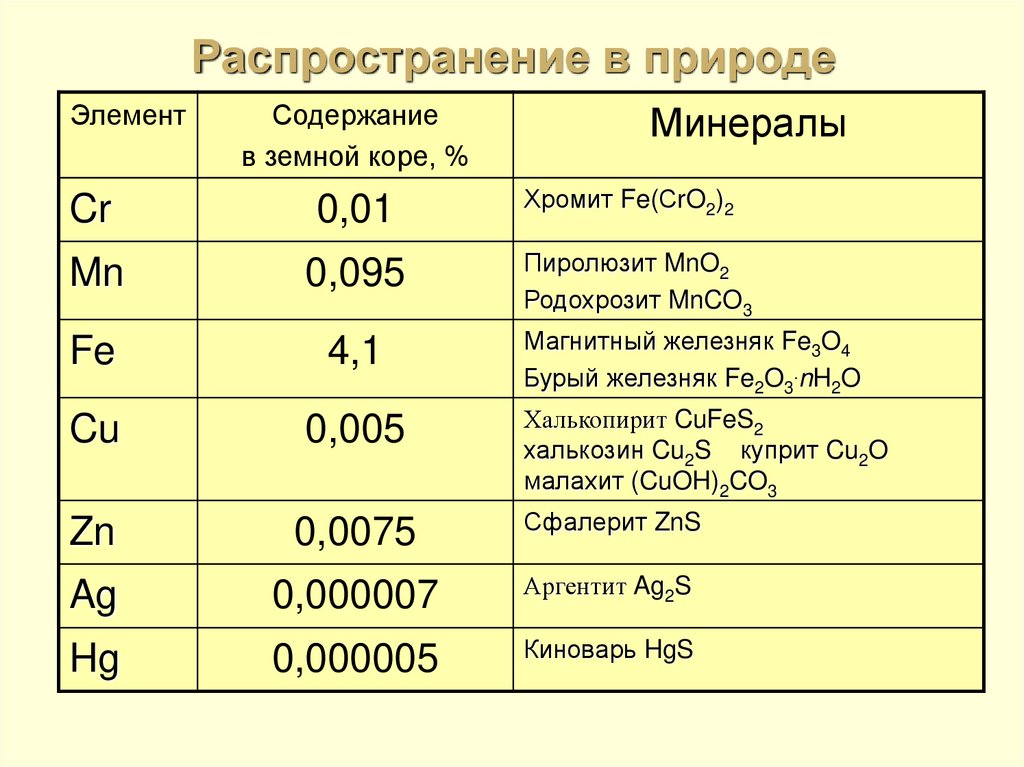
7. Распространение в природе
ЭлементСодержание
в земной коре, %
Минералы
Хромит Fe(СrO2)2
Cr
0,01
Mn
0,095
Fe
4,1
Cu
0,005
Zn
0,0075
Сфалерит ZnS
Ag
0,000007
Аргентит Ag2S
Hg
0,000005
Киноварь HgS
Пиролюзит MnO2
Родохрозит MnCO3
Магнитный железняк Fe3O4
Бурый железняк Fe2O3.nH2O
Халькопирит CuFeS2
халькозин Cu2S куприт Cu2O
малахит (CuOH)2CO3
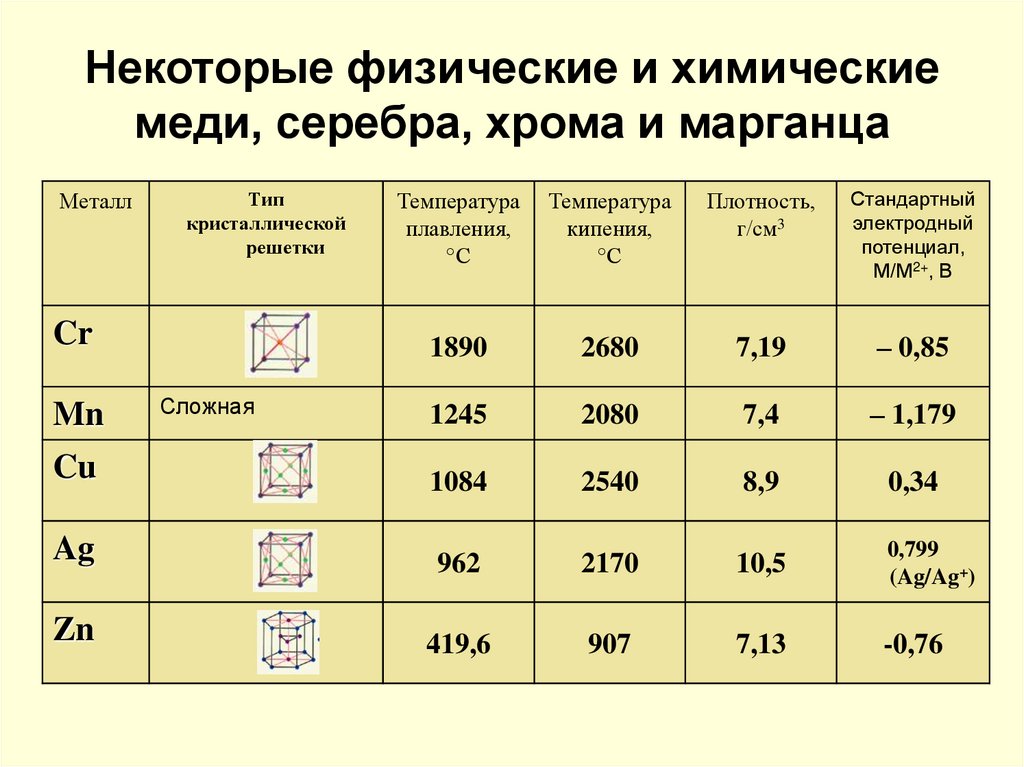
8. Некоторые физические и химические меди, серебра, хрома и марганца
Температураплавления,
°С
Температура
кипения,
°С
Плотность,
г/см3
Стандартный
электродный
потенциал,
М/М2+, В
1890
2680
7,19
– 0,85
1245
2080
7,4
– 1,179
Cu
1084
2540
8,9
0,34
Ag
962
2170
10,5
0,799
(Ag/Ag+)
Zn
419,6
907
7,13
-0,76
Металл
Тип
кристаллической
решетки
Cr
Mn
Сложная
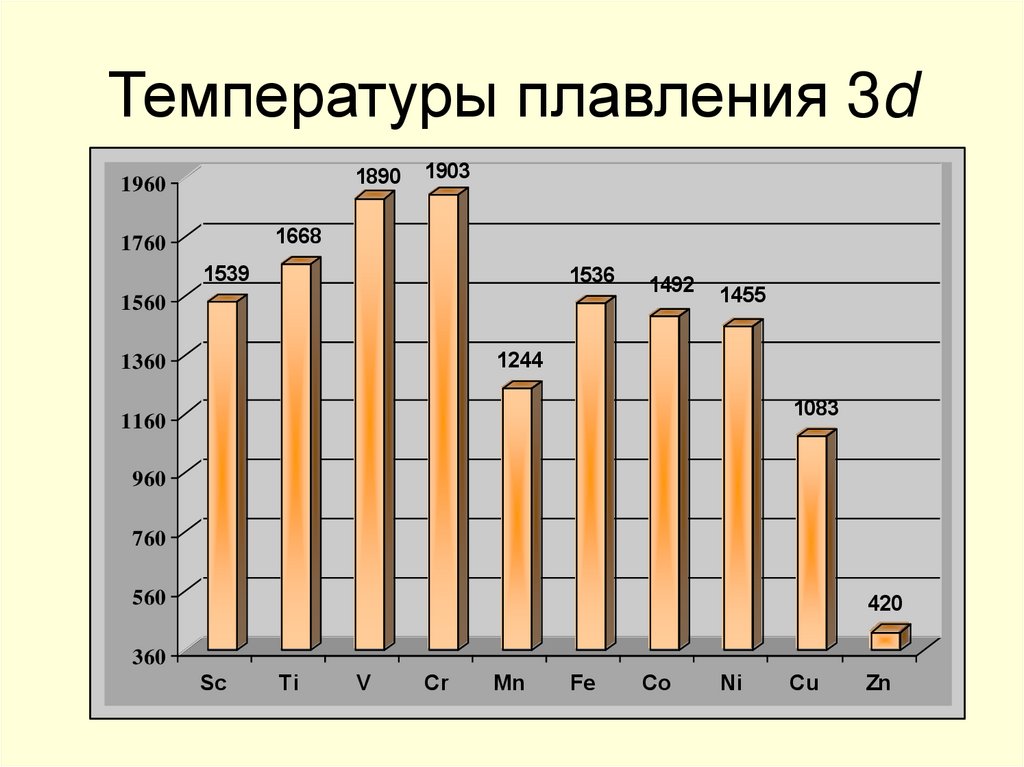
9. Температуры плавления 3d
18901960
1903
1668
1760
1539
1536
1560
1492
1455
1244
1360
1083
1160
960
760
560
420
360
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
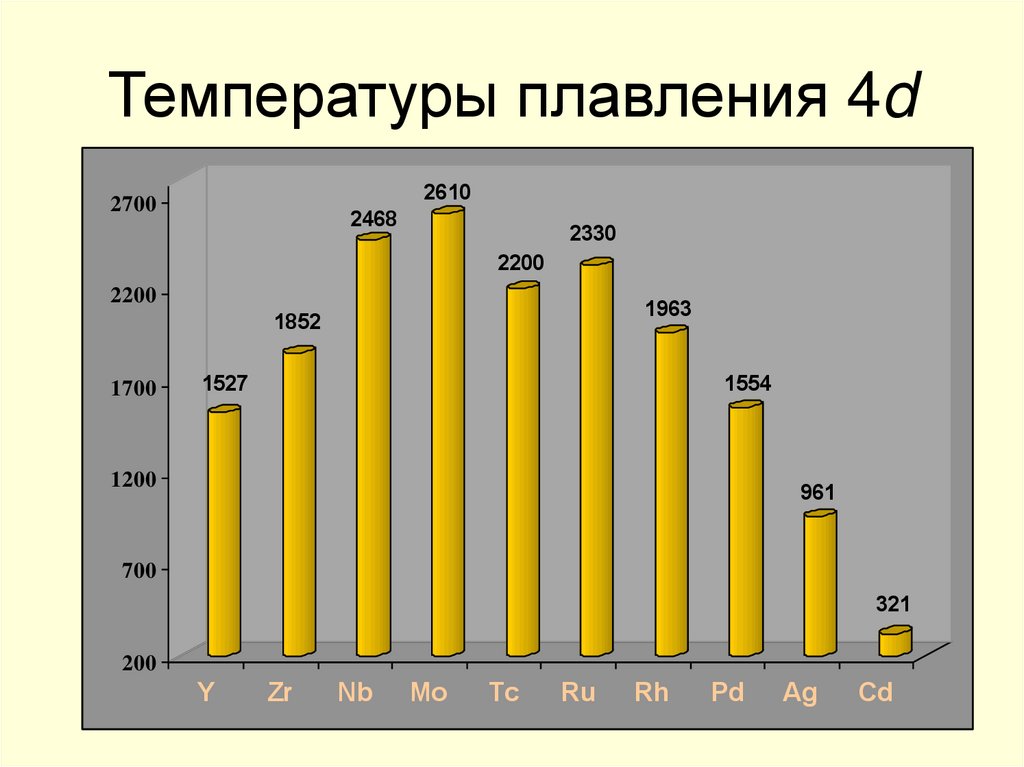
10. Температуры плавления 4d
26102700
2468
2330
2200
2200
1963
1852
1700
1527
1554
1200
961
700
321
200
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
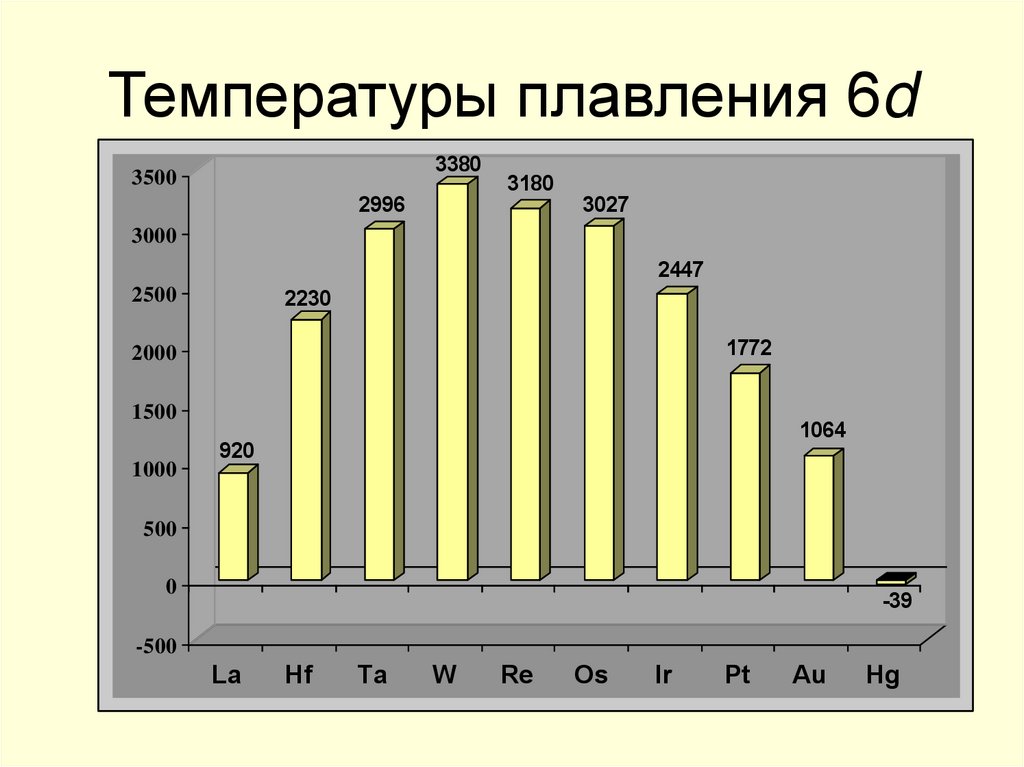
11. Температуры плавления 6d
33803500
2996
3180
3027
3000
2447
2230
2500
1772
2000
1500
1000
1064
920
500
0
-39
-500
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
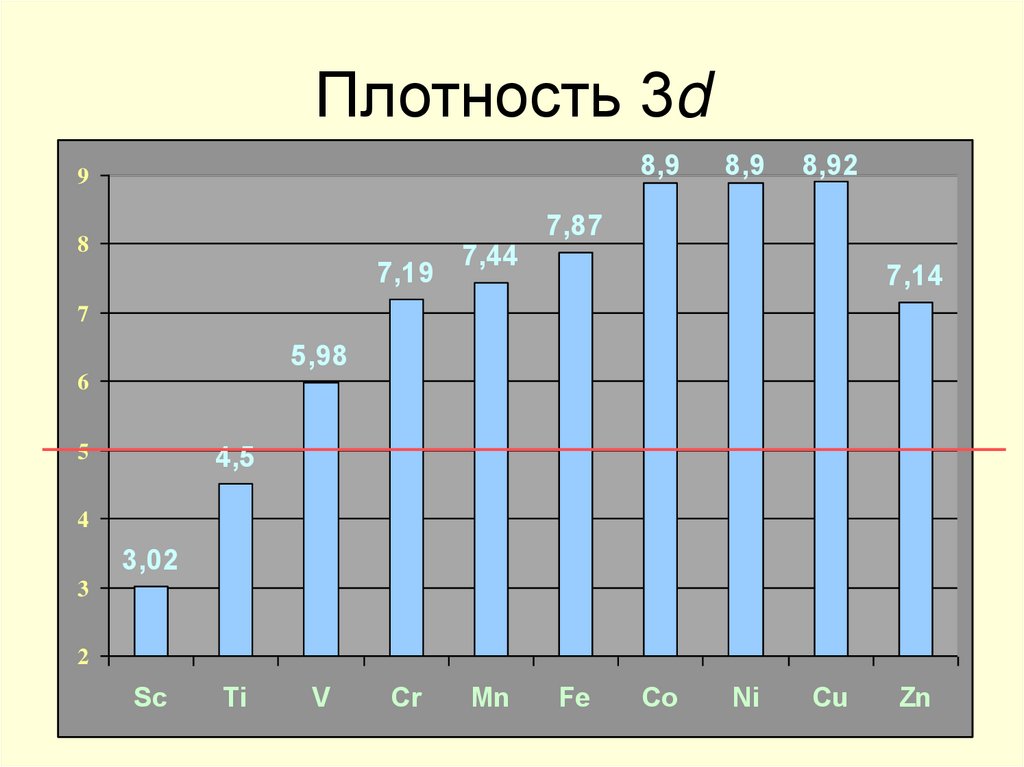
12. Плотность 3d
8,99
8
7,19
7,44
8,9
8,92
7,87
7,14
7
5,98
6
4,5
5
4
3,02
3
2
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
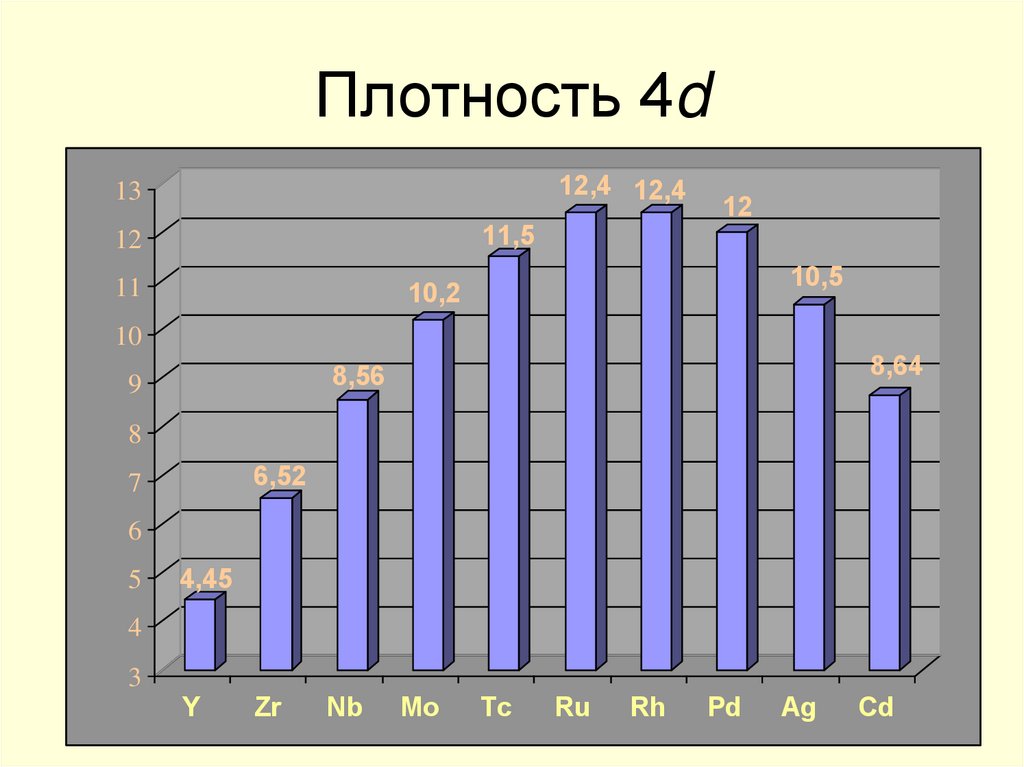
13. Плотность 4d
12,4 12,413
11,5
12
12
10,5
10,2
11
10
8,64
8,56
9
8
6,52
7
6
5
4,45
4
3
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
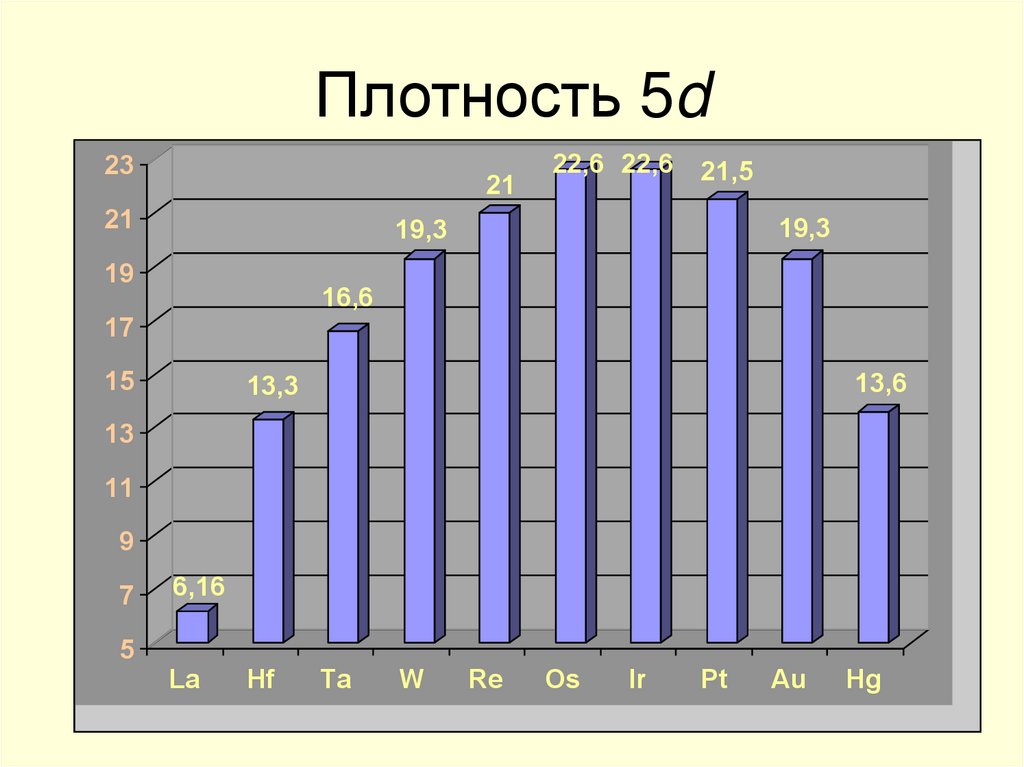
14. Плотность 5d
2321
21
22,6 22,6
21,5
19,3
19,3
19
16,6
17
15
13,6
13,3
13
11
9
7
5
6,16
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
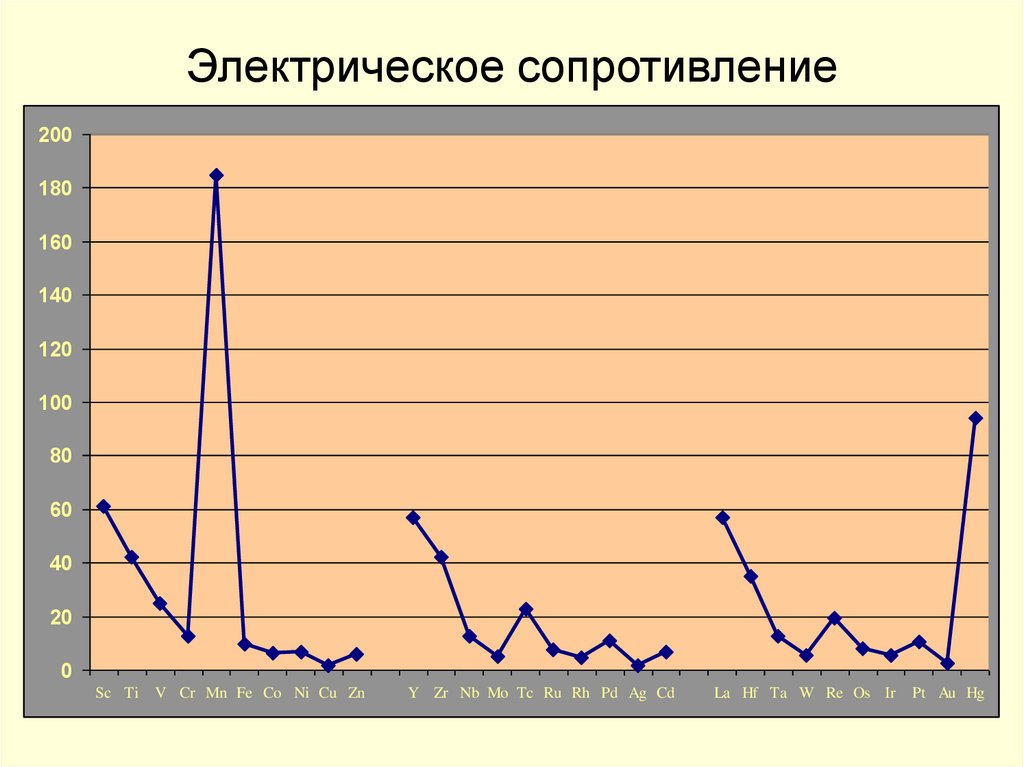
15. Электрическое сопротивление
200180
160
140
120
100
80
60
40
20
0
Sc Ti
V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir
Pt Au Hg
16. Химические свойства меди
2Cu + O2 = 2CuO.Cu + Cl2 = CuCl2
2Cu + S = Cu2S.
Cu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO + 4H2O
2Cu + O2 + CO2 + H2O = (CuOH)2CO3.
17. Химические свойства цинка
2Zn + O2 = 2ZnOZn + Cl2 = ZnCl2
Zn + S = ZnS
Zn + H2O (пар) = ZnO + H2
Zn + 2HCl = ZnCl2 + H2
Zn + H2SO4 = ZnSO4 + H2
4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S + 4H2O
4Zn + 10HNO3 (оч.разб., гор.) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + H3PO4 (конц., гор.) = ZnHPO4 + H2
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2
Zn + 4 NH3.H2O = [Zn(NH3)4](OH)2 + H2 + 2H2O
18. Химические свойства хрома
Не реагирует с холодной водой, щелочами,гидратом аммиака, пассивируется в концентрированной
и разбавленной азотной кислоте, «царской водке».
4Cr (порошок) + 3O2 = 2Cr2O3.
Cr + 2F2 = CrF4
(350-500 °C)
2Cr + 3H2O (пар) = Cr2O3 + 3H2
Cr + H2SO4 (разб.) = CrSO4 + H2
Cr + 2HCl = CrCl2 + H2
19. Химические свойства марганца
Mn + Cl2 = MnCl2Mn + O2 = MnO2
Mn + S = MnS
Mn (порошок) + 2H2O (пар) = Mn(OH)2 + H2
Mn + 2HCl = MnCl2 + H2
Mn + H2SO4 = MnSO4 + H2
Mn + 2H2SO4 (конц.) = MnSO4 + SO2 + 2H2O
3Mn + 8HNO3 (конц.) = 3Mn(NO3)2 + 2NO + 4H2O
20. Химические свойства серебра
2Ag + Cl2 = 2AgCl2Ag + S = Ag2S.
2Ag + 2H2SO4 (конц., гор.) = Ag2SO4 + SO2 + 2H2O
3Ag + 4HNO3 (разб.) = 3AgNO3 + NO + 2H2O
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
Ag + F2 = AgF2
(>300 °C)
21. Химические свойства ртути
2Hg + O2 = 2HgO250-350 °C
Hg + Cl2 = HgCl2
70-120 °C
Hg + HgCl2 = Hg2Cl2
250-300 °C
Hg + S = HgS
2Hg + 2H2SO4 = Hg2SO4 + SO2 + 2H2O
конц., гор.
Hg + 2H2SO4 = HgSO4 + SO2 + H2O
конц.
6Hg + 8HNO3 = 3Hg2(NO3)2 + 2NO + 4H2O
разб.,хол.
Hg + 4HNO3 = Hg(NO3)2 + 2NO2 + 2H2O
конц., гор.
Hg + 4HI = H2[HgI4] + H2
конц.
22. Соединения меди
Cu(OH)2 + 2H+ = Cu2+ + 2H2OCu(OH)2 + 2OH– = [Cu(OH)4]2–
Сульфат меди(II) пятиводный CuSO4 • 5H2O – медный купорос;
Карбонат гидроксомеди(II) (CuOH)2CO3,
основной компонент минерала малахита
23. Соединения серебра
Оксид серебра Ag2O.Твердое вещество темно-коричневого цвета,
при нагревании разлагается.
Аммиачный раствор оксида серебра –
реактив Толленса [Ag(NH3)2]OH - реагент
для проведения реакции серебряного зеркала.
Нитрат серебра AgNO3.
Кристаллы белого цвета.
Хорошо растворим в воде, не подвергается гидролизу.
Используется для проведения качественной реакции на галогенид-ионы:
Ag+ + Cl– = AgCl (белый творожистый осадок)
Ag+ + I– = AgI (желтоватый кристаллический осадок).
Бромид серебра AgBr.
Кристаллы светло-желтого цвета.
Бромид серебра используется в фотографии,
входит в состав светочувствительного слоя фотопленки.
24. Соединения хрома
Cr(OH)2 + 2H+ = Cr2+ + 2H2O4CrCl2 + 4HCl + O2 = 4CrCl3 + 2H2O
Cr(OH)3 + 3H+ = Cr3+ + 3H2O
Cr(OH)3 + 3OH– = [Cr(OH)6]3–
CrO3 + H2O = H2CrO4
2CrO42– + 2H+ Cr2O72– + H2O
K2Cr2O7 + 14HCl = 2KCl + 2CrCl3 + 3Cl2 + 7H2O
K2Cr2O7 + K2SO3 + H2SO4 = Cr2(SO4)3 + K2SO4 + H2O
2Na3[Cr(OH)6] + 3Br2 + 4NaOH = 2Na2CrO4 + 6NaBr + H2O
25. Соединения марганца
MnCO3 = MnO + CO2MnO2 + H2 = MnO + H2O
MnO + 2HCl = MnCl2 + H2O
2Mn(OH)2 + O2 + H2O = 2MnO(OH)2
MnO2 + 4HCl (конц.) = MnCl2 + Cl2 + 2H2O
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O + O2
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O.
Mn2O7 + H2O = 2HMnO4
Mn2O7 + 2NaOH = 2NaMnO4 + H2O
26. Окислительные свойства перманганата
+7+2
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
+7
+4
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
+6
+7
2KMnO4 + K2SO3 + 2KOH = 2 K2MnO4 + K2SO4 + H2O
+6
+7
+4
2K2MnO4 + 2H2O 2KMnO4 + MnO2 + 4KOH
+4
+6
2KMnO4 = K2MnO4 + MnO2 + O2
+7
27. Применение
МеталлОбласти применения
Марганец
Сплавы, легирующая добавка к стали.
Медь
Проводники электрического тока, сплавы (латунь, бронза,
мельхиор и др.), теплообменники.
Серебро
Электротехнические контакты, зеркальные покрытия,
ювелирные изделия, производство фотографических
материалов.
Хром
Сплавы, легирующая добавка к стали, антикоррозийные и
декоративные покрытия.
Цинк
Гальванические элементы, антикоррозийные покрытия,
сплавы.















 chemistry
chemistry








