Similar presentations:
Побочная подгруппа VI группы периодической системы
1.
Побочная подгруппаVI группы
периодической
системы
1
2.
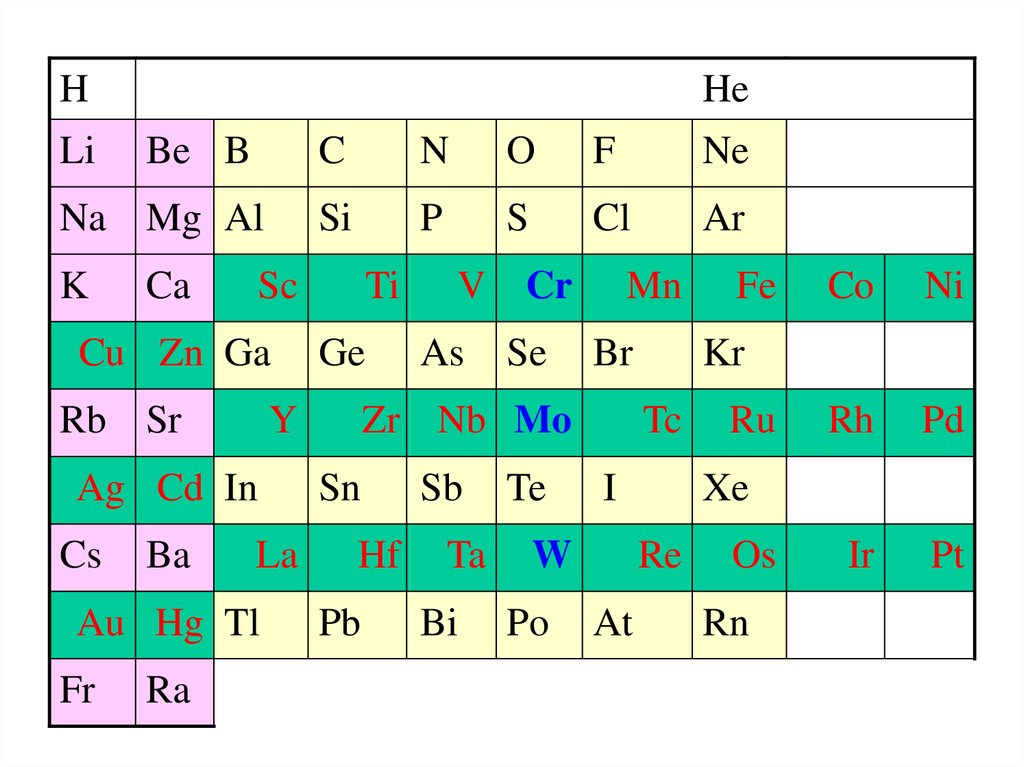
HLi
He
Be B
Na Mg Al
K
Ca
Rb Sr
La
Au Hg Tl
Fr
Ra
O
F
Ne
Si
P
S
Cl
Ar
Ti
Ge
Y
Ag Cd In
Ba
N
Sc
Cu Zn Ga
Cs
C
V Cr
As
Se
Mn
Br
Zr Nb Mo
Sn
Hf
Pb
Sb
Ta
Bi
Te
Po
I
Ni
Ru
Rh
Pd
Ir
Pt
Xe
Re
At
Co
Kr
Tc
W
Fe
Os
Rn
3. Элементы VIB группы
пСтепени окисления
Cr
r, M0 r, M6+
(Å)
(Å)
1,26
0,26
1,56
0, +2, +3, (+4), (+5), +6
Mo
1,40
0,41
1,30 0, (+2), (+3), (+4), (+5), +6
W
1,41
0,42
1,40 0, (+2), (+3), (+4), (+5), +6
rMo ≈ rW как следствие лантаноидного сжатия
Cвойства Mo и W очень похожи и сильно
отличаются от свойств Cr
Склонность к проявлению высшей СО растет
Убывание кислотных свойств (H2CrO4 и H2MoO4)
4. Содержание в земной коре и минералы
• Cr – 20 место. Хромит или хромистый железняк(FeCr2O4 = FeO·Cr2O3), крокоит (PbCrO4).
• Mo – 37 место. Молибденит (MoS2),
вульфенит (PbMoO4),
повеллит (СаМоО4),
молибдит (Fe(MoO4)3·nH2O).
• W – 39 место. Шеелит (CaWO4),
вольфрамит ((Fe,Mn)WO4).
4
5. Открытие элементов
• Cr – в 1797 г. француз Воклен. От греческого«хрома» – «цвет» (из-за разнообразие окрасок в
соединениях).
• Mo – в 1817 г. швед Берцелиус. От греческого
«молюбдос» – «свинец» (из-за внешнего сходства
молибденита (MoS2) со свинцовым блеском (PbS)).
• W – в 1781 г. швед Шееле. От немецкого «Wolf
Rahm» – «волчья пена» (вольфрам, сопровождая
оловянные руды, мешал выплавке олова, переводя его в
пену шлаков – «пожирает олово как волк овцу»).
5
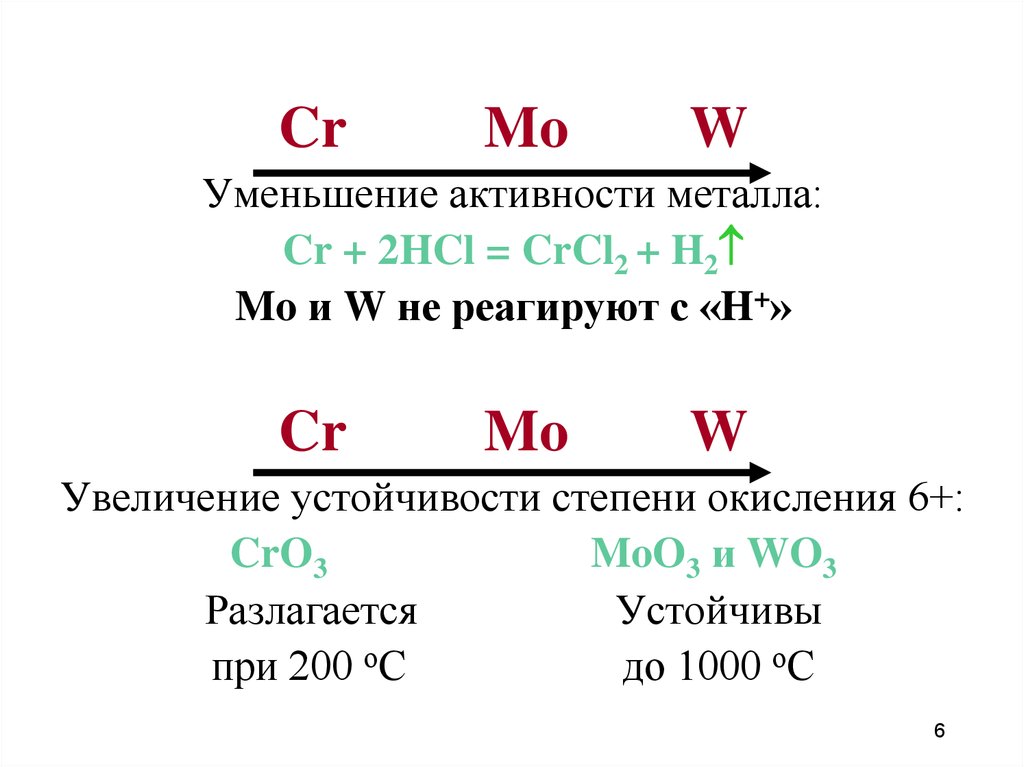
6.
CrMo
W
Уменьшение активности металла:
Cr + 2HCl = CrCl2 + H2
Mo и W не реагируют с «H+»
Cr
Mo
W
Увеличение устойчивости степени окисления 6+:
CrO3
MoO3 и WO3
Разлагается
Устойчивы
при 200 оС
до 1000 оС
6
7. Получение Cr
Выплавка феррохрома:FeCr2O4 + 4C = Fe + 2Cr + 4CO
(хромит)
Получение чистого хрома:
1 стадия – окислительное плавление хромита в щелочной среде:
4FeCr2O4+ 8Na2CO3 + 7O2 = 8Na2CrO4+ 2Fe2O3 + 8CO2
2 стадия – растворение полученного спека в кислой среде:
2Na2CrO4 + 2H2SO4 = Na2Cr2O7 + 2NaHSO4 + H2O
3 стадия – восстановление хрома (VI) до хрома (III):
Na2Cr2O7 + 2C = Cr2O3 +Na2CO3 +CO
Cr2O3 +2Al = Al2O3 + 2Cr
(алюмотермия)
7
8. Получение Mo
1 стадия – окислительный обжиг молибденита:MoS2 + 3,5O2
500-600 ºC
MoO3 + 2SO2
2 стадия – выщелачивание раствором аммиака:
7MoO3 + 6NH3 + 3H2O = (NH4)6Mo7O24
парамолибдат аммония
3 стадия – нейтрализация раствора до рН = 2–3:
(NH4)6Mo7O24 + 6HCl + 4H2O = 7H2MoO4 + 6NH4Cl
молибденовая кислота
4 стадия – термолиз молибденовой кислоты при 450-500 ºС:
H2MoO4 MoO3 + H2O
MoO3 – порошок бледно-зеленого цвета
5 стадия – восстановление оксида MoO3 водородом:
MoO3 + 3H2 Mo + 3H2O
8
9. Получение W
1 стадия – окислительное плавление шеелита в щелочной среде:CaWO4 + Na2CO3 = Na2WO4 + CO2 + CaO
2 стадия – нейтрализация раствора:
Na2WO4 + 2HCl = H2WO4 + 2NaCl
вольфрамовая кислота
3 стадия – термолиз вольфрамовой кислоты:
H2WO4 WO3 + H2O
4 стадия – восстановление оксида WO3 водородом:
WO3 + 3H2 W + 3H2O
9
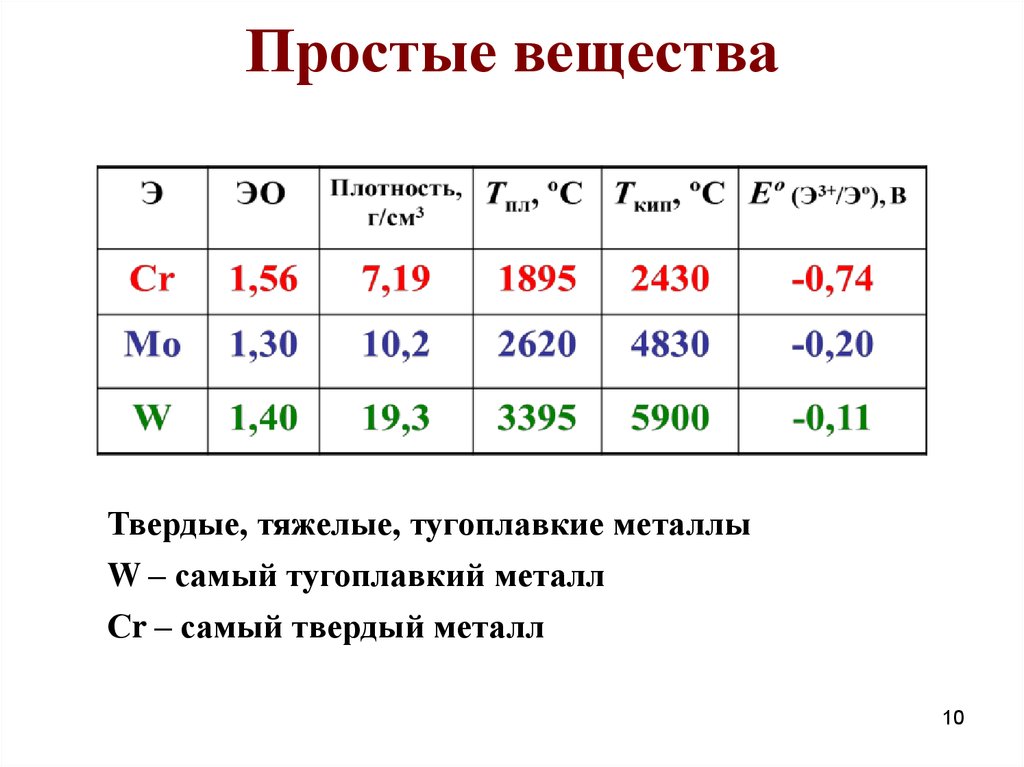
10. Простые вещества
Твердые, тяжелые, тугоплавкие металлыW – самый тугоплавкий металл
Сr – самый твердый металл
10
11. Свойства простых веществ: Cr
1) Cr + 2 HCl = CrCl2 + H2Реакция в атмосфере Ar, голубой [Cr(H2O)6]2+
2) 2Cr + 6HCl + O2 = 2CrCl3 + H2 + 2H2O
Реакция на воздухе, зеленый [Cr(H2O)6]3+
3) 2Cr + 6H2SO4(конц.) = Cr2(SO4)3 + 3SO2 +6H2O
Концентрированная H2SO4 – окислитель. Растворим и в
разбавленной серной кислоте.
4) Конц. HNO3 пассивирует поверхность
5) Щелочи пассивируют поверхность
11
12. Свойства простых веществ: Cr
6) 2Cr + 3H2O = Cr2O3 +3H27) 2Cr + 3/2O2 = Cr2O3
8) Cr + HCl(газ) = CrCl2 (безводный) + H2
Чистый безводный CrCl2 бесцветный.
9) 2Cr + 3Cl2 = 2CrCl3 (безводный)
Безводный CrCl3 фиолетовый, CrCl3.6H2O – темно-зеленый.
Реакции 6–9 идут при нагревании!
12
13. Свойства простых веществ: Mo, W
1) Растворение металлов:а) W + 8HF + 2HNO3 = H2[WF8] + 2NO +4H2O
HNO3 – окислитель, HF – источник лигандов
б) Окислительная щелочная плавка:
Mо + 3NaNO3 + Na2CO3 = Na2MоO4 + 3NaNO2 + CO2
2) Реакции при нагревании:
а) 2W + 3O2 = 2WO3
б) Mo +2S = MoS2
13
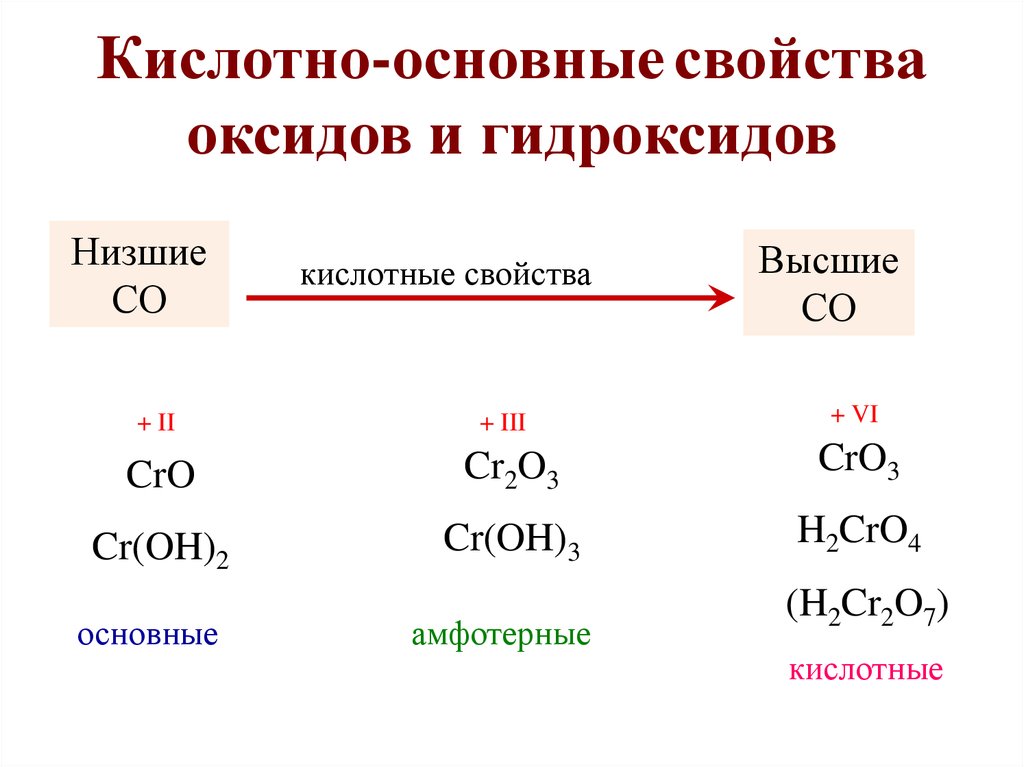
14.
Кислотно-основные свойcтваоксидов и гидроксидов
Низшие
СО
+ II
кислотные свойства
+ III
Высшие
СО
+ VI
CrO
Cr2O3
CrO3
Cr(OH)2
Cr(OH)3
H2CrO4
основные
амфотерные
(H2Cr2O7)
кислотные
15.
Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]
тетрагидроксохромит натрия
t
Cr2O3 + NaOH = NaCrO2 + H2O
хромит натрия
СrO3 – кислотный оксид
CrO3 + KOH = K2CrO4 + H2O
хромат калия
при сплавлении
16. Кислородные соединения Cr6+
Кислородные соединения6+
Cr
CrO3 – темно-красный, разлагается выше 200 оС,
растворим в воде:
- термическое разложение: 4CrO3 = 2Cr2O3 + 3O2
- взаимодействие с водой: CrO3 + H2O = H2CrO4
MoO3 (бесцветный), WO3 (желтый) –
устойчивы до 800 оС, не растворимы в воде.
16
17. Кислородные соединения Cr6+
Кислородные соединения6+
Cr
Способы получения оксидов М6+:
K2Cr2O7 + 2H2SO4конц= 2CrO3↓ + 2KHSO4 +H2O
2M + 3O2 = 2MO3 (M = Mo, W), но 4Cr +3O2 = 2Cr2O3!
(NH4)2MO4 = MO3 + H2O + 2NH3 (M = Mo, W),
но (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O!
17
18. Кислородные соединения Cr6+
Кислородные соединения6+
Cr
H2CrO4: Ka1= 10–1, Ka2= 10–7
H2Cr2O7: Ka2= 10–2
Гидролиз солей:
CrO42– – хромат ион, устойчив в щелочной среде (желтый)
Cr2O72– – дихромат ион, устойчив в кислой среде (оранжевый)
Cr2O72– + H2O = 2CrO42– + 2H+
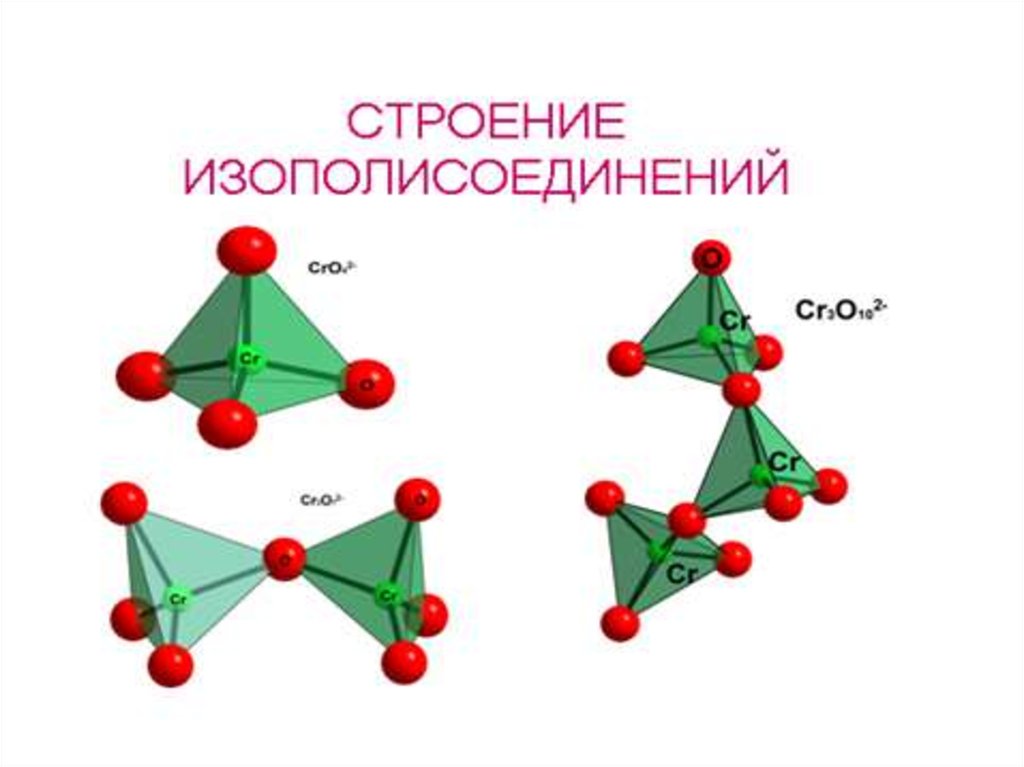
[H+] H2CrO4, H2Cr2O7, H2Cr3O10, H2Cr4O13 CrO3
изополисоединения
процесс полимеризации
Cr2O72– + 2OH– ↔ 2CrO42– + H2O
процесс деполимеризации
18
19.
20.
Кислородные соединения6+
Cr
Соединения Cr6+ гораздо более сильные
окислители, чем соединения Mo6+ и W6+
4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2O
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O
K2Cr2O7 + 14HClконц = 3Cl2 + 2CrCl3 + 7H2O + 2KCl
20
21.
Кислородные соединения6+
Cr
В зависимости от pH раствора:
Cr2O72– + 3SO32– + 8H+ = 2Cr3+ + 3SO42– + 4H2O
2CrO42– + 3SO32– + 5H2O = 2Cr(OH)3 + 3SO42– + 4OH–
2CrO42– + 3Sn2+ + 10OH– + 8H2O = 2[Cr(OH)4]– + 3[Sn(OH)6]2–
21
22.
Кислородные соединения3+
Cr
Cr2O3 – очень стабилен, зеленый пигмент в красках.
Не реагирует с водой, кислотами и р-рами щелочей.
Щелочной плавкой получают хромиты:
Cr2O3 + 2NaOHтв = 2NaCrO2 + H2O
NaCrO2 + 2NaOH + 2H2O = Na3[Cr(OH)6]
22
23. Гидрооксид Cr3+
Получают добавлением щелочей или аммиака:Cr3+ + 3OH– = Cr(OH)3↓
Стареет, свежеосажденный амфотерен:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + NaOH = Na[Cr(OH)4]
23
24.
Соли3+
Cr
Хромовые квасцы KCr(SO4)2.12H2O
Многочисленные комплексы:
CrCl3.6H2O – гидратная изомерия
Соединение
[Cr(H2O)6]Cl3
Цвет
Фиолетовый
[Cr(H2O)5Cl]Cl2.H2O
Светло-зеленый
[Cr(H2O)4Cl2]Cl.2H2O
Темно-зеленый
24
25. Cr3+ Cr6+
3+Cr
6+
Cr
Сильные окислители:
2Cr3+ + 3S2O82– + 7H2O = Cr2O72– + 6SO42– + 14H+
2Cr3+ + 3Br2 + 16OH– = 2CrO42– + 6Br– + 8H2O
26.
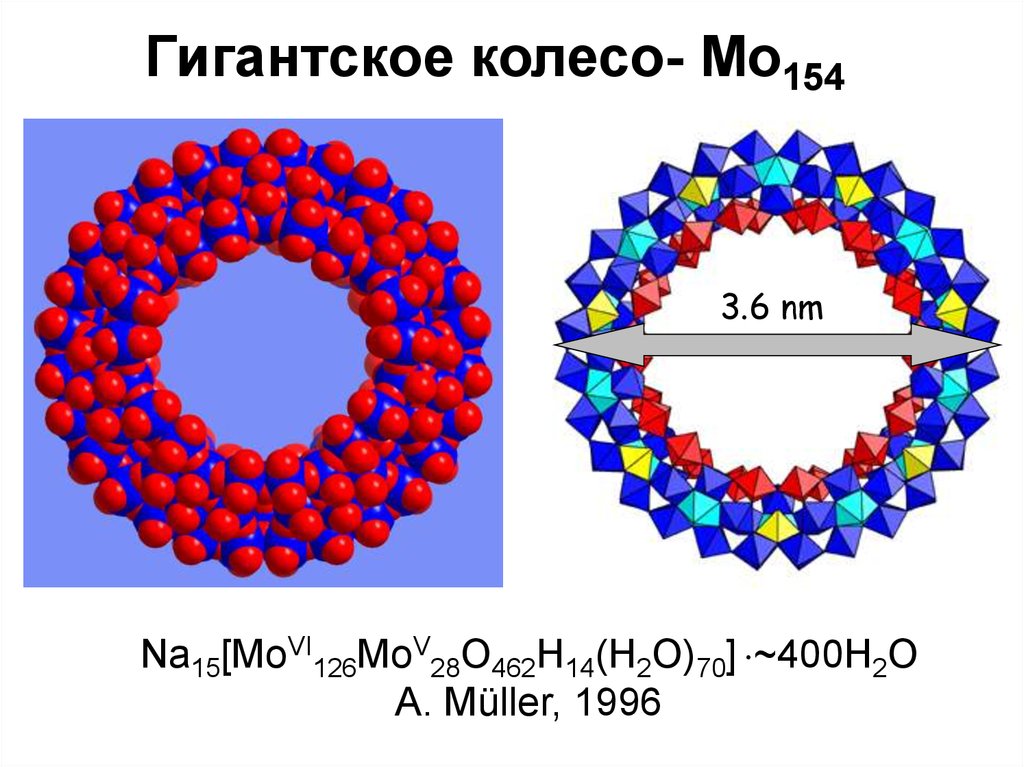
Гигантское колесо- Mo1543.6 nm
Na15[MoVI126MoV28O462H14(H2O)70] ~400H2O
A. Müller, 1996
27. Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48–
А. Мюллер, 200228. Применение
• Cr – коррозионностойкие стали,покрытия, инструменты
• Mo – жаропрочные стали, нагреватели
• W – нити накаливания, радиодетали
28
29.
Побочная подгруппаVII группы
периодической
системы
29
30.
HLi
He
Be B
Na Mg Al
K
Ca
Rb Sr
La
Au Hg Tl
Fr
Ra
O
F
Ne
Si
P
S
Cl
Ar
Ti
Ge
Y
Ag Cd In
Ba
N
Sc
Cu Zn Ga
Cs
C
V
As
Cr
Se
Mn
Br
Zr Nb Mo
Sn
Hf
Pb
Sb
Ta
Bi
Te
Po
I
Ni
Ru
Rh
Pd
Ir
Pt
Xe
Re
At
Co
Kr
Tc
W
Fe
Os
Rn
31.
Mn, Tc, Re (n-1)d5ns2r,M0 r,M4+ r, M7+ Электроотриц.
(Å) (Å) (Å)
Mn 1,30 0,54 0,26
1,60
Tc
1,36
0,64
0,37
1,36
Re
1,37
0,63
0,40
1,46
Степени
окисления
0,+2,+3,+4,
(+5), +6, +7
0,(+3),+4,
(+5), +6, +7
0,(+3),+4,
(+5), +6, +7
Свойства Tc и Re очень похожи и сильно
отличаюся от свойств Mn
31
32. Содержание в земной коре и минералы
• Mn – 15 место.Пиролюзит – рис. слева (MnO2.xH2O);
браунит (Mn2O3); манганит (MnO(OH));
гаусманнит (Mn3O4 = MnIIMnIII2O4);
родохрозит – рис. справа (MnCO3).
33.
Содержание в земной кореи минералы
Tc – первый искусственный элемент,
97Tc: t
.106 лет.
=
2,6
1/2
Re – 81 место, ОЧЕНЬ редкий и рассеянный!!!
Джезказганит (CuReS4);
рениит (ReS2) – на Камчатке и Курилах обычно
примесь в молибдените MoS2;
таркианит ((Cu,Fe)(Re,Mo)4S8)
34. Открытие элементов
• Mn – в 1774 г. шведы Шееле и Ган.Мангановый камень (пиролюзит)
ремесленники добавляли в стекло
• Tc – в 1871 г. Д.И. Менделеев предсказал
существование экамарганца; итальянцы
Сегре и Перрье получили в 1936 г.
98Mo + 2D = 99Tc + 1n
• Re – в 1925 г. немцы супруги Ноддак.
По имени Рейнской провинции.
34
35. Получение простых веществ
• Дешевый методMnO2 + Fe2O3 +5C = Mn + 2Fe + 5CO
• Дорогой метод – алюмотермия
3MnO2.xH2O = Mn3O4 + O2 +3xH2O
3Mn3O4 + 8Al = 9Mn + 4Al2O3
• Получение технеция и рения
2NH4TcO4 = 2TcO2 + 4H2O + N2;
TcO2 + 2H2 = Tc + 2H2O;
2NH4ReO4 + 4H2 = 2Re + N2 + 8H2O (1000 oC)
35
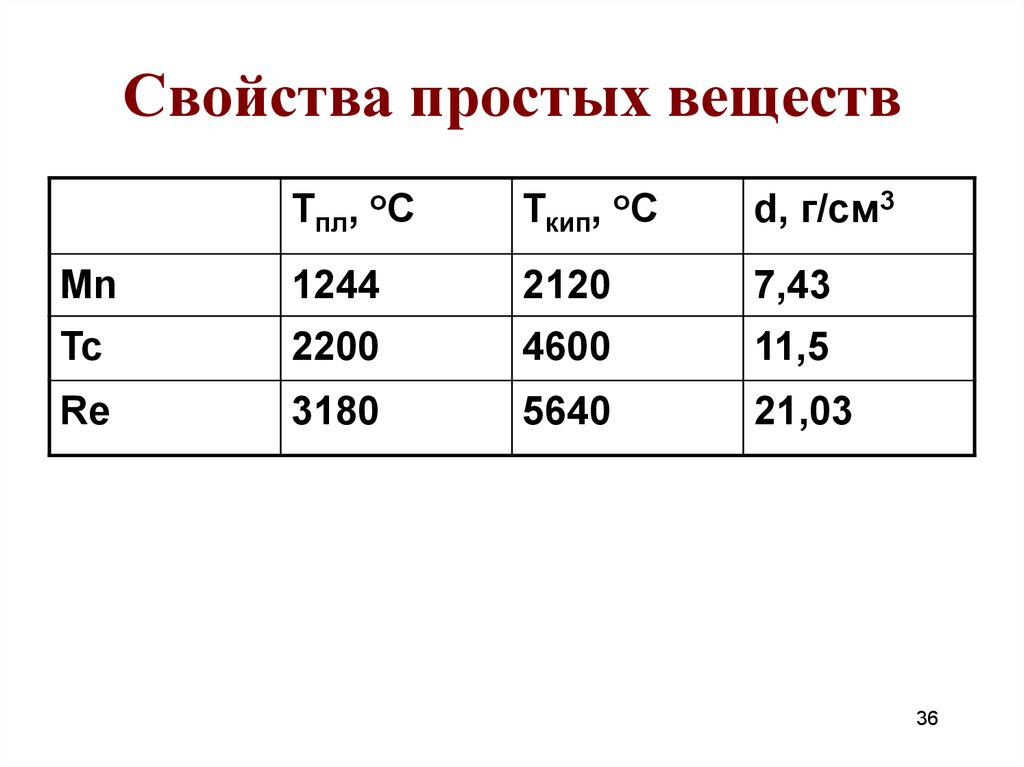
36. Свойства простых веществ
Тпл, оСТкип, оС
d, г/см3
Mn
1244
2120
7,43
Tc
2200
4600
11,5
Re
3180
5640
21,03
36
37. Хим. cвойства простых веществ
Положение в ряду напряж. металлов….Mg Mn Zn…H Cu Tc Re…
Mn +2HCl = MnCl2 + H2 E0 0
Mn + 4HNO3(конц)= Mn(NO3)2 +2NO2 +2H2O
4Re + 4 KOH +7O2 = 4KReO4 +2H2O (расплав)
Re + 7HNO3(конц)= HReO4 +7NO2 +3H2O
2Re + 7H2O2 = 2HReO4 +6H2O
37
38. Реакции при нагревании
3Mn + 2O2 = Mn3O4 (MnIIMnIII2O4)3Mn + N2 = Mn3N2 (1200oC)
Mn + Cl2 = MnCl2
Mn + F2 = MnF2 (и MnF3)
4Re + 7O2 = 2Re2O7 (летучий оксид)
2Re + 5Cl2 = 2ReCl5
Re + 2S = ReS2
38
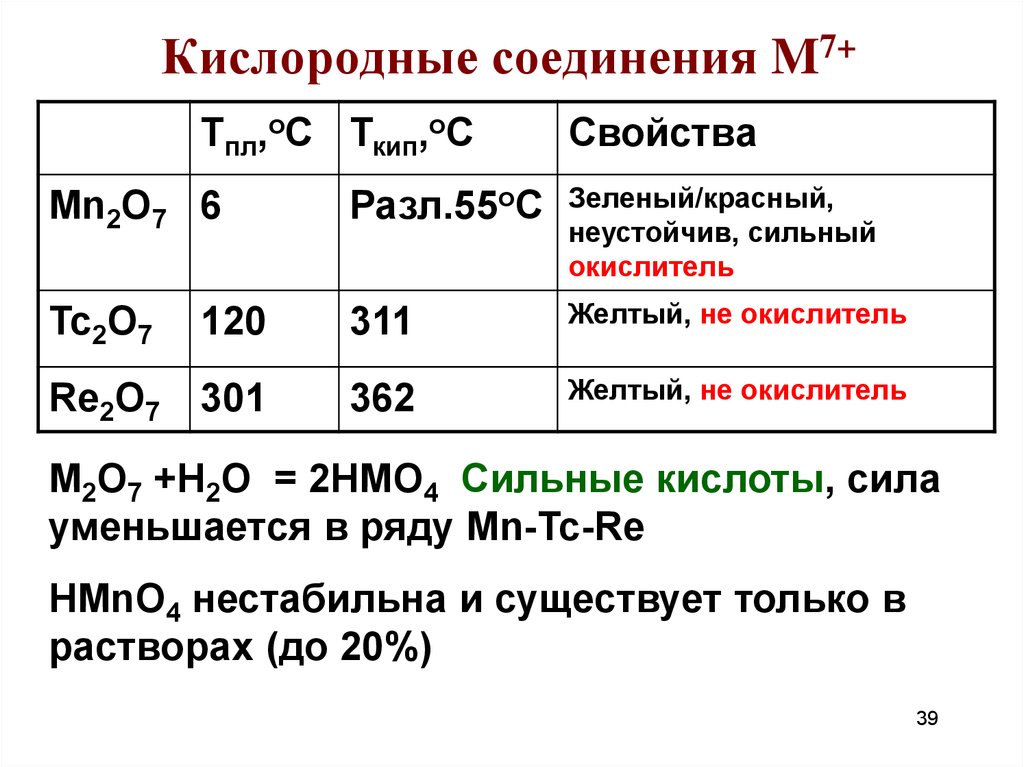
39. Кислородные соединения M7+
Тпл,оС Ткип,оССвойства
Mn2O7 6
Разл.55оС
Зеленый/красный,
неустойчив, сильный
окислитель
Tc2O7
120
311
Желтый, не окислитель
Re2O7
301
362
Желтый, не окислитель
M2О7 +Н2О = 2НMО4 Сильные кислоты, сила
уменьшается в ряду Mn-Tc-Re
HMnO4 нестабильна и существует только в
растворах (до 20%)
39
40. Соли M7+
СолиНазвание
7+
M
Цвет
Устойчивость
Св-ва
KMnO4
Перманганат фиолетовый
Тразл = 250оС
окислитель
KTcO4
Пертехнат
бесцветный
Тразл выше
1000оС
Не
окислитель
KReO4
Перренат
бесцветный
Ткип = 1370оС
Не
окислитель
2KMnO4 = K2MnO4 + MnO2 + O2↑
2MnO4– + 5H2S + 6H+ = 2Mn2+ + 5S + 8H2O
2ReO4– + 7H2S +2H+ = Re2S7↓ + 8H2O
40
41. KMnO4 как окислитель
СредаpH<7
pH>7
pH>>7
Продукт
восстановления
Mn2+
MnO2↓
MnO42-
Цвет
бесцветный
бурый
зеленый
Конпропорционирование
3MnSO4 + 2KMnO4 + 2H2O = 5MnO2↓ + K2SO4 + 2H2SO4
41
42. Получение KMnO4
Две стадии:1) Щелочное плавление пиролюзита:
3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O
2) Окисление до перманганата :
Cl2, O3, PbO2, (NH4)2S2O8, KBiO3, XeF4
Экономично электрохимическое окисление:
КАТОД: 2H2O + 2e = H2 + 2OH–
АНОД: MnO42– – e = MnO4–
2K2MnO4 + 2H2O = 2KMnO4 +2KOH +H2↑42
(формально)
43. Кислородные соединения Mn6+
MnO3 и H2MnO4 – не известныСоли – манганаты (зеленый цвет)
Манганаты склонны диспропорционировать,
особенно в кислой среде
3MnO42– + 4H+ = 2MnO4– + MnO2↓ + 2H2O
(пропускание CO2)
43
44. Кислородные соединения Mn6+
Манганаты – сильные окислители, особеннов кислой среде, где восстанавливаются до
Mn2+; в щелочной среде восстанавливаются
до MnO2
Окисление органики
6K2MnO4 +C2H5OH +H2O = 6MnO2↓+ 2K2CO3 +8KOH
В зависимости от условий этанол
можно окислить до альдегида или кислоты
44
45. Кислородные соединения Mn4+
MnO2 – важнейшее соединениеСвойства окислителя (при нагревании):
MnO2 + 4HClконц = MnCl2 + Cl2↑ + 2H2O
2MnO2 + 2H2SO4 = 2MnSO4 + O2↑ +2H2O
Окисление до манганатов:
(сплавление)
3MnO2 + KClO3 + 3K2CO3 = 3K2MnO4 + KCl + 3CO2
(KNO3)
45
46. Кислородные соединения Mn4+
Слабовыраженные амфотерные свойстваMnO2 + 4HF = MnF4 + 2H2O
MnO2 + CaO = CaMnO3 (метаманганат (IV))
CaMnO3 + CaO = Ca2MnO4 (ортоманганат (IV))
46
47. Кислородные соединения Mn2+
MnO – серо-зеленый, не растворим в водеMnCO3 = MnO + CO2 (при нагревании)
Встречается в природе в виде минерала (розовые кристаллы)
родохрозита (марганцевый шпат).
MnCl2 + 2NaOH = Mn(OH)2↓ + 2NaCl
Mn(OH)2 – белый, окисляется на воздухе, легко
растворим в кислотах, растворим в крепких
щелочах
Mn(OH)2 + H2SO4 = MnSO4 + 2H2O
Mn(OH)2 + KOH = K[Mn(OH)3]
47
48. Соли Mn2+
Водорастворимые соли:MnCl2.4H2O, MnSO4.5H2O, Mn(NO3)2.6H2O – в
водных р-рах [Mn(H2O)6]2+
Не растворимые соли:
MnCO3, MnS, MnC2O4
MnCl2 + (NH4)2S = MnS↓ + 2 NH4Cl
MnS – темный, при стоянии зеленый
ПРMnS= 10-10, поэтому не осаждается H2S, легко
растворим в кислотах
48
49. Применение
• Mn – марганцовые стали (твердость,износоустойчивость).
Микроудобрения
• Tc – радиодиагностика
• Re – сплавы (жаропрочность,
кислотоустойчивость), катализатор
гидрирования
49




















![Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48– Наноежик или голубой лимон [HxMo368O1032(H2O)240(SO4)48]48–](https://cf.ppt-online.org/files/slide/p/PO9mAw0RpdxleogLitTQZMhncsNzy1ICVjf37q/slide-26.jpg)



















 chemistry
chemistry








