Similar presentations:
Органическая химия. Лекция 1. Введение
1.
2.
Лектор и преподаватель практических занятий(подгруппа 1)
Яснюк Евгений Ростиславович
+375444985098
3.
Теоретические занятия – 20Практические занятия – 11 (по 2 пары каждое)
Обязательная контрольная работа
Экзамен
4.
01.09.20235.
6.
Выделение индивидуальных веществ из растительного,
животного или ископаемого сырья;
Синтез и очистка соединений;
Определение структуры веществ;
Изучение механизмов химических реакций;
Выявление зависимостей между структурой органических
веществ и их свойствами.
7.
Изучение состава и строения органических соединений;свойства, реакции и механизм взаимодействия их друг с
другом;
направленный синтез.
8.
9.
10.
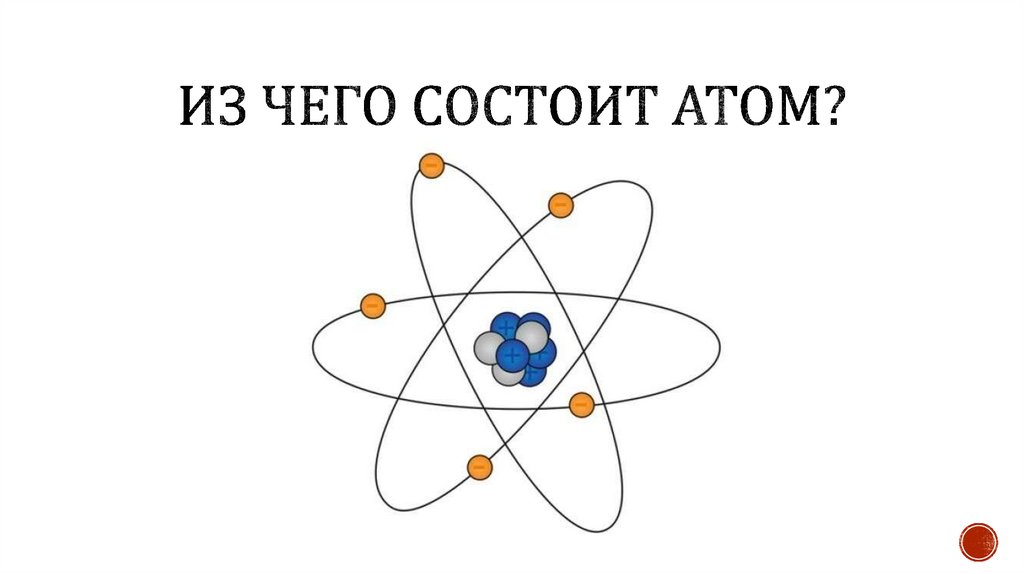
Атомная орбиталь – это часть пространства, где вероятностьнахождения электрона наибольшая.
Энергетический уровень – совокупность электронов с близкими
значениями энергии.
Энергетический подуровень – это совокупность орбиталей с
одинаковыми значениями энергии.
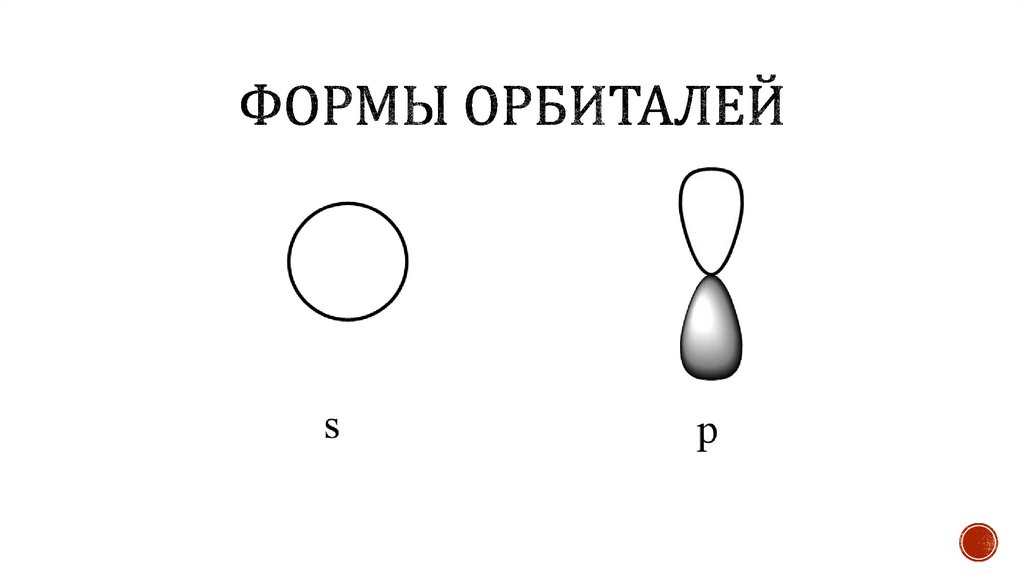
Подуровни s, p, d, f.
11.
12.
Она показывают распределение электронов по энергетическим уровням.13.
Она показывает распределение электронов по орбиталям.14.
Она показывает распределение электронов по орбиталям и спины электронов.↑
1s
s-подуровень:
p-подуровень:
15.
16.
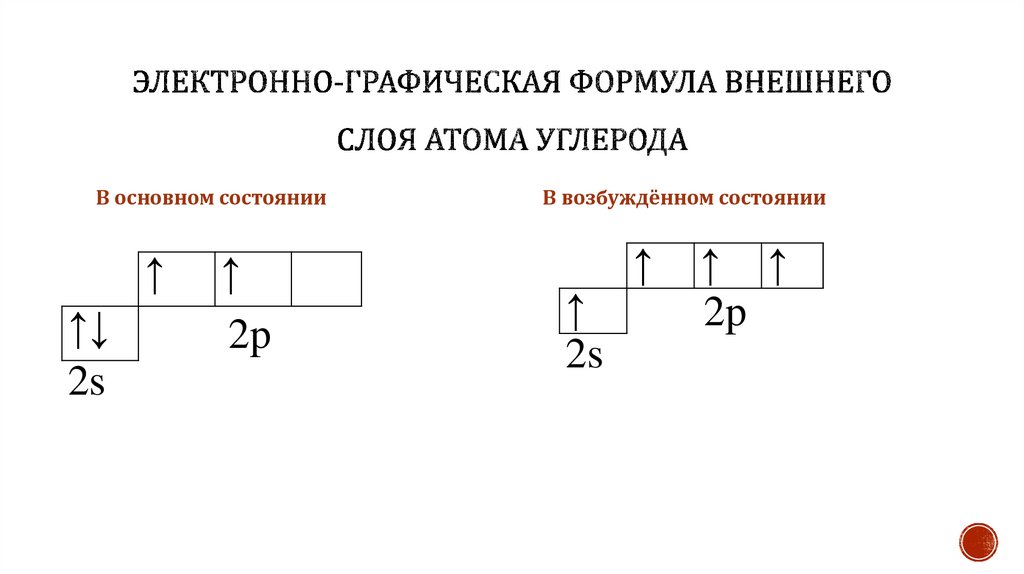
В основном состоянии↑
↑↓
2s
↑
2p
В возбуждённом состоянии
↑
2s
↑
↑ ↑
2p
17.
18.
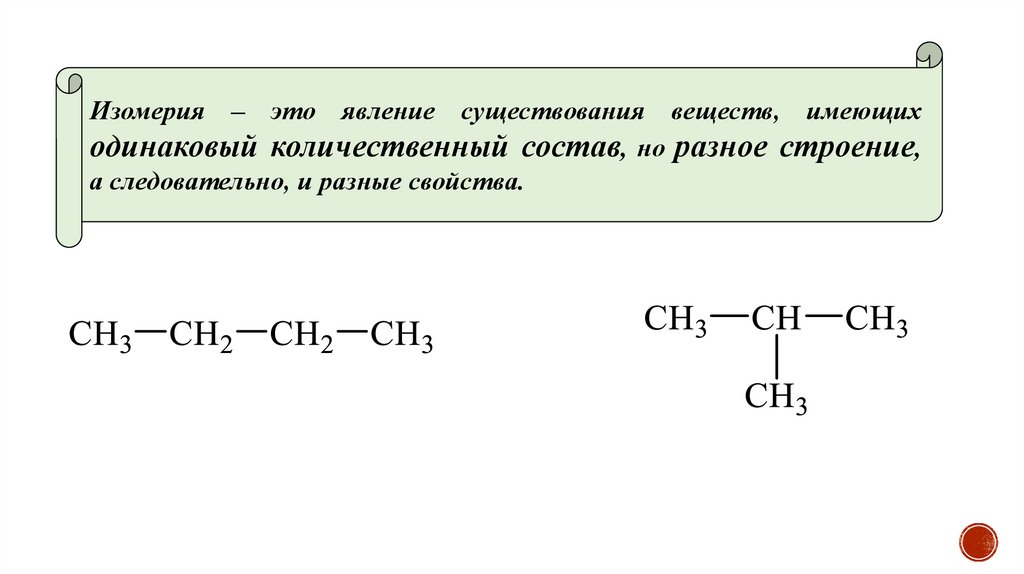
Изомерия – это явление существования веществ, имеющиходинаковый количественный состав, но разное строение,
а следовательно, и разные свойства.
19.
20.
Полярная ковалентная связь образована между атомами сразличной электроотрицательностью (H2O, CH4, H2SO4).
Неполярная ковалентная связь образована между атомами
с одинаковой электроотрицательностью (H2, C, O3).
Ионная связь – связь, образованная между ионами (KCl,
NaOH)
21.
22.
Расстояние между ядрами атомов, образующих связь.Выражается в нанометрах (1 нм = 10-9 м)
23.
Энергия, которую надо затратить на разрыв связи.Выражается в кДж/моль.
24.
Электроотрицательность – способность атомов в молекулестягивать на себя общие электронные пары.
25.
Направленность связи обусловливает молекулярное строениеорганических веществ и геометрическую форму их молекул.
Насыщаемость – способность атомов образовывать
ограниченное число ковалентных связей. Количество связей,
образуемых атомом, ограничено числом орбиталей на внешнем
электронном слое.
26.
возникает в случае, когда водородковалентно связан с сильно
электроотрицательным элементом (О, F, N).
Водородная связь оказывает заметное
влияние на физико-химические
характеристики соединений: температуры
кипения и плавления, растворимость в воде.
27.
28.
29.
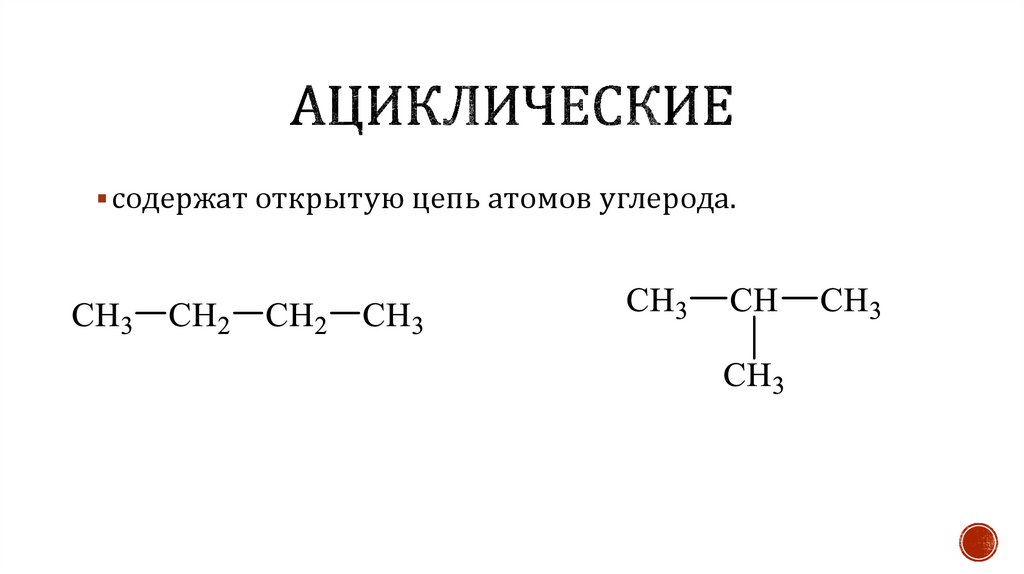
содержат открытую цепь атомов углерода.30.
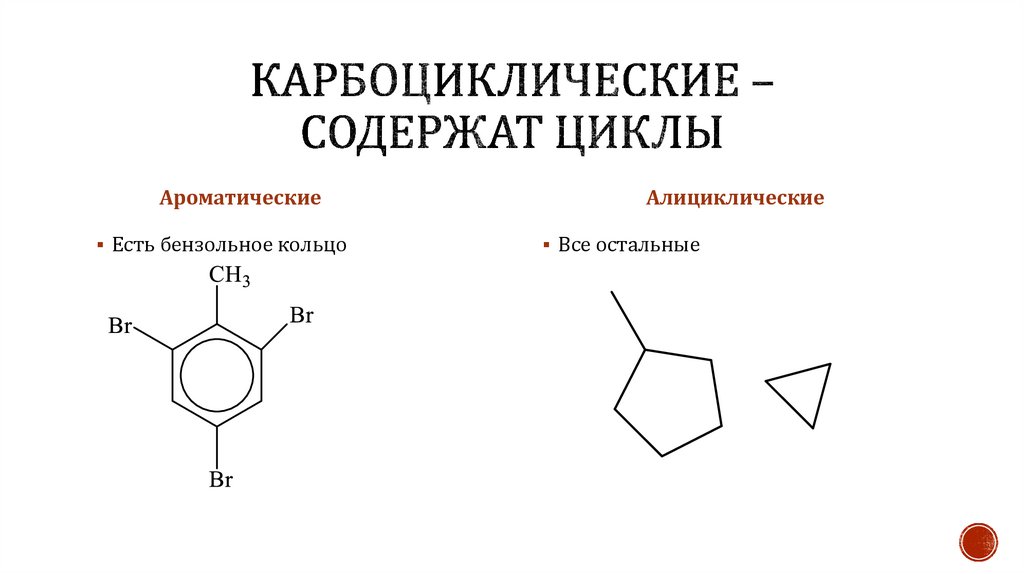
АроматическиеЕсть бензольное кольцо
Алициклические
Все остальные
31.
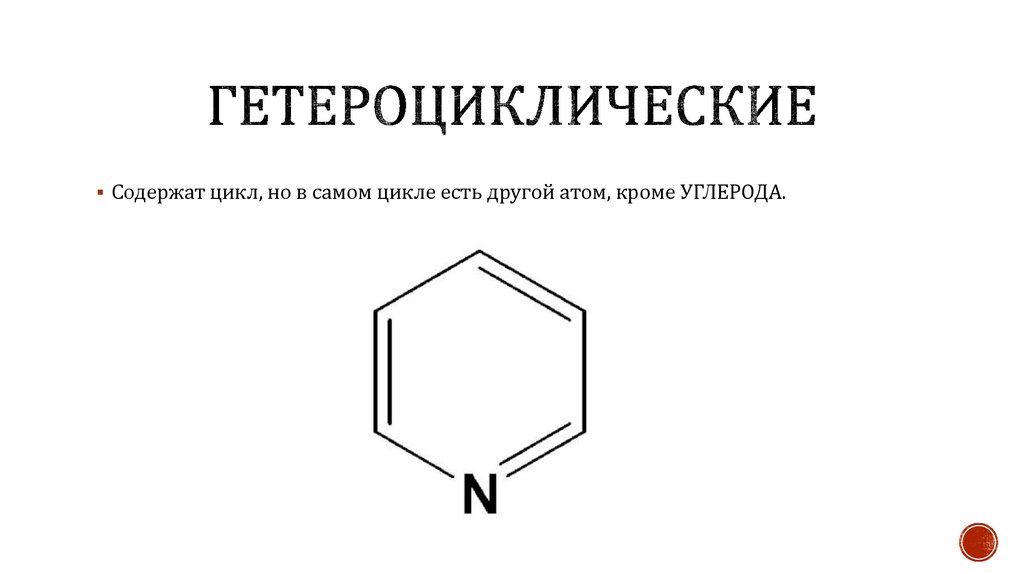
Содержат цикл, но в самом цикле есть другой атом, кроме УГЛЕРОДА.32.
33.
34.
35.
36.
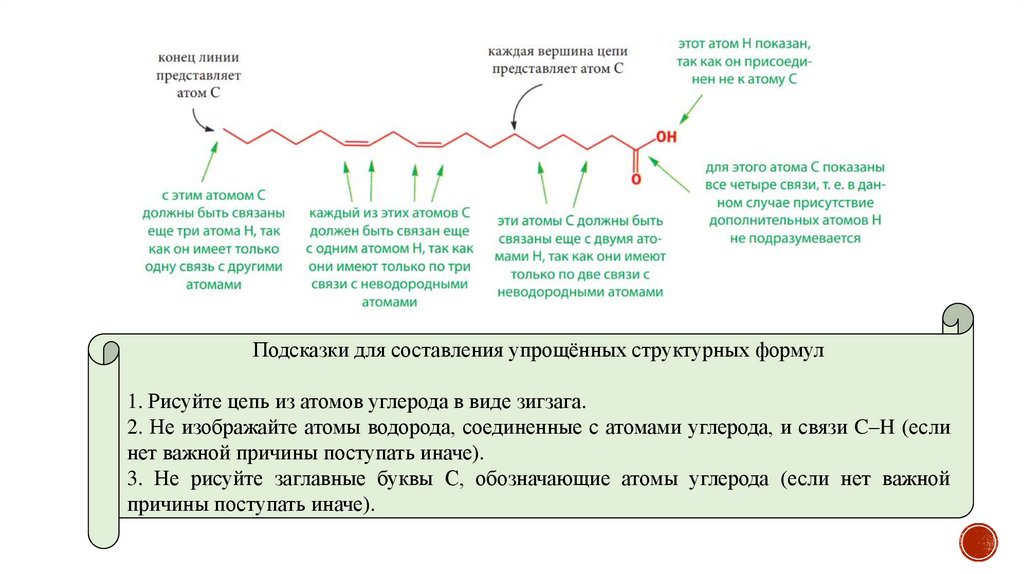
Подсказки для составления упрощённых структурных формул1. Рисуйте цепь из атомов углерода в виде зигзага.
2. Не изображайте атомы водорода, соединенные с атомами углерода, и связи C–H (если
нет важной причины поступать иначе).
3. Не рисуйте заглавные буквы С, обозначающие атомы углерода (если нет важной
причины поступать иначе).
37.
38.
Систематическаяобщепринятая номенклатура, разработанная Международным союзом
чистой и прикладной химии (IUPAC).
39.
Тривиальнаяисторически сложившиеся названия
Они являются случайными и отражают один из признаков:
природный источник вещества (молочная кислота, мочевина, кофеин),
характерные свойства (глицерин, гремучая кислота),
способ получения (пировиноградная кислота, серный эфир),
имя первооткрывателя (кетон Михлера, углеводород Чичибабина),
область применения (аскорбиновая кислота).

























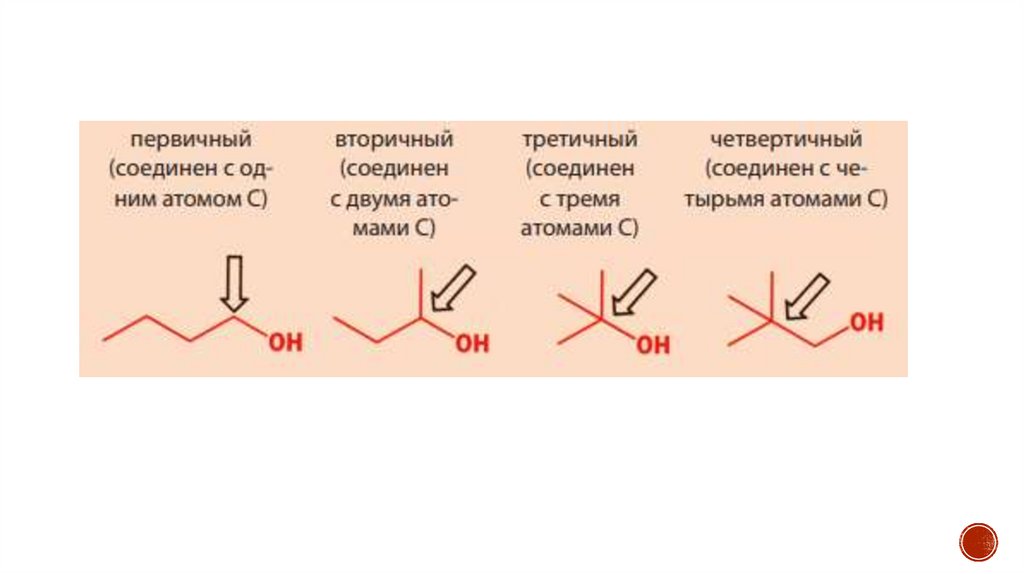


 chemistry
chemistry