Similar presentations:
Органическая химия. Пособие
1.
ОРГАНИЧЕСКАЯ ХИМИЯКофанов Евгений Романович
(д.х.н., профессор)
1
2. Рекомендуемая литература
1. О.А.Реутов, А.Л.Курц, К.П.Бутин, Органическая химия, т.1,2,3,4,“Бином”, Москва, 2005 г.
2. А.Л.Курц и др. Задачи по органической химии с решениями, “Бином”,
Москва, 2004 г.
3. В.Ф.Травень,Органическая химия,т.1,2, «Академкнига», Москва,
2004 г.
4. Ю.С.Шабаров, Органическая химия, ч.1,2, “Химия”, Москва, 1994 г.
5. О.Я.Нейланд, Органическая химия, "Высшая школа", 1990 г.
6. А.А.Петров, Х.В.Бальян, А.Т.Трощенко, Органическая химия изд. 5,
"Высшая школа", 1985 г.
7. В.М.Альбицкая, В.И.Серкова, Задачи и упражнения по органической
химии "Высшая школа", 1983 г.
8. М.С.Белышева, И.С.Колпащикова, B.В.Плахтинский, Номенклатура
органических соединений. Ярославль, 2009 г.
9. И.С.Колпащикова, Е.Р.Кофанов, Е.М.Алов, Углеводороды.
Галогенпроизводные углеводородов. Ярославль, 2007 г.
10. И.С.Колпащикова, А.Ф.Бетнев, Е.М.Алов, Функциональные
производные углеводородов. Ярославль, 2006 г.
11. Лабораторные работы по органической химиипод ред. О.Ф.Гинзбурга
и А.А.Петрова, "Высшая школа", 1974 г.
2
3. Дополнительная литература
1. Органикум (практикум по органической химии) т.1 и т.22.
"Мир",1980 г.
3. А.А.Терней, Современная органическая химия, т. 1,2, «Мир»,
Москва, 1981 г.
4. Р.Моррисон, Р.Бойд, Органическая химия, «Мир», Москва, 1974 г.
5. Дж.Робертс, М.Кассерио, Основы органической химии, «Мир»,
Москва, 1978 г.
6. В.В.Плахтинский, Е.Р.Кофанов, Реакционная способность
органических соединений, Ярославль, 2011 г.
7. n-Line Learning Center for "Organic Chemistry" (Francis A. Carey), http://
www.mhhe.com/physsci/chemistry/carey5e/
8. Library Genesis, http://free-books.dontexist.com/
9. eLibrary, http://elibrary.ru
10. «КнигаФонд» - электронная библиотечная система, knigafund.ru
3
4.
ВведениеNH4NCO
изоцианат
аммония
t OC
H2NCONH2
мочевина
Ф.Веллер
1828 г.
Отличительной особенностью органической
химии можно считать то, что объектом
ее изучения являются соединения,
в составе которых есть углерод.
4
5.
Основные этапы развития химии1. Предалхимический период: до III в. н.э.
2. Алхимический период: III – XVII вв.
3. Период становления (объединения): XVII – XVIII вв.
4. Период количественных законов (атомно-молекулярной
теории): 1789 – 1860 гг.
5. Период классической химии: 1860 г. – конец XIX в.
6. Современный период: с начала XX века по настоящее время.
5
6. Строение атома
В настоящее время считается, что электроны располагаются вокругядра на стационарных орбиталях, которые описываются четырьмя
квантовыми числами.
Главное квантовое число (n) характеризует энергию данной орбитали.
Азимутальное квантовое число (l) определяет угловой момент электрона,
его величина определяет геометрию области наиболее вероятного
нахождения электрона.
Магнитное квантовое число (m) определяет ориентацию различных
орбиталей относительно друг друга.
Спиновое квантовое число (s) описывает "спиновую природу" электрона.
n=3
l=
m=
1(p)
0(s)
0
3s
-1
0
3p
Орбитали третьего
главного квантового
уровня.
2(d)
+1
-2
-1
0
3d
+1
+2
6
7. Форма орбиталей
YY
X
X
Z
Z
1s
2s
7
8.
Потенциал ионизации - количествоэнергии, необходимое для отрыва электрона от молекулы.
Сродство к электрону - количество
энергии, которое выделяется, когда молекула присоединяет
один электрон.
Электроотрицательность – это способность элемента (атома)
удерживать электроны.
Значения электроотрицательности некоторых элементлв
(по шкале Поллинга):
H=2,1; Li=1,0; C=2,5; N=3,0; O=3,5; F=4,0; Cl=3,0; Br=2,8; I=2,5; S=2,5 .
8
9. Структурная теория А.М.Бутлерова
1.В молекулах веществ существует строгаяпоследовательность
химического связывания элементов, которая называется
химической структурой (строением).
2.Химические свойства вещества определяются природой
элементарных составных частей, их количеством и
химическим
строением.
3.Если у веществ с одинаковым составом и молекулярной
массой
различное строение, то возникает явление изомерии.
4.Реакционная способность отдельных атомов меняется в
зависимости от того с какими атомами других элементов
H
H
H
они соединены.
H C H
H
метан
C C
H
H C C H
H
этен
этин
9
10. Типы связей
Ионная связь образуется за счет электростатического притяжения междудвумя противоположно заряженными частицами:
ион-ионные (взаимодействия связи в неорганических солях, например NaCl),
ион-дипольные взаимодействия (сольватация ионов Na+ и Cl- молекулами
воды),
диполь-дипольное взаимодействие,
взаимодействие индуцированных диполей (дисперсионные взаимодействия,
силы Лондона, дисперсионные силы)
_
+
_
Cl
+
+
+ Na+
_
Cl-
_
_
_
_
_
_
+
_
Na
+
_
+
_
+
+
+
+
_
_
+
_
+
_
+
_
+
_
+
+
_
+
- H2O
- Na+
+
_
CH3– NO2
10
11.
Ковалентная связь образуется за счет обобществления двумяатомами двух электронов. (И,Лэнгмюр, 1919 г.)
Принцип дублета-октета:
устойчивым считается атом,
содержащий на внешней оболочке
(орбитали) два или восемь электронов
.. .
.
C
+
.......
.
4H
.... + ....
C
C
+
C
O
H
H
H C H
H C H
H
H
............
.
H
4H
H C
H
.. . + .... + .
. ..
2H
Дж.Н.Льюис, В.Кессель,
1916 г.
...........
.
H
C
H
H
H
H
C C
C H
H
H
H
H
O
C O
H
11
12.
Ковалентная связь может образовываться двумя способами:1. каждая частица, участвующая в образовании связи,
предоставляет по одному электрону:
...
H + . Cl .
..
........
H
..
...
H. C .
H
H Cl
H H
..
..
.
.
.
H. C . C .H
..H ..
.....C .. H
H
H
+
H
2. одна частица предоставляет пару электронов,
другая - незаполненную орбиталь:
+
H
акцептор
+
..NH
H N H
донор
H
3
.
H
+
Ковалентная связь, образованная за счет пары электронов
только одного атома, называется семиполярной,
донорно-акцепторной или координационной связью.
CH3
B
H3C
CH3
акцептор
+
CH3
..
N CH3
CH3
донор
H3C
H3C B
H3C
CH3
N CH3
CH3
+
12
13.
1314.
Водородная связь обусловленная электростатическимпритяжением и ковалентным взаимодействием между
протонированным водородом одной молекулы
и электроотрицательным атомом второй молекулы.
Водородная связь является примером трехцентровой
четырехэлектронной связи.
O
R
. . ... .
H
.O
H
...
O
H
O
H
R
H
O
H
O
R
водородные свя зи в смеси спирт-вода
водородные связи в спиртах
... H
...
...
R
H
H
F ... H
F
... H
F
...
водородные связи в HF
H … N ≈ 8 кДж/моль, связи H … О ≈ 21 кДж/моль,
связи H … F ≈ 36 кДж/моль
Водородные связи имеют энергию 20-40 кДж/моль.
14
15.
Ковалентная связь образуется за счет перекрыванияатомных орбиталей, на которых находились электроны,
образовавшие связь. При этом образуются новые орбитали,
на которых состояние электрона описывается относительно
обоих ядер атомов, которые образовали связь.
Такие орбитали называются молекулярными орбиталями.
E
мо
Разрыхляющая МО
Атомные орбитали (АО)
мо
Связывающая МО
15
16.
Разрыхляющая орбитальСвязывающая орбиталь
16
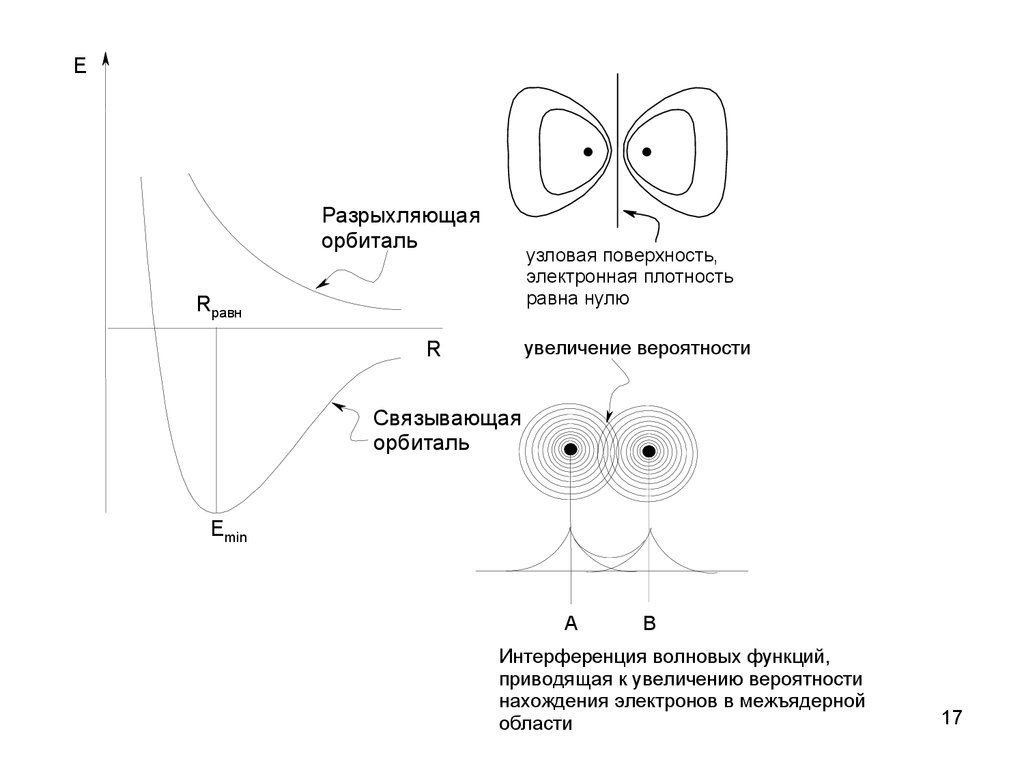
17.
E. .
Разрыхляющая
орбиталь
узловая поверхность,
электронная плотность
равна нулю
Rравн
R
увеличение вероятности
Связывающая
орбиталь
Emin
A
B
Интерференция волновых функций,
приводящая к увеличению вероятности
нахождения электронов в межъядерной
области
17
18.
Состояние электронов в молекуле описывается относительновсех атомов этой молекулы с помощью молекулярных орбиталей
Молекулярные орбитали – линейные
комбинации атомных орбиталей (МО ЛКАО).
φ=c1χ1+ c2χ2+…+ cμχμ+…+ cnχn
Это функция состояния, мера вероятности пребывания электрона
в данной области пространства. Атомные орбитали, включаемые в
расчет, называются базисными.
Нормировка волновой функции
c12+ c22+…+ cμ2+…+ cn2 = 1
Cμ2-вероятность пребывания электрона на АО χμ, электронная
плотность на μ-м атоме.
18
19.
Граничные орбитали.Заполнение МО электронами подчиняется тем же правилам,
что и заполнение АО.
Занятая электронами МО с максимальной энергией (среди набора
занятых МО данной молекулы) называется высшей занятой
МО (ВЗМО).
Свободная МО с минимальной энергией (среди набора свободных
МО данной молекулы) называется низшей свободной МО (НСМО).
В образовании ковалентных связей участвуют электроны,
находящиеся на граничных орбиталях.
19
20.
ВЗМО H2мо
НСМО H2
*мо
21.
1) s-перекрывание, при котором могут перекрыватьсяs+s, s+p, p+p орбитали:
+
S
+
мо
мо
S
+
+
p
S
мо
мо
+
p
+
p
мо
мо
При этом типе перекрывания образуются одинарные или -связи.
Следует обратить внимание на то, что в случае перекрывания
орбиталей s+p и p+p перекрывание происходит вдоль
главной оси p-орбитали. Это обеспечивает максимальное перекрывание
орбиталей, что соответствует максимальной прочности связи.
21
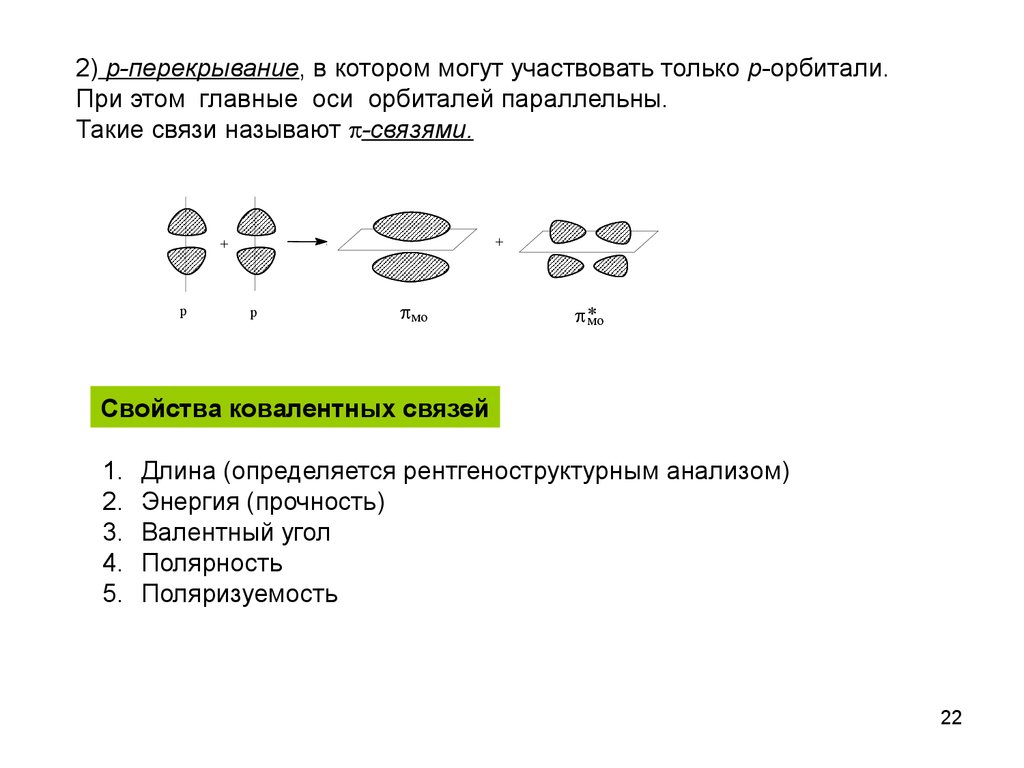
22.
2) p-перекрывание, в котором могут участвовать только p-орбитали.При этом главные оси орбиталей параллельны.
Такие связи называют -связями.
+
+
p
p
мо
мо
Свойства ковалентных связей
1.
2.
3.
4.
5.
Длина (определяется рентгеноструктурным анализом)
Энергия (прочность)
Валентный угол
Полярность
Поляризуемость
22
23.
Характерные свойства ковалентной связиНаправленность
Насыщаемость
Полярность
Поляризуемость
Они определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической
формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей.
Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности
вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи
подразделяются на неполярные и полярные:
неполярные — двухатомная молекула состоит из
одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются
симметрично относительно этих атомов;
полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее
электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию
распределения электрического заряда в молекуле, порождая дипольный момент молекулы.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего
электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется
подвижностью электронов.
Полярность и поляризуемость ковалентных связей определяет реакционную способность
молекул по отношению к полярным реагентам.
24.
Энергия связи – средняя энергия, которая необходима длягомолитического разрыва связи (энергия диссоциации).
Гомолитический разрыв связи – разрыв связи, приводящий к
образованию двух частиц, каждая из которых имеет один неспаренный
электрон.
A : A ⇄ A˙ + A˙ Радикал – частица, имеющая неспаренный электрон.
Гетеролитический разрыв связи – разрыв связи, приводящий к
образованию двух ионов.
Карбокатион - электронодефицитная, положительно заряженная
частица, в которой заряд сосредоточен на одном или делокализован
на нескольких атомах углерода.
Карбоанион – электроноизбыточная , отрицательно заряженная частица …
A : A ⇄ A + + A־
Длина – равновесное расстояние между центрами атомов, связанных
ковалентной связью.
Полярность связи – смещение электронной плотности ковалентной связи
к более электроотрицательному атому.
Поляризуемость связи – смещение электронной плотности в молекулах
под действием внешних факторов (электрическое поле, влияние соседних
молекул).
24
25.
Атом углерода:12
6C
2px 2py 2pz
2p
1s 2 2s 2 2p2
2s
1s
C
+
электронная конфигурация основного
состояния атома углерода
2H
H
C
H
H H
2p
2s
1s
электронная конфигурация гипотетического
соединения CH 2
25
26.
2p x 2p y 2p z2p
2sp3 2sp3 2sp3 2sp3
96 ккал
2s
1s
1s
электронная конфигурация основного
состояния атома углерода
электронная конфигурация
возбужденного состояния
атома углерода
sp3-гибридизация
2sp3 2sp3 2sp3 2sp3
H
H H H
C
+ 4 1s
1s
sp 3-возбужденное
состояние атома
углерода
атом
водорода
Н
молекула метана
CH 4
Тетраэдрическое
расположение связей
Такой тип гибридизации возможен и для других атомов.
H H
H
H H H
2p
1s
2p
2sp32sp3 2sp3
H 3C
2sp32sp32sp3
+
CH3
1s
H3 C CH3
Связывающая МО с
минимальной энергией
-583 ккал/моль
26
27.
sp2-гибридизация2p x 2p y 2p z
2p
2p
2sp2 2sp22sp2
2s
1s
1s
электронная конфигурация sp 2
возбужденного состояния
атома углерода
электронная конфигурация основного
состояния атома углерода
p
p
sp 2
120o
90o
С
sp 2
sp 2
sp 2
sp 2
p
sp 2
Связывающая МО с
минимальной энергией
-634 ккал/моль
Тригональное расположение
связей
Строение граничных орбиталей
ВЗМО
НСМО
27
28.
Молекула этена C2H4.при перекрывании двух 2pорбиталей образуется связь C C
H
H
H
2p
2sp 2 2sp 2
1s
H
2p
2sp 2
2sp 2
2sp 2 2sp 2
1s
при перекрывании двух 2sp 2 -орбиталей образуется -связь C C
H
H
C
H
C
H
H
H
C
H
O
H
C
O
28
29.
Углерод в состоянии sp2-гибридизации может образовывать связь суглеродом в состоянии sp3-гибридизации. Рассмотрим пропен C3H7:
H
c
H a
C
a
a
H
H
sp 2
b
C
e
d
H
b
C
b
H
sp 3
a: 1s2sp 3
b: 1s2sp 2
c: 2sp 32sp 2
d: 2sp 22sp 2
e: 2p2p
HC O
H3C
sp-гибридизация
2p x 2p y 2p z
2p 2p
2p
2sp 2sp
2s
1s
электронная конфигурация основного
состояния атома углерода
1s
электронная конфигурация sp
возбужденного состояния
атома углерода
29
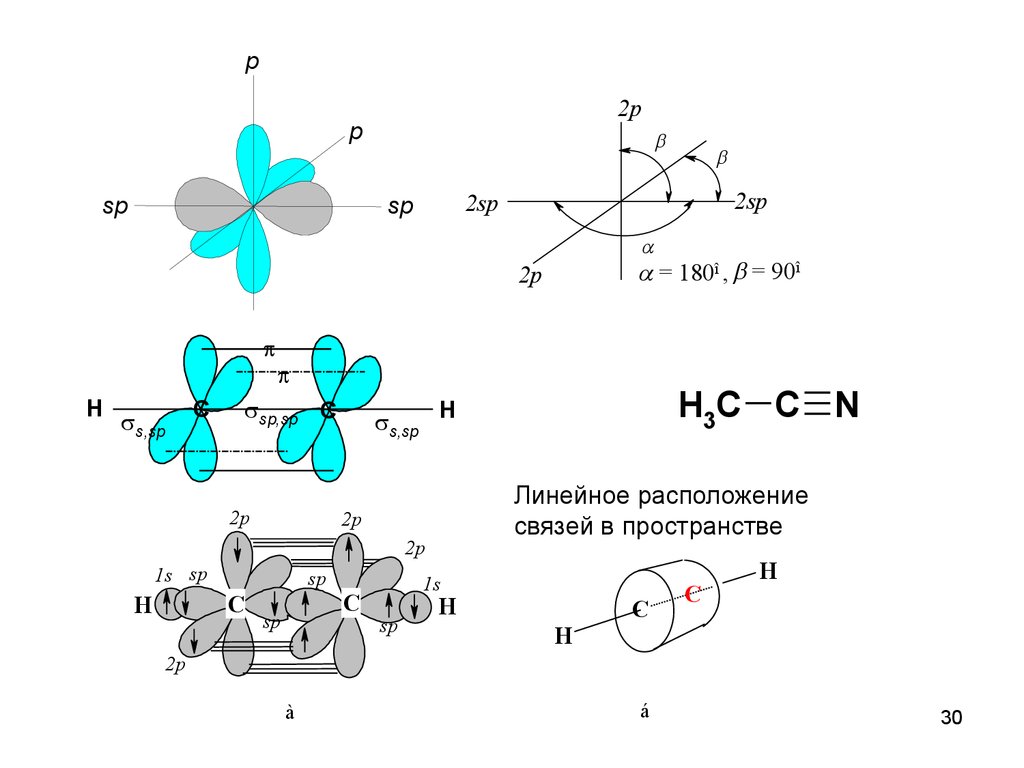
30.
p2p
p
sp
2sp
2sp
sp
= 180î , = 90î
2p
H
s,sp
sp,sp C
C
2p
Линейное расположение
связей в пространстве
2p
2p
1s sp
sp
C
H
C
sp
H3C C N
H
s,sp
1s
sp
H
C
C
H
H
2p
à
á
30
31.
Теория смещения электронных парВсе смещения электронов рассматриваются относительно атома C.
A
C C
O H
C Cl
С
O
C
.. С
.. H
B Смещение
.. Cl
Смещение электронов к более
электроотрицательному атому (поляризация
молекулы), возникновение дипольного момента.
-электронов
A
B
Смещение -электронов
Атомы и группы атомов, отталкивающие электроны, проявляют
электронодонорные свойства, положительный (+)-эффект.
Атомы и группы атомов, притягивающие электроны, проявляют
электроноакцепторные свойства, отрицательный (-)-эффект.
Индуктивный (индукционный) I -эффект
''''+ ''+
H
H
''''+ '''+ '+
H
C
C
Cl
H
H
''''+ ''+
''''+ < '''+ < ''+ < '+
31
32.
Индуктивный эффект – способность заместителя воздействовать на -электроны.Индуктивный эффект – экспериментально наблюдаемый эффект возникновения
зарядов по цепи атомов, связанных ординарными связями
Атомы и группы атомов, отталкивающие электроны, проявляют
электронодонорные свойства, положительный (+I)-индуктивный эффект.
Атомы и группы атомов, притягивающие электроны, проявляют
электроноакцепторные свойства, отрицательный (-I)-индуктивный эффект.
Индуктивные эффекты групп
Отталкивание электронов (+I)
Притяжение электронов (-I)
Н - нулевой эффект
-BӨ(OH)3 > -COOHӨ > -B(OH)2 > -CH3
-NH2 < -OH < -F
-SeӨ > -SӨ > -OӨ
-C(CH3)3 > -CH(CH3)2 > -CH2CH3 > -CH3
< -NO2 < -N(CH3)3 < -N ≡N
-NH2 < -NHCOCH3 < -NHCOCF3 < -N(CF3)2 <
-OH < -OCH3 < -OCF3
-I < -Br < -Cl < -F
32
33.
Мезомерный (М-)эффектЭлектронные эффекты в молекулах, имеющих сопряженные электронные системы.
X Y R Q
X Y Q R
+
X
Y X
..
X Y R
+
R X Y
..
X
Сопряженная электронная система – система, в которой кратные связи,
неподеленные пары электронов, вакантные орбитали отделены друг от
друга одной ординарной связью.
+
C C
'+
C
O N
'C C
Мезомерный эффект ( M) – это электронные смещения в сопряженных
системах с участием π-электронов кратных связей, неподеленных пар
электронов, вакантных орбиталей.
эффект сопряжения ( C), резонансный эффект ( R).
33
34.
Электроноакцепторные группы+
CH 2
CH
Z
Q
'+
CH 2
I, M
CH
Z
'
Q
I, M
Атом с неподеленной парой электронов
+M
+
D
I
CH
CH 2
+M
'+
D
C
I
'
CH
Мезомерные эффекты групп
Отталкивание электронов (+M),
π-донорные группы
Притяжение электронов (-M)
π-акцепторные группы
-OӨ > -ORӨ > -OR2
-CR=NR2 > -CR=NR
-SӨ > -SRӨ > -SR2 (-SR2 проявляет –Мэффект
-NR2> -OR > -F
-C=O > -CR=NR > CR=CR2
-C≡N > -C≡CR
-OR > -SR > -SeR
-F > -Cl > -Br > -I
34
35.
Эффект сверхсопряжения (гиперконьюгация)+
CH 3
CH
CH 2
+I,+M
'+
CH 3
C
+I,+M
'
CH
H
H C C C
H
sp3
sp2
sp2
Электроотрицательность атомов углерода в различных состояниях гибридизации
Сsp > Csp2 > Csp3
Электротрицательность возрастает с увеличением
s – вклада в гибридную орбиталь
35
36.
Основные понятия о реакционной способности органических соединенийЭлементарный акт реакции это процесс, в котором происходит разрыв
одной и образование другой химической связи.
Реакционный центр это атом, у которого происходит разрыв или
образование связей.
36
37.
Формальный зарядАтом состоит из двух частей: «остова» и внешних электронов (Дж.Н.Льюис).
«Остов» это ядро атома и внутренние электроны (не принимает участия в обычных
химических изменениях).
Химические изменения затрагивают только внешние (валентные) электроны.
.. .
.. Cl
.. . ...... .
.. Cl
Cl .
.. .. C......
.Cl
.. .
Символы С и Cl изображают остовы атомов углерода и хлора,
● - внешние (валентные) электроны.
Величина формального заряда атома определяется по следующей формуле:
ф.з. а b с
a – число валентных электронов атома (номер группы);
в – число неподеленных электронов;
с – число двухэлектронных связей.
Формальный заряд атомов углерода и хлора в молекуле CCl4 равен нулю.
.
..
H C H
H
0
H C H
H N H
H
H
-1
H
..
H N H
H
0
+1
37
38.
Взаимодействие кетона со спиртомO
R
C
OR2
25 OC
+ 2 HOR
R
2
R1
C
OR2
R1
Кеталь
Механизм
O
R C
++ ..
..
OH
+
H
R
R1
C
HO
R1
+
OH2
R
C
R1
OR2
-H2O
R
+
C
R1
OR2
OH
R2
..
+ ..
HO
R
C
H
O
+
R2
R1
R2
-H+
H
O
R
C
+
R1
R2
OR2
OH
R
C
+
OR2
H
R1
полукеталь
OR2
-H+
R C OR2
R1
кеталь
Механизм реакции это схема, в которой изображены элементарные акты
реакции, показаны реакционные центры, исходные, промежуточные
и конечные продукты.
Под этим термином подразумевается детальное описание превращения исходных
соединений в продукты с возможно более подробным описанием состава, строения
и других характеристик промежуточных продуктов и переходных состояний.
38
39.
Энергия активации - это минимальная энергия, которой должна обладатьмолекула (атом, ион, радикал), чтобы преодолеть энергетический
барьер реакции.
исходные
молекулы
активированные
молекулы
переходное
состояние
продукты
реакции
переходное
состояние
Энергия
Ea
ПЕРЕХОДНОЕ СОСТОЯНИЕ (активированный комплекс) –
конфигурация системы атомных ядер и электронов,
участвующих в элементарном акте химической реакции,
в момент преодоления системой энергетического барьера,
разделяющего ее начальное и конечное состояния, при
движении по координате реакции.
исходные
вещества
продукты
реакции
Координата реакции
Координата реакции это траектория, которую описывает система в
многомерном (6N-6) координатном пространстве с минимальным барьером
активации в направлении максимального возрастания модуля градиента
энергии системы
39
40.
Поверхность потенциальной энергии41.
Реакция образования 3-фенил-5-метил-1,2,4-оксадиазолаO
C
R'
H2N
C
Cl +
R
H2N C R
N C
R'
N
C
C
C -H2O
R'
O
O
O
R
C
HO
Механизм
NH2
I
Py
Py
H
+ Cl
O
CH3
N
O
NH2
OH
N
N
O
+ O
Cl
К
CH3
.
- Py HCl
N
NH2
+
Cl
.
-Py H
CH3
+
- Py HCl
Cl
O
CH3
N
O
NH2
К6
~H
+
H
H
К3
N
H
O ~
O
CH3
.
O
CH3
+
N O
NH2
VI
H .Py
+
O
N
H
+
К4
N
Py
O
..
HN
+
O
..
N
H
O
N
+ OH
C
CH3
NH2
К1
H
O
CH3
К7
ДГОДА
O
CH3
N
+
N OH ~ H
OH
CH3
H .Py
+
C
+
N
O
-H2O
N O
N
CH3
IX
.
+
O H Py
CH3
NH
К8
O OH
N
CH3
+
Py
N
+
H
H
- Py H
К2
.
41
42.
Расчетная ППЭ для различных маршрутов протекания реакцииобразования 3-фенил-5-метил-1,2,4-оксадиазола
42
43.
Омепразол44.
Энергетическая диаграмма нитрования бензолаï åðåõî äí î å ñî ñòî ÿí è å
Е
NO2
+
-K1
-K
NO2+
H
-К2
NO2
+
H
NO2
+ H+
+
+ NO2
Координата реакции
44
45.
EE
экзотермичесая реакция
эндотермичесая реакция
H > 0
H < 0
кр
кр
Постулат Хэммонда.
Малые изменения энергии молекулы могут соответствовать только
малым изменениям структуры. Вследствие этого переходное состояние
должно быть структурно близко к той молекуле, энергия которой
ближе к энергии переходного состояния.
При экзотермической реакции переходное состояние близко по строению
к исходной молекуле. Его называют ранним переходным состоянием.
При эндотермической реакции переходное состояние близко по строению
к конечному продукту (позднее переходное состояние).
45
46.
Кинетика органических реакций.Химическая кинетика изучает скорости протекания химических реакций
и их зависимость от концентрации реагирующих веществ,
температуры, давления, облучения, типа растворителя.
Скорость химической реакции
dCИВ
v
dt
Скорость расходования исходного вещества во времени
Реакции первого порядка (A B)
v = kC.
Реакции второго порядка (2A B) v = kC2, если реагирующее вещество
было одно,
если реагирующие вещества разные (A+B C) v = kCaCb .
Реакции третьего порядка ( 2A+B C) v kCa2Cb .
Такая реакция является реакцией второго порядка по отношению
к реагенту A и реакцией первого порядка по отношению к реагенту B.
k называется константой скорости реакции или удельной скоростью реакции.
k Ae
Ea
RT
A-предэкспоненциальный множитель
Ea-энергия активации
R-универсальная газовая постоянная
T-температура по шкале Кельвина
46
47.
Ak1
k -1
B
Обратимые (равновесные) реакции
характеризуются константой равновесия К
K=
k1
k -1
=
B
A
[A], [B]-равновесные концентрации
Концепция кислотности и основности.
Протолитическая концепция кислот и оснований (Бренстед, Лоури,1923г.)
Кислоты это соединения, способные отщеплять (генерировать) протон.
Основания - соединения, способные присоединять протон.
Процесс ионизации кислоты R H в растворителе Sol:
R
H +
Sol
кислота
протоноакцепторный растворитель
(основание)
+
+
HSol
сопряженсольватиное оснорованный
вание
протон
(кислота)
R
47
48.
Кислоты характеризуютсяконстантой кислотности (K) или
показателем кислотности (pKa):
Ka =
H+
R
R O H + Sol
OH- кислота
R'
-
RH
R C H + Sol
R"
CH- кислота
R'
pKa = - lg K a
R N H + Sol
+
+
HSol
R'
R C +
R"
+
HSol
R O
R'
R N +
+
HSol
NH- кислота
Основания характеризуют константой кислотности сопряженной кислоты pKBH+
Процесс ионизации основания в растворителе Sol:
+
B + HSol
основание
B+
H + Sol
сопряженная
кислота
K BH + =
H+
B
BH +
pK BH+ = - lg K +
BH
48
49.
Концепция кислот и оснований Д. Льюиса... D
A
+
кислота
основание
(акцептор
(донор
электронов) электронов)
+
A D
Кислотами называются все молекулы и катионы - акцепторы пары электронов.
Основания молекулы и анионы – доноры пары электронов.
Кислотами Льюиса, например, являются AlCl3, BF3, FeCl3, BCl3, SnCl4,
NO2+ (катион нитрония), неорганические и органические кислоты и другие.
Основаниями по Льюису являются аммиак, вода, органические и
неорганические анионы.
Концепция жестких и мягких кислот и оснований.
Жесткие кислоты – кислоты Льюиса, у которых небольшой размер
акцепторного атома, высокий положительный заряд, низкая поляризуемость,
высокая электроотрицательность, относительно низкий уровень энергии НСМО.
Жесткие основания – основания Льюиса, имеющие донорный атом небольшого
размера, высокая электроотрицательность, низкая поляризуемость, относительно
высокий уровень энергии ВЗМО.
49
50.
Мягкие кислоты – кислоты Льюиса, имеющие акцепторные атомы большого размера,малый положительный заряд, небольшую электроотрицательность, высокую
поляризуемость, относительно низкий уровень энергии НСМО.
Мягкие основания – основания Льюиса имеют донорные атомы большого размера,
низкую степень окисления, низкую электроотрицательность, высокую поляризуемость.
относительно высокий уровнем энергии ВЗМО.
Принцип ЖМКО, принцип Пирсона.
Жесткие кислоты Льюиса преимущественно взаимодействуют с
жесткими основаниями; мягкие кислоты – с мягкими основаниями.
Взаимодействие между кислотой и основанием зависит от следующих факторов:
1. Взаимодействие граничных орбиталей (орбитальное взаимодействие);
2. Кулоновское взаимодействие;
3. Пространственные препятствия;
4. Сольватация.
qμ , qν-заряды на атомах донора и акцептора;
Eполн
D A
2
q qv D A [Ci C jv v ]
r
v
Eij
,v
i
j
r μν-расстояние между атомами донора и акцептора;
ε – диэлектрическая проницаемость растворителя;
D
C
i
- значение собственного коэффициента μ-ой АО в
i-й МО донора D;
C jvA
- значение собственного коэффициента АО в
j-й МО акцептора A;
v
- резонансный интеграл, оценивающий взаимодействие
μ-ой и ν-ой АО на расстоянии r μν;
ΔE – разница энергий рассматриваемых МО.
50
51.
В «жестких» реагирующих системахреализуется зарядовый контроль
В «мягких» реагирующих
системах реализуется
орбитальный контроль
Eполн Eкул
,v
D
A
i
j
Eполн Eорб
q qv
r v
[C(DВЗМО ) C(AНСМО ) v v ]2
Eij
НСМО
ВЗМО
основание
(донор)
кислота
(акцептор)
51
52.
ПОНЯТИЕ О "ЖМКО"НУКЛЕОФИЛЫ
ЖЕСТКИЕ
МЯГКИЕ
1.маленький (маленькая поляризуемость)
2. заряженный
3. основный (HY – слабая к-та)
4. низкая энергия ВЗМО
5. “любит” С=О (большой заряд!)
6. RO–, NH2–, MeLi ит.п.
1. большой (большая поляризуемость)
2. нейтральный (но м.б. и заряженный)
3. не основный (HY – сильная к-та)
4. высокая энергия ВЗМО
5. ”любит” углерод в sp3-гибридизации
6. RS–, I–, R3P и т.п.
Жесткие кислоты – Al3+>Mg2+>Na+.
Мягкие кислоты : Ag+> Cd2+>Au3+> Sn4+.
Катионы Ж – сродство больше к F>O>N>Cl>I>S.
Катионы М: сродство S>I>Br>Cl>N>O>F .
Наиболее прочные соединения Ж+Ж или М+М.
53.
Типы реакций.1) реакции замещения (S) R X + A
R A + X
2) реакции отщепления (E) R Y Z
B
R=Y + B Z
3) реакции присоединения (A) Y=Z + A B
Типы реагентов
Y Z
A B
1. Радикал - частица с неспаренным электроном.
2. Нуклеофил – частица с электронодонорными свойствами, образует
связь с другим реагентом, отдавая свою пару электронов.
Основания Льюиса – нуклеофилы. H:¯, :NH2¯, H2O, H2S и др.
3. Электрофил – частица с электроноакцепторными свойствами, образует
связь с другим реагентом, принимая пару электронов на вакантную
орбиталь. Кислоты Льюиса – электрофилы. H+, Li+, BF3, AlCl3, NO2+ и др.
53
54.
Нуклеофильность и основностьНуклеофильность
Кинетически контролируемая реакция
электронной пары донора с электрофильным
атомом (С), с образованием новой
ковалентной связи C-Nu
Основность
Равновесная (термодинамически контролируемая)
реакция электронной пары донора с протоном,
с образованием новой связи H-X
55.
Классификация механизмов реакций.Тип реагента
Тип реакции
N
S A E
SN AN EN
E
SE AE EE
R
SR AR ER
55
56.
Субстрат – исходное вещество, структура которого определяет структуруцелевого продукта реакции.
Реагент – исходное вещество, структура которого определяет дополнительный
элемент структуры целевого продукта реакции, либо совсем в не входит в
структуру целевого продукта.
Субстрат выбирают, руководствуясь целью синтеза, а реагент − методом
достижения цели.
субстрат
реагент
+
CH3
O
2-метилциклогексанон
NH
промежуточный
продукт
1) CH3I
TsOH
реагент
+
C6H6
пирролидин
N
CH3 2) H
целевой
продукт
H3C
CH3
O
2,6-диметилциклогексанон
56
57.
Классификация и номеклатура органических соединений.По номеклатуре ИЮПАК органические соединения классифицируют по
1. характеристическим группам (функциям);
2. расположению углеродных атомов в молекуле.
Характеристические группы: Cl, Br, I, NH2, NO2, COOH, OH, SH, C=O, COOH и др.
-галогенпроизводные углеводородов RCl, ArI
-спирты и фенолы ROH, ArOH
O
-альдегиды R
C
-простые эфиры
R1 O R2
O
-кетоны
R
C
H
O
R'
-сложные эфиры
R1
C
O R2
-кислоты
R
C
O
-нитрилы -С≡N
OH
57
58.
По расположению атомов углерода в молекуле органическиесоединения делятся на:
1. ациклические соединения - соединения с открытой (незамкнутой)
цепью углеродных атомов CH3-CH2-CH3 CH2=CH2 CH3-CH=CH2 и т.д.
и их производные, содержащие различные характеристические
группы (функции). Насыщенные (алканы), ненасыщенные (алкены, алкины)
2. карбоциклические соединения - соединения с циклами из углеродных атомов:
алициклические соединения - циклические углеводороды и их производные с
различной величиной цикла и числом циклов, разным числом двойных связей, кроме
шестичленных циклов с тремя двойными связями:
ароматические соединения (арены) и их производные - циклические углеводороды и
их производные, которые построены из шестичленных циклов с тремя двойными
связями:
CH3
COOH
NO2
Гетероциклические соединения и их производные - циклические соединения, циклы
которых построены не только из атомов углерода:
N
N
H
S
O
N
58
59.
Сырьевые источники органических веществ.Животные и растительные организмы, полезные ископаемые :
уголь, нефть, сланцы и т.п.
59
























































 chemistry
chemistry








