Similar presentations:
Химическая связь и строение органических соединений
1. Химическая связь и строение органических соединений
2.
• Химическая связь – совокупность сил,удерживающих два и более атома в
многоатомной системе.
• Ковалентная связь – это связь,
возникающая между двумя и более
атомами вследствие обобществления
валентных электронов.
3. Два способа образования двухэлектронной ковалентной связи:
1. Коллигация:H
CH3
H
CH3
H
H
CH3 CH3
4. 2.Координация:
а) Передача электронной пары отдонора катиону:
H
H N
H
H
H N H
H
R O R
H
H
R O R
H
5. б) Передача электронной пары от донора акцептору на вакантную орбиталь:
RR N
R
H
R
B H
H
R
R N
B H или R3NBH3
R
H
R
R
R N
H
O
R N
R
O
или
R3N O
6.
• В основе теории хим. связи лежитволновая теория – квантовая механика.
Движение электрона описывается
волновой функцией . Уравнение
Шредингера описывает волновую
природу атома.
• Краткая форма уравн. Шрединга:
^
H E
7.
^H E
• оператор Гамильтона.
e
H 2 ( 2 2 2)
r
8 m x
y
z
^
h
2
2
2
2
2
• h-постоянная планка.
• m-масса электрона.
• r-расстояние между электроном и
ядром.
• E-собственная энергия системы.
8.
• Решение уравнения Шредингеравозможно только для простейших систем:
для H и H2+.
• для решения более сложных систем
необходимы дополнения.
– В 30-е годы для описания строения молекул
предложена теория МО:
9.
• - каждый электрон принадлежит молекуле в целом идвижется в поле всех атомных ядер;
• - каждому электрону отвечает волновая функция ,
которая называется молекулярной орбиталью МО, в
отличие от АО - МО- многоцентровые;
вероятность нахождения электрона на МО.
• - МО
характериз. квантовыми числами n (энергия), l
2
( (форма),
)
m (пространственная ориентация).
• - энергия высшей МО (занятой) равна потенциалу
ионизации.
• - электроны занимают МО начиная с меньшей энергии
согласно принципу Паули (2 на каждой орбитали).
• - при переходе электрона с низшей орбитали на более
высокую, молекула переходит в возбужденное
состояние.
10.
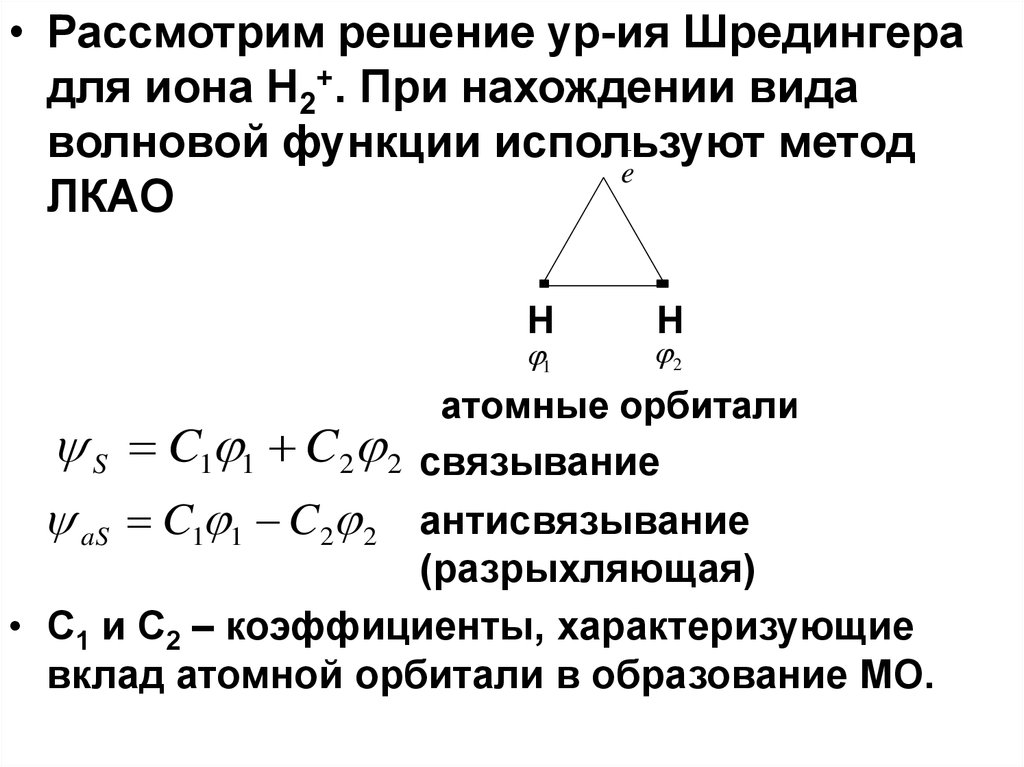
• Рассмотрим решение ур-ия Шредингерадля иона H2+. При нахождении вида
волновой функции используют метод
e
ЛКАО
H
1
S C1 1 C2 2
H
2
атомные орбитали
связывание
aS C1 1 C2 2 антисвязывание
(разрыхляющая)
• С1 и С2 – коэффициенты, характеризующие
вклад атомной орбитали в образование МО.
11.
Таким образом, метод МО показывает
следующее:
1. Природа сил, обеспечивающих хим.
связь носит электрический характер.
2. Движущей силой образования связи
явл. снижение потенц. энергии.
3. На возникновение хим. связи влияет
одновременно взаимодействие
электрона с 2 и более ядрами. Для
образования хим. связи не обязательна
–пара электронов, хим. связь может
образовать и один .
12. Условия образования МО:
1. Комбинируемые МО близки поэнергии.
2. АО, участвующие в образовании
МО, должны перекрываться max.
3. АО, образующие МО, должны
обладать одинаковыми свойствами
симметрии относительно
межъядерной оси образующейся
связи.
13. Классификация МО
В зависимости от критерия существует
несколько способов классификации:
1. по способу комбинирования АО различают
связывающие и разрыхляющие МО.
(ТАБЛ. 2.1 СТР. 29)
2. по способу перекрывания АО различают и π- МО
(ТАБЛ. 2.2 СТР. 30).
3. по количеству охватываемых ядер различают
двуцентровые и многоцентровые МО. Последние
выгоднее.
14. Энергия связывания будет равна:
Es1 s
•S-интеграл перекрывания S<<1.
15. Энергия антисвязывания будет равна:
E as1 s
16.
-кулоновский интеграл, который характеризуеткулоновское взаимодействие частиц и включает Е
электрона в атоме в основном состоянии, кулоновское
отталкивание ядер и взаимодействие второго протона с
электронным облаком, окружающим первый.
-обменный интеграл, характеризующий понижение Е,
обусловленное возможностью движения электрона в
поле двух ядер. при R=
и понижает энергию МО.
=0, при остальных
1
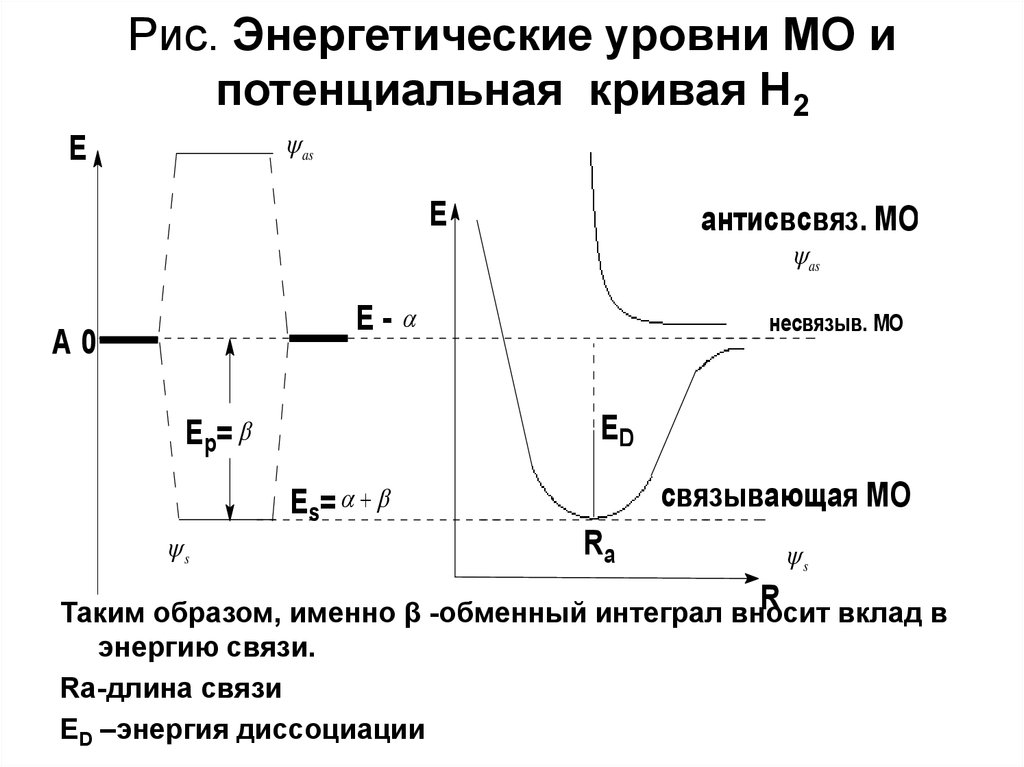
17. Рис. Энергетические уровни МО и потенциальная кривая H2
asE
E
антисвсвяз. МО
as
E-
A0
несвязыв. МО
ED
E p=
E s=
s
связывающая МО
Ra
s
R
Таким образом, именно β -обменный интеграл вносит
вклад в
энергию связи.
Ra-длина связи
ED –энергия диссоциации
18. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА СВЯЗЫВАЮЩИХ И РАЗРЫХЛЯЮЩИХ МО
Ψs связывающие МОψas разрыхляющие МО
1. Получается сложением АО
Ψs= Ψ1+ Ψ2
2.[ Ψ]2 –распределение
электронной плотности, то член
2 Ψ1.Ψ2 показывает увеличение
электронной плотности между
ядрами
1. Получается вычитанием АО
Ψas= Ψ1- Ψ2
2. Член 2 Ψ1.Ψ2 показывает
уменьшение электронной
плотности между ядрами, то
есть орбиталь имеет мin.
электронной плотности между
ядрами (узловая плоскость).
3. Имеет энергию более
высокую, чем каждая из
исходных АО:
Es=α-β
4. Заполнение Ψаs электронами
приводит к ослаблению
(разрыхлению) химической
связи и повышению энергии
системы.
3. Имеет энергию более низкую,
чем каждая из исходных АО:
Es=α+β
4. Заполнение Ψs электронами
приводит к образованию
химической связи между
атомами.
19. СРАВНИТЕЛЬНАЯ ТАБЛИЦА σ- и π-МО
π-МОσ- МО
1. Образуется при
1. Образуется при
осевом
боковом
перекрывании АО: перекрывании АО:
A
A
B
A
B
B
A
B
20.
σ- МО2. Электронное облако имеет
π-МО
2. Электронное облако
осевую симметрию, max.
симметрично относительно
электронной области лежит на
узловой плоскости, проходящей
линии,соединяющей центры
через межъядерную ось.
атомов.
3. Степень π-бокового
3. Степень осевого перекрывания перекрывания АО меньше σАО больше бокового.
осевого.
4. Различие между энергиями σs
4. Различие между энергиями πs
σas больше, поэтому переход
πas меньше, чем у σ –МО,поэтому
электрона из основного
π- электронное облако легко
состояния в возбужденное
поляризуется
требует больших затрат энергии,
т.е. электронное облако обладает
невысокой подвижностью.
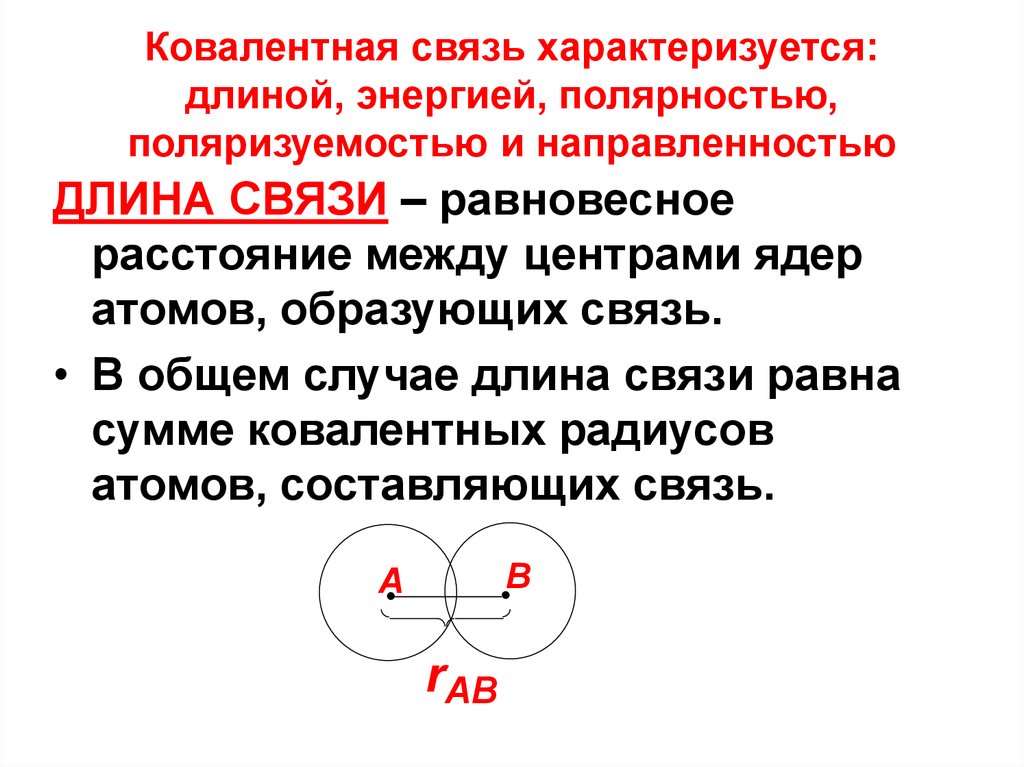
21. Ковалентная связь характеризуется: длиной, энергией, полярностью, поляризуемостью и направленностью
ДЛИНА СВЯЗИ – равновесноерасстояние между центрами ядер
атомов, образующих связь.
• В общем случае длина связи равна
сумме ковалентных радиусов
атомов, составляющих связь.
B
A
rAB
22.
• ЭНЕРГИЯ СВЯЗИ – энергия, которуюнеобходимо затратить, чтобы разорвать
химическую связь ( или выделяется при
образовании связи)
• ЕД (энергия диссоциации =энергии
образования связи). При больших
значениях энергии связи (кДж/моль)
связь устойчива. Определяют
экспериментально (метод теплового
равновесия, метод электронного удара,
фотоионизация).
23.
• Средняя энергия связи Ес –приближенная усредненная величина,
получаемая расчетным путем на основе
допущения, что все связи данного типа в
молекуле обладают одинаковой
прочностью.
24. Для оценки стабильности молекулы исп. также:
• ∆На – теплота образования соединенийиз атомов. Это сумма энергий ,
выделяющихся при образовании всех
связей молекулы, которая характеризует
термодинамическую устойчмвость
молекулы. Чем больше ∆На, тем
устойчивее молекула.
25.
• ∆Нс – теплота сгорания соединения. Чемменьше ∆Нс, тем устойчивее молекула,
т.е. меньше тепла выделяется при
сгорании вещества и меньшим запасом
внутренней энергии оно обладает.
26.
• ПОЛЯРНОСТЬ СВЯЗИ – асимметрияраспределения электронной плотности
между атомами вследствие различия их в
электроотрицательности.
• Шкала электроотрицательности по
Полингу (Учебник, табл. 2.3, стр.38):
• Na-0,9 Н-2,1
С-2,5
N-3,0
O-3,5
F-4,0 Cl-3,0
Br-2,8
I- 2,4
27.
Мерой полярности служит разностьэлектроотрицательностей (РЭО):
РЭО>2 – ионная связь;
РЭО<2 – полярная связь;
РЭО=0 – неполярная связь.
Для обозначения используют
символы:
δ
CH3
δ
Cl
28. Мерой полярности связи является дипольный момент:
μ =q r29.
ПОЛЯРИЗУЕМОСТЬ – способностьизменять свою полярность под
действием внешнего поля ( как
правило, реагента).
Порляризуемость растет с увеличением
размеров атома ( электронной
оболочки):
C-I > C-Br > C-Cl > C-F
Поляризуемость увеличивается с
увеличением кратности связи.
30.
• НАПРАВЛЕННОСТЬ СВЯЗИ определяетсягибридным состоянием атома С.
31. Ковалентная связь ХАРАКТЕРИЗУЕТСЯ длиной, энергией, полярностью, поляризуемостью и направленностью.
Связь Длина Энергия Дипольный Мол.рефр3
(нм)
акция,
см
кДж/моль момент, Д
С-Н
0,109
415
0,4
1,7
С-С
0,154
348
0
1,3
С=С
0,133
620
0
4,2
С≡С
0,120
810
0
6,2
С-О
0,143
340
0,7
1,5
С=О
0,121
710
2,4
3,3
О-Н
0,096
465
1,5
1,7
32. ГИБРИДИЗАЦИЯ. ЛОКАЛИЗОВАННЫЕ СВЯЗИ. Два типа связей
• σ-связиH H
H Cl
Cl Cl
•Если два атома связаны одинарной связью,
то эта связь всегда σ-связь.
33.
• σ - связь это связь, при образованиикоторой мах. электронная плотность
лежит на линии, соединяющей центры
атомов.
34.
При образовании кратной связи( двойной, тройной ) кратность
связи повышается за счет πсвязывания, то есть первая
связь всегда σ, а каждая
последующая между этими же
атомами π-связь.
35. π-СВЯЗЬ
• Кратность связи повышается за счет πсвязывания36.
• π - связь - это связь, при образованиикоторой мах. электронная плотность
лежит
над и под линией, соединяющей
центры атомов.
π - связь менее прочна, чем σ - связь и
ее электроны могут легче смещаться от
атома.
37.
Электронная конфигурация атома углеродаС* 1s22s12p3
1энергетический уровень
2энергетический уровень
2pz
2pz
2py
2py
2s
2s
2px
2px
38.
Если атом С образует 4 σ - связи, то эти связи равноценны,В их образовании участвуют равноценные орбитали атома С.
Эти орбитали образуются при смешении (гибридизации)
атомных орбиталей атома С.
3
1s+3p= 4sp
2pz
2s
2py
+
2px
+
+
109o28'
4sp
3
39.
Электронная формула молекулы метана:Гибридное состояние атома С в метане sp3:
H
H C H
H
H
109o28'
C
H
H
H
40.
21s+2p= 3sp
2pz
2py
2s
+
2px
+
+
2pz
o
120
3sp
2
41.
Электронная формула молекулы этилена:1s + 2p = 3sp2
H
π
C C
H
H
H
H
H
C
H
H
42.
1s+1p= 2sp2pz
2py
2s
+
2px
2pz
+
+
2py
o
180
2sp
43.
Электронная формула молекулыацетилена:
Гибридное состояние
атома С в
этилене sp:
H C
2pz
H
C
πC H
π
2py
2pz
C
2py
H
44.
Электроотрицательность С зависит от егогибридного состояния:
sp3 – 2,51
sp2 – 2,59
sp– 2,75
45.
ДЕЛОКАЛИЗОВАННЫЕ СВЯЗИH
H
σ
σ
C π σ C π σH
σ C
H σ σ C
σ
σ
H
sp2 H
sp2
H
H
C C
0,148
(0,154)
H
sp2
H
sp2
C C
0,136
(0,133)
H
H
46.
• Отклонение от принципов аддитивностидлин и энергий связи ( теплота
гидрирования меньше на 3,1 ккал/моль,
чем удвоенная теплота гидрирования
этилена).
47.
48.
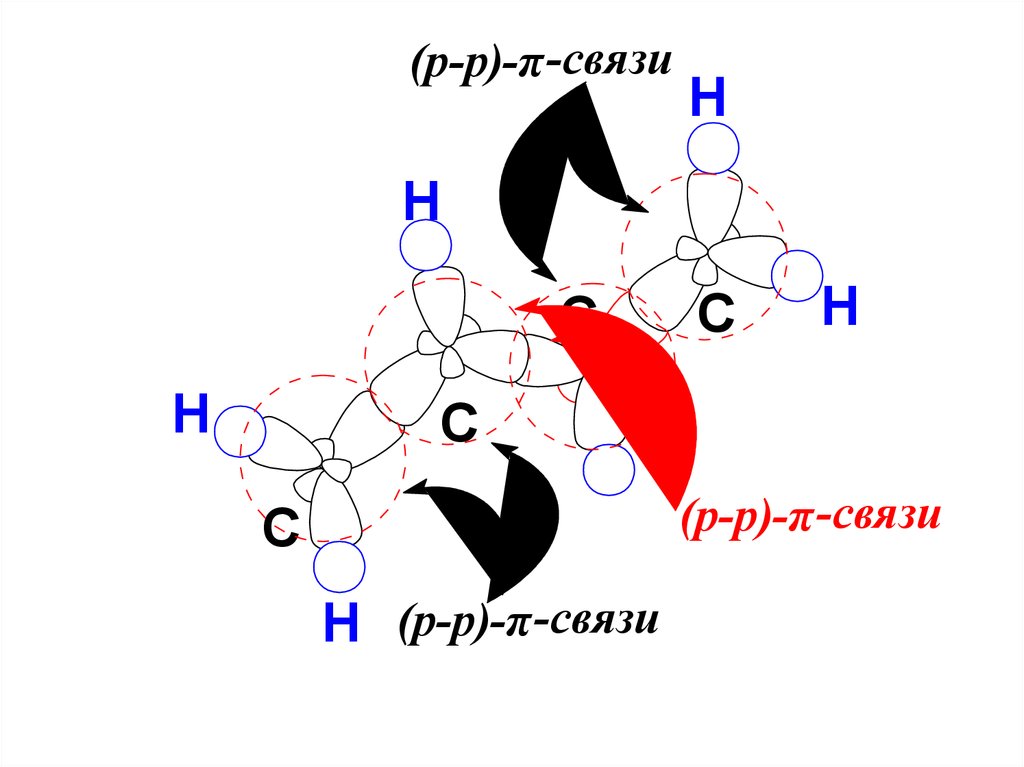
(p-p)-π -связиH
H
C
H
C
H
C
(p-p)-π -связи
C
H (p-p)-π -связи
49.
Под сопряжением (мезомерией)понимают
двустороннее перекрывание
электронных облаков π-связей
с образованием как бы единого
электронного облака,
то есть делокализацию π-связей.
50.
Классическая формулане полностью отражает
строение бутадиена.
Предлагается изображать ее набором
валентных схем (мезомерных структур):
CH2 CH CH CH2
CH2 CH CH CH2
CH2 CH CH CH2
51. Отклонение от принципов аддитивности у сопряженных систем
– Зная структурную формулу молекулыможно рассчитать согласно принципу
аддитивности различные параметры
молекулы:
∆Нс расч. >∆Нс эксп. – говорит о стабилизации
∆На расч. <∆Нa эксп.
системы
Ест.= ∆Нсрасч. -∆Нсэксп. = ∆Нaэксп. - ∆Нарасч.
Rm расч. < Rm эксп. - электронное облако
более подвижно
52.
R C=C расч. < R C=C эксп.R C-C расч. > R C-C эксп.
– говорит о перераспределении
электронной плотности
53.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ (СМЕЩЕНИЯ) ВОРГАНИЧЕСКИХ МОЛЕКУЛАХ
Индуктивный (или индукционный) эффект I-эффект –
обусловлен асимметрией распределения электронного
облака между двумя атомами.
Распространяется вдоль цепи
по механизму электростатической индукции:
δ δ δ δδ
δ
C3 C2 C1
δ
X
54. I-эффект быстро затухает по цепи σ - связей. I-эффект может быть +I-эффект и -I-эффект.
-I-эффект:а) электроотрицательные атомы и группы:
F > Cl > Br > I; OH, NH2 и др.
б) группы с семиполярными связями:
N
O
R3N
O
O
в) ониевые и катионные заместители:
NH3
OR2
NR3
г) ненасыщенные и ароматические заместители:
C
O
OH
C
O
H
C
O
R
C
N
CH CH2
55. +I-эффект:
а) алкильные группы:CH3 <
CH2CH3 <
CH(CH3)2 <
б) анионные заместители:
O
NR
C(CH3)3
56. Мезомерный эффект (М-эффект) –электронные смещения по системе полярных делокализованных π-связей.
Мезомерный эффект (М-эффект) –электронные смещения по системе
полярных делокализованных π-связей.
Изображение:
CH2 CH C
H
O
δ
CH2 CH C
H
δ
O
57. -М-эффект: π-π-сопряженные системы
C C C XC C C X
CH2 CH C
O
C C C X
CH2 CH C
C C C X
N
H
C
Группы, обладающие –М-эффектом:
O
OH
C
O
H
C
O
R
C
N
N
O
O
O
S
O
OH
58. +М-эффект n-π- сопряженные системы
C C XH
C C Cl
H
H
C C X
H
C C OCH3
H
H
Группы, обладающие +М-эффектом:
R2N
RO
Hal
59. Чтобы установить, имеется ли М-эффект необходимо:
Чтобы установить, имеется ли Мэффект необходимо:выделить в молекуле сопряженную
систему связей;
если система симметрична – Мэффекта нет;
если имеется n-π сопряженная
система, то имеется +М-эффект, а
если π-π-сопряженная система – то
-М-эффект.























































 chemistry
chemistry








