Similar presentations:
Органическая химия. Введение. Классификация веществ
1. Органическая химия
Введение.2.
Классификация веществВещества
ОРГАНИЧЕСКИЕ
НЕОРГАНИЧЕСКИЕ
Наряду с другими
элементами всегда
содержат углерод
Нет такого хим.элемента,
который присутствовал бы
во всех веществах
Исключения:
CO, CO2, CaC2, H2CO3
Органическая химия изучает соединения углерода - строение и реакции, которые
с ними происходят.
3. Важнейшие причины выделения органической химии в отдельную науку
• 1. Число известных органических соединений (более 20 млн)значительно превышает число (ок. 300 тыс) соединений всех
остальных элементов периодической системы Менделеева.
Примерно 200 тыс. новых органических соединений получают
сейчас за один год. Это объясняется способностью элемента
углерода давать соединения, содержащие практически
неограниченное число атомов углерода, связанных в цепи и
циклы.
• 2. Органические вещества имеют важное значение вследствие их
широкого практического применения, и особенно потому, что
они играют важную роль в процессах жизнедеятельности
организмов.
• 3. Имеются существенные отличия в свойствах и реакционной
способности органических соединений от неорганических,
вследствие чего возникла необходимость в развитии многих
специфических методов исследования органических соединений.
4.
Возникновение органической химии как наукиЙенс Якобс Берцелиус (1779 – 1848) 1807г.
«Вещества, получаемые из организмов (растительного и
животного происхождения) – ОРГАНИЧЕСКИЕ, наука, их
изучающая – ОРГАНИЧЕСКАЯ ХИМИЯ.»
По Берцелиусу органические вещества нельзя получить в
лаборатории, как неорганические. Они создаются организмами
под влиянием «жизненной силы»
Учение о «жизненной силе» - виталистическое учение (от лат. vita
– жизнь)
Положительные моменты теории: разделение органических и
неорганических веществ на классы.
.
5. Эксперименты приведшие к краху витализма — идеалистического учения о жизненной силе
• 1828 г. Вёлер показал, что неорганическое вещество —циановокислый аммоний ([NH4+] [NCO-]) — при нагревании
превращается в продукт жизнедеятельности животного
организма — мочевину ((NH2)2CO). (Вёлер написал Берцелиусу
письмо, в котором говорил, что он стал свидетелем «великой
трагедии в науке — убийства прекрасной гипотезы уродливым
фактом». «Прекрасной гипотезой» был витализм; «уродливым
фактом» — пробирка с кристаллами мочевины).
• 1845 г. Кольбе синтезировал типичное органическое вещество —
уксусную кислоту, использовав в качестве исходных веществ
древесный уголь, серу, хлор и воду. За сравнительно короткий
период был синтезирован ряд других органических кислот,
которые до этого выделялись только из растений.
• 1854 г. Бертло синтезировал вещества, относящиеся к классу
жиров.
• 1861 г. Бутлеров действием известковой воды на
параформальдегид впервые осуществил синтез метиленитана —
вещества, относящегося к классу сахаров.
6. Теория радикалов
• Все химические вещества состоят из электроотрицательных иэлектроположительных
атомов
или
групп
атомов,
удерживаемых в молекуле силами электростатического
притяжения.
• При целом ряде химических превращений группа из нескольких
атомов в неизменном виде переходит из молекулы одного
вещества в молекулу другого, подобно тому как переходят из
молекулы в молекулу атомы элементов. Такие неизменяемые
группы атомов получили название радикалов.
• 1832 год Либихом и Вёлером исследовано горько-миндальное
масло — вещество, которое теперь называется бензойным
альдегидом С7Н6О. При изучении реакций этого вещества был
получен ряд соединений, неизменно содержащих в своей
молекуле группу атомов С7Н5О, названную ими радикалом
бензоилом:
7. Теория радикалов
На определенном этапе развития органической химии теориярадикалов сыграла значительную роль, т.к. в основе теории
радикалов лежало очень важное обобщение: при химических
реакциях группы атомов (радикалы) в неизменном виде входят в
образующиеся в этих реакциях молекулы.
8. Опровержение теории радикалов
• Открытие французским химиком Дюма химическихреакций, при которых легко изменялись некоторые из
наиболее обычных радикалов.
• При действии хлора на уксусную кислоту атом водорода в
радикале ацетиле легко замещался на атом хлора, причем
получающееся вещество по химическим свойствам мало
отличалось от уксусной кислоты:
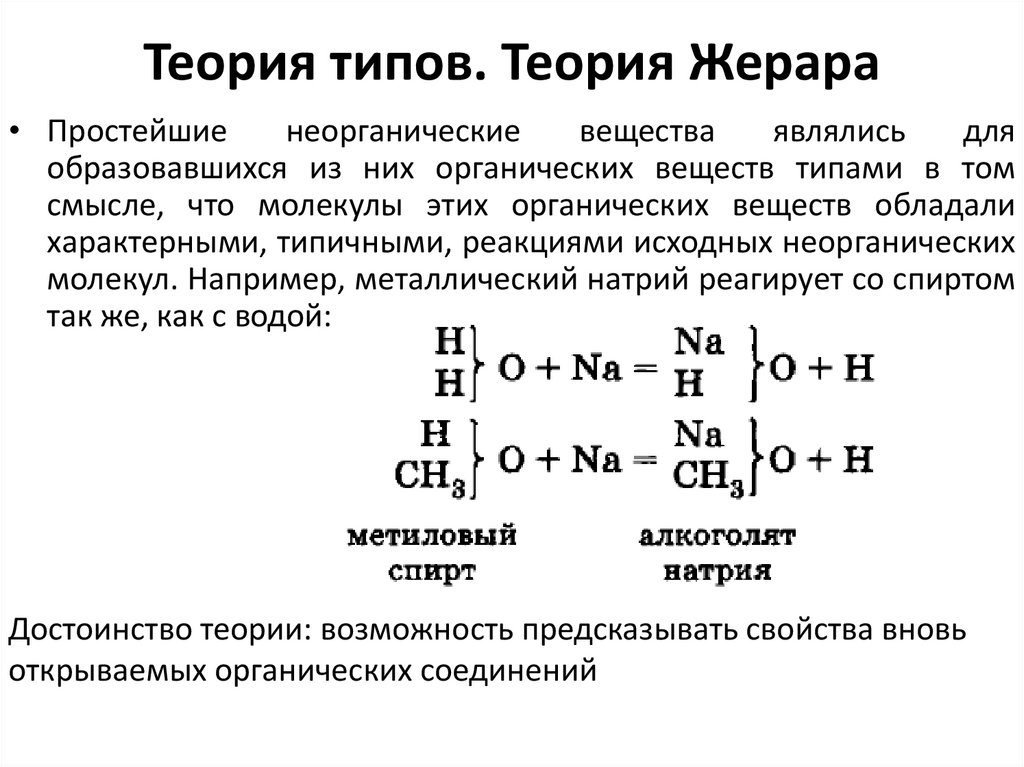
9. Теория типов. Теория Жерара
• теория типов, в качестве классифицирующего признакарассматривала наиболее изменчивые части молекулы и
причины
этой
изменчивости.
Теория
типов
подчеркивала, что в реакциях органических веществ
обнаруживается сходство с реакциями простейших
неорганических соединений.
• Органические вещества предлагалось рассматривать
образовавшимися из простейших неорганических
веществ замещением в последних одного или
нескольких атомов на разные органические группы
10. Теория типов. Теория Жерара
11. Теория типов. Теория Жерара
• Простейшиенеорганические
вещества
являлись
для
образовавшихся из них органических веществ типами в том
смысле, что молекулы этих органических веществ обладали
характерными, типичными, реакциями исходных неорганических
молекул. Например, металлический натрий реагирует со спиртом
так же, как с водой:
Достоинство теории: возможность предсказывать свойства вновь
открываемых органических соединений
12. Теория строения А. М. Бутлерова
• Предпосылки возникновения:Открытие валентности элементов.
Исследуя состав металлоорганических соединений,
Франкланд (1853) нашел, что каждый металл дает
соединения со строго определенным числом
радикалов; это число и представляет собой валентность
данного металла:
Вывод: атомы могут соединяться в молекулы только в
отношениях, определенных валентностью атомов
13. Теория строения А. М. Бутлерова
Основные идеи теории А. М. Бутлерова сформулированы им в 1861 г. в
статье «О химическом строении вещества».
1. В молекулах соединений существует определенный порядок связи
атомов, который и носит название строения.
2. Химические свойства соединения определяются составом и
строением его молекул.
3. Различное строение при одном и том же составе и молекулярной
массе вещества обусловливает явление изомерии.
4. Так как при отдельных реакциях изменяются не все, а только
некоторые части молекул, то, изучая продукты химических
превращений соединения, можно установить его строение.
5. Реакционная способность атомов, входящих в молекулу, меняется в
зависимости от того, с какими атомами они связаны в данной
молекуле. Это изменение химического характера обусловливается
главным образом взаимным влиянием непосредственно связанных
друг с другом атомов. Взаимное влияние атомов, не связанных
непосредственно, обычно проявляется значительно слабее.
Вывод: свойства органического вещества определяются не только
составом (каких и сколько атомов в молекуле), но и способом
связывания этих атомов, т.е. химическим строением.
14. Электронная теория валентности
• Современные представления о природе химической связи основаны наэлектронной теории валентности. Эту теорию разработали
независимо Г.Н. Льюис и В. Коссель в 1916 г. Согласно электронной
теории валентности, атомы, образуя связи, приближаются к
достижению наиболее устойчивой, т.е. имеющей наиболее низкую
энергию электронной конфигурации.
• Электронная конфигурация атомов меняется так, что на их внешних
электронных оболочках оказывается по восемь электронов.
Исключением являются водород и литий, имеющие во внешней
оболочке по два электрона, как у ближайшего к ним благородного газа
гелия. Таким образом, «электронный октет (дублет) представляет собой
для элементов наиболее устойчивую электронную конфигурацию. Этот
принцип заполнения электронных оболочек называется правилом
«октета».
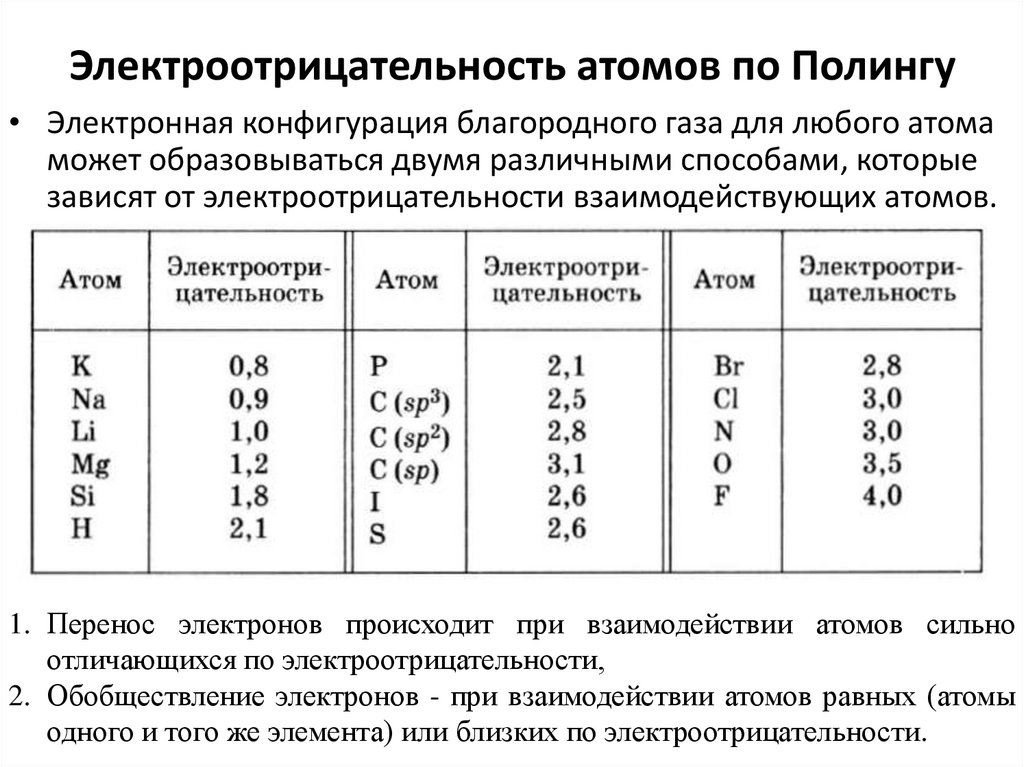
15. Электроотрицательность атомов по Полингу
• Электронная конфигурация благородного газа для любого атомаможет образовываться двумя различными способами, которые
зависят от электроотрицательности взаимодействующих атомов.
1. Перенос электронов происходит при взаимодействии атомов сильно
отличающихся по электроотрицательности,
2. Обобществление электронов - при взаимодействии атомов равных (атомы
одного и того же элемента) или близких по электроотрицательности.
16. Ионная связь
• Такая связь возникает при большой разнице в электроотрицательностяхсвязываемых атомов (∆χ >2), когда менее электроотрицательный атом почти
полностью отдает свои валентные электроны и превращается в катион, а
другой более электроотрицательный атом, эти электроны присоединяет и
становится анионом.
• Например, в хлориде натрия NaCl разность электроотрицательностей равна:
На приведенной схеме образовавшийся ион натрия обладает электронной
конфигурацией неона, а ион хлора — конфигурацией аргона (оба иона имеют по 8
электронов на внешней оболочке). Связь между двумя разноименными ионами
осуществляется за счет электростатического взаимодействия.
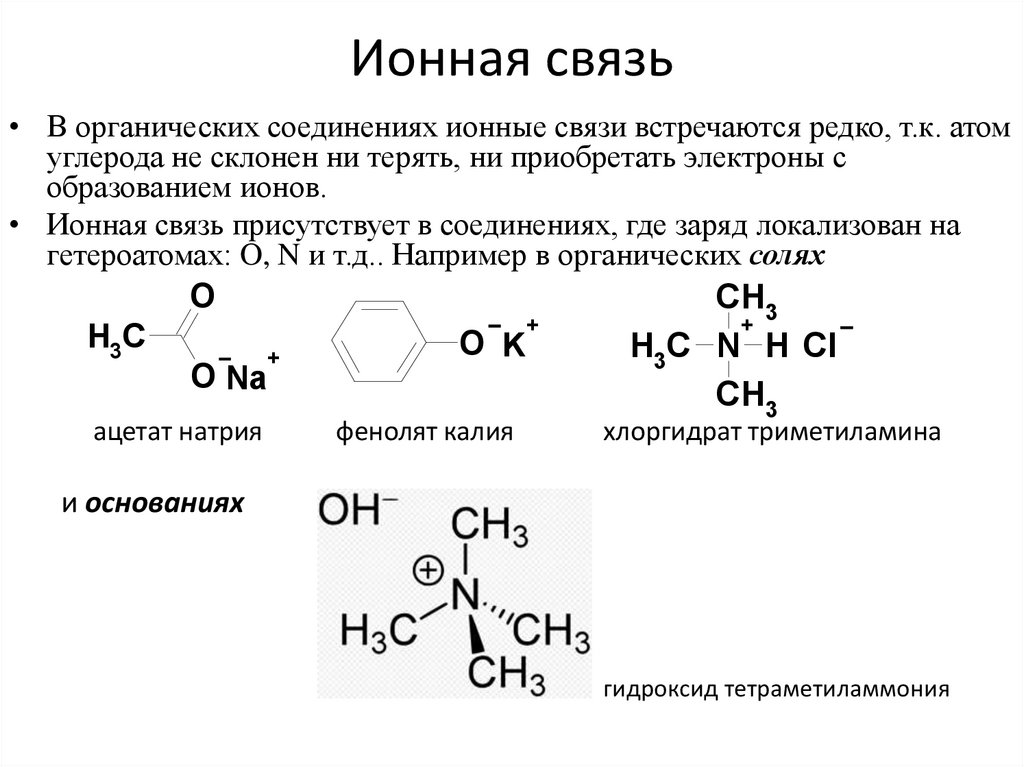
17. Ионная связь
• В органических соединениях ионные связи встречаются редко, т.к. атомуглерода не склонен ни терять, ни приобретать электроны с
образованием ионов.
• Ионная связь присутствует в соединениях, где заряд локализован на
гетероатомах: O, N и т.д.. Например в органических солях
O
CH3
+
+
H3C
O K
H3C N H Cl
+
O Na
ацетат натрия
фенолят калия
CH3
хлоргидрат триметиламина
и основаниях
гидроксид тетраметиламмония
18. Ковалентная связь
• Атомы могут также приобретать устойчивые внешние электронныеконфигурации путем обобществления электронов. Образование
электронной конфигурации благородного газа для таких атомов
происходит вследствие обобщения двух, четырех или шести электронов
взаимодействующими атомами. Каждая из обобщенных пар электронов
образует одну ковалентную связь. Такая связь возникает между
атомами
с
относительно
малыми
различиями
в
электроотрицательностях (∆χ <2), например, С и Н, С-О, С-N, C-Cl,
N-O
19. Ковалентная связь
• Атомы, связанные ковалентной связью, также обладают полнымоктетом электронов, так как электронная пара ковалентной связи
принадлежит обоим связанным ею атомам. Ковалентная связь —
наиболее распространенный в органической химии тип связи. Эта связь
обладает высокой прочностью.
• Ковалентная связь и соответственно молекула могут быть
неполярными, когда оба связанных атома имеют одинаковое сродство к
электрону. Такая связь обладает высокой прочностью.
H3C CH3
HOOC COOH
H2C CH2
этан
щавелевая кислота
этилен
Ковалентная связь может быть полярной, когда электронная пара
вследствие большего сродства к электрону одного из атомов оттянута
в его сторону:
CH3
хлорметан
Cl
или
CH3δ+-Clδ-
20. Донорно-акцепторная связь
• В некоторых молекулах или многоатомных ионах обаэлектрона для образования связи могут поставляться
только одним атомом.
• Атомы азота, кислорода, галогенов и ряд других атомов
имеют в своих ковалентных соединениях заполненные
октеты, хотя не все окружающие их электроны внешней
оболочки участвуют в образовании ковалентных связей.
Эти электроны образуют так называемые неподеленные
электронные пары (n-электроны):
21. Донорно-акцепторная связь
• При взаимодействии атомов, имеющих неподеленныеэлектронные пары, с протоном или другим атомом, у которого не
хватает до образования октета двух электронов, неподеленная
электронная пара становится общей и образует между этими
атомами новую ковалентную связь. При этом атом, отдающий
электроны, называется донором, а атом, принимающий
электроны, называется акцептором.
Образовавшаяся ковалентная связь отличается от имевшихся в молекуле
только способом образования, по физическим и химическим свойствам они
абсолютно идентичны. При образовании координационной связи два электрона в
равной мере принадлежат уже двум атомам, что равносильно потере этим
атомом одного электрона, следовательно, атом-донор приобретает при этом
положительный заряд.
22. Семиполярная связь
• Разновидностью донорно-акцепторной связи является связь азота скислородом в нитросоединениях или N-окисях. В этом случае азот
связан с одним кислородным атомом обычной двойной ковалентной
связью за счет обобществления двух электронов азота и двух
электронов, кислорода, а оставшаяся неподелённая электронная пара
азота образует связь со вторым атомом кислорода. При этом, на азоте
появляется положительный заряд, а на кислороде — отрицательный.
• связь между атомом азота и вторым атомом кислорода представляет
собой сочетание ковалентной и ионной связей и носит название
семиполярной связи; ее обозначают следующим образом:
23. Семиполярная связь
• Вприведенных
на
предыдущем
слайде
формулах
нитросоединения связи азота с кислородом неравноценны.
Однако, как показывают результаты физических исследований,
эти связи энергетически совершенно одинаковы. Следовательно,
электронная пара, обуславливающая отрицательный заряд, не
сосредоточена целиком на одном кислородном атоме, а
несколько смещена к азоту при одновременном смещении от
азота ко второму кислородному атому подвижной π-электронной
пары двойной связи. В результате выравнивания электронной
плотности в нитрогруппе формальный отрицательный заряд (-1)
распределяется поровну (-1/2) между обоими атомами
кислорода:
24. Водородная связь
• Присутствию у ряда атомов неподеленной пары электроновобязана своим существованием и водородная связь. Она
образуется между молекулами, содержащими
электроотрицательные атомы (О, N, F), которые имеют
неподеленную электронную пару, и молекулами с активными
атомами водорода. Активными называются атомы водорода,
связанные с другим атомом сильно полярной ковалентной
связью.
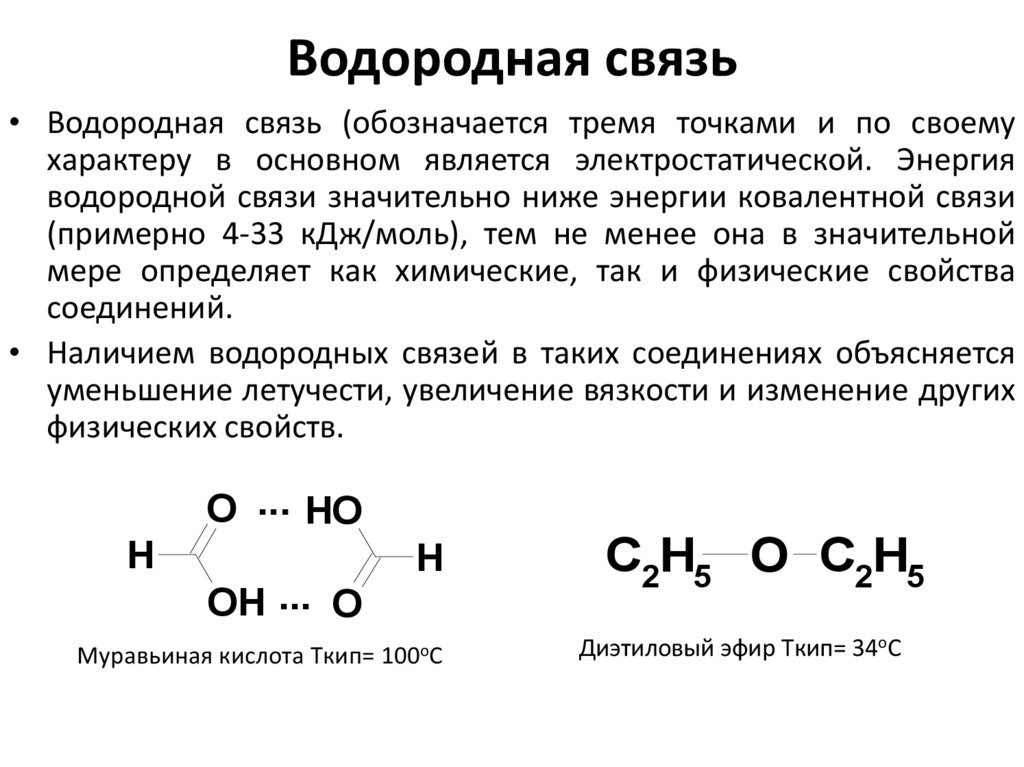
25. Водородная связь
• Водородная связь (обозначается тремя точками и по своемухарактеру в основном является электростатической. Энергия
водородной связи значительно ниже энергии ковалентной связи
(примерно 4-33 кДж/моль), тем не менее она в значительной
мере определяет как химические, так и физические свойства
соединений.
• Наличием водородных связей в таких соединениях объясняется
уменьшение летучести, увеличение вязкости и изменение других
физических свойств.
O ... HO
H
H
OH ... O
Муравьиная кислота Tкип= 100оС
C2H5 O C2H5
Диэтиловый эфир Tкип= 34оС
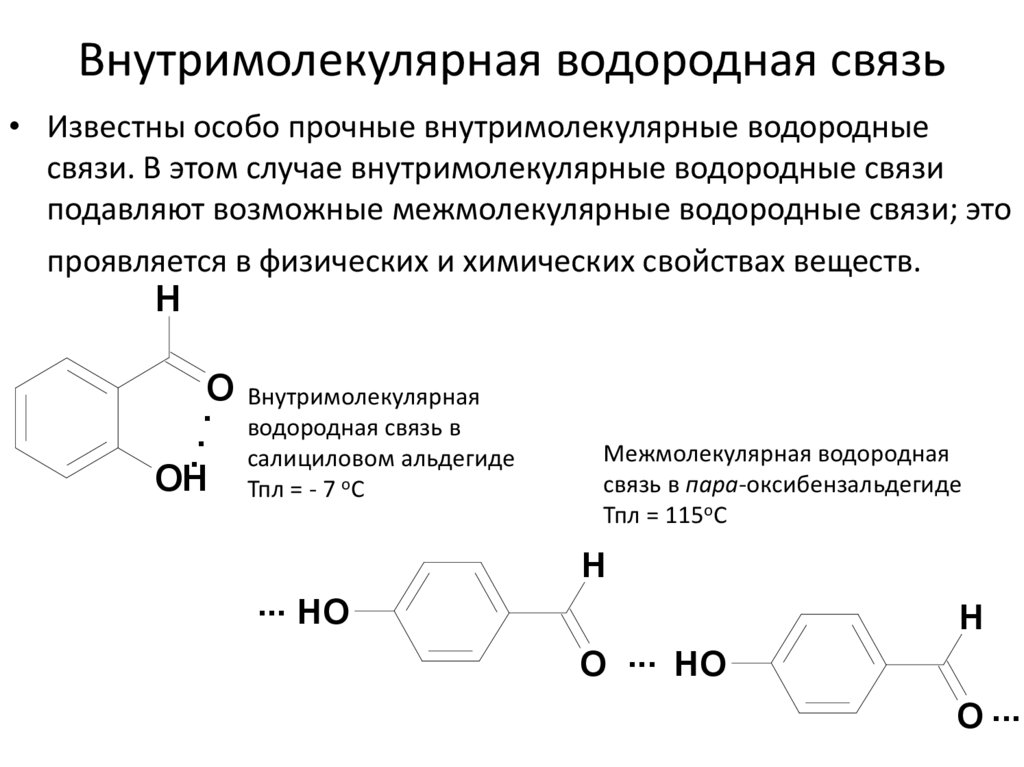
26. Внутримолекулярная водородная связь
• Известны особо прочные внутримолекулярные водородныесвязи. В этом случае внутримолекулярные водородные связи
подавляют возможные межмолекулярные водородные связи; это
проявляется в физических и химических свойствах веществ.
H
O Внутримолекулярная
. водородная связь в
.
. салициловом альдегиде
OH Тпл = - 7 оС
Межмолекулярная водородная
связь в пара-оксибензальдегиде
Тпл = 115оС
H
... HO
H
O ... HO
O ...
27. Энергия связей
• Энергия, которую надо затратить, чтобы разорвать химическуюсвязь между атомами, называется энергией связи. Эта же энергия
выделяется при образовании связи между атомами. При больших
значениях энергии связи она устойчива (С—С, С—Н, Н—Н), при
малых — неустойчива (О—О, N—N).
28. Энергия связей
• В симметричных молекулах наиболее устойчивы связи междуатомами, имеющими значение электроотрицательности в
пределах 2—2,5 (Н—Н, С—С).
• Если
элементы
имеют
высокую
или
низкую
электроотрицательность, связи непрочные (F—F 151 кДж/моль;
Na—Nа 75 кДж/моль).
• Если связь образована неодинаковыми атомами, то чем больше
разница в электроотрицательности, тем связь прочнее (Н—F 665
кДж/моль), но при переходе от ковалентной к ионной ее
прочность резко падает (Н—Li 242 кДж/моль). Энергия связи
может заметно изменяться в зависимости от природы
заместителей, находящихся у связанных атомов. Так, энергия
связи О—О в Н2O2 равна 205 кДж/моль, а в перекиси бензоила
С6Н5—С(О)—О—О—С(О)—С6Н5 121 кДж/моль.
29. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
• Органические молекулы состоит из двух частей: фрагмента,который в ходе реакции остается без изменения, и группы/групп,
подвергающейся
при
этом
превращениям.
Последняя
представляет собой - атом или группу атомов, придающих
молекуле органического вещества характерные свойства,
называется функциональной группой.
CH3-CH2-OH
CH3-CH2-
OH
ациклический ряд
ароматический ряд
-OH
функциональная группа
-OH функциональная группа
30. Ациклический (или алифатический) ряд
насыщенные (предельные) соединенияненасыщенные (непредельные) соединения
31. Циклический ряд
карбоциклические соединения, содержащие углеродный скелет,замкнутый в цикл
гетероциклические соединения, содержащие гетероатомы (иные,
нежели углерод) в составе циклов
32. карбоциклические соединения
• ароматический ряд, который включает углеводороды и ихпроизводные, содержащие шестичленные циклы с
чередующимися простыми и двойными связями (ароматические
ядра)
алициклическии ряд, который объединяет все остальные
карбоциклические соединения, как насыщенные, так и ненасыщенные
33. Классы органических веществ
• Наличие тех или иных функциональных групп в молекулеорганического соединения определяет принадлежность этого
соединения к тому или иному классу.
34. НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
• Правило: каждому названию должносоответствовать только одно
соединение.
• Правила, по которым образуются названия
органических соединений, составляют
номенклатуру. В настоящее время в
органической химии применяют несколько
систем номенклатуры.
35. Тривиальная номенклатура
• Это система исторически сложившихся названий, ноприменяемых до настоящего времени. Эти названия
были даны в ранний период развития органической
химии и никак не отражают строение органического
вещества
36. Рациональная номенклатура
• По правилам рациональной номенклатуры за основу названия органическогосоединения принимают название наиболее простого члена данного
гомологического ряда. Все остальные соединения рассматривают как его
производные, образованные замещением в нем атомов водорода
37. Систематическая номенклатура ИЮПАК
• Систематические названия составлены из слов, специальносозданных или выбранных для описания структурных
особенностей соединения.
• Для названия органического соединения нужно:
• 1. выбрать родоначальную структуру;
• 2. выявить все имеющиеся в соединении функциональные
группы;
• 3. установить, какая группа является старшей; название этой
группы отражается в названии соединения в виде суффикса и его
ставят в конце названия соединения; все остальные группы дают
в названии в виде префиксов (приставок);
• 4. обозначить ненасыщенность соответствующим суффиксом (-ен
или -ин), а также префиксом (дегидро-, тетрагидро- и др.);
• 5. пронумеровать главную цепь, придавая старшей группе
наименьший из номеров;
• 6. перечислить префиксы (приставки) в алфавитном порядке (при
этом умножающие префиксы ди-, три- и т. д. не учитываются);
• 7. составить полное название соединения.
38. Порядок старшинства основных функций
СООН > SO3H > CN > СНО > СО > ОН > NH2 > (ен, ин) > NO2 > HalГлавная функция обозначается в названии суффиксом: гидроксильная
группа -ол; альдегидная -аль; кетонная -он и т. д., остальные – префиксами.
Общая схема построения названия
39. Родоначальная структура
• В ациклических соединениях главной цепью называют цепьуглеродных атомов, составляющую основу названия и
нумерации. В состав этой цени должна входить старшая
характеристическая группа. Главная цепь должна содержать
наибольшее число заместителей, максимальное количество
кратных связей и должна быть наиболее длинной. Главную цепь
нумеруют в соответствии с наименьшей суммой цифровых
индексов, указывающих положения заместителей и кратных
связей.
40. Алициклические соединения
• главной цепью считают замкнутую цепь углеродных атомов. Вназвании этой цепи применяют префикс цикло-.
После того как определена родоначальная структура, выбрана старшая группа
(обозначается суффиксом), проведена нумерация, выявлены другие группы, составляют
полное название. При этом цифровые индексы, указывающие положение заместителей и
кратных связей, дают перед префиксом и перед суффиксом
41. Радикало-функциональная номенклатура
• Эта система использует те же приемы, что ирациональная, но не содержит суффиксов. По этой
номенклатуре роль суффикса играет название класса
соединения.
42. Классификация органических реакций
• Органические реакции классифицируют поразличным признакам:
• - По типу превращения субстрата;
• - По типу активирования;
• - По характеру разрыва связей.
43. Классификация по типу превращения субстрата
• Реакции замещения• Реакции присоединения
• Реакции элиминирования
• Перегруппировки
44. Реакции замещения
• Замещение - реакция, в ходе которой атом водорода (илифункциональная группа) в органической молекуле замещается
на какую-либо функциональную группу (или атом водорода).
В реакции Сl - уходящая группа, ОН - вступающая группа
45. Реакции присоединения
• Присоединение - реакция, в ходе которой реагентприсоединяется по кратной связи (С=С, С=O, С=N)
молекулы субстрата. Это, например,
гидробромирование этилена.
Реакции присоединения обозначают латинским символом Ad (от англ. «addition»
- присоединение). Продукт такой реакции обычно называют аддуктом.
Образование аддукта происходит без потери атомов реагирующих молекул.
46. Реакции элиминирования
• Элиминирование - реакция, в ходе которой от субстратаотщепляется молекула или частица (вода, галогеноводород и
• т. д.). Этот тип превращения обозначают латинской буквой Е (от
англ. «elimination» - элиминирование, отщепление).
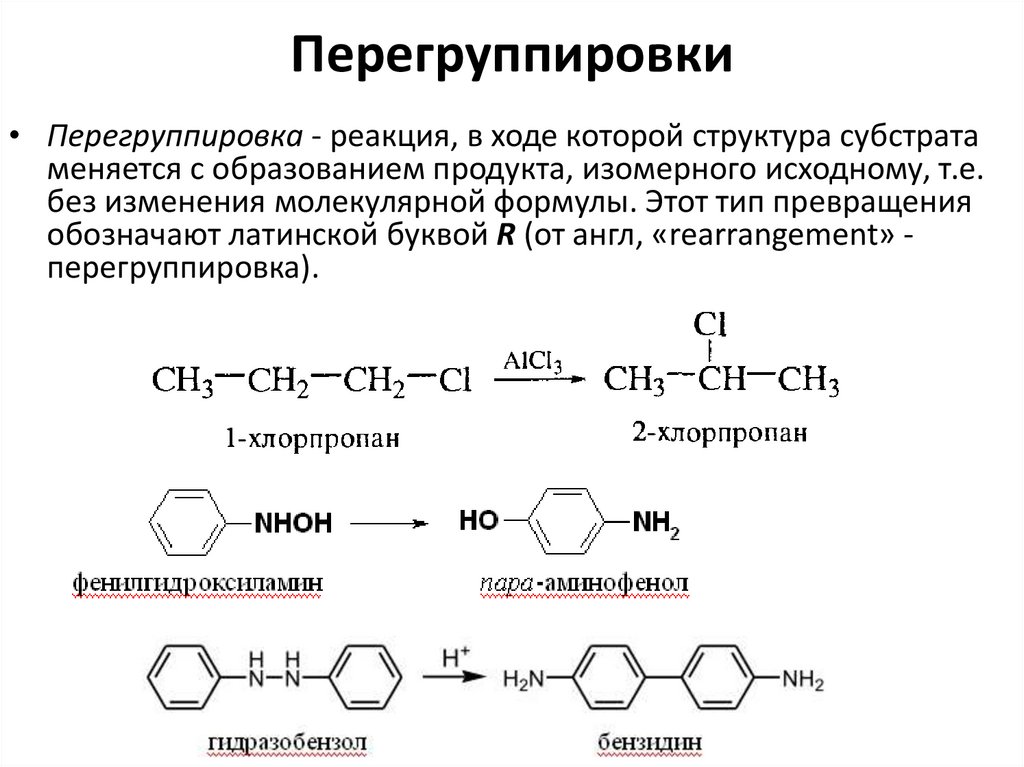
47. Перегруппировки
• Перегруппировка - реакция, в ходе которой структура субстратаменяется с образованием продукта, изомерного исходному, т.е.
без изменения молекулярной формулы. Этот тип превращения
обозначают латинской буквой R (от англ, «rearrangement» перегруппировка).
48. Классификация по типу активирования
Некаталитические реакцииNO2
NO2
NO2+
t oC
Каталитические реакции
кислотный катализ
основной катализ
Фотохимические реакции
NO2
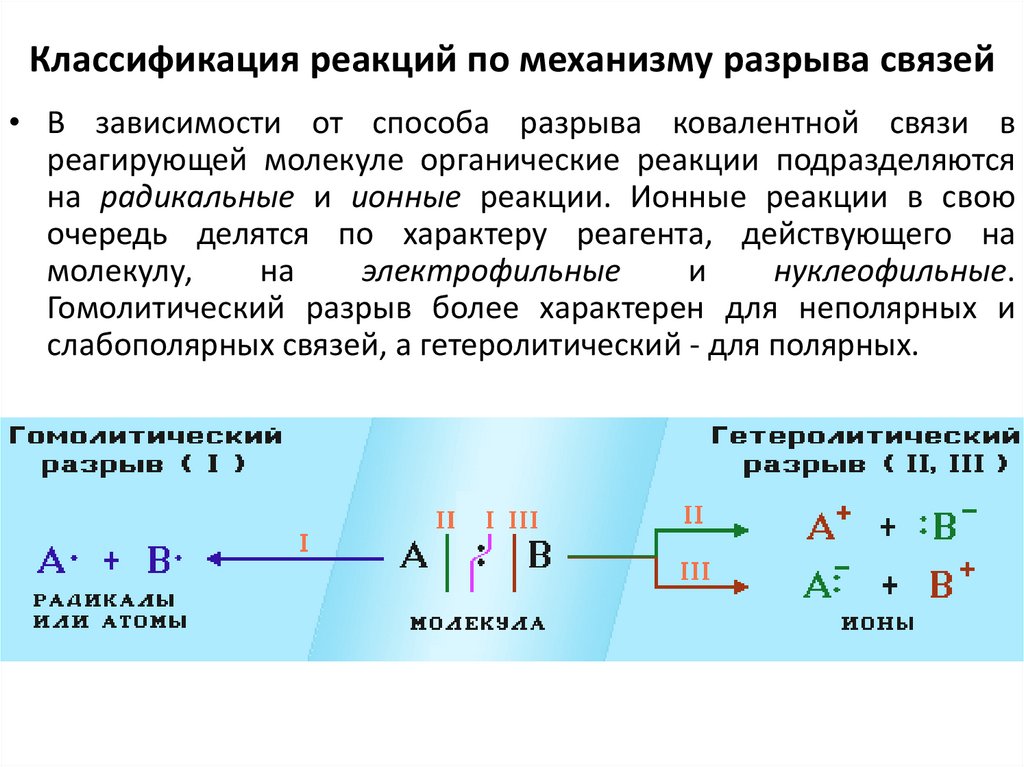
49. Классификация реакций по механизму разрыва связей
• В зависимости от способа разрыва ковалентной связи вреагирующей молекуле органические реакции подразделяются
на радикальные и ионные реакции. Ионные реакции в свою
очередь делятся по характеру реагента, действующего на
молекулу,
на
электрофильные
и
нуклеофильные.
Гомолитический разрыв более характерен для неполярных и
слабополярных связей, а гетеролитический - для полярных.
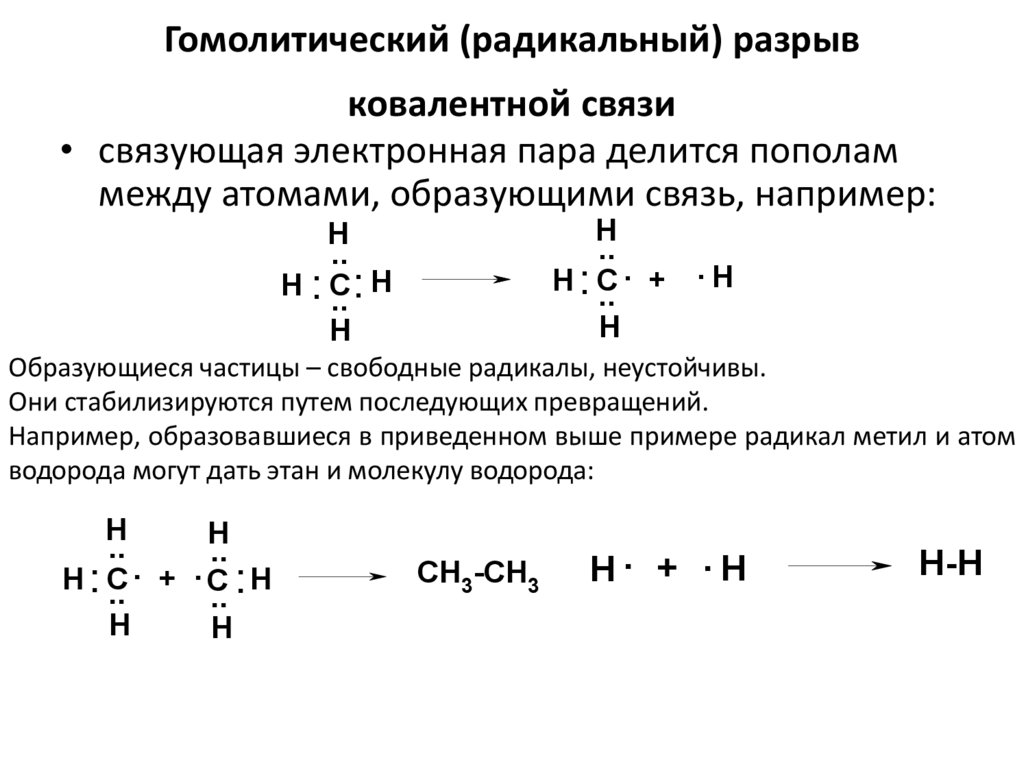
50. Гомолитический (радикальный) разрыв ковалентной связи
• связующая электронная пара делится пополаммежду атомами, образующими связь, например:
H
..
.
. + .H
H.C
..
H
H
.. .
.
H
H.C
.. .
H
Образующиеся частицы – свободные радикалы, неустойчивы.
Они стабилизируются путем последующих превращений.
Например, образовавшиеся в приведенном выше примере радикал метил и атом
водорода могут дать этан и молекулу водорода:
H
H
..
.. .
.
.
.
H. C
H
.. + C
.. .
H
H
CH3-CH3
H. + .H
H-H
51. Гетеролитический разрыв связи (ионный)
• связующая электронная пара целиком отходит к одному из атомов,образующих связь, и он приобретает отрицательный заряд, а другой
атом становится положительно заряженным, например:
H
.. .
H .. C
.. . Br
H
+
CH3
.
+ .Br
Метильная группа приобрела положительный заряд и превратилась в метилкатион, а атом брома стал анионом. Такой характер гетеролитического разрыва
определяется относительной электроотрицательностью связанных атомов. Как и
радикалы, образующиеся при гетеролитическом разрыве, ионы неустойчивы. Они
стабилизируются в ходе последующих реакций с другими ионными частицами.
Если показанный выше разрыв связи C-Br произошел в присутствии КОН,
продуктом реакции будет спирт:
CH3+ + OH- = CH3-OH
52. Поляризация ковалентной связи и ее дальнейший разрыв
• У большинства органических соединений дело не доходит дообразования настоящих ионов: в ходе реакции происходит лишь
увеличение поляризации связи. Но, знание характера
поляризации связи позволяет предвидеть ее поведение во время
реакции. Например:
СH3δ+-Iδ- + H δ+-Oδ--H → CH3-OH + HI
СH3δ--Naδ+ + Hδ+-Oδ--H → CH4 + NaOH
В иодистом метиле углеродный атом несет частичный положительный заряд,
поэтому он взаимодействует с отрицательным концом диполя воды – с атомом
кислорода, образуя метиловый спирт. В метилнатрии углерод заряжен
отрицательно, поэтому он взаимодействует с положительным концом диполя
воды – с водородом, образуя метан.
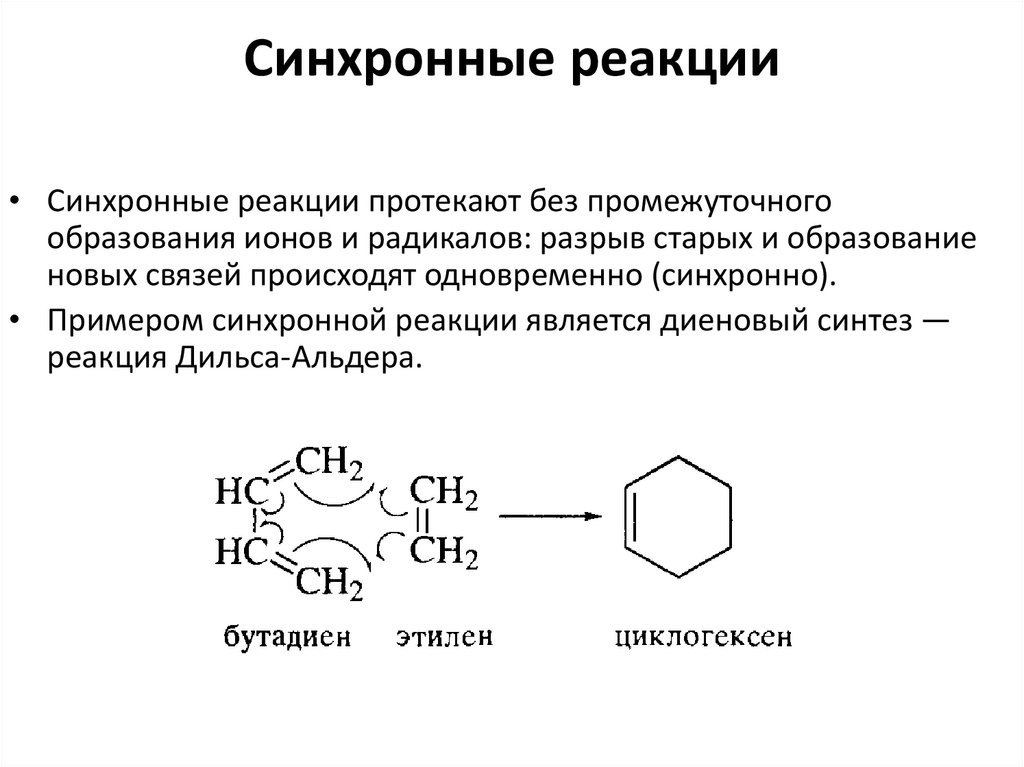
53. Синхронные реакции
• Синхронные реакции протекают без промежуточногообразования ионов и радикалов: разрыв старых и образование
новых связей происходят одновременно (синхронно).
• Примером синхронной реакции является диеновый синтез —
реакция Дильса-Альдера.
54. Электронные эффекты. Индуктивный эффект
Индуктивный эффект (I) – это смещение электронной плотности вдоль σ–связи от
одного атома к другому вследствие их разной электроотрицательности. При этом
происходит поляризация связи.
Наличие в молекуле полярной σ–связи вызывает поляризацию ближайших двух-трех σ–
связей и ведет к возникновению частичных зарядов δ+ (дельта плюс) или δ– (дельта
минус) на соседних атомах.
Из-за слабой поляризуемости σ -связей I-эффект быстро затухает с удалением от
заместителя и через 3-4 связи становится практически равным 0.
Атомы и группы атомов, электроотрицательность которых больше электроотрицательности
атома углерода, в связах с ним оттягивают на себя электроны связи и обладают
отрицательным индуктивным эффектом –I.
Индуктивный эффект называется положительным (+I), если заместитель увеличивает
электронную плотность на атоме углерода, индуцируя на нем частичный отрицательный
заряд. Направление (знак) I-эффекта заместителя качественно оценивается путем
сравнения со стандартом — атомом водорода, индуктивный эффект которого принят за 0.
Заместители, вызывающие отрицательный индуктивный эффект:
NO2, CN, -COOH, -F, -Cl, -Br, I, -COOR, COR.
Заместители, вызывающие положительный индуктивный эффект:
- Mg, - Li, -CH3, C2H5 и т.д..
55. Мезомерный эффект (эффект сопряжения).
Мезомерный эффект - смещение электронной плотности по цепи сопряженных π-связей• Этот эффект проявляют заместители, связанные с sp2- или sp-гибридизованным атомом.
Благодаря подвижности p-электронов, М-эффект передается по цепи сопряжения без
затухания. +М-эффектом обладают заместители, повышающие электронную плотность
в сопряженной системе. К ним относятся группы, которые содержат атомы с
неподеленной парой электронов, способные к передаче этой пары электронов в общую
систему сопряжения. +М-эффект характерен для групп -OH и -NH2 . Так, в молекуле
фенола группа -OH проявляет +М-эффект за счет участия одной из неподеленных
электронных пар атома кислорода в системе сопряжения.
-М-эффект проявляют заместители с
электроотрицательными атомами и смещающие
электронную плотность на себя. -М-эффект
характерен для групп -CH=O, -COOH, -NO2.
Хотя эти группы имеют неподеленные
электронные пары, пространственное
расположение орбиталей с этими электронами
не позволяет им вступать в систему сопряжения.
Таким образом, в данном случае заместитель
может лишь оттягивать электроны из общей
системы сопряжения за счет своей более
высокой электроотрицательности.
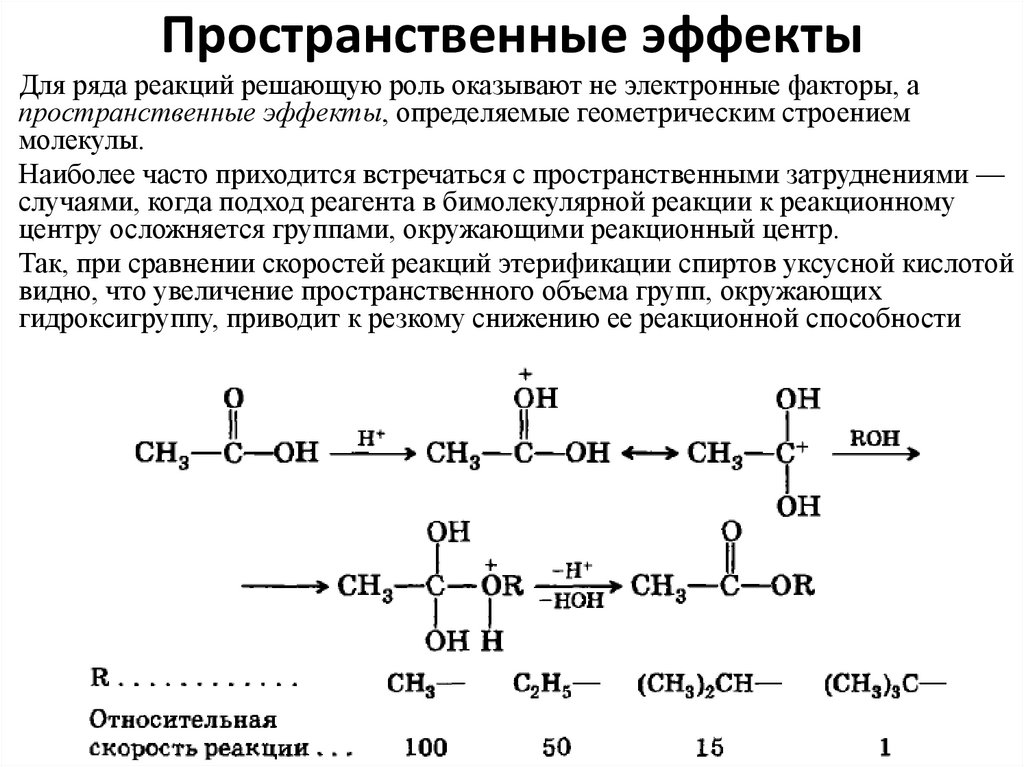
56. Пространственные эффекты
Для ряда реакций решающую роль оказывают не электронные факторы, апространственные эффекты, определяемые геометрическим строением
молекулы.
Наиболее часто приходится встречаться с пространственными затруднениями —
случаями, когда подход реагента в бимолекулярной реакции к реакционному
центру осложняется группами, окружающими реакционный центр.
Так, при сравнении скоростей реакций этерификации спиртов уксусной кислотой
видно, что увеличение пространственного объема групп, окружающих
гидроксигруппу, приводит к резкому снижению ее реакционной способности















































 chemistry
chemistry








