Similar presentations:
Гидролиз солей
1.
Гидролиз солей9 класс
2.
ПовторениеСоли – это сложные вещества, состоящие из
ионов металла и кислотного остатка
NaCl
CuSO4
KMnO4
Na2Cr2O7
Ba(NO3)2
3.
• Некоторые соли способны взаимодействоватьс водой
• Происходит это потому, что молекулы воды –
слабый электролит и способны
диссоциировать на ионы
• Эти ионы и вступают во взаимодействие с
солями
• Процесс взаимодействия солей с водой
называют гидролизом
4.
Когда соли могутподвергаться гидролизу?
• Если соль образована слабым
основанием и сильной кислотой (AlCl3)
• Если соль образована сильным
основанием и слабой кислотой (Na2CO3)
5.
Соль образована слабым основанием исильной кислотой (AlCl3)
Диссоциация хлорида алюминия:
AlCl3 = Al3+ + 3ClГидролиз осуществляется по катиону Al3+
Al3+ + H2O = …
Запишем воду как HOH:
Al3+ + HOH = AlOH2+ + H+
Добавим хлорид-ионы:
Al3+ + 3Cl- + HOH = AlOH2+ + H+ + 3ClСоединим ионы:
AlCl3 + H2O = AlOHCl2 + HCl
В результате гидролиза образовалась соляная кислота,
соответственно среда раствора стала кислой (pH<7 )
6.
Соль образована сильным основанием ислабой кислотой (Na2CO3)
Диссоциация карбоната натрия:
Na2CO3 = 2Na+ + CO32Гидролиз по аниону:
CO32- + HOH = HCO3- + OH-
Добавим ионы натрия:
CO32- + 2Na+ + HOH = HCO3- + OH- + 2Na+
Соединим ионы:
Na2CO3 + H2O = NaHCO3 + NaOH
В результате гидролиза образовалась щелочь, соответственно
среда раствора стала щелочной (pH>7 )
7.
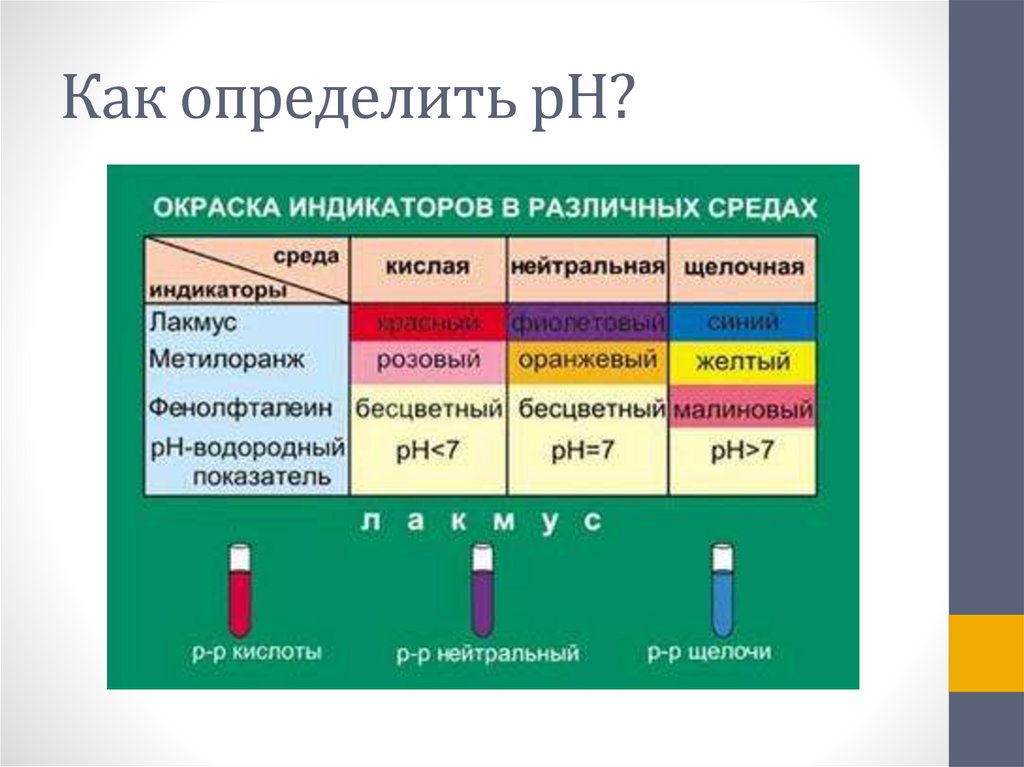
Как определить pH?8.
9.
Важно!Гидролизу НЕ подвергаются:
• Соли, образованные сильным
основанием и сильной кислотой
• Нерастворимые в воде соли
Если соль образована слабым
основанием и слабой кислотой, то
происходит полный гидролиз









 chemistry
chemistry








