Similar presentations:
Сабақтың тақырыбы: донорлыакцепторлы байланыс. Комплексті қосылыстар
1.
Қостанай мемлекеттік университетіСабақтың тақырыбы: Донорлыакцепторлы байланыс.
Комплексті
қосылыстар.
2016-2017 оқу жылы
2.
Комплекс қосылыстары түзілетін процестер мәнін ашу үшіншвейцария химигі А.Вернер ұсынған және көрнекті ғалымдар
Л.А.Чугаев, И.Л. Черняев, А.А. Гринберг толықтырған
координациялық теориямен қысқаша танысамыз.
Бұл теорияның негізгі қағидалары мынадай:
1. Комплекс қосылысында иондар мен атомдардың біреуі орталық
деп саналады, оны комплекс түзуші деп атайды.
2. Орталық ион (атом) – комплекс түзуші маңында лигандалар
деп аталатын қарама-қарсы зарядталған иондар немесе полюсті
молекулалар орналасады (координацияланады).
3. Орталық ион (атом) мен лигандалар қосылыстың ішкі
координациялық сферасын түзеді, оны квадрат жақшаға алып
жазады.
4. Көп жағдайда орталық ионмен (атоммен) тікелей байланысқан
лигандалар саны координациялық сан деп аталады, ол көбінесе
2 , 4, 6, 8 мәндеріне ие болады.
5. Орталық ионнан (атомнан) бір шама алысырақ орналасқан
иондар сыртқы координациялық сфера түзеді.
3.
Координациялық теория тұрғысынан құрамында аммонийионы бар (NH4 Cl) тұздар кристаллогидратын алюминаттар
құрылысын қарастырамыз (ІІ). Бұл қосылыстар комплекс
қосылыстарына жатады және координациялық теорияға
сәйкес олардың химиялық формулаларын схема түрінде
төмендегідей белгілейміз:
4.
Коваленттік байланыс түзілу барысында атомдарда ортақ жұп түзуүшін жалқы электрондар әрбір атомда болуы шарт емес. Байланысқа
қатынасушы бір атомда электрондар жұбы болса, екіншісінде сол
электрондар орналаса алатындай бос орын, яғни деңгейше болса, олар
өзара бір-бірімен донорлы-акцепторлы байланыс түзеді. Электрон
жұбы бар атом не бөлшек донор, ал бос деңгейшесі бар атом не бөлшек
акцептор деп аталынады. Мысалы, аммиак пен хлорлы сутек
арасындағы қосылу реакциясы:
Аммиак құрамындағы азоттың бос электрон жұбы
хлорсутек молекуласындағы сутек атомының бос s деңгейшесінен
орын алып, өзара байланыс түзді. Мұндағы аммиак құрамындағы азот
– донор, ал хлорсутек молекуласындағы сутек – акцептор қызметін
атқарып тұр. Донорлы-акцепторлы байланысу нәтижесінде көптеген
иондардың гидратациялануы, бейорганикалық қосылыстардың өзара
қосылуы, комплексті қосылыстардың түзілуі жүзеге асады.
5.
Комплекс қосылыстардың химиялық формулаларынқарапайым түрде жазсақ:
[NH4] Cl, [Cu(Н20)4] SO4 H2O, Na [Al (OH)4]
Орталық ион мен (атоммен) лигандалар арасындағы
байланыс табиғаты екі жақты болуы мүмкін. Бір
жағынан, орталық ионның лигандалармен
байланысы электростатикалық тартылыс күшіне
негізделген, себебі лигандалар комплекстүзушімен
салыстырғанда қарама-қарсы зарядты ион болып
келеді. Мысал ретінде натрий алюминатын
қарастырамыз (дәлірек, натрий
тетрагидроксоалюминатын Na[Al(OH) 4]. Бұл
қосылыстар орталық алюминий атомының ішінара
оң заряды, ал лигандалар – гидроксид-иондарының
– теріс заряды бар.
6.
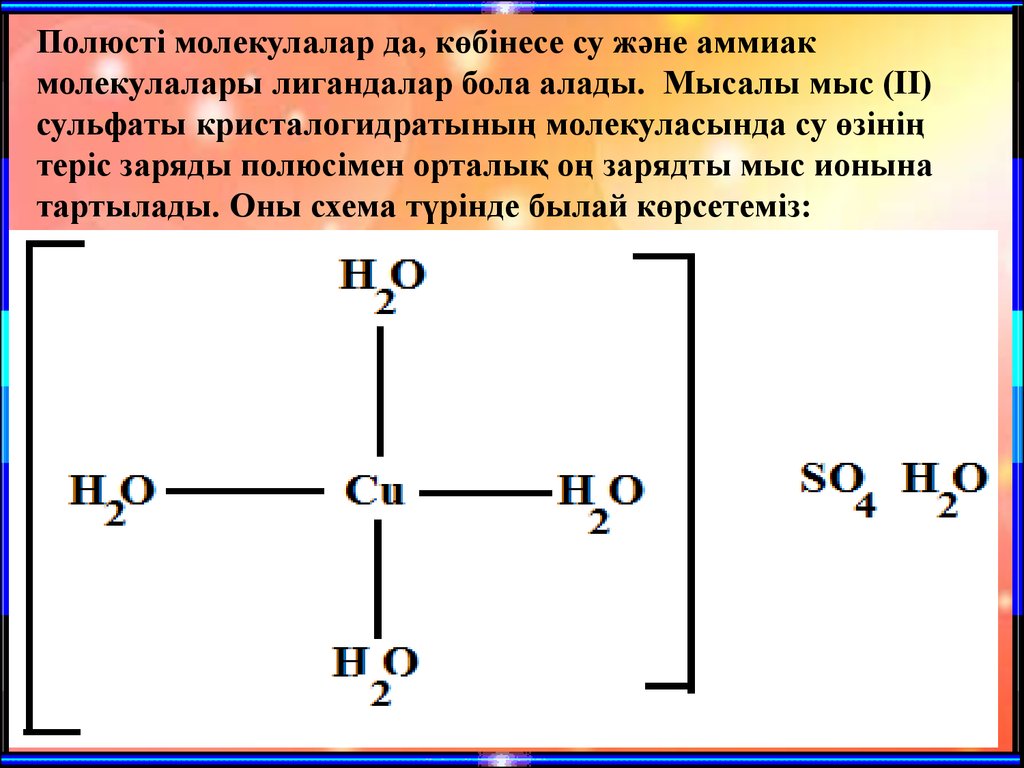
Полюсті молекулалар да, көбінесе су және аммиакмолекулалары лигандалар бола алады. Мысалы мыс (ІІ)
сульфаты кристалогидратының молекуласында су өзінің
теріс заряды полюсімен орталық оң зарядты мыс ионына
тартылады. Оны схема түрінде былай көрсетеміз:
7.
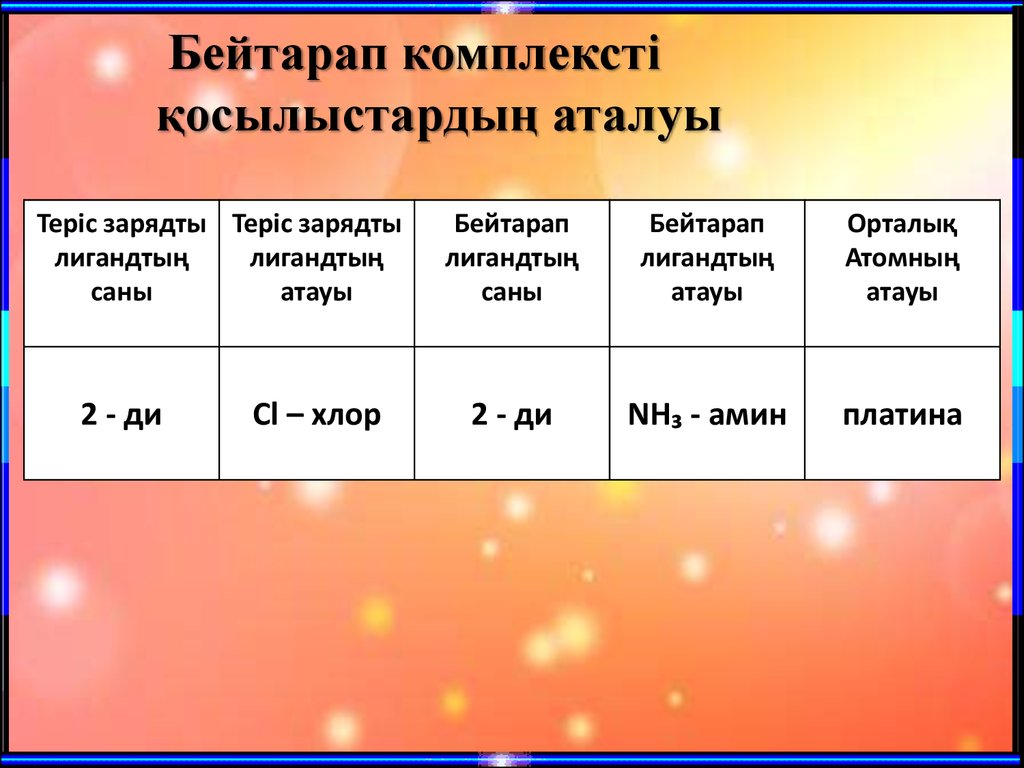
Бейтарап комплекстіқосылыстардың аталуы
Теріс зарядты Теріс зарядты
лигандтың
лигандтың
саны
атауы
2 - ди
Сl – хлор
Бейтарап
лигандтың
саны
Бейтарап
лигандтың
атауы
Орталық
Атомның
атауы
2 - ди
NH₃ - амин
платина
8.
Катионды комплексті қосылыстардың аталуыАнион
SO₄²⁻ - сульфат
Катион
Лигандтар
саны
Лиганд
атауы
4 - тетра
NH₃ - амин
Орталық
ионның аты
Тотығу
дәрежесі
Мыс
ІІ
Анионды комплексті қосылыстардың аталуы
Анион
катион
Лигандтар
саны
Лиганд
атауы
Орталық
ионның аты
Тотығу
дәрежесі
6 - гекса
CN - цианид
феррат
ІІІ
калий
9.
Екінші жағынан, орталық атом мен лигандалар арасындабайланыс, аммоний ионы түзілгені сияқты, донорлыакцепторлы механизммен түзілуі мүмкін.
Көптеген комплекс қосылыстарда орталық ион мен
лигандалар арасындағы байланыс электростатикалық
тартылыс күштерімен қоса комплекстүзшінің бөлінбеген
электрон жұптасымен лигандалардың бос орбитальдары
арқылы да байланыстар түзіледі.
Комплекс қосылыстарының көпшілігі – электролиттер.
Мысалы калий (ІІ) гексацианоферрат су ертінділерінде
төмендегідей диссоциацияланды:
10.
Комплекс қосылыстары диссоциацияланғандакомплекс иондарының түзілетінін, олардың
біршама берік екенін, олардың диссоцияциялану
дәрежесі өте аз екенін ерекше атаған жөн.
Комплексті қосылыстармен іс жүзінде танысу
үшін төмендегі тәжірибені жасауға болады.
Сu (OH)2 + 2NaOH --- Na2 [Cu (OH)4]
Натрий тетрагидроксокуптриты
11.
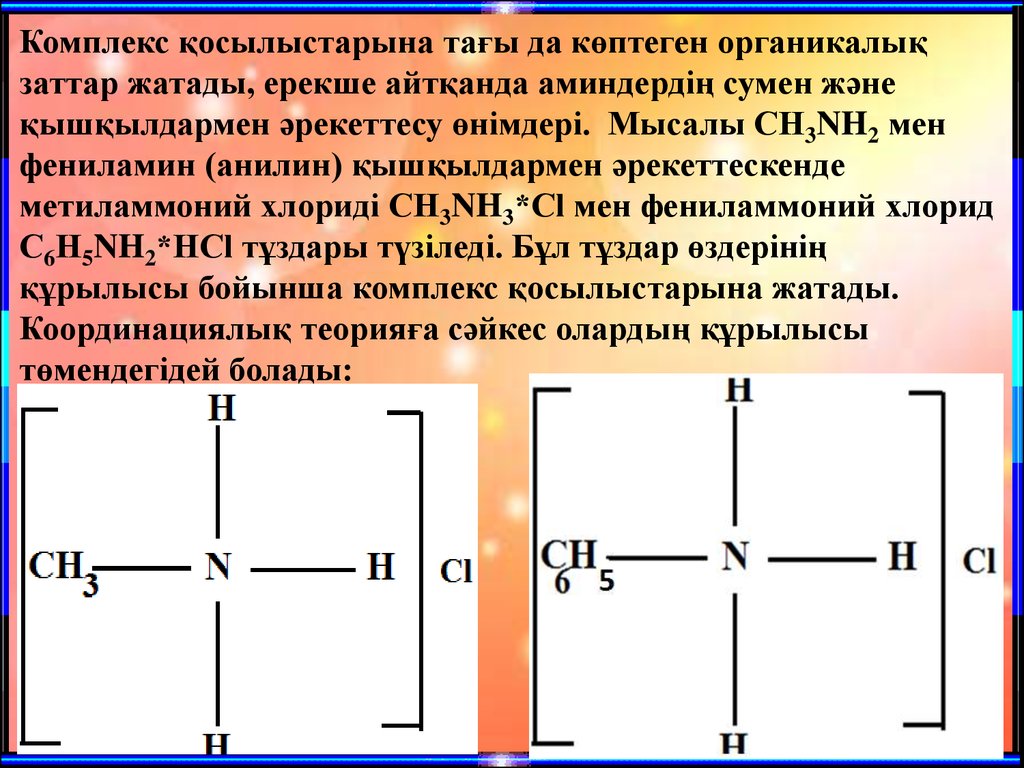
Комплекс қосылыстарына тағы да көптеген органикалықзаттар жатады, ерекше айтқанда аминдердің сумен және
қышқылдармен әрекеттесу өнімдері. Мысалы СН3NH2 мен
фениламин (анилин) қышқылдармен әрекеттескенде
метиламмоний хлориді CH3NH3*Cl мен фениламмоний хлорид
С6Н5NH2*HCl тұздары түзіледі. Бұл тұздар өздерінің
құрылысы бойынша комплекс қосылыстарына жатады.
Координациялық теорияға сәйкес олардың құрылысы
төмендегідей болады:
12.
Бұл қосылыстардағы азот –комплекстүзуші, ал лигандалары –
сутегі атомы және метил мен фенил
радикалдары, комплекс қосылысының
ішкі сферасын түзушілер. Сыртқы
сферада хлорид-иондары бар.
Тіршілікте үлкен маңызы бар көптеген
органикалық заттар комплекс
қосылыста. Оларға гемоглабин,
хлорофилл, ферменттер және басқа да
көптеген қосылыстар жатады.
13.
Комплекс қосылыстарын практикада қолдану. Комплексқосылыстары:
1) аналитикалық химияда көптеген иондарды алу үшін.
Мысалы, төменгі реакция жолымен және анықтау үшін:
2) кейбір металдарды (лантаноидтарды) бөлу үшін және
жоғары дәрежелі таза металдарды (алтын, күміс, т.б.)
алуда
3) бояғыш заттар ретінде
4) судың кермектігін жою үшін
5) маңызды биохимиялық процестердің стимуляторы
ретінде кең қолданылады.
14.
Комплексті қосылыстардыңжіктелуі:
А) комплекстің заряды бойынша:
1) Қышқылдық
2) Анионды
3) Бейтарап
[Cu(H₂O)₆]Cl₃
K₃[[CrCl₆]³
[PtCl₂(H₂O)₂]⁰
Б) лигандтың табиғатына қарай:
1) Аквакомплексті
[Cr(H₂O)₆]Cl₃
2) Гидроксокомплексті
Na₃[Al(OH)₆]
2) Ацидокомплексті
K₄[Fe(CN)₆]
4) Аммиакаттар
[Zn(NH₃)₄]SO₄












 chemistry
chemistry








