Similar presentations:
Классификация реакций. Таблица
1.
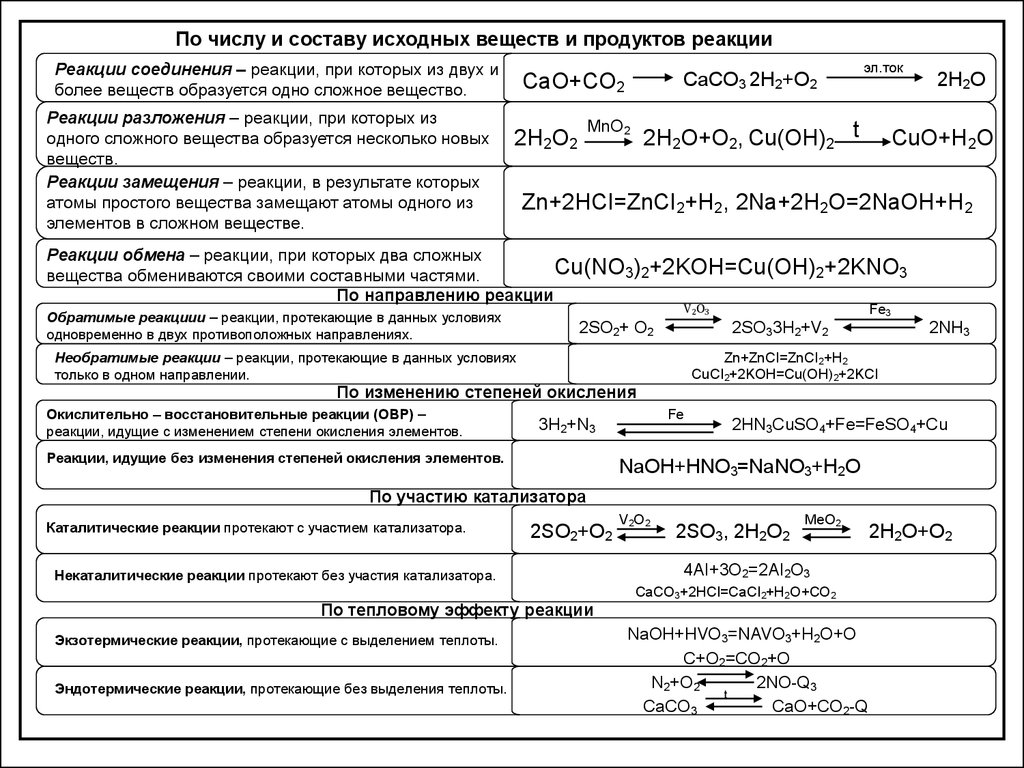
По числу и составу исходных веществ и продуктов реакцииРеакции соединения – реакции, при которых из двух и
более веществ образуется одно сложное вещество.
Реакции разложения – реакции, при которых из
одного сложного вещества образуется несколько новых
веществ.
Реакции замещения – реакции, в результате которых
атомы простого вещества замещают атомы одного из
элементов в сложном веществе.
CaCO3 2H2+O2
CaO+CO2
MnO2
2H2O2
эл.ток
2H2O+O2, Cu(OH)2 t
2H2O
CuO+H2O
Zn+2HCI=ZnCI2+H2, 2Na+2H2O=2NaOH+H2
Реакции обмена – реакции, при которых два сложных
Cu(NO3)2+2KOH=Cu(OH)2+2KNO3
вещества обмениваются своими составными частями.
По направлению реакции
Обратимые реакциии – реакции, протекающие в данных условиях
одновременно в двух противоположных направлениях.
V2O3
2SO2+ O2
Необратимые реакции – реакции, протекающие в данных условиях
только в одном направлении.
Fe
3H2+N3
Реакции, идущие без изменения степеней окисления элементов.
2NH3
Zn+ZnCI=ZnCI2+H2
CuCI2+2KOH=Cu(OH)2+2KCI
По изменению степеней окисления
Окислительно – восстановительные реакции (ОВР) –
реакции, идущие с изменением степени окисления элементов.
Fe3
2SO33H2+V2
2HN3CuSO4+Fe=FeSO4+Cu
NaOH+HNO3=NaNO3+H2O
По участию катализатора
Каталитические реакции протекают с участием катализатора.
2SO2+O2
Некаталитические реакции протекают без участия катализатора.
По тепловому эффекту реакции
Экзотермические реакции, протекающие с выделением теплоты.
Эндотермические реакции, протекающие без выделения теплоты.
V2O2
2SO3, 2H2O2
MeO2
4AI+3O2=2AI2O3
CaCO3+2HCI=CaCI2+H2O+CO2
NaOH+HVO3=NAVO3+H2O+O
C+O2=CO2+O
N2+O2
2NO-Q3
t
CaCO3
CaO+CO2-Q
2H2O+O2
 chemistry
chemistry








