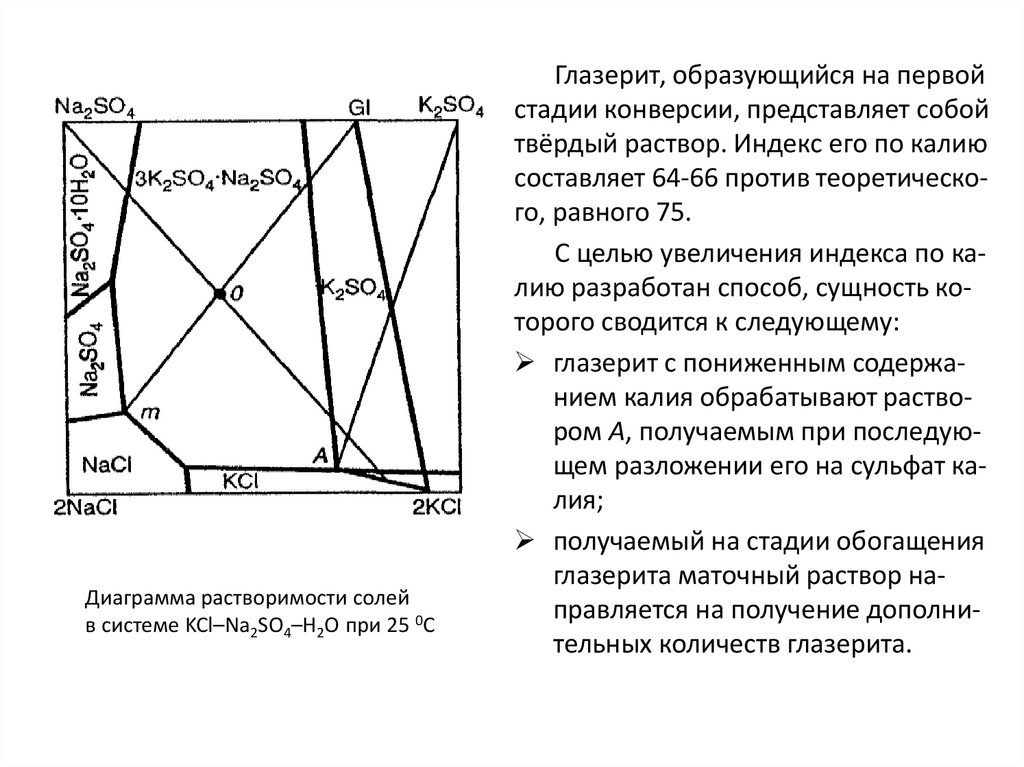
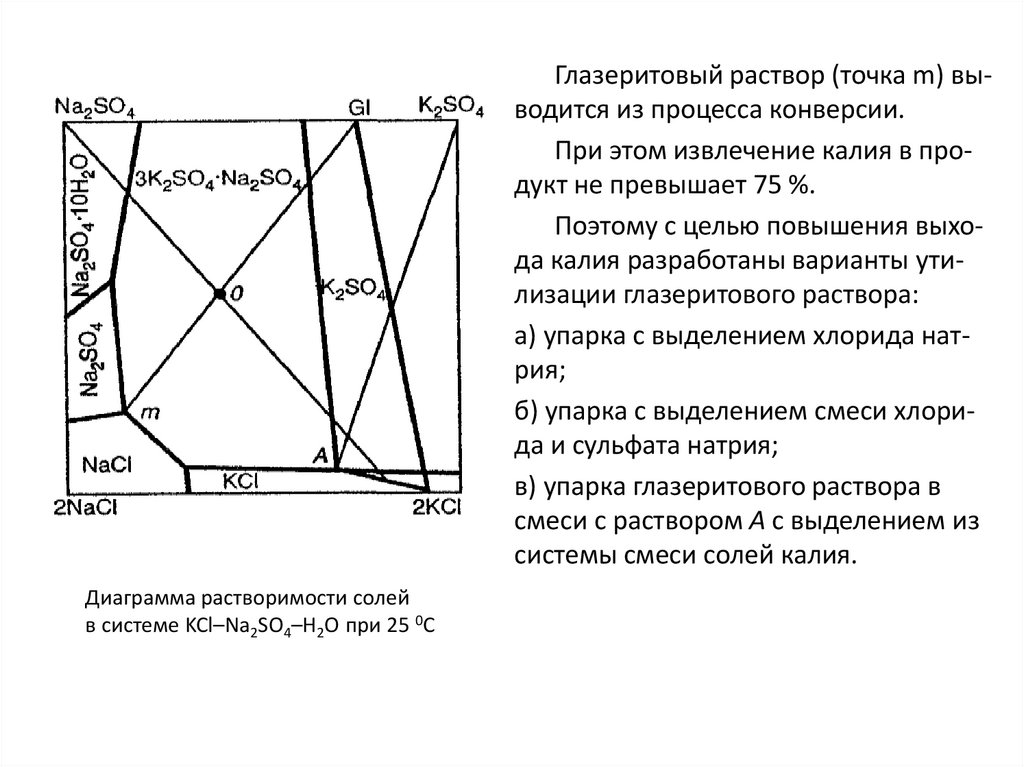
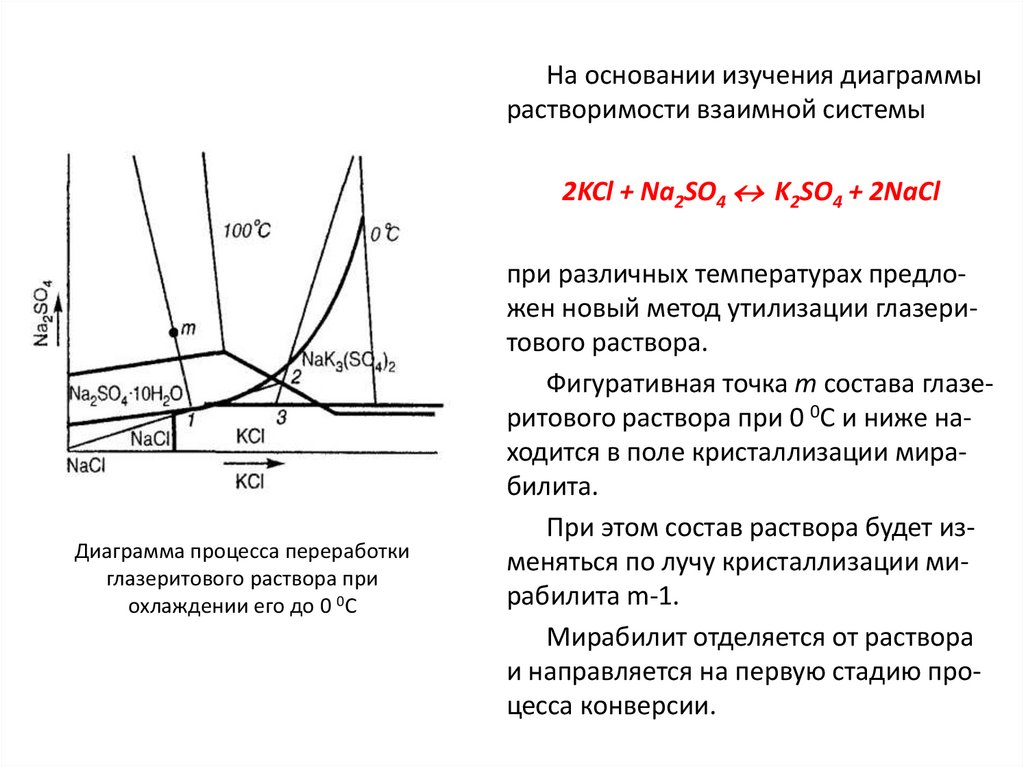
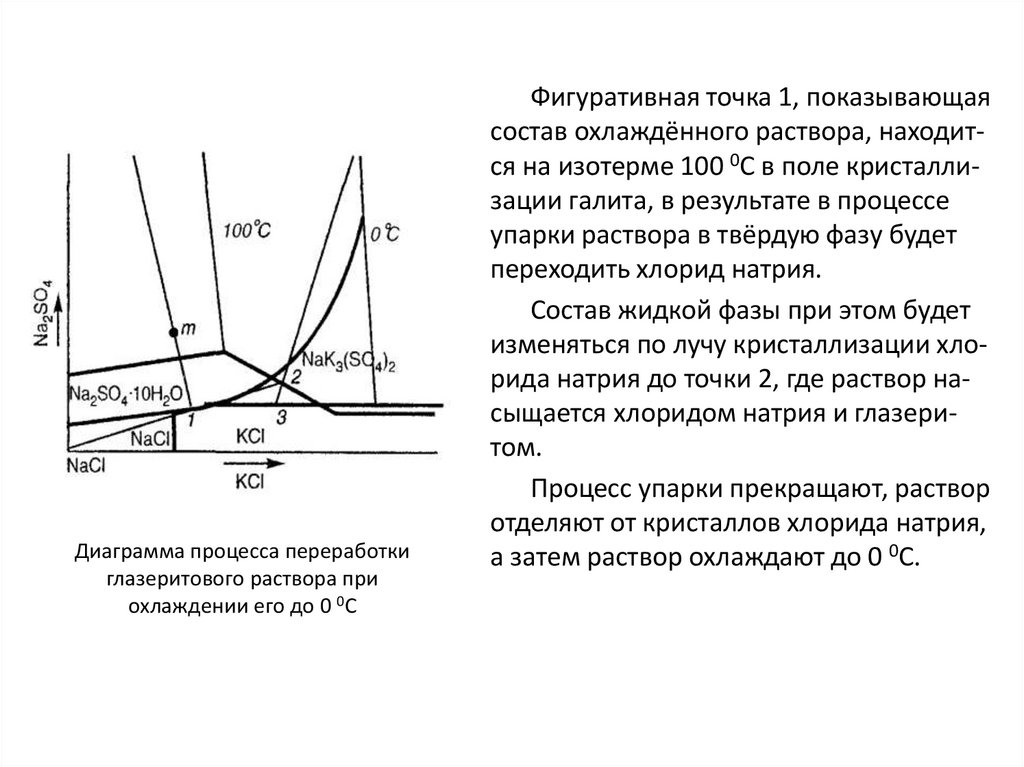
Similar presentations:
Производство хлорида калия
1.
Производствохлорида калия
2.
Классификация калийных удобрений- сырые калийные соли – размолотые природные водорастворимые калийные минералы;
- концентрированные калийные удобрения – продукты
заводской переработки сырых солей;
- калийные соли – продукты, получаемые смешением
сырых солей, содержащих калий и натрий и концентрированных солей калия.
3.
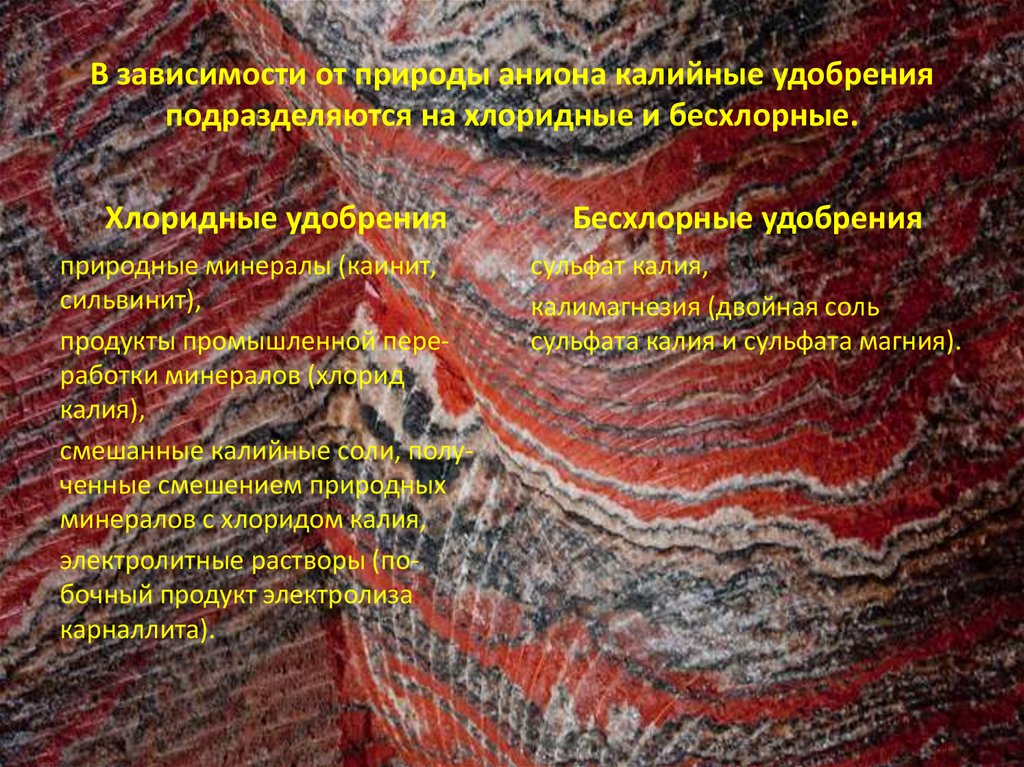
В зависимости от природы аниона калийные удобренияподразделяются на хлоридные и бесхлорные.
Хлоридные удобрения
природные минералы (каинит,
сильвинит),
продукты промышленной переработки минералов (хлорид
калия),
смешанные калийные соли, полученные смешением природных
минералов с хлоридом калия,
электролитные растворы (побочный продукт электролиза
карналлита).
Бесхлорные удобрения
сульфат калия,
калимагнезия (двойная соль
сульфата калия и сульфата магния).
4.
Сырьё для калийных удобрений1. Сильвинит (NaCl KCl)
2. Карналлит (КСl МgСl2 6Н2О)
3. Лангбейнит (К2SО4 2МgSО4)
4. Каинит (КСl МgSО4 3Н2О)
5.
Производство хлорида калиягалургическим способом
6.
Принципиальная схема переработки сильвинитовых рудвключает следующие основные операции:
выщелачивание измельчённого сильвинита горячим маточным раствором, полученным после кристаллизации хлорида калия;
отделение горячего щёлока от осадка галита и осветление от мелких
увлечённых твёрдых частиц, промывка отвала и глинистого шлама;
вакуум-охлаждение щёлока, сопровождающееся кристаллизацией
хлорида калия;
отделение кристаллов хлорида калия от маточного раствора и их
сушка;
нагревание маточного раствора, возвращаемого на выщелачивание
хлорида калия из новых порций сильвинита.
7.
Выщелачиваниехлорида калия
из сильвинита
8.
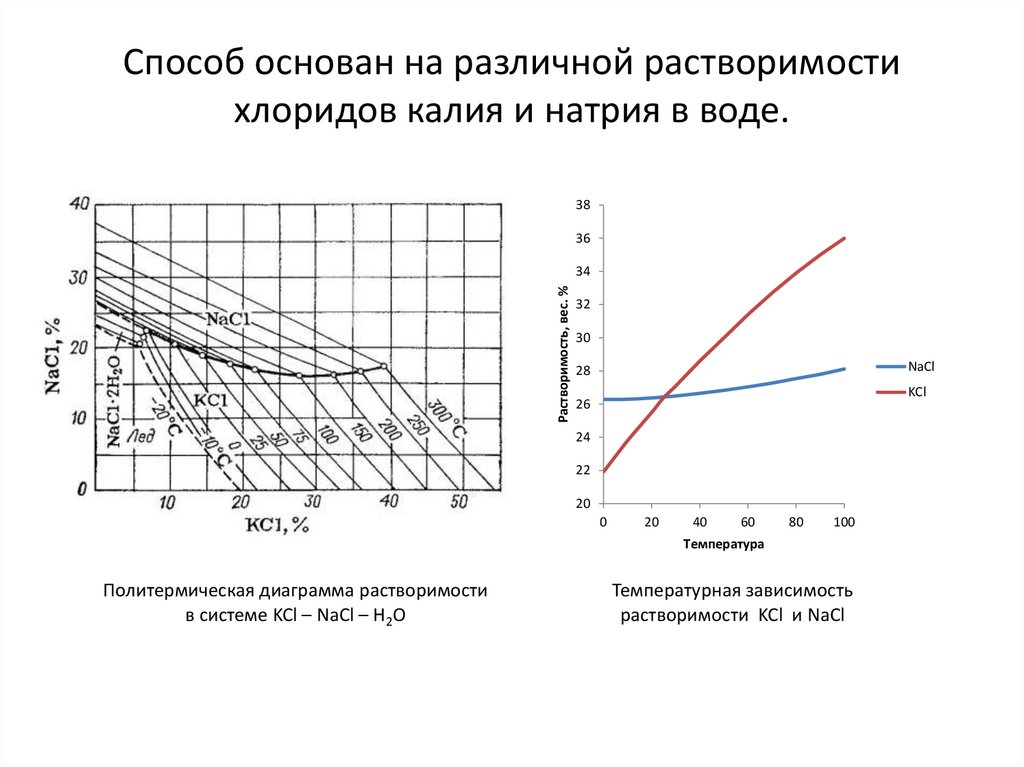
Способ основан на различной растворимостихлоридов калия и натрия в воде.
38
36
Растворимость, вес. %
34
32
30
NaCl
28
KCl
26
24
22
20
0
20
40
60
80
100
Температура
Политермическая диаграмма растворимости
в системе KCl – NaCl – H2O
Температурная зависимость
растворимости KCl и NaCl
9.
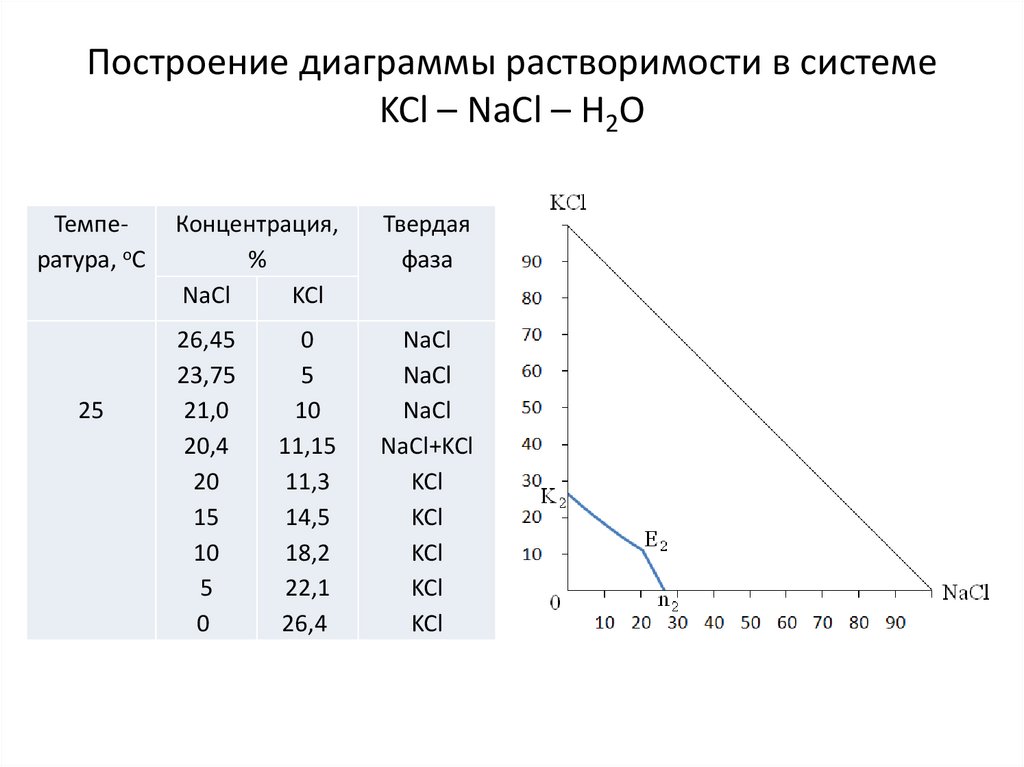
Построение диаграммы растворимости в системеKCl – NaCl – H2O
Температура, оС
25
Концентрация,
%
NaCl
KCl
Твердая
фаза
26,45
23,75
21,0
20,4
20
15
10
5
0
NaCl
NaCl
NaCl
NaCl+KCl
KCl
KCl
KCl
KCl
KCl
0
5
10
11,15
11,3
14,5
18,2
22,1
26,4
10.
Построение диаграммы растворимости в системеKCl – NaCl – H2O
Температура, оС
100
Концентрация,
%
NaCl
KCl
28,2
25,4
22,7
20,1
17,6
16,8
15
10
5
0
0
5
10
15
20
21,7
23,0
27,1
31,4
35,9
Твердая
фаза
NaCl
NaCl
NaCl
NaCl
NaCl
NaCl+KCl
KCl
KCl
KCl
KCl
11.
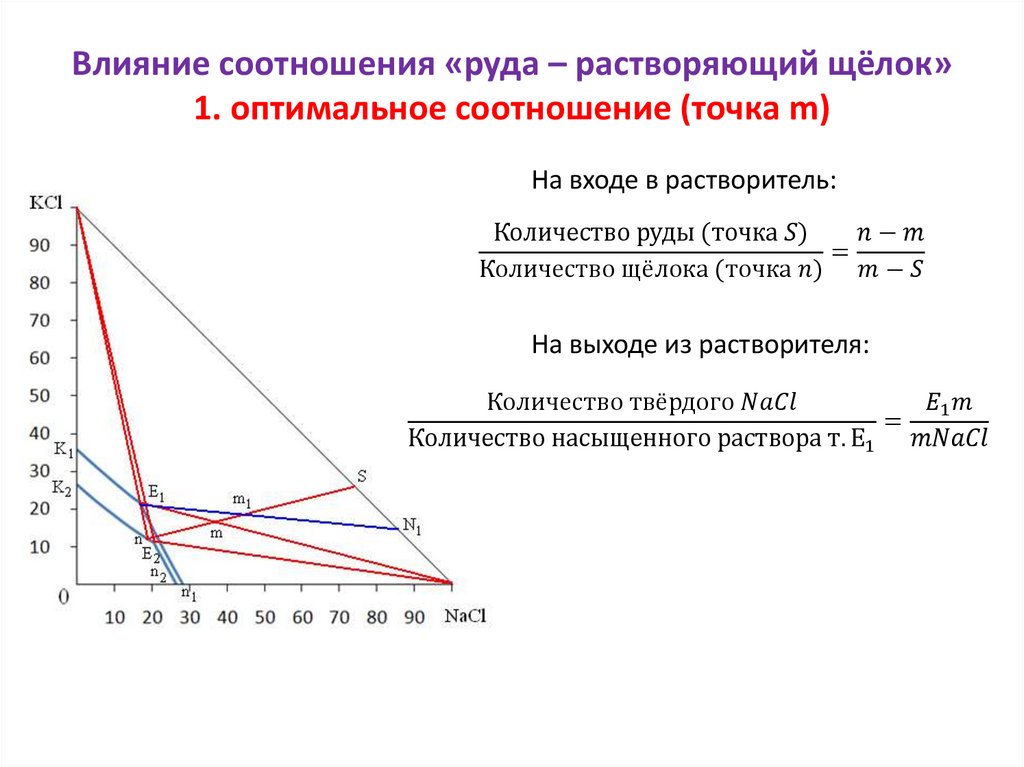
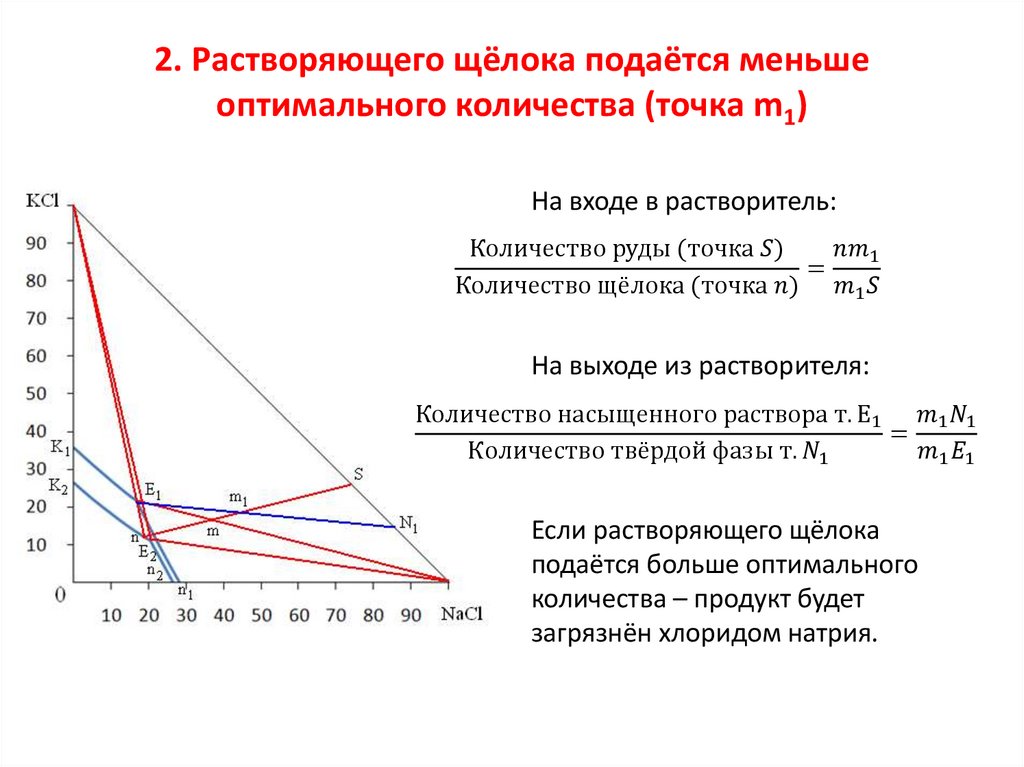
Физико-химические основы процессавыщелачивания хлорида калия
К1Е1 и К2Е2 – линии растворов, насыщенных KCl при 100 и 25 0С;
E1n1 и E2n2 – линии растворов, насыщенных NaCl при 100 и 25 0С;
Е1 – эвтонический раствор при 100 0С;
Е2 – эвтонический раствор при 25 0С;
KCl–K1E1 и KCl–K2E2 – область кристаллизации хлорида калия;
NaCl–E1n1 и NaCl–E2n2 – область кристаллизации хлорида натрия;
0–n1E1K1 и 0–n2E2K2 – области ненасыщенных растворов;
KCl–E1–NaCl и KCl–E2–NaCl – области
совместной кристаллизации солей.
Диаграмма состояния
системы KCl – NaCl – H2O
12.
Правила пользования диаграммой1.
выбрать фигуративную точку первоначально взятой системы;
2.
провести поля кристаллизации при той температуре, до которой будет охлаждена система;
3.
определить, в какое поле кристаллизации попала фигуративная точка первоначально взятой системы;
4.
с помощью принципа соединительной прямой определить комплексы, на которые распалась исходная система после охлаждения;
5.
с помощью принципа рычага определить количество образовавшихся фаз.
13.
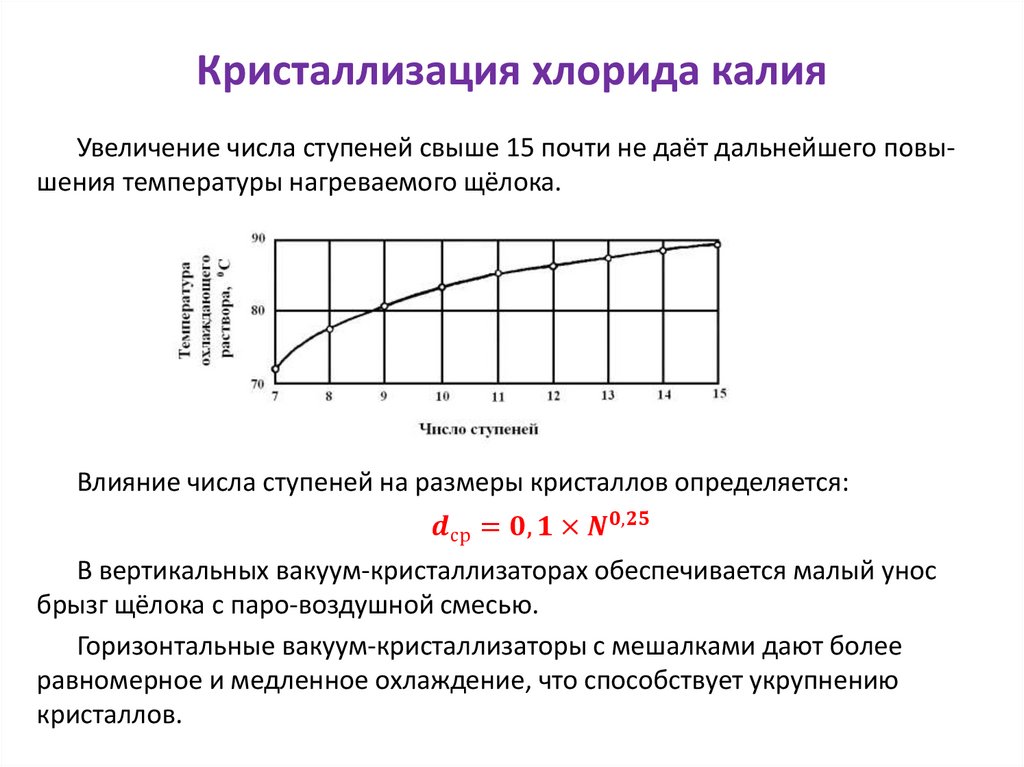
Влияние температуры на процесс растворенияКоличество твёрдого










































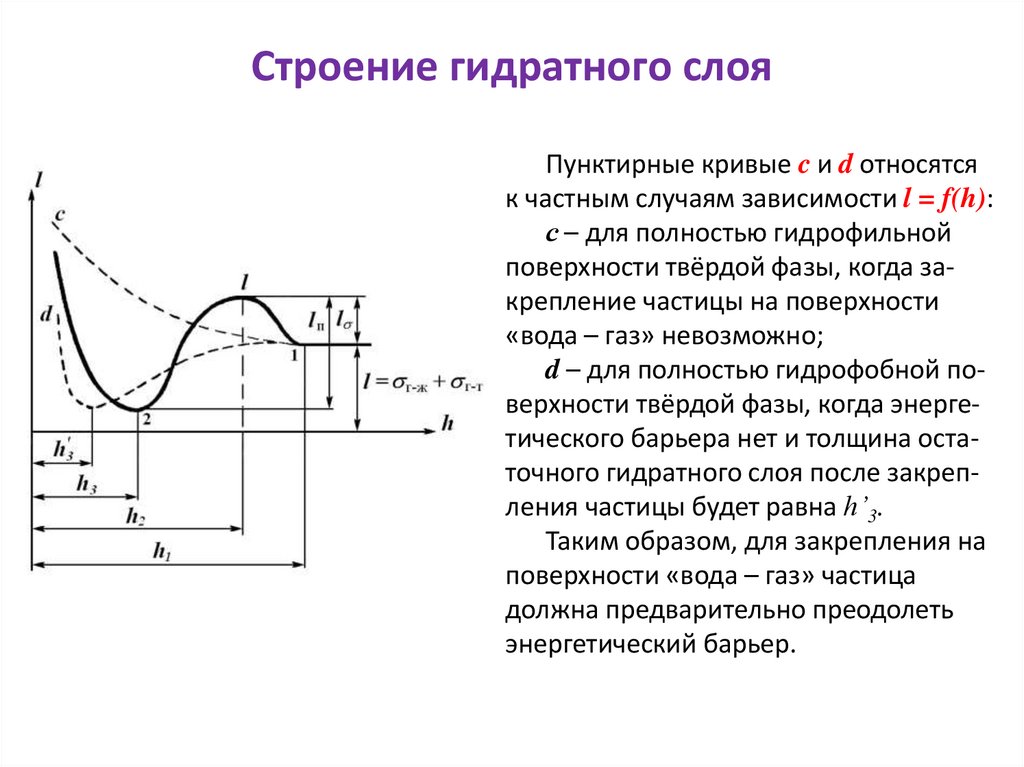










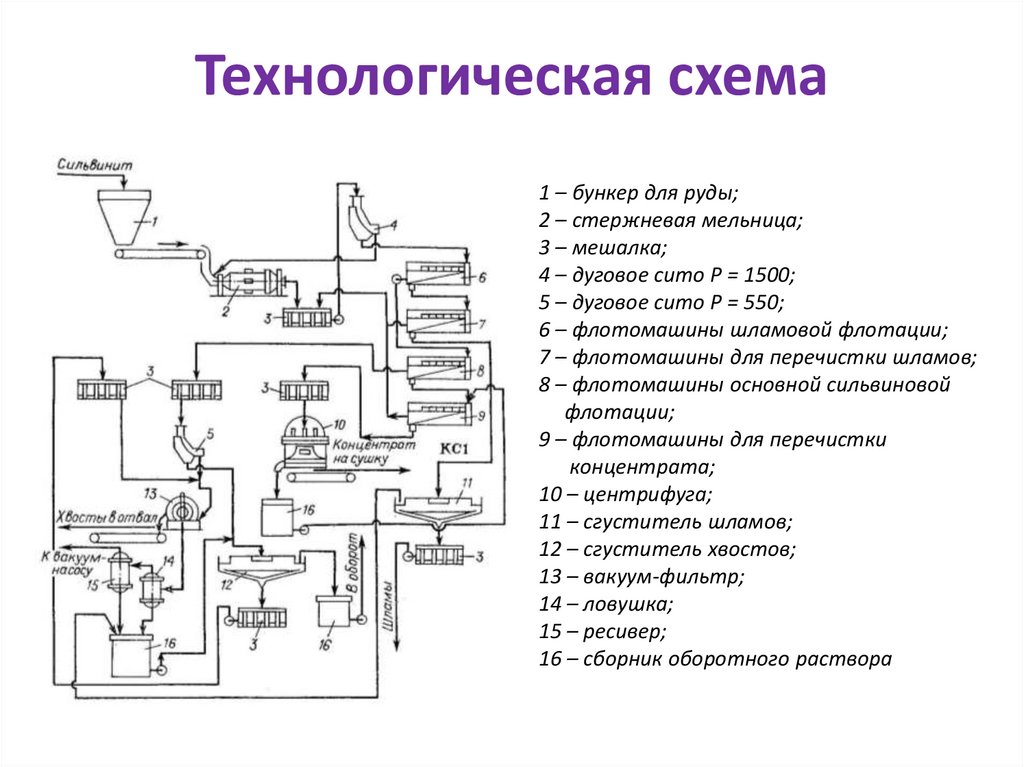










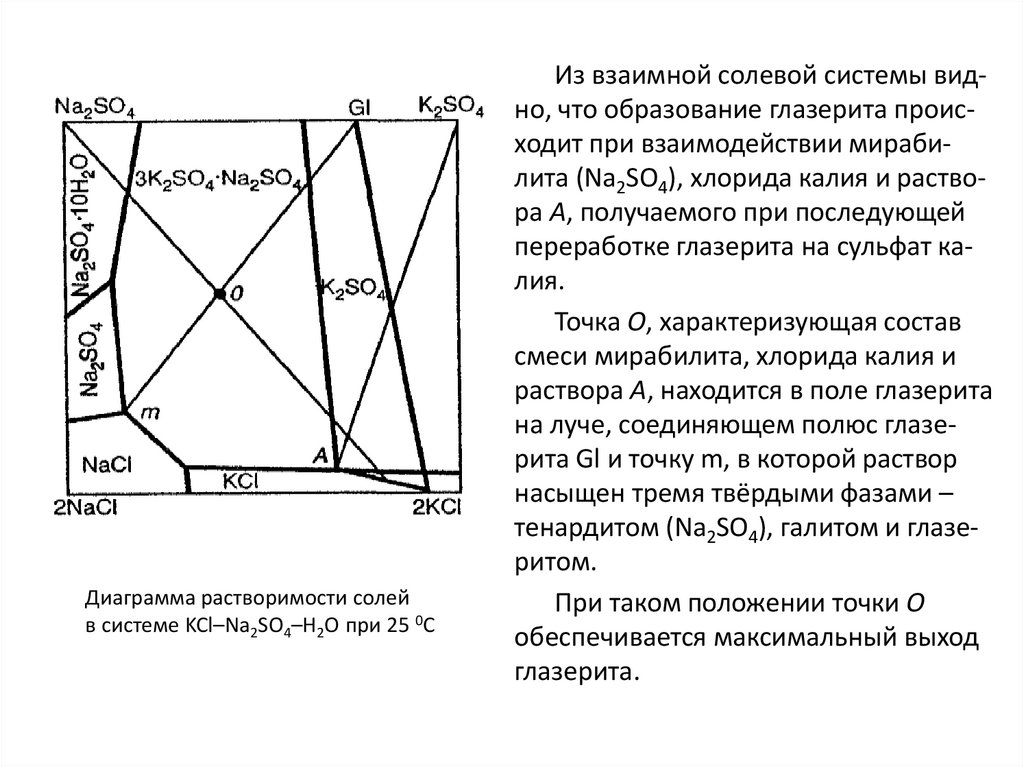
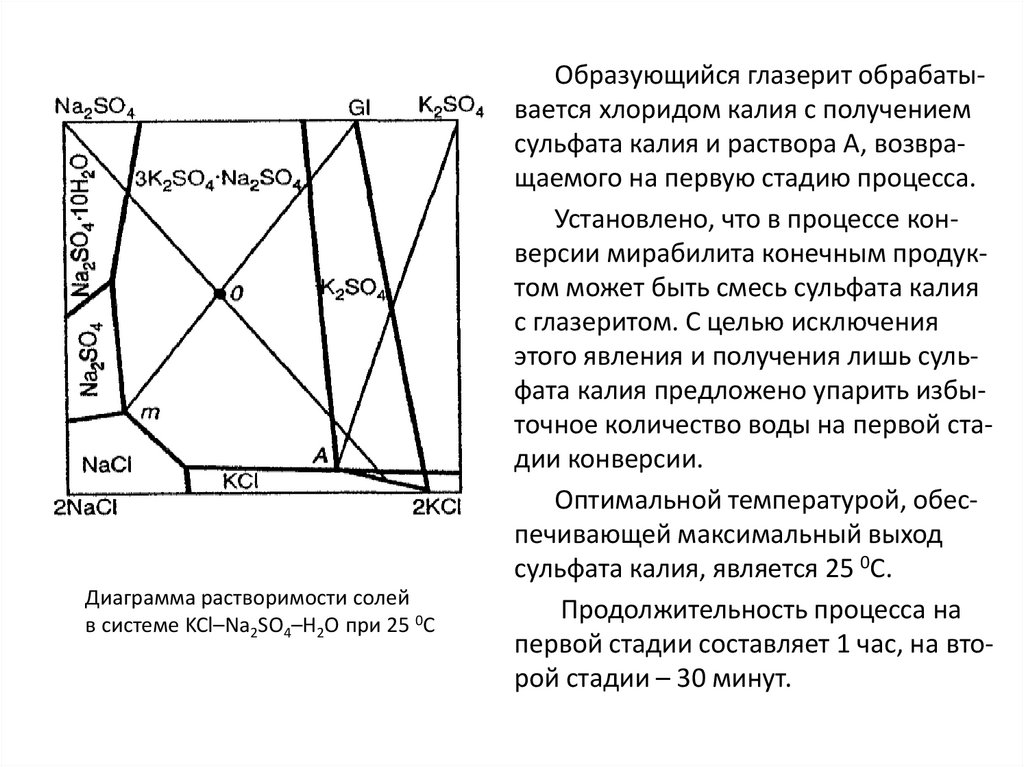
 industry
industry