Similar presentations:
Производство удобрений
1.
Производство удобрений2.
3.
34.
4Классификация минеральных
удобрений
1.органические - содержат питательные элементы в виде органических соединений
(навоз, торф)
2.минеральные – вещества, который содержат питательные вещества в виде
неорганических соединений.
1. Жидкие (дешевле), но перевозить и хранить их не выгодно.
2. Твёрдые:
а) гранулированные (в виде гранул) - используют больше, т.к. не слипаются при
хранении. Труднее вымываются из почвы, не распыляются
б) не гранулированные – дешевле.
5.
5По основному питательному элементу:
- фосфорные
- азотные
- калийные
По числу питательных элементов:
- простые (аморфная селитра)
- комплексные (2 или 3 питательных элемента)
Удобрения делятся на :
- концентрированные, если содержание основных питательных элементов
превышает 37,5%
- неконцентрированные – менее 37,5%
Если содержит смесь разных удобрений- смешанные (тукосмесь), .
Среди производимых удобрений 98% - минеральные удобрения и 2% - органические
удобрения.
Из 98% производимых минеральных удобрений - 50% это азотные удобрения; 30% фосфорные; 18% - калийные.
6.
Производство азотныхудобрений
7.
Азотные удобрения — неорганические иорганические азотосодержащие вещества.
Получают главным образом из синтетического
аммиака.
Азотные удобрения представляют собой
белый или желтоватый кристаллический
порошок (кроме цианамида калия и жидких
удобрений) , хорошо растворимы в воде.
Большинство из них обладает высокой
гигроскопичностью и требует особой упаковки
и хранение.
8.
Азотные удобрения содержат азот втрех основных формах:
1) в форме аммиака, связанного с какой-нибудь минеральной
кислотой, — аммиачные удобрения;
2) в нитратной форме, т. е. в виде солей азотной кислоты,—
нитратные удобрения;
3) в амидной форме—амидные удобрения.
9.
К аммиачным удобрениям относятся: сульфат аммония, хлористыйаммоний, бикарбонат аммония, жидкие аммиачные удобрения.
К аммиачно-нитратным удобрениям относятся: аммиачная селитра
(нитрат аммония, азотнокислый аммоний), известковая селитра
(сульфонитрат аммония, лейна-селитра, монтан-селитра, нитросульфат
аммония).
Нитратные удобрения — натриевая селитра (нитрат натрия,
азотнокислый натрий, чилийская селитра), кальциевая селитра (нитрат
кальция, азотнокислый кальций, известковая селитра, норвежская
селитра), калийная селитра (нитрат калия, азотнокислый калий).
Калийная селитра, кроме азота, содержит калий и является источником
азотно-калийного питания растений.
Амидные удобрения — мочевина (карбамид), цианамид кальция,
мочевино-формальдегидные удобрения. Наиболее ценна мочевина.
10.
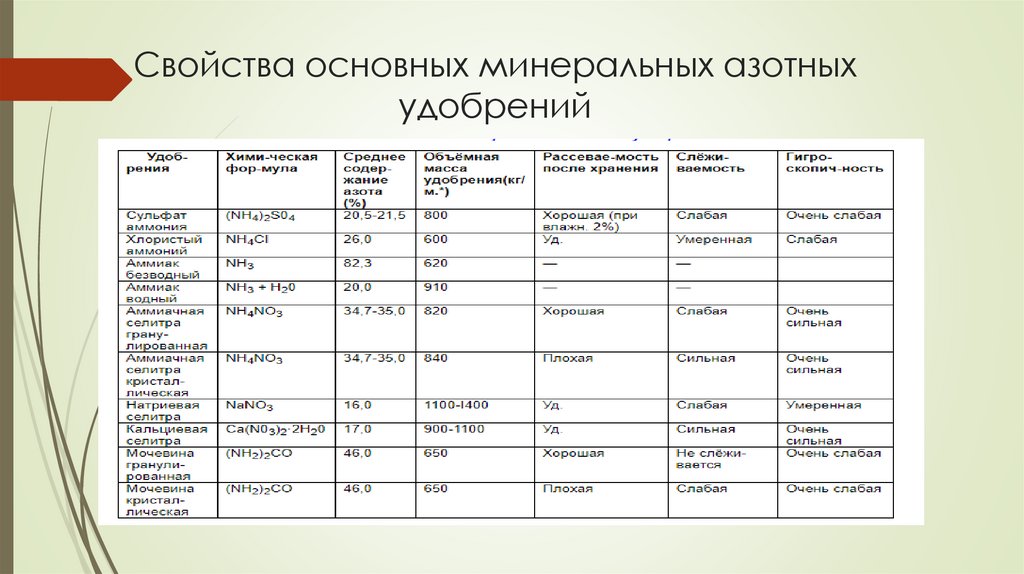
Свойства основных минеральных азотныхудобрений
11.
Аммиачная селитраили нитрат аммония NH4NO3
12.
В основе процесса производства аммиачной селитры лежитгетерогенная реакция взаимодействия газообразного аммиака с
раствором азотной кислоты:
NH3+HNO3 = NH4NO3;
ΔН = —144.9кДж
Принципиальная схема производства:
13.
Схема агрегата аммиачной селитры АС-7214.
Карбамидили мочевина (NH2)2CO
Карбамид белое кристаллическое вещество,
содержащее 46,6% азота, среди азотных
удобрений занимает второе место по объему
производства после аммиачной селитры. Рост
производства карбамида обусловлен широкой
сферой его применения в сельском хозяйстве.
Он обладает большей устойчивостью к
выщелачиванию по сравнению с другими
азотными удобрениями.
15.
Получение карбамида основано на реакции взаимодействияаммиака с диоксидом углерода:
2NH3 + CO2↔ CO(NH2)2 + H2O;
ΔН = —110.1 кДж
На первой стадии происходит синтез
карбамата:
2NH3(г) + CO2(г) ↔ NH2СОО NH4(ж);
ΔН =–125,6кДж
На
второй
стадии
протекает
эндотермический процесс отщепления
воды от молекул карбамата, в результате
которого и происходит образование
карбамида:
NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2 O (ж) ;
ΔН =15,5кДж
16.
Жидкие азотные удобрениярастворы аммиачной селитры;
карбамида;
кальциевой селитры;
их смесей в жидком аммиаке
или в концентрированной
аммиачной воде – так называемые
аммиакаты.
17.
Жидкие азотные удобренияПлюсы
Минусы
обеспечивает возможность ускоренного
строительства азотных заводов по «короткой»
схеме;
в случае большой их концентрации
происходит высаливание, кристаллизация
солей при понижении температуры;
дешевизна;
требуется сооружение резервуаров
большой емкости для хранения жидких
удобрений;
жидкие удобрения не обладают такими
отрицательными свойствами твердых удобрений,
как гигроскопичность, слеживаемость,
обладают повышенными коррозионными
согрегация и т.п
свойствами по отношению к черным
металлам.
18.
Технология производства калийныхудобрений
19.
Минеральными удобрениями называют соли, содержащие в своем составеэлементы, необходимые для питания, развития и роста растений
В качестве калийных удобрений применяют сырые природные вещества (чаще
всего сильвинит) и продукты их переработки (хлорид и сульфат калия; 40%ные калийные соли), а также золу растений.
20.
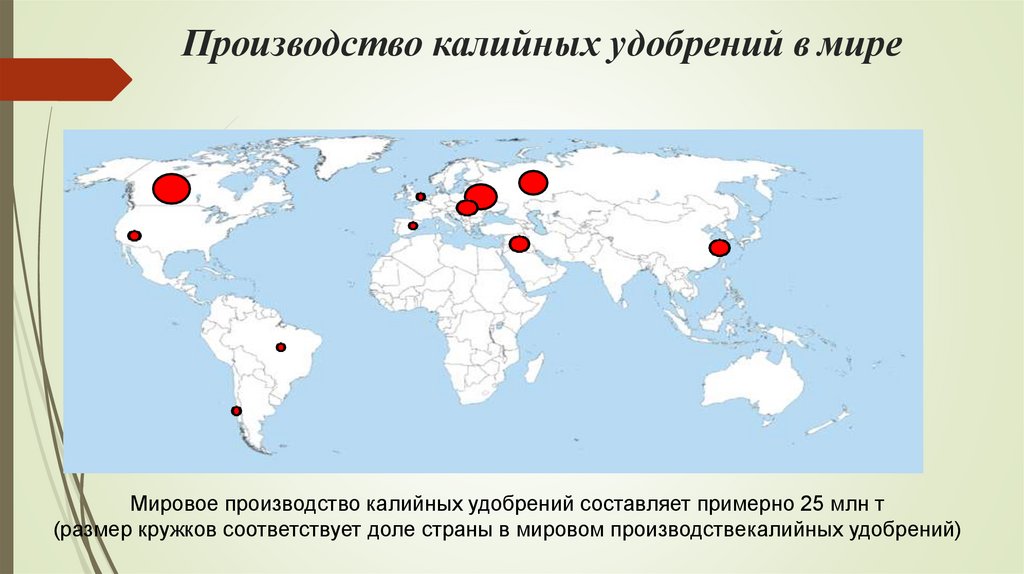
Производство калийных удобрений в миреМировое производство калийных удобрений составляет примерно 25 млн т
(размер кружков соответствует доле страны в мировом производствекалийных удобрений)
21.
Технологии добычи калийных солей• Рудник
•Подземное
выщелачивание
• Выпаривание рассолов
Большая часть залежей располагается на глубине до
1 км , поэтому выработка открытым способом не
практикуется
Мертвое море
the Great Salt Lake
22.
Сырье для производства калийных удобренийВсе коммерческие запасы калийных солей имеют морское происхождение.
1.Залежи твердых калийных солей – высохшие древние моря и океаны.
2.Природные рассолы
23.
Минералы и породыкалийных месторождений
Минерал
Состав
Хлориды:
Сильвинит
Сильвин
Карналит
Каинит
KCl NaCl KCl
KCl MgCl2 6H2O
4KCl 4MgSO4 11H2O
28
63
17
18
Сульфаты:
Полигалит
Лангбейнит
Шенит
K2SO4 2MgSO4 2CaSO4 2H2O
K2SO4 2MgSO4 K2SO4 MgSO4 4H2O
15
22
23
Нитраты:
Калиевая селитра KNO3
Содержание K2O
(%)
46
24.
KCl - наиболее распространенный видкалийных удобрений
• Состав: 60 - 63% K2O; 46%Cl
• Производится из сильвинитовой руды, содержащей
KCl и NaCl
• Стандартный розовый порошок и
гранулы
применяют для прямого внесения в почву.
• Розовый цвет удобрениям придают оксиды железа.
• Стандартный белый порошок применяют для
производства сложных удобрений (NPK), и
фертигации.
25.
Калийный рудникГорные выработки
пород.
прокладываются в
толще
Специальные лифты используются для доставки
оборудования, руды и людей.
26.
Калийный рудникОсновной способ отбойки руды на рудниках – комбайновый. Также применяется
буровзрывной способ добычи руды.
На рудниках работают десятки комбайновых комплексов, приспособленных к выработке в
различных геологических условиях.
27.
Калийный рудникБуровзрывной способ добычи руды
Закладка взрывчатых
веществ
Обвал руды после взрыва
28.
Калийный рудникНа рудниках применяют два вида транспорта – конвейерный и самоходный.
Руда может транспортироваться на много километров от места выработки.
29.
Подготовка руды и измельчение• Раскрытие минералов в результате
разрушения природных сростков
сильвина с галитом и глинистыми
минералами.
• При классификации отсеиваются
минералы с размером зерен на
выходе < 2,0 мм.
30.
ОбесшламливаниеМеханическая очистка руды от
нерастворимых остатков:
•предварительная
очистка
руды от
нерастворимого
остатка.
•шламовая флотация.
Martin
Mraz
Martin
Mraz
31.
Метод галургииоснован на использовании различной растворимости
хлоридов калия и натрия. При совместном
присутствии обеих солей растворимость хлорида
натрия с ростом температуры падает, а KCl - сильно
возрастает. На этих различиях и построены
галургические операции разделения. Из диаграммы
состояния системы КСl—NaCI—H2 O (рис.) видно,
что избирательная кристаллизация КСl возможна из
всех растворов, состав отвечает полю ниже линии
H2 O —E1 (10°С) или H2 O—Е2 (100 ° С)
32.
Если
исходный
раствор
имеет
состав,
отвечающий
точке а, а температура его 100 ° С, то первым из этого раствора
начинает кристаллизоваться КСl (точка b).При понижении
температуры до 10°С состав раствора изменится вдоль линии bd и
часть КСl, а именно ( b-d) моль, кристаллизуется. Когда такими
последовательными
операциями
нагревания—охлаждения
системы придет в составу, отвечающему точке k, то при низкой
температуре из этого раствора будет выкристаллизовываться КСl,
а при высокой (точка k') — уже хлорид натрия.
Поэтому при получении хлорида калия сильвинит при
повышенной температуре обрабатывают насыщенным на холоду
раствором обеих солей. При этом раствор обогащается КСl, а
часть NaCl переходит в осадок и отделяется фильтрованием. Затем
раствор охлаждают; при этом из него выделяются
кристаллы КСl, которые отделяют от маточного раствора и
высушивают. Маточный раствор снова направляют на растворение
сильвинита. Получаемый таким способом технический продукт
содержит 52—60% K2O.
33.
Флотация• Флотационное разделение хлористого калия и хлористого натрия основано на селективной
гидрофобизации поверхности частиц хлористого калия (различной смачиваемости водой
KCl и NaCl), которое обеспечивается специальными реагентами – аминами.
• Амины создают условия для закрепления частиц хлористого калия на пузырьках воздуха и
извлечения их в пенный продукт.
KCl
`
NaCl
34.
ФлотацияПузырьки воздуха вместе с минералами KCl
всплывают на
поверхность,
образуя пену.
После флотации содержание полезного вещества
в концентрате (К2О) увеличивается до 60%.
35.
Финальныестадии:
обезвоживание,
классификация и обработка реагентами
сушка,
• В процессе обезвоживания влажность концентрата снижается до 5%.
• После сушки влажность снижается с 5% до 0,1 %.
• Высушенный концентрат обрабатывается специальными реагентами – антислеживателем и
пылеподавителем.
36.
Производство гранул• Прессование нагретого
мелкозернистого
хлористого
калия в валковых прессах с
последующим дроблением
спрессованной
плитки, классификацией дробленного продукта
и «облагораживанием».
37.
Применение калийных удобрений в основныхрегионах мира, % (2009)
Западная Европа
Другие страны Азии
Китай
7
21
12
Индия 14
17 Другие страны
14
Бразилия
Источник информации: IFA, Fertecon,PCS
15
США
38.
Основные фосфорные удобрения:1. простой суперфосфат
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Ca3(PO4)2 + 4H3PO4 →3Ca(H2PO4)2
Ca3(PO4)2 + 2H2SO4 →Ca(H2PO4)2 + 2CaSO4 – балласт (недостаток)
CaSO4 – отделять не выгодно, дорого и тяжело
2.
Двойной суперфосфат
Ca3(PO4)2 + 4H3PO4 → 3Ca(H2PO4)2 Смешивают с фосфорной кислотой " чисто удобрение
без балласта. Фосфорная кислота дороже серной " это удобрение дорогое.
3.
Преципитат
CH2O + CaCO3 + H3PO4 → CO2 + 2H2О + CaHPO4 (водный раствор).
Можно использовать как в жидком состоянии, так и в гранулированном.
4.
Фосфоритная мука.
Ca3(PO4)2 подвергается тонкому измельчению (как мука)




































 chemistry
chemistry industry
industry








