Similar presentations:
Анализ катионов и анионов. Лекция № 2
1. Лекция № 2. «Анализ катионов и анионов»
2. Рассматриваемые вопросы
1. Аналитические реакции и способы ихвыполнения
2. Дробный и систематический анализ
3. Методы повышения чувствительности
реакций
4.Аналитическая классификация катионов
5. Аналитическая классификация анионов
3. 1. Аналитические реакции и способы их выполнения
Аналитическая (или качественная) реакция— это химическая реакция, с помощью
которой обнаруживают (открывают или
идентифицируют) тот или иной ион в
растворе. Следовательно, такая реакция
должна
сопровождаться
каким-либо
внешним, видимым эффектом:
1.
Образование
малорастворимых
соединений;
2. Изменение окраски раствора;
3. Образование и выделением газов.
4.
Наименьшее содержание определяемого компонента(Сх), при котором его можно обнаружить данным
методом с заданной доверительной вероятностью
(Р), называют пределом обнаружения.
Пусть предел обнаружения равен 10-4 г при
доверительной вероятности Р=0,95. Это означает,
что при содержании 10-4 г определяемого компонента
в анализируемой пробе в 95 опытах из 100 получают
правильный результат, т.е. обнаруживают искомый
компонент.
Если Сх > 10-4 г, то вероятность обнаружения
становится выше. Если содержание вещества в
пробе меньше предела обнаружения, то его нельзя
обнаружить данным методом.
5.
Аналитическаячувствительнее,
обнаружения.
реакция
чем ниже
тем
предел
Предел обнаружения зависит от:
- концентрации реагентов;
- присутствия посторонних ионов;
- электролитов или мешающих веществ,
среды;
- температуры растворов.
6.
Классификация аналитических реакций:NH4+ + OH- NH3 + H2O
7.
8.
Взависимости
от
количества
исследуемого
вещества,
объема
раствора
и
техники
выполнения
операций
аналитические
методы
качественного анализа подразделяют
на макро-, микро- и полумикрометоды.
9.
1. Макрометод - наиболее старый методхимического анализа, при котором для анализа берут
сравнительно большие количества вещества и
реактивов: 1 г сухого вещества или 20-30 мл реактива,
2. Микрометод - при этом методе для
исследования берут примерно в 100 раз меньшие
количества вещества, чем в макрометоде: 5-10 мг
сухого вещества или 0.2-0.3 мл раствора. При
микрометоде
используют
высокочувствительные
реакции – микрокристаллоскопические и капельные,
которые проводят на предметном стекле, а о наличии
определяемого вещества судят по форме кристаллов,
рассматривая их под микроскопом,
10.
3.Полумикрометод
занимает
промежуточное
положение между макро- и микрометодом. Для анализа
берут: 50 мг сухого вещества или 0.1-1.0 мл раствора.
Применяют в основном те же реакции, что и при
макрометоде, но выполняют их с меньшим количеством
реагирующих веществ. Этот метод анализа наиболее
удобен, так как требует наименьших затрат, времени,
реактивов и оборудования.
Анализируемые вещества могут находиться в различных
агрегатных
состояниях
(твердом,
жидком
и
газообразном). Соответственно этому и качественные
аналитические реакции могут быть выполнены „сухим”
или „мокрым” путем.
11.
Анализ сухим путем осуществляют с помощью такихприемов, как проба на окрашивание пламени,
получение цветных стекол („перлов”) и рассмотрение
металлических “корольков”. Эти приемы называют
пирохимическими (от греч. „пир” - огонь).
При выполнении окрашивания в пламени пробы,
исследуемое вещество на петле платиновой (или
нихромовой) проволочки вносят в бесцветное пламя
горелки. По характерной окраске пламени узнают о
присутствии того или иного элемента.
Например, натрий окрашивает пламя в ярко желтый
цвет, калий - в фиолетовый, медь и бор - в яркозелёный, свинец и мышьяк – в бледно-голубой.
12.
Окрашенные стекла, или перлы, приготовляютсплавлением исследуемого вещества с бурой
Na2B407•10H2O (или с гидрофосфатом натрия-аммония
NaNH4HPO4•4Н2О) в ушке платиновой проволочки над
пламенем. Окраска перла указывает на присутствие
того или иного металла. Например, хром окрашивает
перл буры в зеленый цвет, кобальт - в синий, марганец
- в фиолетовый.
Металлические
корольки
получаются
при
прокаливании
анализируемых
минералов
на
древесном угле с помощью паяльной трубки. По
внешнему виду их также можно судить о составе
испытуемого материала.
13.
Анализ „сухим” путем используют главным образом вполевых
условиях
для
качественного
или
полуколичественного исследования минералов и
руд.
В лабораторных условиях обычно применяют анализ
„мокрым” путем, который основан на реакциях в
растворах. Естественно, что при этом исследуемое
вещество должно быть сначала переведено в
раствор.
Если
оно
не
растворяется
в
дистиллированной воде, то используют уксусную,
соляную, азотную и другие кислоты.
14.
Техника выполнения аналитических реакцийПо технике выполнения анализа все реакции
обнаружения можно разделить на три группы:
пробирочные,
капельные
и
микрокристаллоскопические.
1) Пробирочные реакции выполняются путем
смешивания анализируемого раствора с реагентами в
пробирке. При этом объемы растворов обычно
составляют 1-3 капли. Приливать растворы в пробирку
следует пипеткой (вакуумным капилляром), не касаясь
стенок пробирки во избежание возможных загрязнений
реактива. Растворы необходимо перемешивать
стеклянной палочкой.
14
15.
2) Капельные реакции выполняются намаленьком листочке фильтровальной бумаги,
имеющем треугольную форму. На кусочек
бумаги наносят каплю исследуемого раствора.
Затем рядом с нанесенной каплей, на
расстоянии 1-1,5 мм наносят каплю реактива.
В
месте
перекрывания
двух
капель
наблюдают
окраску
образующегося
соединения и делают соответствующий
вывод.
15
16.
3)Микрокристаллоскопические
реакции
(мкс)
выполняются на предметном стекле, которое
должно быть тщательно вымыто, ополоснуто
дистиллированной водой и насухо вытерто
фильтровальной бумагой.
Из капилляра-пипетки
выдавливают небольшую каплю исследуемого
раствора. Рядом с ней на расстоянии 2-3 мм
помещают такую же каплю реагента. Затем с
помощью чистой стеклянной палочки соединяют
обе капли и помещают стекло на предметный
столик микроскопа так, чтобы место слияния
капель оказалось под объективом. Отмечают
форму и цвет кристаллов, поскольку именно это
служит основанием для заключения о присутствии
или отсутствии иона.
16
17.
Условия выполнения аналитических реакцийЧеткий и однозначный результат анализа может
быть получен только при соблюдении строго
обозначенных условий проведения реакции.
1. Кислотность раствора.
Многие реакции требуют определенной
раствора, выражаемой значением рН.
среды
Ca2+ + C2O42- CaC2O4 - осадок белого цвета.
В кислой среде осадок не образуется:
C2O42- + H+ НC2O4Ag+ + Cl- AgCl - в кислой среде осадок белого
цвета.
В щелочной среде: AgOH → AgO .
17
18.
Проверить среду или значение рН можнос помощью индикаторных бумаг.
Лакмусовая индикаторная бумага бывает
красной и синей. При нанесении капли
испытуемого раствора на красную лакмусовую
бумагу она окрашивается в синий цвет, если
среда раствора щелочная, и остается красной
в кислой среде.
Синий лакмус, наоборот, краснеет в кислой
среде.
18
19.
19Более подробную информацию дает
бумага,
пропитанная
универсальным
индикатором (УИ). При смачивании ее
анализируемым раствором она окрашивается
в разные цвета, которые обозначены на шкале
стандартов,
прилагаемой
к
упаковке
универсального индикатора.
Сравнивая цвет пятна на бумаге со
шкалой, можно определить не только среду
раствора, но и примерное значение рН в
пределах от 1 до 12. Сравнение со
стандартной
шкалой
УИ
необходимо
проводить сразу, иначе цвет пятна со
временем может измениться.
20.
2) Температура раствора.Многие реакции идут при нагревании, о чем
обязательно
говорится
в
руководстве.
Нагревания требуют все реакции растворения
осадков,
часто
окислительновосстановительные
реакции,
реакции
с
выделением газов и другие.
Pb2+ + 2Cl- PbCl2
осадок белого цвета, растворяется в
горячей воде.
Нагревание проводят в пробирках,
помещаемых
в
водяную
баню,
при
перемешивании.
20
21.
3) Количество добавляемого реагента.В отношении количества реактивов надо
строго придерживаться прописи.
Hg2+ + 2I- HgI2
осадок красного цвета, растворяется в
избытке KI.
HgI2 + 2I- HgI42- - бесцветный раствор.
Нужно прибавлять разбавленный раствор KI
по каплям.
21
22.
2. Дробный и систематический анализКачественный
анализ
Дробный
Систематический
23.
Специфическиереакции
позволяют
обнаруживать
ион
в
отдельной
порции
анализируемого
раствора,
не
считаясь
с
присутствием
других
ионов.
При
этом
последовательность обнаружения ионов может
быть произвольной.
Дробным
анализом называют обнаружение
ионов с помощью специфических реакций в
отдельных порциях анализируемого раствора,
производимое в любой последовательности.
24.
Дробный анализ применяют агрохимические и заводскиелаборатории, особенно в тех случаях, когда состав
исследуемого материала достаточно хорошо известен и
требуется только проверить отсутствие некоторых
примесей.
Если же используемые реакции не специфичны, а
мешающее действие посторонних ионов устранить не
удается, то проведение дробного анализа невозможно. В
этом случае применяют систематический ход анализа.
Сисmемаmическим
ходом
анализа называется
определенная
последовательность
выполнения
аналитических реакций, при которой каждый ион
обнаруживают после того, как будут обнаружены и
удалены другие ионы, мешающие его обнаружению.
25.
+ 2NH4ClДопустим, что раствор нужно испытать на
присутствие катиона Са2+, но в нем одновременно может
содержаться и ион Ва2+. Катион Са2+ принято
обнаруживать в виде оксалата: CaCl2 + (NH4)2С2О4 =
СаС2О4 + 2NH4Cl
Эта реакция достаточно чувствительна, но не
специфична, так как оксалат аммония дает белый
кристаллический осадок не только с ионами кальция, но
также с ионами бария и некоторыми другими ионами.
Поэтому, прежде чем обнаруживать катион кальция,
необходимо проверить, присутствует ли в растворе
мешающий ион бария, действуя хроматом калия, с
которым катион бария дает характерный желтый осадок:
BaCl2 + К2Сг04 = ВаСг04↓ + 2KCl
26.
Присутствие иона Са2+ не мешает обнаружению ионаBа2+ этой реакцией, так как хромат кальция СаСгО4
хорошо растворим в воде (выпадает в осадок только
из очень концентрированных растворов солей
кальция).
Дальнейший ход анализа зависит от результата
проведенного испытания. Если окажется, что ион Bа2+
отсутствует, то в другой порции раствора можно
обнаруживать катион Са2+, действуя оксалатом аммония (NH4)2С2О4.
Если же катион Bа2+ присутствует, то прежде чем
обнаруживать Са2+, следует полностью удалить из
раствора ионы Bа2+.
27.
Для этого на весь раствор действуютизбытком хромата калия К2Сr04 (или
дихромата калия К2Сr207), убеждаются, что
ионы Bа2+ полностью осаждены в виде
хромата бария BaСrО4 и, отделив осадок,
беспрепятственно обнаруживают катионы
Са2+.
Следовательно, в систематическом
ходе
анализа применяют не только реакции
обнаружения отдельных ионов, но также и
реакции отделения их друг от друга.
28. 3. Методы повышения чувствительности реакций
При проведении химического анализа часто приходитсярешать задачи по открытию или определению данного
вещества либо в присутствии других веществ, либо
тогда, когда концентрация определяемого вещества
очень мала (иногда — ниже определяемого минимума),
либо в таких случаях, когда и концентрация
определяемого вещества незначительна и имеются
примеси мешающих веществ.
В подобных ситуациях необходимо осуществлять
разделение или концентрирование веществ.
29.
Разделение — это операция (процесс), в результатекоторой композиты, составляющие исходную смесь,
отделяются друг от друга. При этом концентрации
разделяемых компонентов могут быть одинаковыми и
различными.
Концентрирование — это такая операция (процесс), в
результате корой повышается отношение концентрации
(количества)
микрокомпонента
к
концентрации
(количеству) макрокомпонента (или основы).
Под
микрокомпонентом
и
макрокомпонентом
подразумевают
составные
компоненты
смеси,
находящиеся соответственно в микроколичестве и в
макроколичестве.
30.
Различаютабсолютное
концентрирование
и
относительное конценmpupoeaнue
Абсолютное концентрирование — это перевод
микрокомпонента из большой массы (или большого
объема) образца в малую массу (или в малый объем).
При этом повышается концентрация микрокомпонента.
Относительное концентрирование (обогащение) —
это увеличение соотношения между количествами
микрокомпонента и макрокомпонента.
К микрокомпонентам в этом случае относится и
растворитель.
Относительное
концентрирование
можно
рассматривать как частный случай разделения, в
результате которого концентрации компонентов смеси
оказываются резко различными.
31.
Методы разделения и концентрирования основаны наиспользовании различий в свойствах компонентов
анализируемой системы, таких, как растворимость,
температура кипения, скорость движения частиц во
внешнем электрическом поле, сорбция и др.
К числу наиболее распространенных методов
разделения
и
концентрирования
относятся
следующие:
Методы
испарения
(упаривание,
перегонка,
сублимация)
основы,
в
которой
содержится
концентрируемый компонент.
Обычно различают упаривание и выпаривание.
Упаривание — испарение основы, при котором часть
ее остается в системе по окончании процесса
испарения. Выпаривание (досуха) — испарение
основы, при котором последняя удаляется полностью.
32.
Озоление—
метод,
при
котором
исходный
анализируемый материал путем термической обработки
на воздухе превращают в минеральный остаток — золу.
Применяют тогда, когда определяемый компонент (например, металлы-микроэлементы) распределен в
большой массе сгораемой основы.
Метод часто используют при анализе растительного
лекарственного сырья — осторожно сжигают на воздухе
сухую массу сырья.
33.
При сухом озолении анализируемый образец (1—5 г)помещают
в
фарфоровый,
кварцевый
или
платиновый тигель, медленно нагревают, не
допуская бурного удаления продуктов сгорания,
после их выгорания и улетучивания осторожно
прокаливают остаток при красном калении (~ 500 С °)
до постоянной массы тигля с зольным остатком,
охлаждают (тигель в эксикаторе при комнатной
температуре
каждый
раз
перед
очередным
взвешиванием.
В случае неполного сгорания углеродсодержащих
частиц остаток охлаждают, прибавляют к нему
небольшой объем воды или насыщенного раствора
нитрата аммония NH4NO3, выпаривают воду (на
водяной бане) и сухой остаток прокаливают. Эту
операцию при необходимости повторяют.
34.
Примокром
озолении
исходную
навеску
анализируемого
вещества,
помещенную
в
фарфоровый
тигель,
обрабатывают
раствором
соответствующего реактива (например, смачивают
небольшим объемом концентрированной серной
кислоты), медленно нагревают для удаления летучих
продуктов и растворителя, после чего осторожно
прокаливают остаток (при ~ 500 °С, красное каление)
до постоянной массы.
Операцию
при
необходимости
повторяют.
В
полученном зольном остатке открывают и определяют
подходящими методами те или иные компоненты.
35.
Чувствительность реакции зависит от многихфакторов и может быть повышена, если тем или
иным
способом
увеличить
концентрацию
обнаруживаемого иона в растворе.
Обогатить раствор обнаруживаемым ионом и,
следовательно, повысить чувствительность реакции
можно с помощью ионного обмена, экстрагирования
соединений органическими растворителями, путем
соосаждения, дистилляции, электролиза, удаление
примесей, мешающих выполнению реакции и т. п.
36.
Метод ионного обмена. Для концентрированияионов этим методом в качественном анализе
используют так называемые ионообменные смолы
(иониты). Одни из них поглощают из раствора
катионы и называются катионитами, другие
сорбируют анионы и именуются анионитами.
Процесс ведут либо в статических условиях, внося
зерна ионита в исследуемый раствор, либо в
динамических, пропуская анализируемый раствор
через “колонку” - трубку, наполненную ионитом. При
этом каждое зерно ионита накапливает в себе
обнаруживаемый ион. Этот метод позволяет
повысить чувствительность многих реакций в десятки
и сотни раз.
37.
Метод экстрагирования. Экстрагирование - это одиниз видов фазового разделения веществ. Оно основано
на том, что некоторые органические растворители, не
смешивающиеся с водой, обладают способностью
извлекать из водных растворов отдельные компоненты
смесей.
Для экстрагирования подбирают такой органический
растворитель, в котором определяемое вещество
растворяется хорошо, а другие компоненты смеси
практически не растворяются.
Смесь двух жидкостей и растворенного вещества
встряхивают, после чего оставляют стоять до появления
резкой границы раздела между жидкостями. Из
полученного экстракта определяемое вещество выделяют выпариванием, высушиванием, перегонкой или
кристаллизацией.
38.
Метод соосаждения. В раствор, содержащий следыопределяемого иона, вводят посторонний катион
(или анион), который и осаждают подходящим
реактивом в виде малорастворимого соединения.
При этом соосаждаются и следы определяемого
иона. Таким образом, получающийся осадок играет
роль коллектора, т. е. собирателя определяемых
ионов. Установлено, что чем меньше концентрация
определяемого иона в растворе, тем полнее он
сорбируется коллектором.
Причины соосаждения определяемых ионов с
коллекторами различны: адсорбция соосаждаемых
ионов на поверхности коллектора, ионный обмен,
образование твердых растворов.
39.
Ваналитической
практике
используются
как
неорганические (гидроокиси алюминия и железа,
фосфат железа), так и органические соосадители
(малорастворимые соединения ионов органических
веществ,
например
метилового
фиолетового,
метилового оранжевого, нафталин,α -сульфокислоты,
диметиламиноазобензола). Предпочтение отдается
органическим соосадителям, которые позволяют
выделять определяемые ионы из растворов с
концентрацией до 1 : 1013 и отличаются высокой
селективностью.
Кроме
того,
органические
соосадители легко озоляются, благодаря чему
соосаждаемые элементы удается получить в чистом
виде.
40.
Электрохимические методы. Для разделения иидентификации компонентов смесей применяют
методы
электрофореза
(электрофоретические
методы), основанные на использовании различий в
скоростях движения заряженных частиц растворенных
веществ во внешнем электрическом поле.
Перемещаясь с различными скоростями под
действием
внешнего
электрического
поля,
заряженные частицы (ионы) в конце концов,
разделяются на зоны, каждая из которых содержит
ионы одинаковой природы. Эти зоны можно затем
идентифицировать различными способами.
41.
Электрофорезпроводят
либо
в
свободной
незакрепленной среде (в свободной жидкости) —
фронтальный электрофорез, либо в закрепленной
среде —
зональный электрофорез — на крупнопористых
носителях фильтровальная бумага, целлюлоза,
порошкообразная
пластмасса,
агар-агар,
ацетилцеллюлоза, стеклянный порошок) или на
мелкопористых
носителях
(силикагель,
полиакриламидный гель, целлюлоза, оксид алюминия,
крахмал и др.).
42.
4. Аналитическая классификация катионовВ настоящее время существуют пять методов
классификации ионов. Это сероводородный, аммиачнофосфатный, дифталатный, тиоацетамидный и
кислотно-основной методы.
Сероводородный
метод
основан
на
различной
растворимости сульфидов, хлоридов и карбонатов.
В дифталатном методе для разделения групп ионов
используют дифталат калия с гидроксидом калия или
натрия.
Тиоацетамидный метод основан на применении в
качестве
группового
реагента
тиоацетамида,
хлороводородной кислоты и карбоната аммония.
В кислотно-основном методе основными реагентами
являются кислоты HCl и H2SO4, гидроксиды калия и
натрия и водный раствор аммиака.
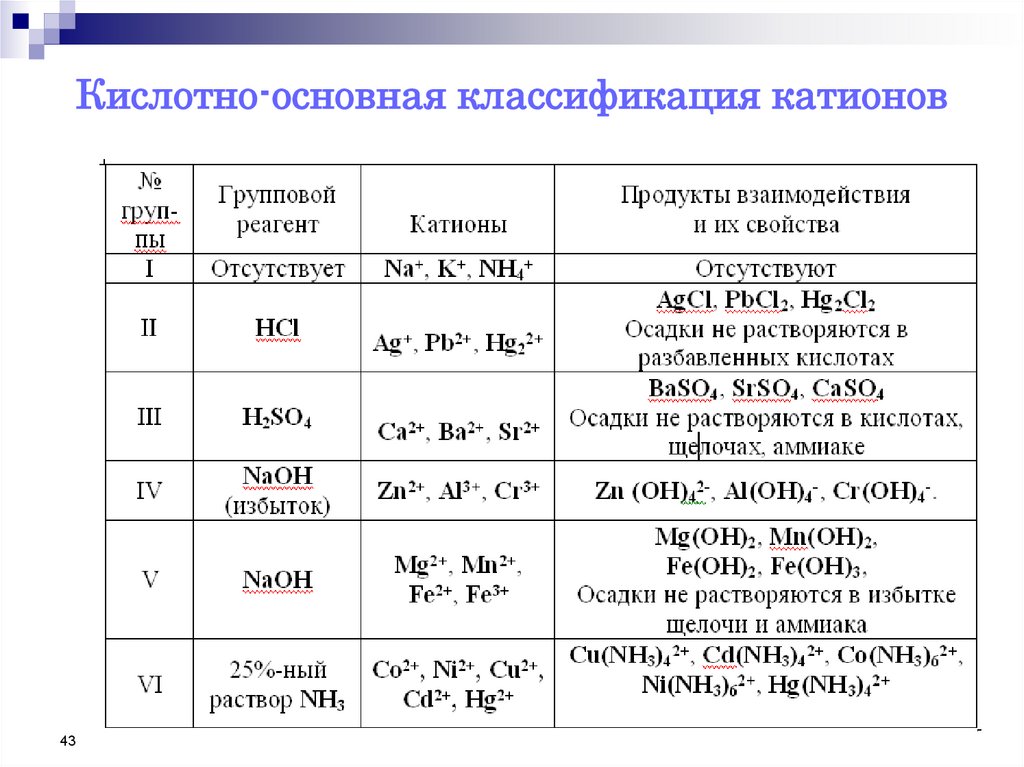
43. Кислотно-основная классификация катионов
4344.
Достоинства кислотно-основнойклассификации:
1)
Использует
основные
свойства
элементов – отношение к кислотам и
щелочам,
способность
к
комплексообразованию,
амфотерность
гидроксидов.
2)
Аналитические
группы
в
этой
классификации ближе совпадают с группами
периодической системы.
3) Метод более экспрессный по сравнению
с сероводородным и менее токсичный.
44
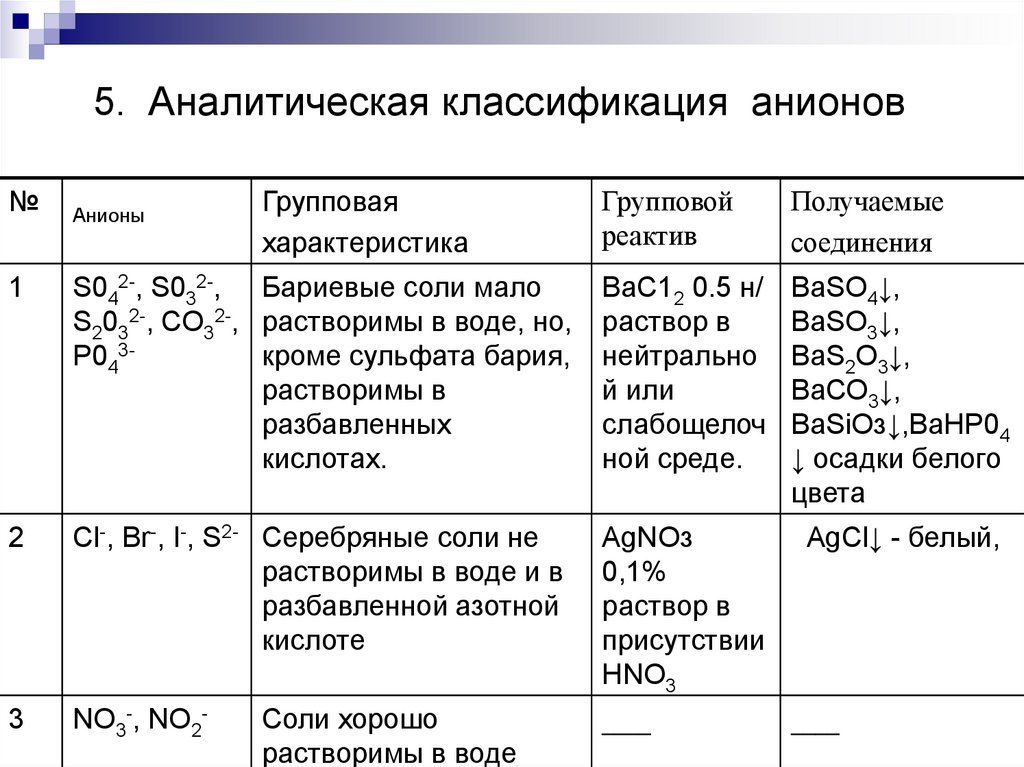
45. 5. Аналитическая классификация анионов
№Анионы
Групповая
характеристика
Групповой
реактив
Получаемые
соединения
1
S042-, S032-, Бариевые соли мало
S2032-, СО32-, растворимы в воде, но,
Р043кроме сульфата бария,
растворимы в
разбавленных
кислотах.
ВаС12 0.5 н/
раствор в
нейтрально
й или
слабощелоч
ной среде.
ВаSО4↓,
ВаSО3↓,
ВаS2О3↓,
ВаСО3↓,
ВаSiOз↓,ВаНР04
↓ осадки белого
цвета
2
Сl-, Вr-, I-, S2- Серебряные соли не
растворимы в воде и в
разбавленной азотной
кислоте
АgNОз
0,1%
раствор в
присутствии
НNО3
АgCl↓ - белый,
3
NО3-, NО2-
Соли хорошо
растворимы в воде
────
────










































 chemistry
chemistry








