Similar presentations:
Катионы. Анионы
1.
ИОНРЕАГЕНТ
УРАВНЕНИЕ РЕАКЦИИ И
УСЛОВИЯ
Fe3+
ПРОВЕДЕНИЯ
АНАЛИТИЧЕСКИЙ
ЭФФЕКТ
NaOH
FeCl3 + 3NaOH = Fe(OH)3 +3NaCl
Образование
бурого осадка
NaOH изб
FeCl3 + 3NaOH = Fe(OH)3 +3NaCl
NH4OH
FeCl3 + 3NH4OH = Fe(OH)3 +3NH4Cl
NH4OHизб
FeCl3 + 3NH4OH = Fe(OH)3 +3NH4Cl
Осадок не
растворяется в
избытке NaOH
Образование
бурого осадка
Осадок не
растворяется в
избытке NH4OH
4FeCl3 + 3 K4[Fe(CN)6] = Fe4[(CN)6]3 +12KCl
K4[Fe(CN)6]
рН = 2
Образуется темносиний осадок
берлинской
лазури
2.
Катионы+
+
2+
2+
NH4 ; K ; Ca ; Ba ;
2+
3+
2+
3+
2+
Zn ; Al ; Fe ; Fe ; Mn ;
2+
2+
2+
Co ; Ni ; Cu
2+
Pb .
3.
Анионы223Cl , SO4 , CO3 , PO4 , NO3
4.
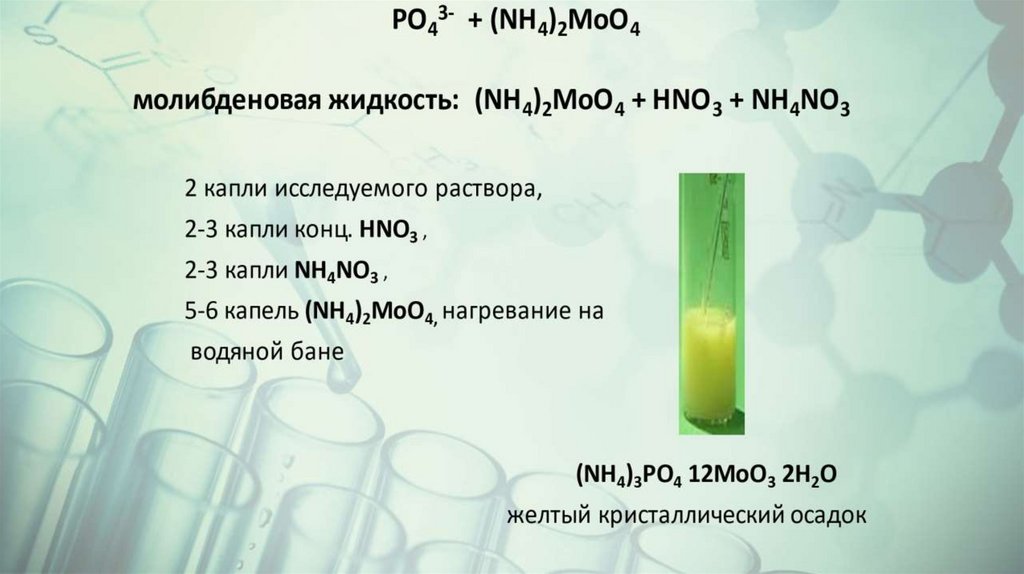
Качественные реакции на анионыSO42BaCl2+HCl
ClAgNO3 +HNO3
PO43AgNO3
CO32-
HCl;
MeCO3+HCl
Ba(OH)2
Ba(OH)2
5.
6.
Значение рН для солей фосфорнойкислоты
Na3PO4
pH 12,1 (NH4)3 PO4
Na2HPO4
pH 8,9
NaH2PO4 pH 4,7
9,4
(NH4)2 H PO4 8,0
NH4H2PO4
4,4
7.
8.
Идентификация индивидуальных солей1.По цвету анализируемой соли делаем вывод о присутствии или отсутствии в
ней катионов, обладающих специфической окраской.
2. Устанавливаем присутствие в анализируемом веществе карбонат- ионов.
Для этого небольшое количество препарата помещаем на предметное стекло
и добавляем 1-2 капли раствора соляной кислоты. Если заметно выделение
газа, то с помощью специфической реакции в двухколенной пробирке
подтверждаем присутствие карбонат- ионов в анализируемом веществе.
3. Переводим анализируемое вещество в раствор.
Растворяем в
а) холодной дистиллированной воде; б) дистиллированной воде при
нагревании;
в) растворе уксусной кислоты.
Если вещество растворяется в холодной воде, то пункты б) и в) не выполняют.
9.
4.Идентификация катиона.5.Идентификация аниона.
Пример 1.
Анализируемая соль белого цвета, следовательно,
отсутствуют
катионы , образующие окрашенные соли.
Определяем возможное присутствие карбонат-ионов.
HCl →
Добавление нескольких капель HCl не привело к
образованию пузырьков газа. Следовательно,
карбонат-ионы отсутствуют.
10.
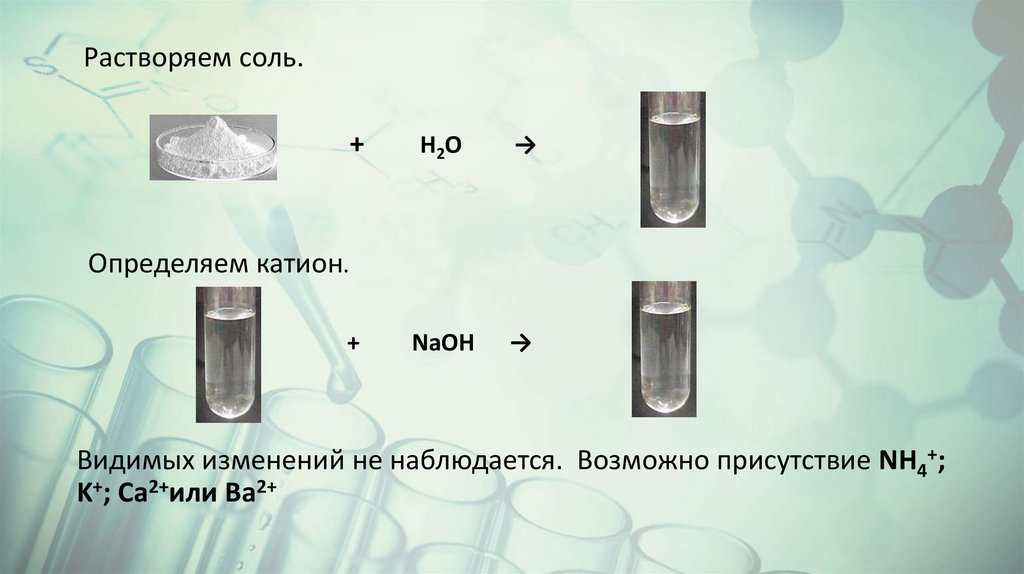
Растворяем соль.+
H2O
→
NaOH
→
Определяем катион.
+
Видимых изменений не наблюдается. Возможно присутствие NH4+;
K+; Ca2+или Ba2+
11.
Обнаружение ионов NH4+.Реакция в газовой камере. Аналитического эффекта нет. Ионы
NH4+ отсутствуют.
Обнаружение ионов K+ .
+ СH3COOН +Na3[Co(NO2)6] →
Образование желтого осадка свидетельствует о присутствии в
растворе ионов K+ .
12.
Определяем анион+ AgNO3
→
+ HNO3
→
Осадок не растворился в сильной кислоте, значит присутствуют ионы Cl- .
Вывод: анализируемая соль - KCl.
13.
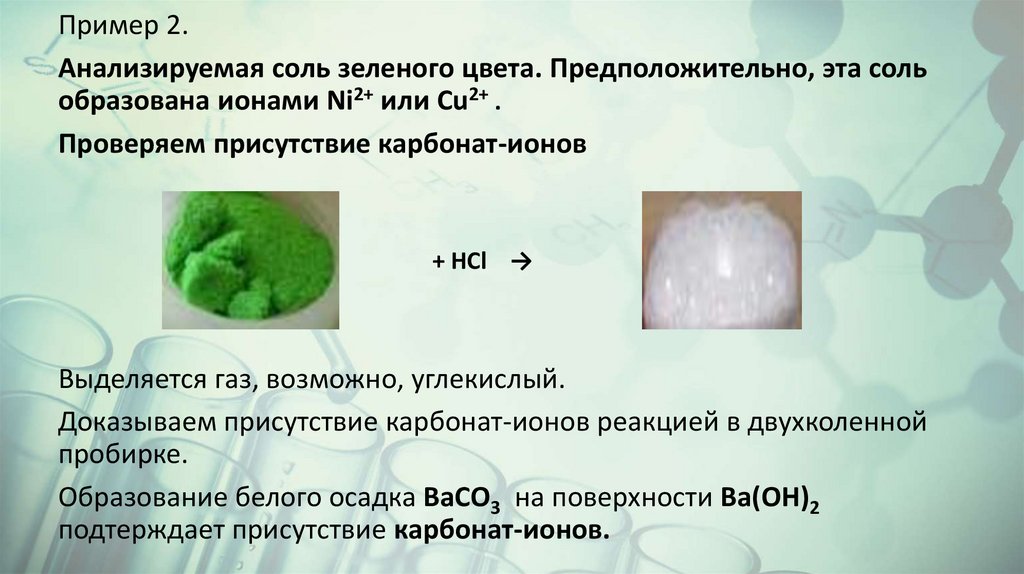
Пример 2.Анализируемая соль зеленого цвета. Предположительно, эта соль
образована ионами Ni2+ или Cu2+ .
Проверяем присутствие карбонат-ионов
+ HCl →
Выделяется газ, возможно, углекислый.
Доказываем присутствие карбонат-ионов реакцией в двухколенной
пробирке.
Образование белого осадка BaCO3 на поверхности Ba(OH)2
подтерждает присутствие карбонат-ионов.
14.
Растворяем соль.В холодной воде и при нагревании соль не растворяется.
При действии CH3COOH образуется раствор зеленого цвета.
Предположительно, соль образуют ионы Ni2+.
+ NaOH →
15.
+ NH4OHизбыток →
+ NH4OH + ДМГ →
Вывод: анализируемая соль - NiCO3
16.
Задача 1 .Анализируемая соль белого цвета. Добавление нескольких
капель HCl к сухой соли вызвало выделение пузырьков газа.
Такая же реакция в двухколенной пробирке привела к
образованию белого осадка на поверхности Ba(OH)2 . В воде соль
растворилась. При добавлении к раствору анализируемой соли
NaOH аналитический эффект не наблюдался. В результате
реакции в «газовой камере» полоска универсального индикатора
окрасилась в зеленый цвет.
Из какого катиона и аниона состоит анализируемая соль?
17.
Задача 2.Для анализа получена соль белого цвета. При действии HCl на
сухую соль газ не выделялся. Соль растворилась в воде. К
небольшой порции полученного раствора добавлен раствор
NaOH. Выпал белый осадок, который постепенно приобретал
бурую окраску. В избытке NaOH осадок не растворился. После
добавлении к осадку H2O2 осадок стал черного цвета. Добавление
к новой порции раствора соли раствора AgNO3 в присутствии HNO3
привело к образованию белого осадка.
Какой состав анализируемой соли?
18.
Задача 3.Анализируемая соль зеленого цвета. При действии HCl на сухую
соль газ не выделялся. Соль растворилась в воде. Раствор
окрашен в голубой цвет. К небольшой порции полученного
раствора добавлен раствор NaOH. Выпал осадок синего цвета ,
который не растворился в избытке NaOH, но растворился в
избытке NH4OH с образованием синего раствора. После
добавления к новой порции раствора соли нескольких каплей
K4[Fe(CN)6] выпал красный осадок. К отдельной порции раствора
добавили раствор AgNO3 в присутствии HNO3 Аналитический
эффект не наблюдался. К анализируемому раствору добавили
раствор BaCl2+HCl. Выпал осадок белого цвета.
Какой состав анализируемой соли?
.















 chemistry
chemistry








