Similar presentations:
Галогеналканы
1.
Галогеналканы2.
• Галогеналканы• Галогеналканы (алкилгалогениды) — органические
соединения, которые содержат в своём составе
связь «углерод-галоген»
Т.к. галогеналканы -это производные алканов, в
котором один или несколько атомов водорода (H)
заменены на атом галогена, то их
• общая формула:
• n — количество атомов углерода (≥1),
• Х — F, Cl, Br или J
3.
• Номенклатура галогеналканов• согласно ИЮПАК:
1. указывается номер атома, к которому крепится галоген;
2. называется сам галоген;
3. называется углеводород соответственно количеству атомов
• (если галогенов несколько, то их названия указываются в
алфавитном порядке):
• 1-бром-2 — хлорэтан
4.
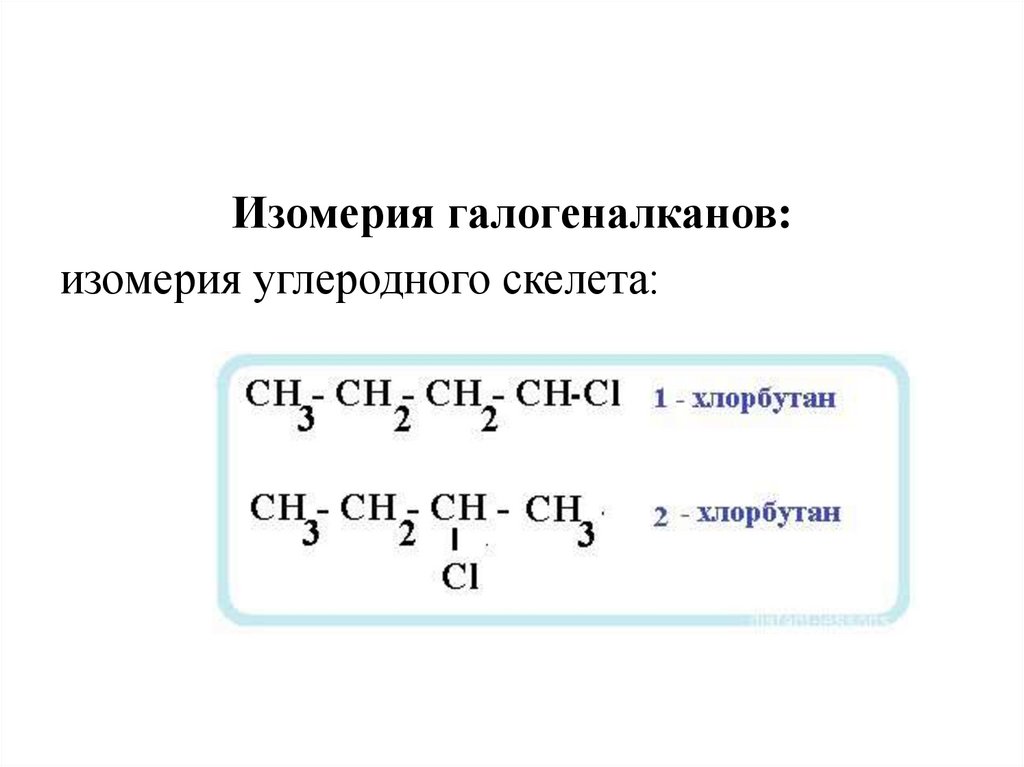
Изомерия галогеналканов:изомерия углеродного скелета:
5.
Физические свойства:Большинство галогеналканов — бесцветные
(или желтоватые) вещества.
Чем больше атомов углерода, тем выше
температуры плавления и кипения.
6.
• Химические свойства галогеналканов:• Реакция Вюрца:
• 1 вариант -реакция удвоения углеводородной цепи:
CH3Cl + 2Na + ClCH3 → C2H6 + 2NaCl
• 2 вариант — просто удлинение цепи на любое
количество атомов:
СH3Cl + 2Na + ClC3H7 → C4H10 + 2NaCl
7.
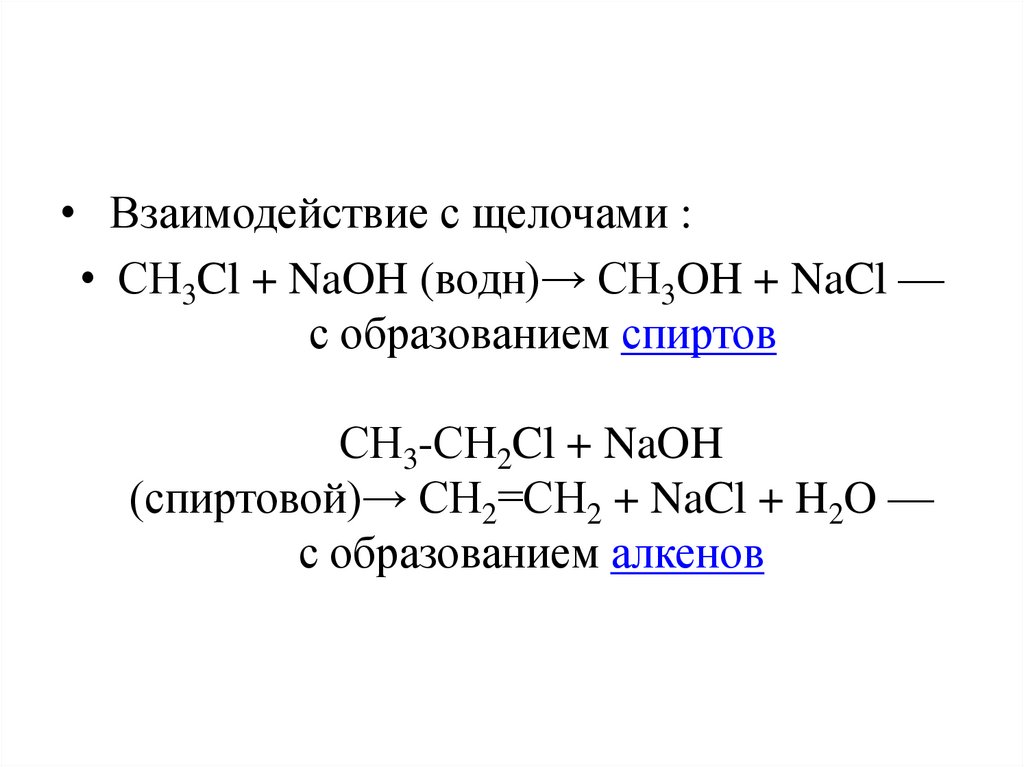
• Взаимодействие с щелочами :• СH3Cl + NaOH (водн)→ СH3OH + NaCl —
с образованием спиртов
СH3-СH2Cl + NaOH
(спиртовой)→ СH2=СH2 + NaCl + H2O —
с образованием алкенов
8.
• Взаимодействие сароматическими
соединениями:
СH3Cl + C6H6 → C6H5-СH3 + HCl
Горение галогеналканов:
4C2H5Сl + 13O2 = 8CO2 + 10H2O + 2Cl2
9.
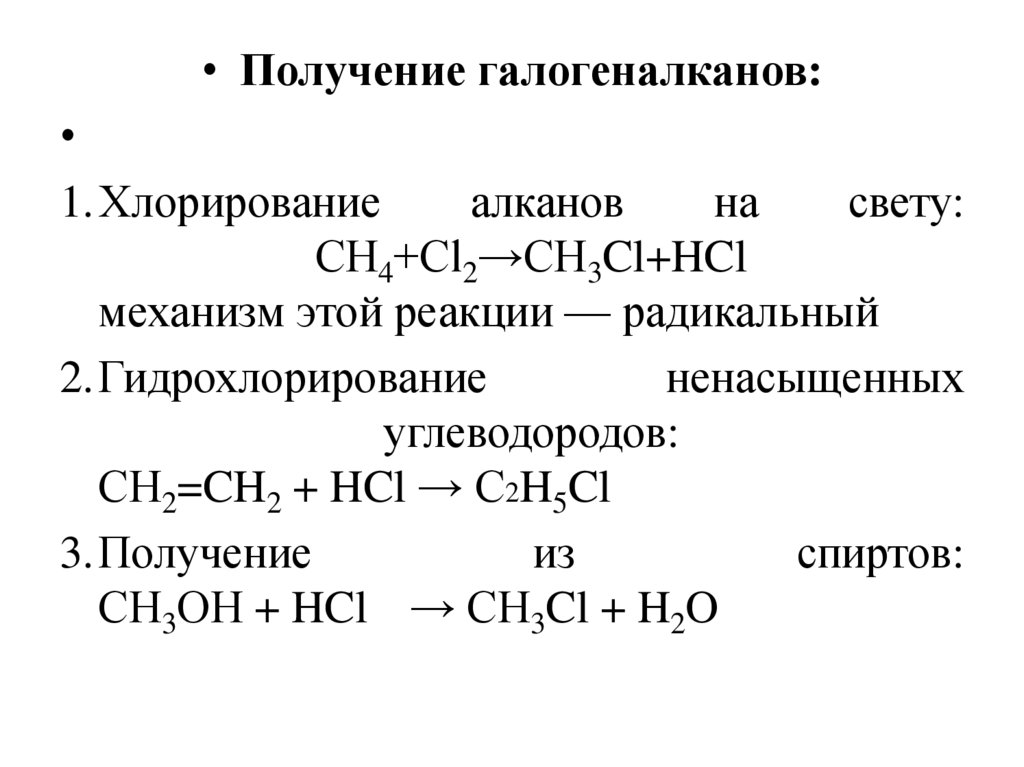
• Получение галогеналканов:1.Хлорирование
алканов
на
свету:
СH4+Сl2→СH3Cl+HCl
механизм этой реакции — радикальный
2.Гидрохлорирование
ненасыщенных
углеводородов:
СH2=CH2 + HCl → С2H5Cl
3.Получение
из
спиртов:
СH3ОН + HCl → СH3Cl + H2O
10.
• Применение хлоралканов• Большую долю рынка хлорметанов занимает четырёххлористый
углерод, основное использование которого заключается в
дальнейшем производстве фреонов трихлорфторметана (R-11)
и дифтордихлорметана (R-12). С 1976 года, когда появилась
теория разрушения озонового слоя, производство
четырёххлористого углерода снижается. Также его применяют
как дезинфицирующее средство и фунгицид для зерновых.
• Хлорметан и дихлорметан занимают по 25 % рынка хлорметанов.
Хлорметан расходуется преимущественно на
производство силиконов (60-80 % от рынка). Его использование в
производстве топливной присадки тетраметилсвинца постепенно
сокращается. Дихлорметан используют преимущественно в
качестве моющего средства и растворителя для краски (40-45 %),
для создания давления в аэрозолях (20-25 %), а также в
качестве экстрагирующего растворителя.
• Трихлорметан среди хлорметанов занимает наименьшую долю
рынка (16 %). В основном он используется для
производства дифторхлорметана (R-22) (90 % от производимого
количества). Также он находит применение как экстрагирующий
растворитель. Из-за токсикологических свойств его практически
не применяют в качестве ингаляционного анестетика
11.
• задание:• Составьте уравнение химической реакции
взаимодействия
• 1) этана с хлором
• 2)Горение хлорметана
• 3) хлорэтан с гидроксидом натрия
• 4) составьте структурную формулу
2-хлорпропана, 2,3 дихлорпентана








 chemistry
chemistry








