Similar presentations:
Алканы
1.
Алканы1. Получение, физические и
химические свойства.
2. Применение алканов.
2.
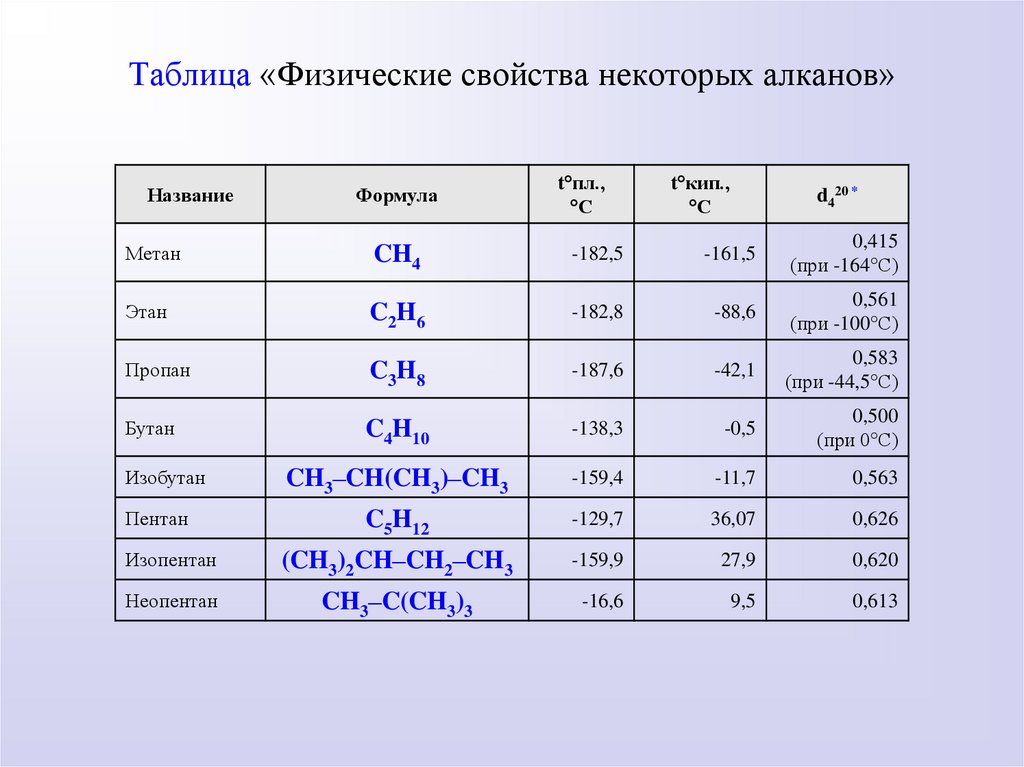
ФИЗИЧЕСКИЕ СВОЙСТВАСН4 до С4Н10 - газы,
С5Н12 - С17Н36 - жидкости,
С18Н38 - твердые тела.
Температуры плавления и кипения алканов зависят
от их плотности и увеличиваются с ростом
молекулярной массы. Все алканы легче воды, в ней
не растворимы, однако растворимы в неполярных
растворителях и сами являются хорошими
растворителями.
3.
Таблица «Физические свойства некоторых алканов»Название
Формула
t пл.,
С
t кип.,
С
d420 *
Метан
CH4
-182,5
-161,5
0,415
(при -164 С)
Этан
C2H6
-182,8
-88,6
0,561
(при -100 С)
Пропан
C3H8
-187,6
-42,1
0,583
(при -44,5 С)
Бутан
C4H10
-138,3
-0,5
0,500
(при 0 С)
CH3–CH(CH3)–CH3
-159,4
-11,7
0,563
C5H12
-129,7
36,07
0,626
Изопентан
(CH3)2CH–CH2–CH3
-159,9
27,9
0,620
Неопентан
CH3–C(CH3)3
-16,6
9,5
0,613
Изобутан
Пентан
4.
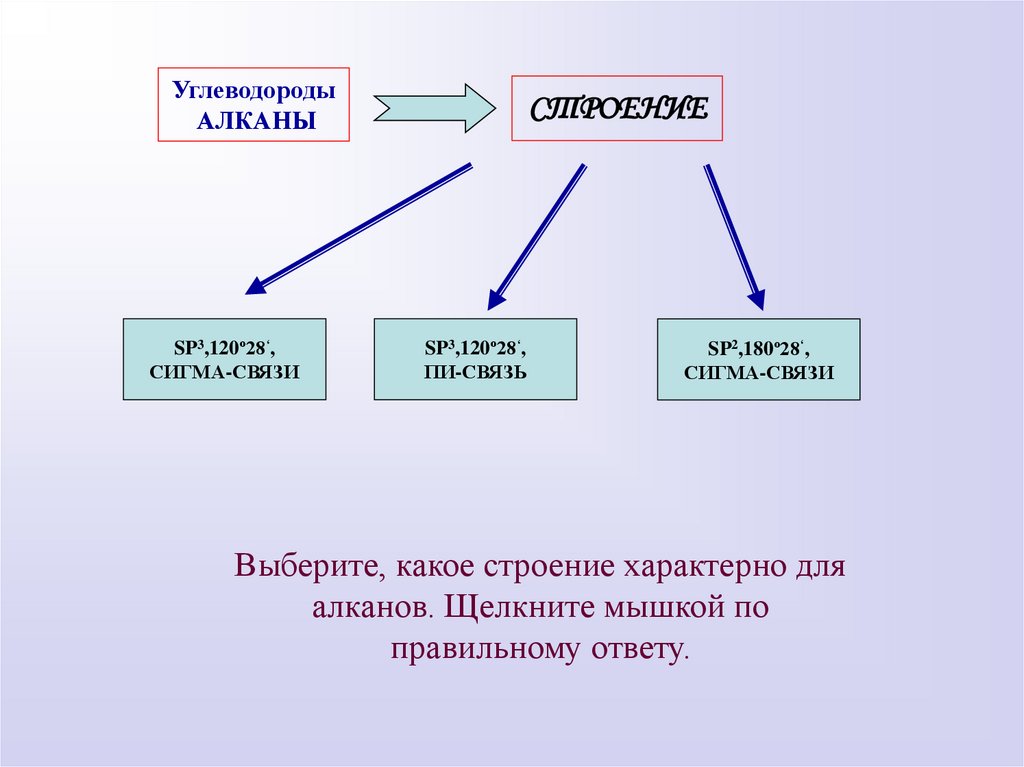
УглеводородыАЛКАНЫ
SP3,120º28‘,
СИГМА-СВЯЗИ
СТРОЕНИЕ
SP3,120º28‘,
ПИ-СВЯЗЬ
SP2,180º28‘,
СИГМА-СВЯЗИ
Выберите, какое строение характерно для
алканов. Щелкните мышкой по
правильному ответу.
5.
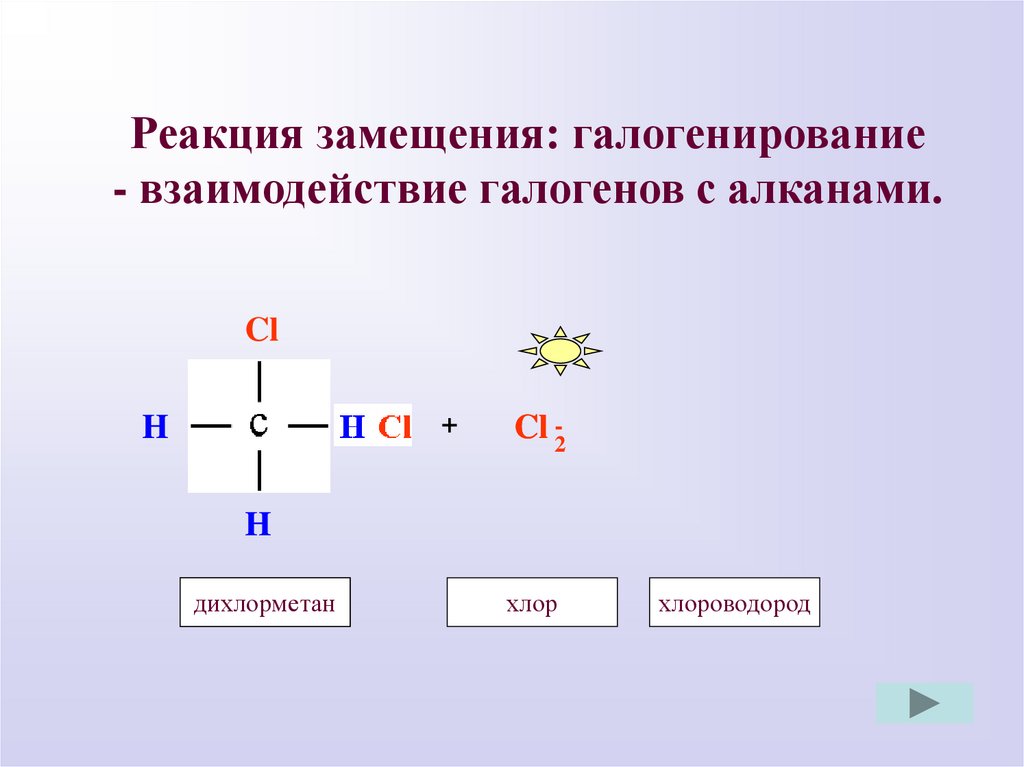
Реакция замещения: галогенирование- взаимодействие галогенов с алканами.
Cl
H
H
+
Cl -2
H
дихлорметан
хлорметан
хлор
хлороводород
6.
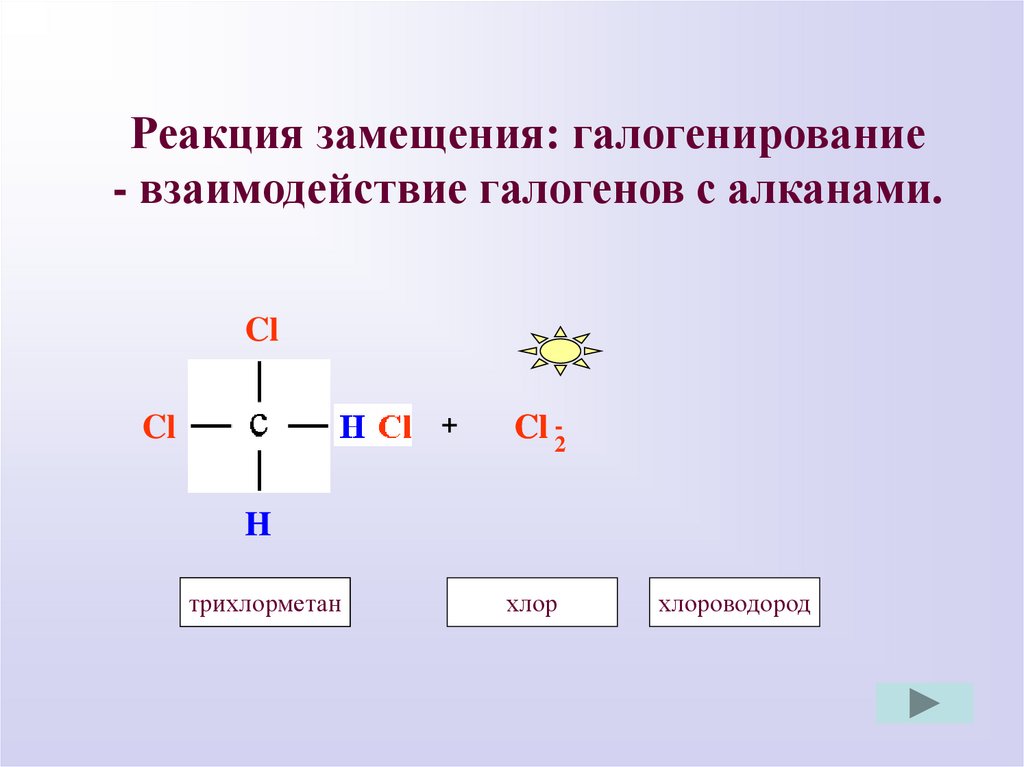
Реакция замещения: галогенирование- взаимодействие галогенов с алканами.
Cl
Cl
H
+
Cl -2
H
трихлорметан
дихлорметан
хлор
хлороводород
7.
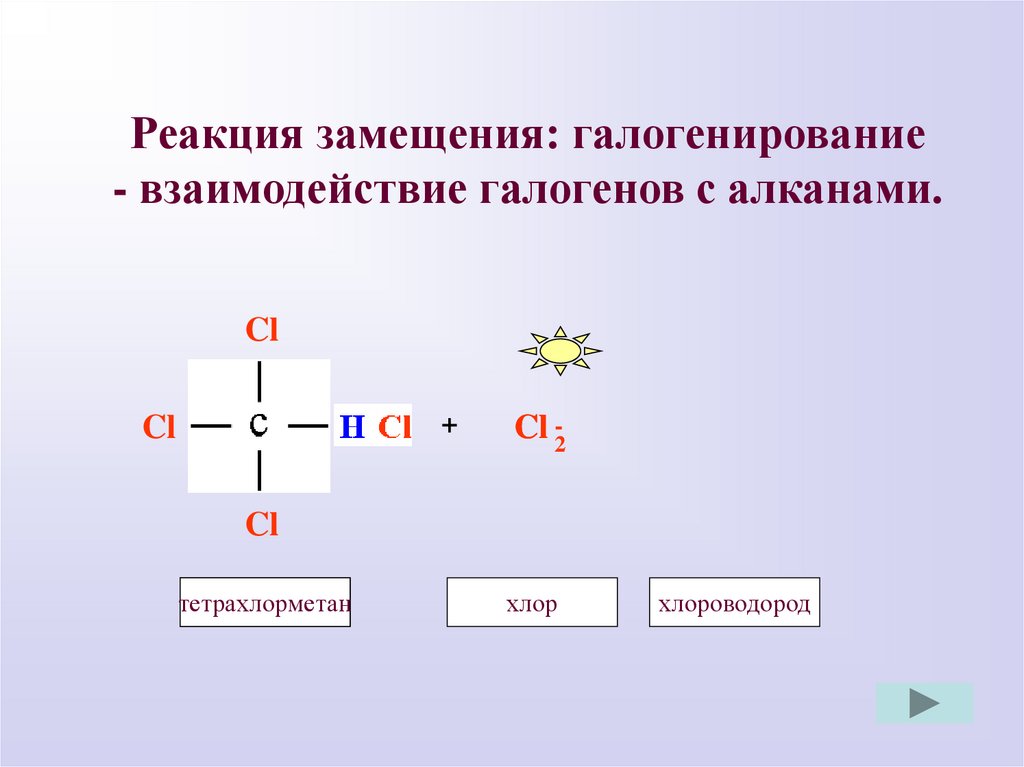
Реакция замещения: галогенирование- взаимодействие галогенов с алканами.
Cl
Cl
H
+
Cl -2
Cl
тетрахлорметан
трихлорметан
хлор
хлороводород
8.
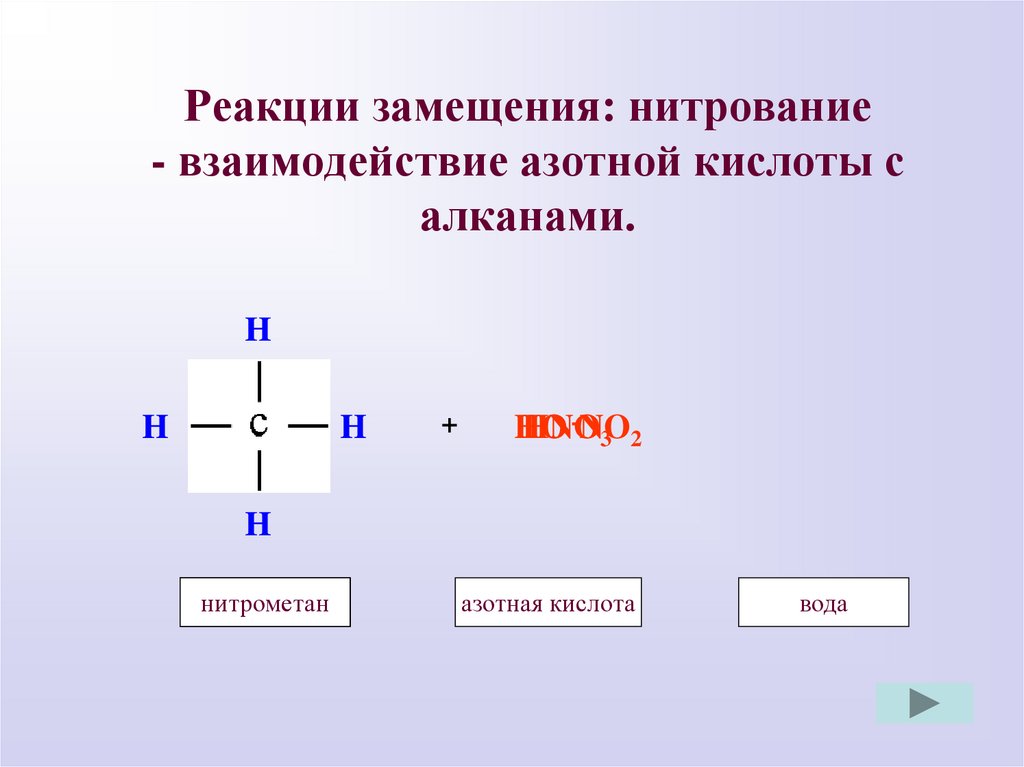
Реакции замещения: нитрование- взаимодействие азотной кислоты с
алканами.
H
H
H
+
-NO
HO
HNO
3 2
H
нитрометан
метан
азотная кислота
вода
9.
Реакции замещения:- взаимодействие серной кислоты с
алканами.
H
H15C7
H
+
H2SOSO
4
2
H
сульфокислота
метан
октан октана
серная кислота
вода
10.
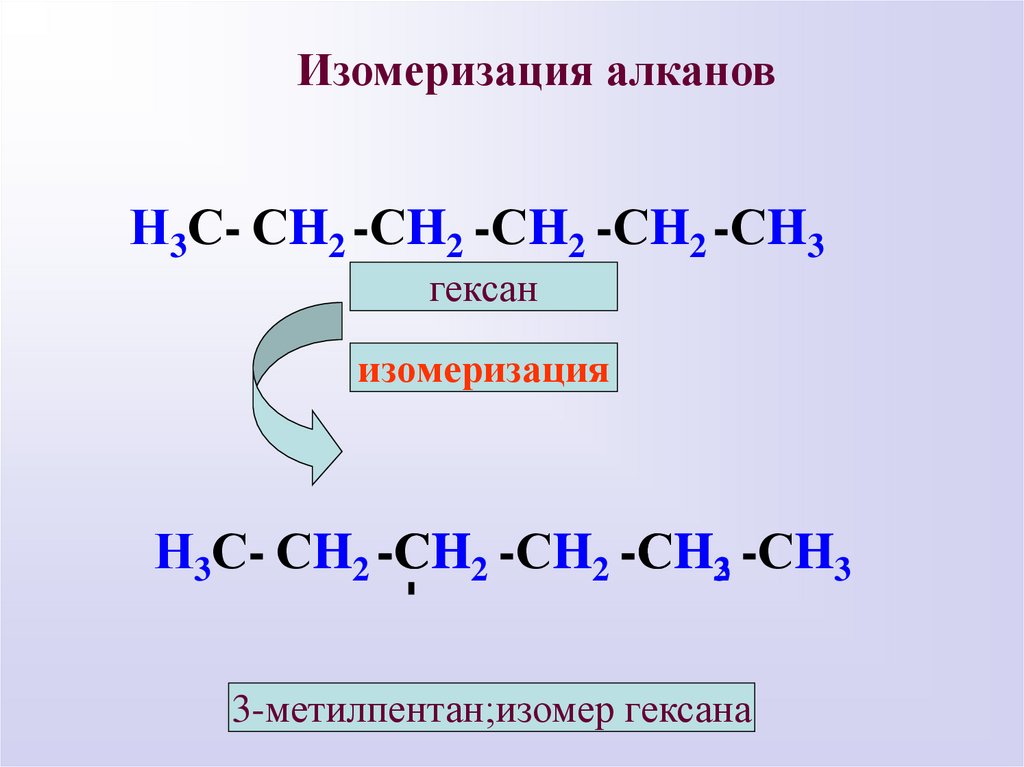
Изомеризация алкановН3С- СH2 -СH2 -СH2 -СH2 -СH3
гексан
изомеризация
-
Н3С- СH2 -СH2 -СH2 -СH32 -СH3
3-метилпентан;изомер гексана
11.
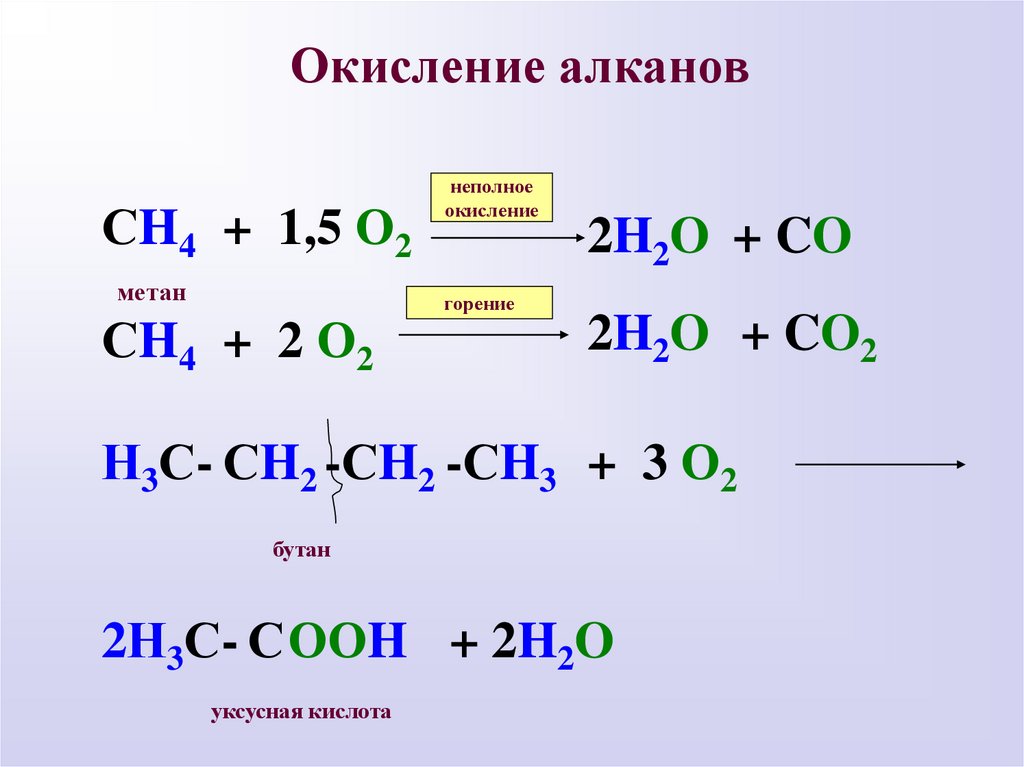
Окисление алкановСH4 + 1,5 О2
метан
СH4 + 2 О2
неполное
окисление
горение
2H2O + CO
2H2O + CO2
Н3С- СH2 -СH2 -СH3 + 3 О2
бутан
2Н3С- СООH + 2H2O
уксусная кислота
12.
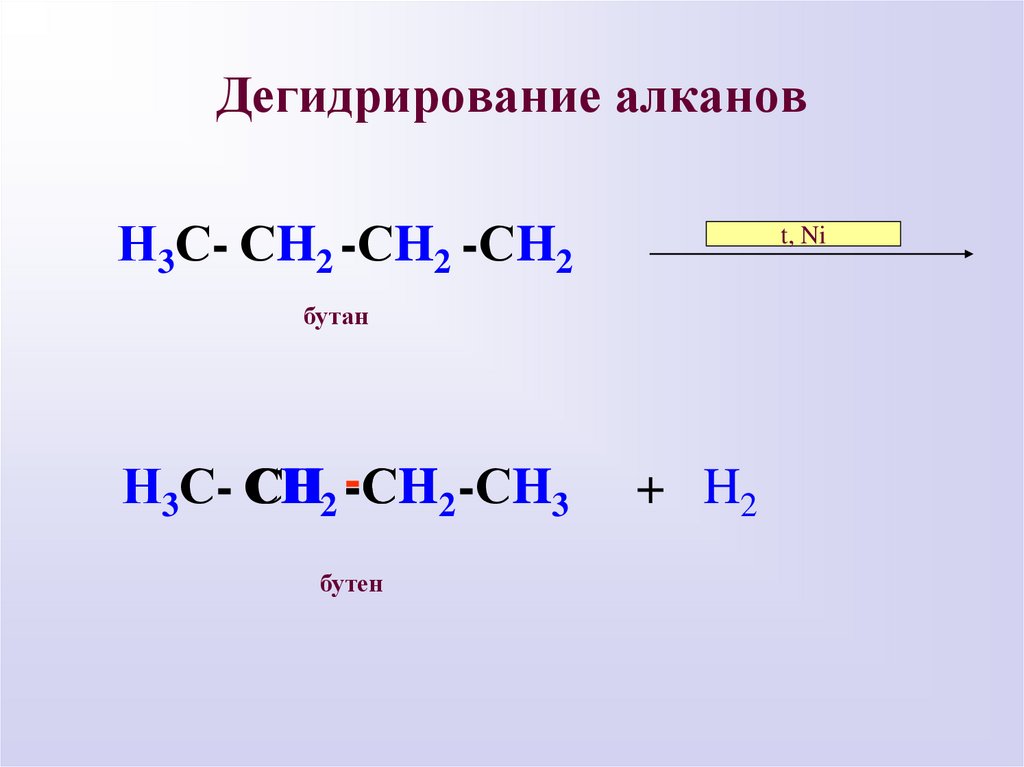
Дегидрирование алкановН3С- СH2 -СH2 -СH2
t, Ni
бутан
Н3С- СH2 --СH
СH2 -СH3
бутен
+ H2
13.
Получение алканов1) гидрирование угля под давлением в присутствии катализаторов (железо, кобальт, никель);
n C + (n+1) H2 CnH2n+2
2) гидрирование оксида углерода под давлением в присутствии катализаторов (железо, кобальт,
никель);
n CO + (2n+1) H2 CnH2n+2+ n H2O
3) гидрирование непредельных или циклических углеводородов в присутствии катализаторов
(платины, палладия, никеля);
R–CH=CH–R' + H2 R–CH2–CH2–R'
Pd
+ H2 –– CH3 –CH2 –CH3
циклопропан
пропан
4) реакция Вюрца;
2CH3–CH2Br + 2Na CH3–CH2–CH2–CH3 + 2NaBr
бромистый этил
5) крекинг нефти.
бутан
14.
Д/З1) Составьте сообщение о применении
алканов (для всех задание);
2) Объясните на примере предельных
углеводородов следующую взаимосвязь:
СТРОЕНИЕ
СВОЙСТВА
ПРИМЕНЕНИЕ





 chemistry
chemistry








