Similar presentations:
Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
1. Количественный учет влияния заместителя на реакционную способность и его использование для интерпретации механизмов реакций
Цель: Измерить количественно степеньвлияния электронной природы
заместителя вблизи реакционного
центра на скорость или равновесие
реакции
2. Полярные эффекты в ароматических системах
-константы Гаммета - получены при изучении влияния
электронной природы заместителя на константы ионизации м- и
п-замещенных бензойных кислот в воде при 25°C. Чем больше
положительное значение -константы, тем сильнее электроноакцепторные свойства заместителя; чем больше отрицательное значение -константы – тем сильнее донорные свойства
Kx
Log
KH
= x
COOH
Example:
Ka = 6.25x10
Log
-5
10.0x10
-5
6.25x10
-5
COOH
Cl
Ka = 10.0x10
-5
= 0.204 = p for Cl
2
3. Смысл параметров и r
Смысл параметров иσ — параметр заместителя (константа)
σ > 0 – акцептор (увеличивает кислотность бензойной кислоты)
σ < 0 – донор (снижает кислотность бензойной кислоты)
ρ — параметр чувствительности реакции к действию
заместителя, зависит от типа реакции а не от заместителя.
ρ > 1: В ходе реакции на реакционном центре генерируется
высокий «–» заряд, причем более требовательный к
заместителям, чем бензоат-ион при диссоциации бензойной
кислоты. Реакция сильно ускоряется акцепторами.
ρ = 0-1: На реакционном центре генерируется невысокий «–»
заряд. Реакция менее чувствительна к заместителям, чем
диссоциация бензойной кислоты. Реакция слабо ускоряется
акцепторами
ρ = 0: нет чувствительности к заместителям, заряд не
меняется.
ρ= -1-0: в ходе реакции на реакционном центре генерируется
невысокий «+» заряд, реакция слабо ускоряется донорами.
3
ρ <-1: на реакционном центре генерируется высокий «+»
4.
ИндуктивныйИндуктивный+Мезомерный
4
5.
56.
6Домашне
е
задание
7.
H. Brown-шкала
cтандартная серия для cольволиз, SN1, = -1)
Me
Me
Me H O-Me CO
:
2
2
7
+
C
X
NH2
H
MeO
F
Cl
Cl
Me
C+
Me
X
пара
пара
(Браун)
(Гаммет) (Гаммет)
-1.3
0
-0.778
-0.073
0.114
C
X
OH
Me
мета
-0.66
0
-0.268
0.062
0.227
-0.16
0
0.115
0.337
0.373
NH2
H
MeO
F
Cl
Если значения lgKX/KH лучше коррелируют с +-константами, чем с то
в ПС образуется КАТИОН, сопряженный с бензольным кольцом
8.
Стандартная серия дляпара
X
+
H
N
H
H
H
мета
-М
+М
( =1)
8
-NO2
0.710
-СN
0.56
-COCH3
0.38
NH2
-0.161
N
X
H
пара
0.778
0.66
0.50
-0.660
+
H+
пара
1.270
1.00
0.84
-0.660
Если значения lgKX/KH лучше коррелируют с —константами, чем
с то в ПС образуется АНИОН, сопряженный с бензольным
кольцом (или снижается «+» заряд)
9.
Уравнение Гаммета для предсказания скоростей реакцийCO2Me
CO2k = 2 x 10-4/M s
log(km-NO2/kH) = = 2.38 x 0.71 = 1.69
km/kH = 101.69 = 49
CO2Me
CO2-
km = 49 х kH = 98 x 10-4 M-1.s-1
k=?
NO2
NO2
Cl
OH
Br
Cl
OH
NO2
NO2
Cl
OH
= -1.31
X
Какая реакция быстрее?
log(kp-Br/kH) = p-Br = -1.31 x 0.23 = -0.3
Br
X
m (NO2) = 0.71
kp-Br/kH = 10-0.3 = 2
log(kp-NO2/kH) = p-NO2 = -1.31 x 0.78 = -1
kp-NO2/kH = 10-1 = 0.1
kp-Br/kp-NO2 = 2 / 0.1 = 20
SN2; < 0
9
10.
Уравнение Гаммета для установления механизмов= 2.23
Не отличаются
->
необходимы
другие
эксперименты
= -5.09 -> SN1подобный
механизм
Если SN2: то
из-за небольшого
изменения заряда
в реакции
10
11.
Изгибы в корреляции Гаммета могутсвидетельствовать об изменении
лимитирующей стадии процесса
11
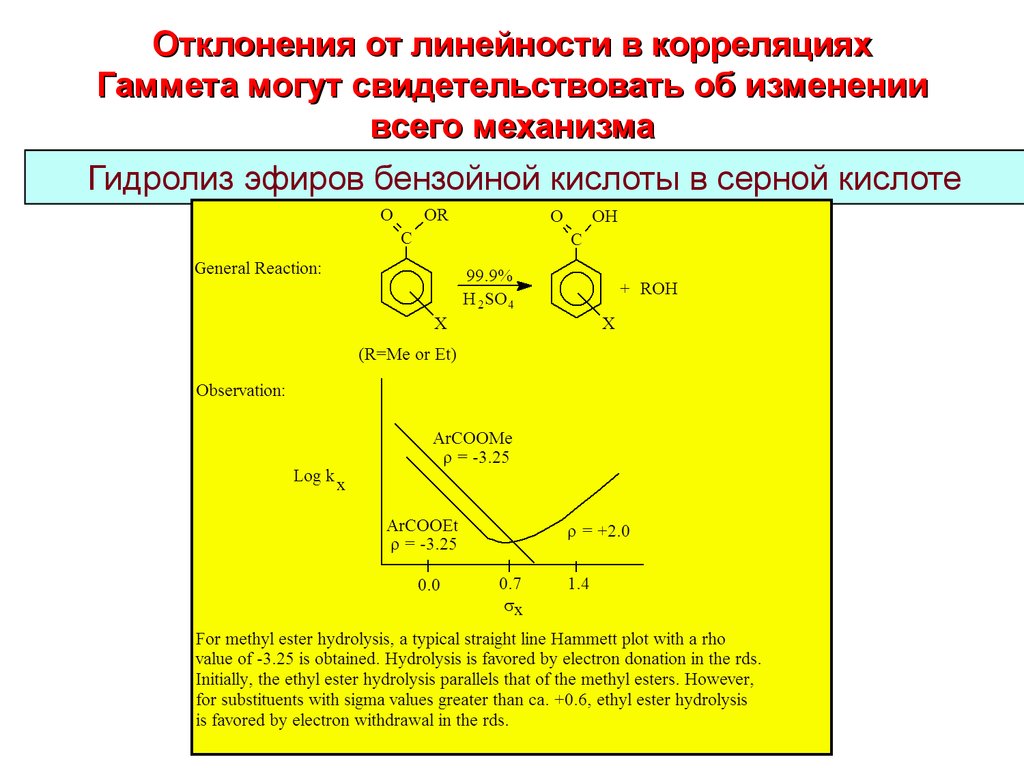
12. Отклонения от линейности в корреляциях Гаммета могут свидетельствовать об изменении всего механизма
Гидролиз эфиров бензойной кислоты в серной кислоте12
13. Гидролиз эфиров бензойной кислоты в H2SO4
For all Methyl esters and Ethyl esters with substituents having
values < ca. +0.6
A AC 1 Pathway : Unimole cular acid catalyze d acyl-oxyge n cle avage
Ar
C OR
H+
Ar
+
C OR
O H
O
rds
For Ethyl esters with substituents having
Ar
C+ + ROH
H2 O
Ar
O
C OH + H+
O
values > ca. +0.6
A AL 1 Pathway : Unimole cular acid catalyze d alkyl-oxyge n cle avage
Ar
C OEt
O
H+
Ar
+
C O Et
O H
rds
Ar
C OH + Et
+
H2 O
EtOH + H+
O
Discussion:
In the unimole cular acyl-oxygen cleavage pathway, the rds involve s formation of
an acyl cation. Electron donation stabilizes this inte rme diate and e nhance s its rate
of formation.
In the unimole cular alkyl-oxyge n pathway, the rds involve s bre aking the oxyge ne thyl group bond. Ele ctron withdrawing substitue nts we ake n the oxyge n-ethyl
carbon bond the re by facilitating the formation of e thyl carbocation.
Comments:
Due to the diffe rence in stability of e thyl carbocation vs. methyl carbocation, the
me thyl e ste r hydrolyse scannot proce e d via the unimolecular alkyl-oxygen cle avage
pathway.
13
14.
SN1: large negative +carbocation is developed
SN2
14
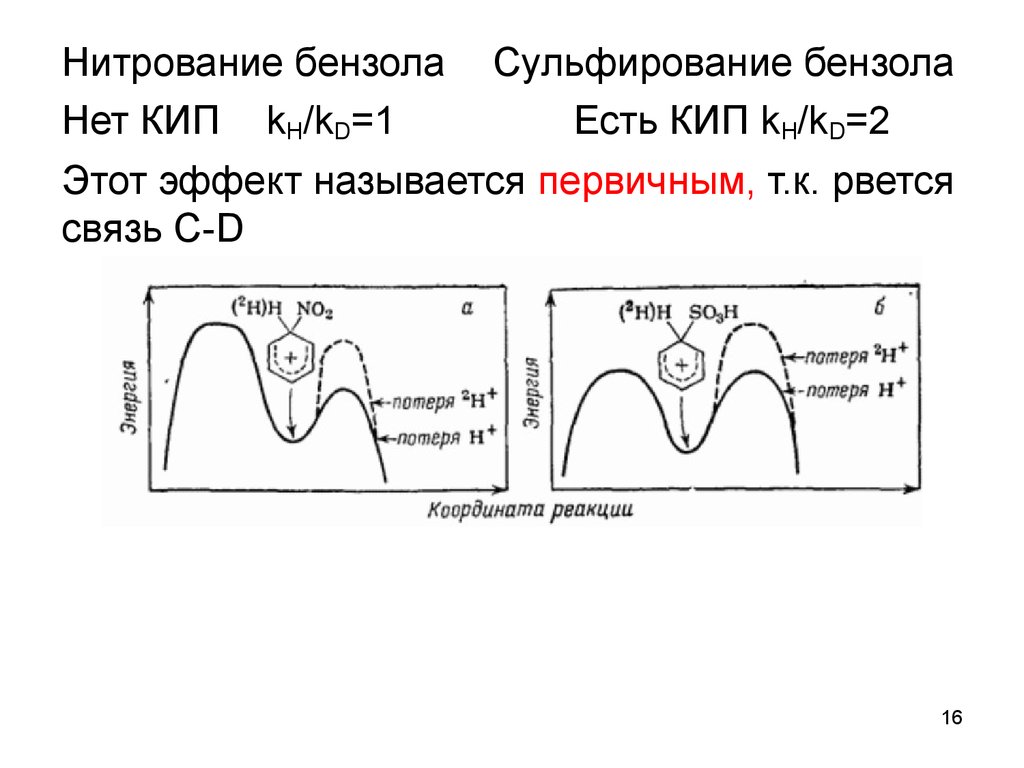
15. Кинетические изотопные эффекты (КИП)
15Хим. природа 12С и 13С (1Н и 2Н) не
отличается, но изменяется
прочность связи: более тяжелый
атом связывается более прочной
связью
Кинетический изотопный
эффект – отношение константы
скорости реакции с участием
частицы, содержащей легкий
изотоп, к константе скорости
реакции с участием частицы,
содержащей
В случае участия разрыва связи
с болеетяжелый
тяжелымизотоп:
изотопом в
kH/kD=1-10,
kH/k
скоростьопределяющей стадии
реакции
(первичный
КИП)
T=7-12.
скорость обычно снижается (в случае дейтерия 2Н - до 7 раз, в
случае углерода 13С – до 1,1), если эта связь рвется на другой
стадии, то kH/kD=1 (нет эффекта)
16.
Нитрование бензолаНет КИП kH/kD=1
Сульфирование бензола
Есть КИП kH/kD=2
Этот эффект называется первичным, т.к. рвется
связь С-D
16
17.
1718.
1819. Эффект растворителя 1. Общий
1920.
2021.
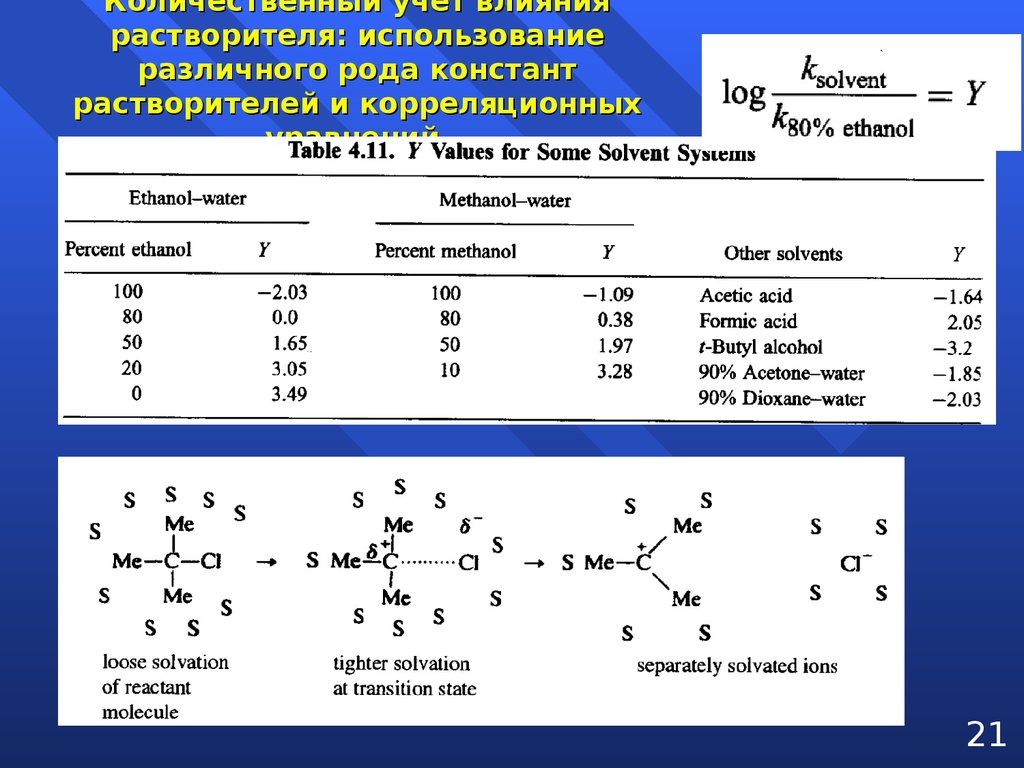
Количественный учет влияниярастворителя: использование
различного рода констант
растворителей и корреляционных
уравнений
21
22.
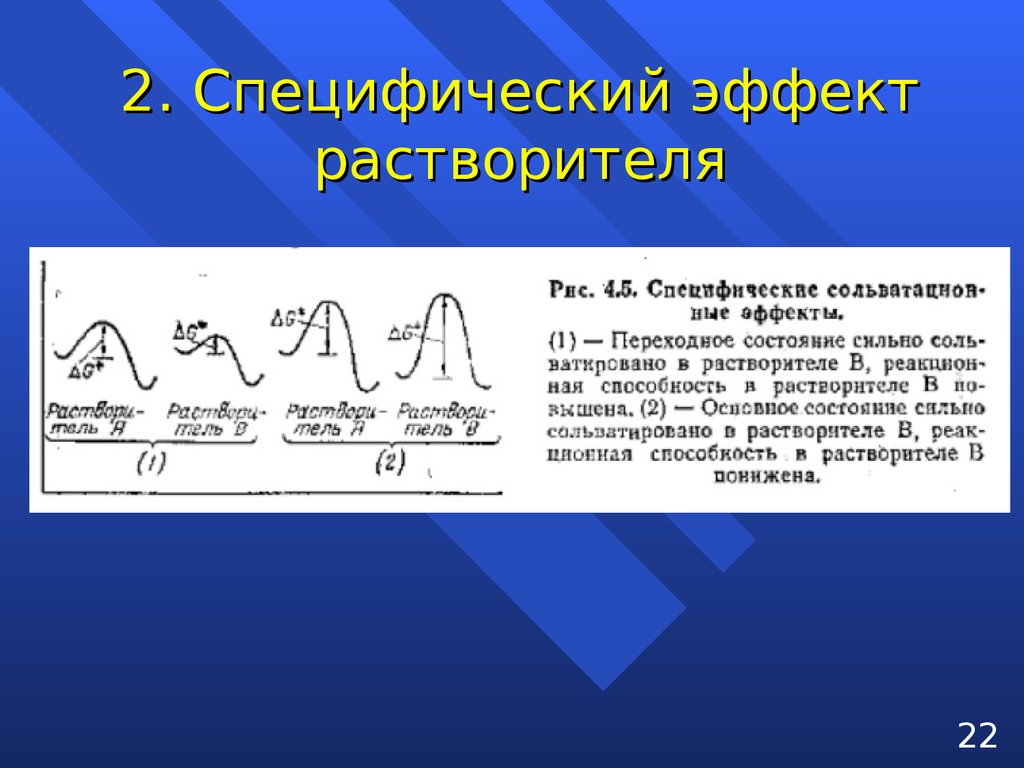
2. Специфический эффектрастворителя
22
23.
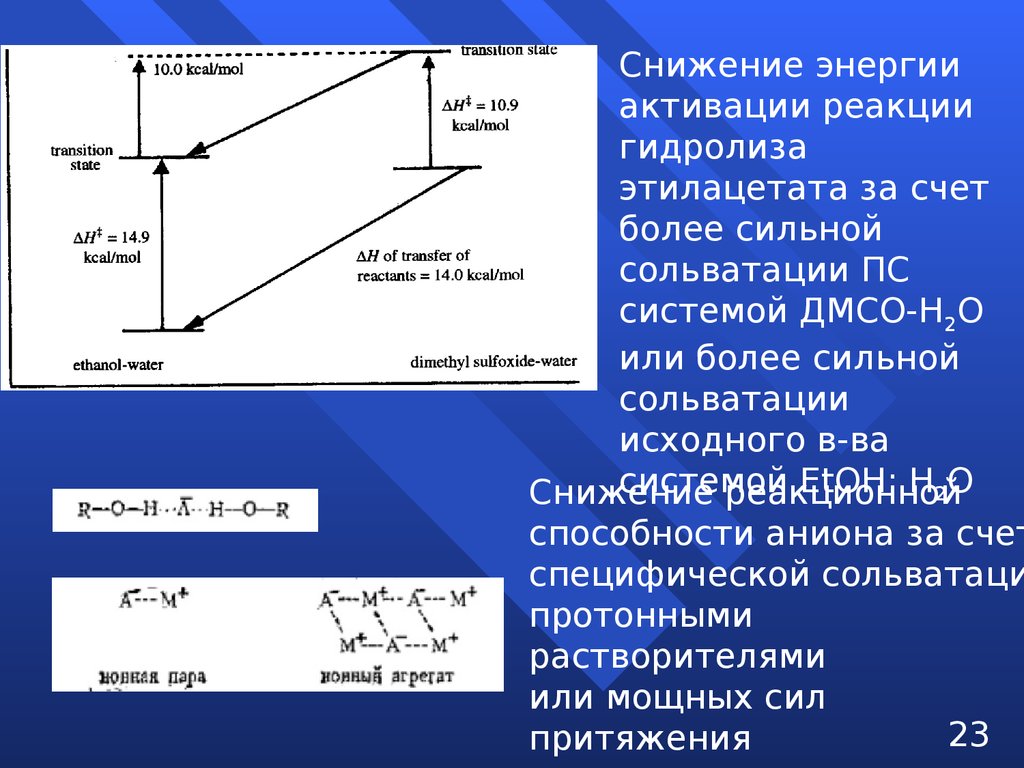
Снижение энергииактивации реакции
гидролиза
этилацетата за счет
более сильной
сольватации ПС
системой ДМСО-Н2О
или более сильной
сольватации
исходного в-ва
системой
ЕtOH: H2O
Снижение
реакционной
способности аниона за счет
специфической сольватаци
протонными
растворителями
или мощных сил
23
притяжения
24.
Увеличение реакционнойспособности аниона за
счет специфической
сольватации катиона и
растворимости
24



















 chemistry
chemistry








