Similar presentations:
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
1.
ЛЕКЦИЯ«Арены. Понятие ароматичности.
Правило Хюкклея. Круг Фроста.»
Лектор: доцент кафедры химии
Оренбургского государственного университета,
канд. хим. наук
Строганова Елена Алексеевна
2.
Арены – циклические углеводороды, содержащие фенильную группу вкачестве функциональной и образующие гомологический ряд с общей
брутто-формулой СnH2n-6
Классификация :
По количеству фенильных групп:
-Одноядерные (содержат 1 бензольное кольцо);
-Биядерные (содержат 2 бензольных кольца);
-Три-, тетра- и т.д.
-По взаимному расположению фенильных групп в полиядерной ароматике:
-Мостиковые (2 бензольных кольца через одну или несколько –CH2-);
-Конденсированные (2 бензольных кольца имеют общую связь).
Номенклатура (для моноядерной ароматики):
1. Систематическая
Нумерация осуществляется по кольцу, начиная с атома углерода при
старшем заместителе и в сторону ближайшего заместителя (т.е. с
соблюдением правила наименьших локанотов).
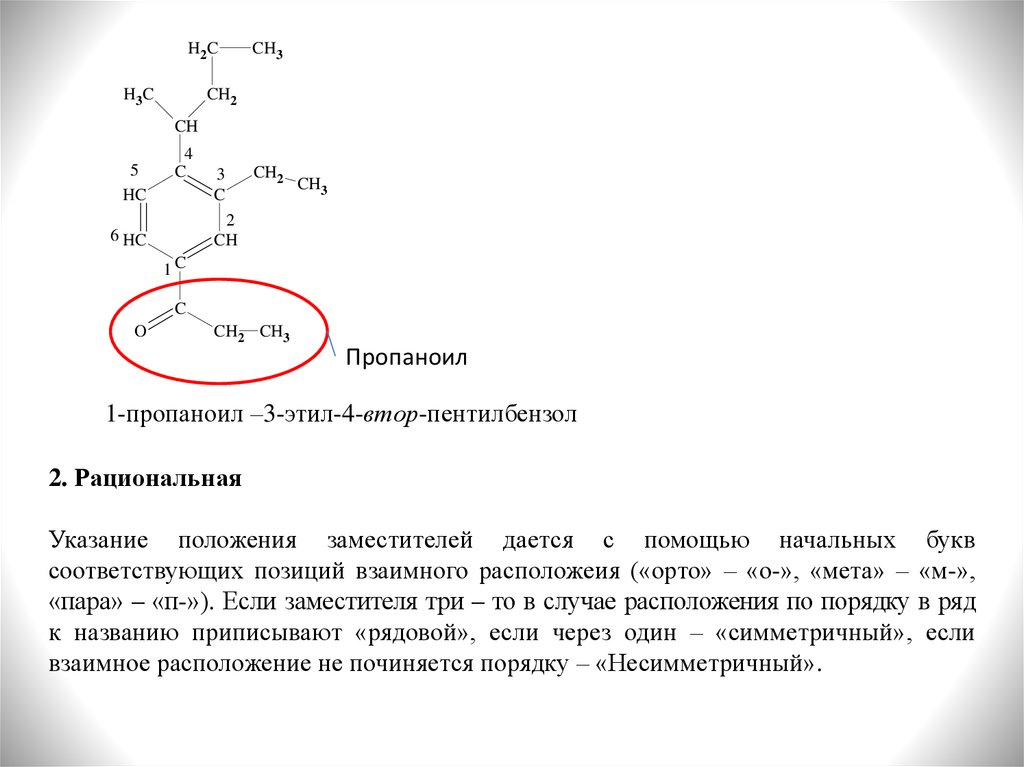
3.
H2 CH 3C
CH3
CH2
CH
5
HC
4
C
3
C
CH2
CH3
2
CH
6 HC
1C
C
O
CH2 CH3
Пропаноил
1-пропаноил –3-этил-4-втор-пентилбензол
2. Рациональная
Указание положения заместителей дается с помощью начальных букв
соответствующих позиций взаимного расположеия («орто» – «о-», «мета» – «м-»,
«пара» – «п-»). Если заместителя три – то в случае расположения по порядку в ряд
к названию приписывают «рядовой», если через один – «симметричный», если
взаимное расположение не починяется порядку – «Несимметричный».
4.
CH2H3 C
CH
C
C
HC
H3C
CH3
CH3
H 3C
C
C
CH
CH
CH3
H3C
C
CH
C
CH3
C
C
HC
CH
HC
CH
CH
CH3
CH
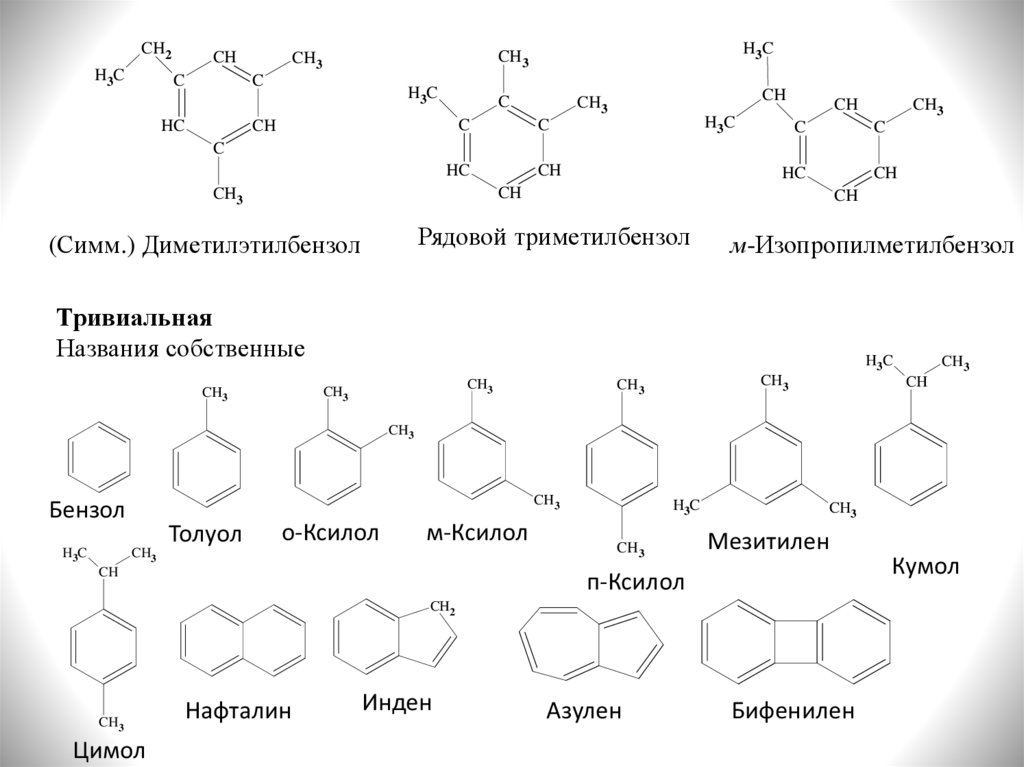
Рядовой триметилбензол
(Симм.) Диметилэтилбензол
м-Изопропилметилбензол
Тривиальная
Названия собственные
H3 C
CH3
CH3
CH3
CH3
CH3
CH3
CH
CH3
CH3
Бензол
H3C
Толуол
о-Ксилол
м-Ксилол
CH3
CH
H3C
CH3
CH3
Мезитилен
п-Ксилол
CH2
CH3
Цимол
Нафталин
Инден
Азулен
Бифенилен
Кумол
5.
H 2CАнтрацен
Фенантрен
Фенален
Ацефенантрилен
CH2
Флуорен
Ацеантрилен
Аценафтилен
Трифенилен
Нафтацен
Хризен
Пицен
6.
ПериленПентафен
Коронен
Пентацен
Физические свойства
Ароматические соединения — твёрдые или жидкие вещества,
отличающиеся от алифатических и алициклических аналогов высокими
показателями преломления (1,5-1,55) и поглощения в близкой УФ и
видимой области спектра, а также относительно высокую плотность (880900 кг/м3).
7.
Бензол и его простейшие гомологи в обычных условиях – токсичныежидкости с характерным запахом. Они плохо растворяются в воде, но
хорошо в органических растворителях. Первые члены гомологического
ряда бензола – бесцветные жидкости со специфическим запахом. Бензол и
его гомологи сами являются хорошими растворителями для многих
органических веществ. Все арены горят коптящим пламенем ввиду
высокого
содержания
углерода
в
их
молекулах.
По данным рентгеноструктурного анализа молекула бензола содержит
эквивалентные С-С связи (l = 1,397 Å) и С-Н связи (l = 1,09 Å). Углы ˪ССС
= ˪ССН = 120 ͦ , что соответствует sp2-гибридному состоянию атомов
углерода . Т.о. по шести связанным между собой σ-связями sp2-гибридным
атомам углерода шесть негибридных p-орбиталей формируют единую
сопряженную систему, состоящую формально из трех π-связей. 6 атомных
р-орбиталей формируют 6 молекулярных орбиталей, энергию и симметрию
которых можно представить следующим образом:
8.
E3 узловых поверхности
H
α-2β
H
H
H
H
α-β
H
H
H
H
H
H
H
H
H
H
α+β
H
H
H
H
H
α+2β
H
H
H
H
H
2 узловых поверхности
H
H
H
H
H
1 узловая поверхность
H
H
H
H
H
H
Нет узловых поверхностей
9.
Энергетический критерий ароматичности (по Хюккелю)Впервые подойти к проблеме ароматичности с т.з. теории МО удалось
Хюккелю (1931) – его метод молекулярных орбиталей (МОХ) позволил
соотнести геометрию циклической π-системы, заселенность МО и энергию с
проявляемыми свойствами.
Хюккель: «..ароматической системой, т.е. системой, обладающей
повышенной термодинамической стабильностью, может рассматриваться
любая циклическая, полностью сопряженная система, имеющая плоское
строение и содержащая (4n+2), nϵz π-электрона, расположенных только
на связывающих МО замкнутой оболочки..»
При этом наоборот, крайняя термодинамическая неустойчивость характерна
для подобных же систем, содержащих 4n, nϵz π-электрона. Такие частицы
являются
антиподами
ароматическим
и
их
принято
называть
«антиароматическими».
10.
HH
H
H
H
H
Системы, для которых не выполняется хотя бы одно условие ароматичности
относятся к НЕароматическим.
Круг Фроста
Для
приблизительной
оценки
принадлежности
частицы
к
ароматическим/антиароматическим применяют графическую интерпретацию
метода Хюккеля – «круг Фроста».
Круг Фроста представляет собой
окружность, каждая точка которой – энергия атомной орбитали циклической
системы, формирующей ВЗМО. Энергия выражается в через математические
операторы волновых функций: α – кулоновский интеграл (описывает
взаимодействие «ядро-ядро», β – резонансный интеграл (описывает
взаимодействие «электрон-ядро»). Вертикальная диагональ пересекает
окружность в двух точках: верхней, что соответствует энергии
и отвечает
α-2β
орбитали с самым высоким значением энергии, и нижней, что
соответствует энергии
и отвечает орбитали с самым низким значением
α+2β
энергии
11.
Горизонтальная диагональ пересекает окружность в точках с энергией α, чтоотвечает несвязывающим орбиталям.
Отнесение остальных точек окружности осуществляется путем дробного
деления дуг с присвоением соответствующего дробного значения β-интеграла.
Чтобы оценить энергию циклической сопряженной π-системы необходимо
представить частицу в виде правильного многоугольника (в соответствии с
количеством атомов цикла), вписать этот многоугольник так, чтобы одна из
вершин совпала с нижней точкой окружности, а затем определить энергии АО,
соответствующих пересекаемым точкам окружности. Далее «заселить»
полученные атомные орбитали единой системы электронами в соответствии с
правилами Паули и Хунда и рассчитать суммарную энергию МО путем
сложения энергий каждой АО, умножениных на количество заселяющих
электронов.
Если результирующая энергия, выраженная в α и β-интегралах, будет
представлять собой суперпозицию, в которой β-операторов больше, то система
является ароматической; если α-операторов больше (или равны) –
антиароматической.
12.
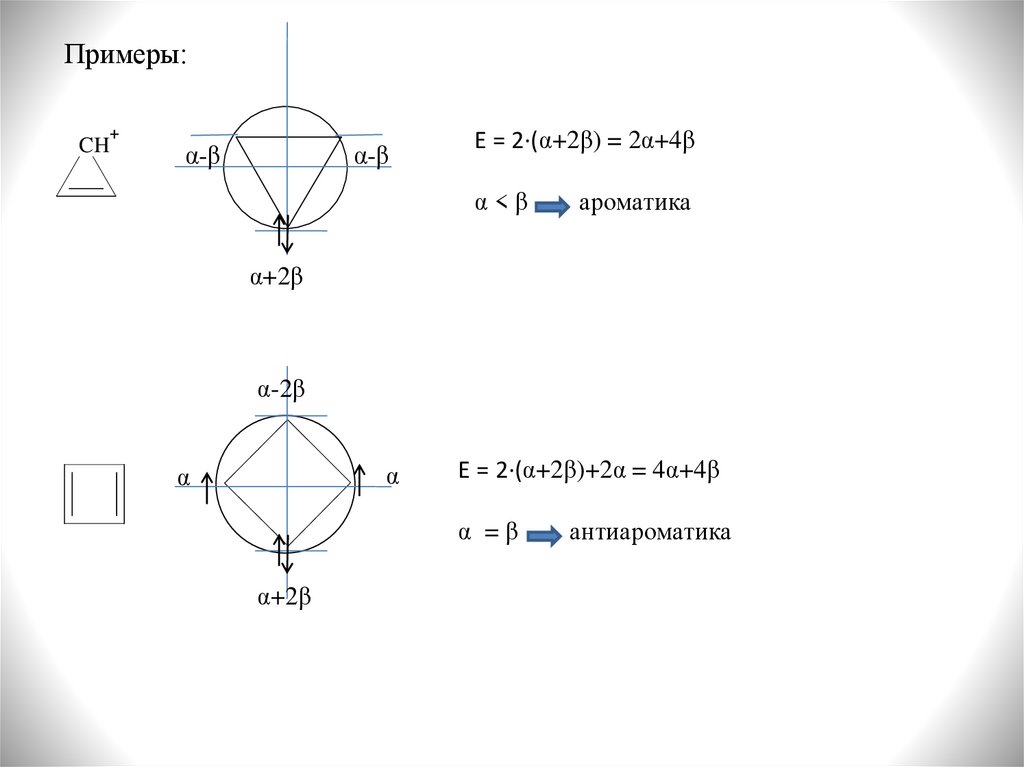
Примеры:CH
+
α-β
α-β
E = 2·(α+2β) = 2α+4β
α<β
ароматика
α+2β
α-2β
α
α
E = 2·(α+2β)+2α = 4α+4β
α =β
α+2β
антиароматика
13.
Другие критерии ароматичности:1) Структурный – ароматические частицы планарны (плоские),
циклические, сопряженные.
2) Химический – ароматические соединения устойчивы к реакциям
окисления и присоединения.
3) Магнитный – ароматические соединения – это замкнутые
сверхпроводники, в которых при попадании во внешнее электромагнитное поле возникает диамагнитный кольцевой ток (для
антиаромматики – возникает парамагнитый кольцевой ток).
4) Спектральный – протонный резонанс в слабом магнитном поле (для
антиароматики – в сильном поле).
14.
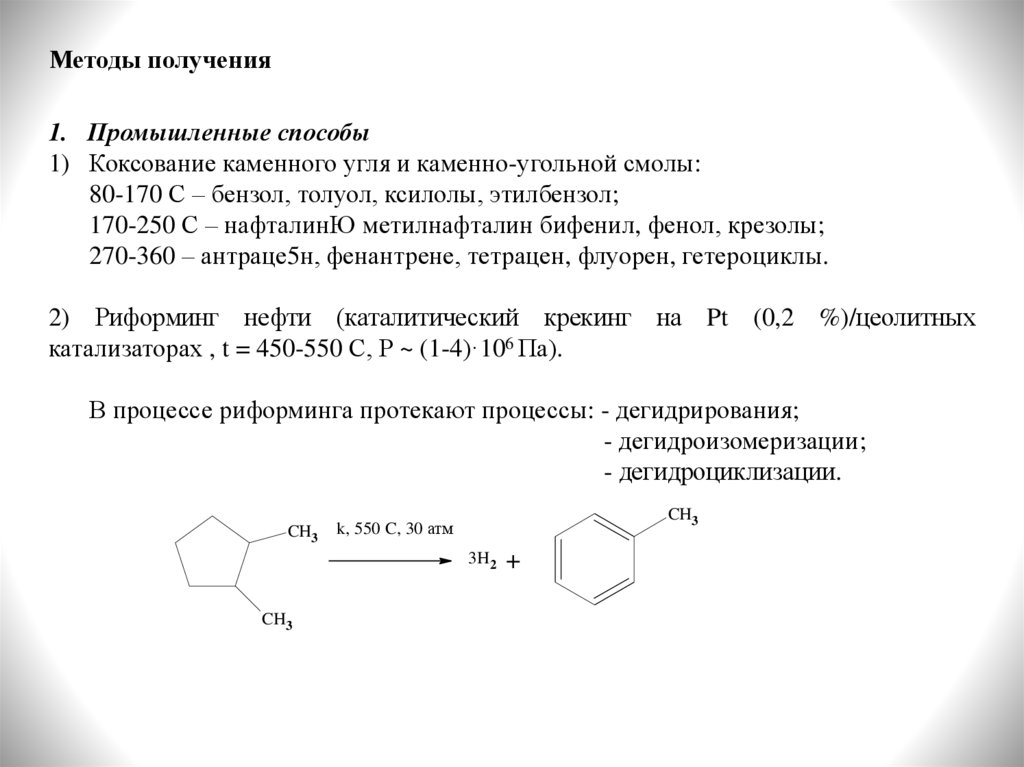
Методы получения1. Промышленные способы
1) Коксование каменного угля и каменно-угольной смолы:
80-170 С – бензол, толуол, ксилолы, этилбензол;
170-250 С – нафталинЮ метилнафталин бифенил, фенол, крезолы;
270-360 – антраце5н, фенантрене, тетрацен, флуорен, гетероциклы.
2) Риформинг нефти (каталитический крекинг на Pt (0,2 %)/цеолитных
катализаторах , t = 450-550 С, Р ~ (1-4)·106 Па).
В процессе риформинга протекают процессы: - дегидрирования;
- дегидроизомеризации;
- дегидроциклизации.
CH3
CH3
k, 550 C, 30 атм
3H2
CH3
+
15.
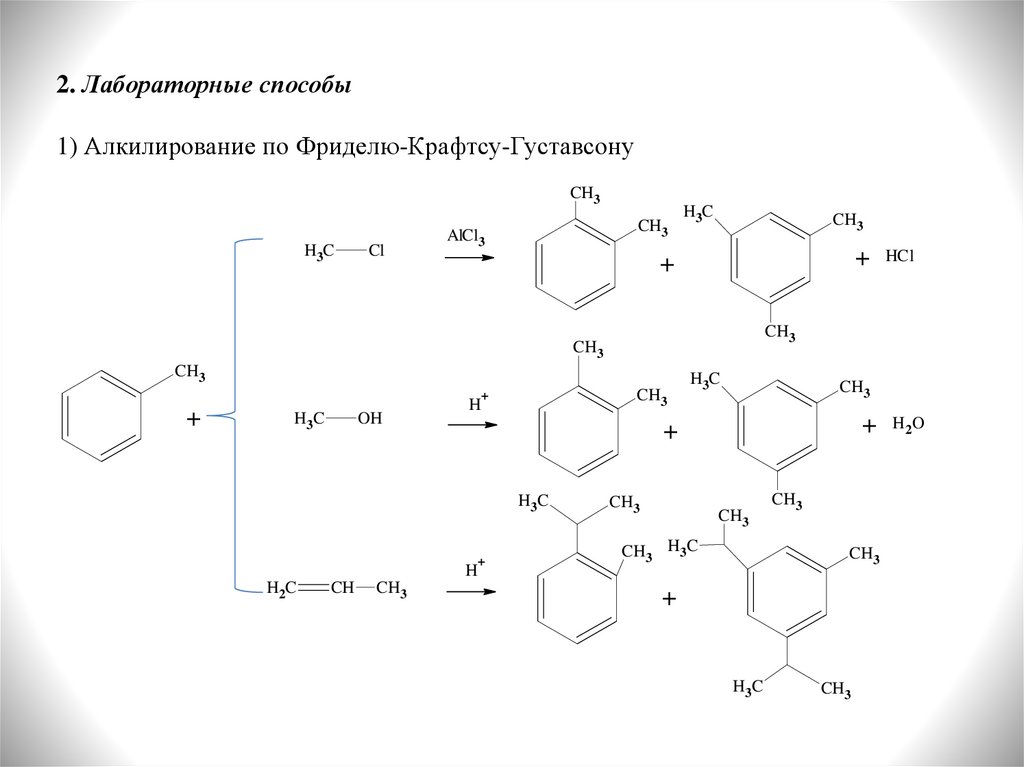
2. Лабораторные способы1) Алкилирование по Фриделю-Крафтсу-Густавсону
CH3
H3C
Cl
CH3
AlCl3
H3C
CH3
+
+
CH3
CH3
CH3
+
H3C
OH
H
CH3
+
H
H2 C
CH
CH3
H3C
CH3
+
+
H3 C
+
HCl
CH3
CH3
CH3 H3C
CH3
CH3
+
H3C
CH3
H2O
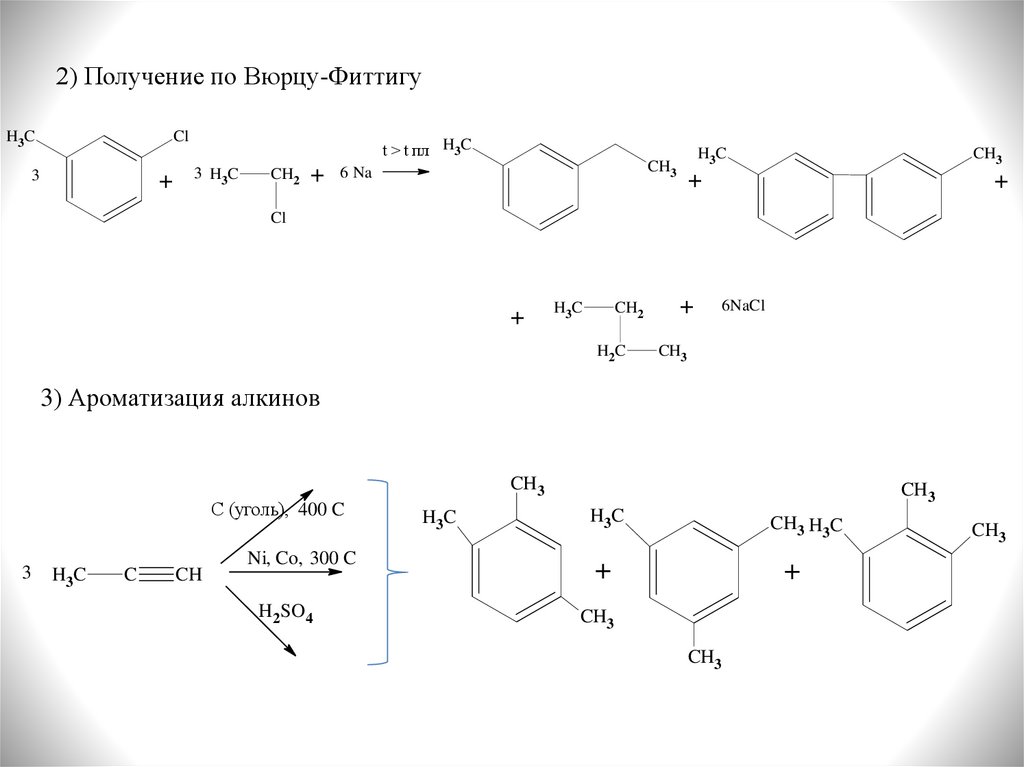
16.
2) Получение по Вюрцу-ФиттигуCl
H3C
3
+
t > t пл H3C
3 H3C
CH2
+
H3C
CH3
6 Na
CH3
+
+
Cl
+
H3C
CH2
H2C
+
6NaCl
CH3
3) Ароматизация алкинов
CH3
C (уголь), 400 C
3
H3C
C
CH
Ni, Co, 300 C
H2SO4
H3C
CH3
H3C
CH3 H3C
+
+
CH3
CH3
CH3










 chemistry
chemistry








