Similar presentations:
Кремний. Германий, олово, свинец (Лекция № 6)
1.
Кремний.Германий, олово, свинец
Лекция № 6
2.
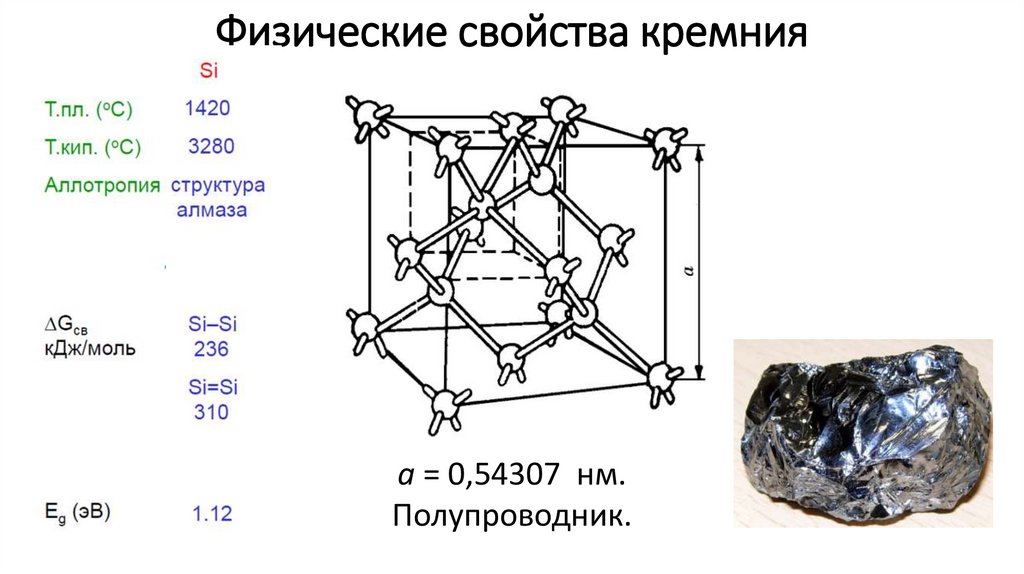
Физические свойства кремнияa = 0,54307 нм.
Полупроводник.
3.
Нахождение в природе, получениеКремний – второй по распространенности (после кислорода)
элемент в земной коре (25,7 масс. %). Он входит в состав силикатов
и алюмосиликатов, слагающих земную кору.
Кварц – одна из модификаций диоксида кремния.
Получение кремния из кварца.
SiO2 + 2 C (t) Si + 2 CO
(SiO2 надо брать в избытке во избежание образования
SiC)
SiO2 + 2 SiC (t) 3 Si + 2 CO.
Для получения ферросилиция восстановление
проводят в присутствии железного лома.
Кремний высокой чистоты получают из SiCl4 или SiHCl3.
SiCl4 очищают фракционной перегонкой.
SiCl4 + 2 Zn (t) Si + ZnCl2 (цинк не образует
Альтернативный способ получения особо
силицидов)
чистого кремния SiI4 (t, вольфрамовая
SiCl4 + 2 H2 (t) Si + 4 HCl.
нить) Si + 2 I2.
4.
Химические свойства кремнияХимически более активен по сравнению с углеродом в форме алмаза.
Электроотрицательность атома кремния меньше по сравнению с углеродом.
Возможна реализация координационного числа 6.
1. Образование силицидов с активными металлами
Силициды образуют щелочные металлы, металлы 2 группы, многие d и fэлементы. p-элементы и Be, Ag, Au, Zn, Cd, Hg, силициды не образуют.
2 Mg + Si (t) Mg2Si.
2. Взаимодействие с неметаллами (галогенами, кислородом, S, P, N, B) при
повышенных температурах:
Si + 2 F2 SiF4 (при комнатной температуре)
Si + 2 Cl2 SiCl4 ( t = 400 C)
Si + 2 Br2 (I2) SiBr4 (SiI4) (t = 650 C (Br2), 800 C (I2))
Si + O2 SiO2 (t = 600 C)
5.
3. Кремний стоек в кислотах. Единственнаякислотная
смесь, в которой растворяется кремний, HNO3конц + HFконц:
3 Si + 4 HNO3 + 18 HF 3 H2[SiF6] + 4 NO + 8 H2O.
4. Кремний нестоек в растворах (расплавах) щелочей:
Si + 2 NaOH + H2O Na2SiO3 + 2 H2.
5. Кремний реагирует с хлороводором:
Si + 3 HClг (Сu, 350 С) SiHCl3 + H2.
6. При высоких температурах кремний реагирует с
аммиаком и сероводором:
3 Si + 2 N2 Si3N4 (1300 1500 C)
Si + 2 H2S SiS2 + 2 H2.
6.
СилицидыСилициды известны для всех элементов 1 10 групп, кроме бериллия. В 11, 12
группах они известны только для меди.
Как и бориды и карбиды, формулы силицидов не могут быть выведены из
«простых» представлений о валентности. Известны силициды состава M6Si, M5Si,
M4Si, M15Si4, M3Si, M5Si2, M2Si, M5Si3, M3Si2, MSi, M2Si3, MSi2, MSi3, MSi6
Электроотрицательность атома кремния меньше по сравнению с атомом
углерода и сопоставима с электроотрицательностью атома бора. Однако r(Si) =
0,118 нм, а r(B) = 0,088 нм, поэтому силицидов, изоструктурных боридам, мало.
Получение силицидов:
1. Прямым синтезом 2 Mg + Si (t) Mg2Si
2. Взаимодействием оксида кремния с избытком металла 4 Mg + SiO2 (t)
Mg2Si + 2 MgO
3. Взаимодействием кремния с гидридами металлов CaH2 + Si (t) Ca2Si + 2 H2
4. Одновременным восстановлением оксида кремния(IV) и оксида металла
магнием или алюминием 5 TiO2 + 3 SiO2 + 16 Mg (700 C, 2 ч, в расплаве
LiCl/KCl) Ti5Si3 + 16 MgO.
7.
Химическая связь в силицидах щелочных и щелочно-земельных металловможет быть рассмотрена как ионная. Они более реакционноспособны:
Mg2Si + 4 HCl 2 MgCl2 + SiH4
2 NaSi + 5 H2O Na2Si2O5 + 5 H2 .
В структуре NaSi, KSi, BaSi2 присутствуют ионы Si44 , изоструктурные молекуле
белого фосфора P4.
Силициды переходных металлов являются металлоподобными. Они менее
реакционноспособны.
V3Si – сверхпроводник
ReSi – полупроводник
MoSi2 – жаростойкий материал.
Большое практическое значение имеет ферросилиций. Кремний повышает
твёрдость стали, сопротивление разрыву, пределы упругости и текучести,
увеличивает сопротивление окислению, снижает потери электроэнергии.
8.
Кремневодороды (силаны, гидриды кремния)Известны силаны SinH2n+2 с разветвленными и
неразветвленными цепями до n = 8 и циклические
силаны SinH2n (n = 5,6).
Связь Si Si гораздо менее прочная по сравнению
со связью C C, поэтому у силанов нет такого
разнообразия, как у углеводородов.
По сравнению с углеводородами, силаны гораздо
более реакционноспособны: они самопроизвольно
воспламеняются или взрываются на воздухе.
Термическая устойчивость силанов уменьшается с
увеличением длины цепи: SiH4 устойчив в
отсутствие окислителей, Si2H6 медленно
разлагается (2,5 % за 8 месяцев), тетрасиланы
Si4H10 разлагаются значительно быстрее.
9.
Получение силанов1. Обработка силицидов, содержащих Si , протонным реагентом,
например, водным раствором кислоты. С 1945 г. метод почти не
используется….
Mg2Si + 4 HCl 2 MgCl2 + SiH4
(образуется смесь силанов, они гидролизуются, выход мал, реакция
хорошо подходит для демонстрационных опытов (см. выше, но не для
синтеза…). Еще в 30-ые годы были сделаны попытки усовершенствовать
методику: использовать неводные системы типа NH4Br жидкий аммиак
и т.д., но, в целом, она сейчас не применяется.
2. Действие на соединения, содержащие Si +, реагентами, содержащими
гидрид-ион (Li[AlH4], LiH и т.д.) в эфирном растворе:
SiCl4 + Li[AlH4] (Et2O) SiH4 + AlCl3 + LiCl
SinCl2n+2 + (0,5n+0,5) Li[AlH4] (Et2O) SinH2n+2 + (0,5n+0,5)AlCl3 +
(0,5n+0,5)LiCl.
10.
Химические свойства силанов1. Сильные восстановители (сильнее углеводородов). Вспыхивают на
воздухе:
SiH4 + 2 O2 SiO2 + 2 H2O
5 SiH4 + 8 KMnO4 + 12 H2SO4 5 SiO2 nH2O + 8 MnSO4 + 4 K2SO4 +
(22 n) H2O.
SiH4 + AgCl Ag + SiH3Cl + HCl.
Реакции с галогенами практически не используются.
2. Гидролизуются в водных растворах. Гидролиз существенно ускоряется
щелочами:
SiH4 + 2 KOH + H2O K2SiO3 (условно, см. ниже) + 4 H2.
11.
Оксид кремния(IV)Существует в виде полиморфных модификаций:
Отличаются способом
сочленения тетраэдров
[SiO4].
12.
Свойства диоксида кремнияСтрого говоря, свойства зависят от модификации, но, в целом, SiO2 – достаточно
инертное соединение.
Оксид кремния(IV) устойчив к действию кислот, кроме HF:
SiO2 + 4 HFг SiF4 + 2 H2O
SiO2 + 6 HFр-р H2[SiF6] + 2 H2O.
Кислотный оксид. Растворяется в концентрированном растворе щелочи, быстрее
в расплавах щелочей и карбонатов с образованием силикатов:
SiO2 + 2 NaOHр-р Na2SiO3 (силикаты) + H2O
SiO2 + Na2CO3 (t, в расплаве) Na2SiO3 + CO2 .
При высоких температурах:
SiO2 + Si (1300 C, 10 4 мм.рт.ст.) 2 SiO (пары конденсируются в чернокоричневый порошок нестехиометрического состава).
SiO медленно разлагается 2 SiO Si + W-SiO2.
13.
SiO2 nH2OКремниевые кислоты
H4SiO4 единственная мономерная форма кремниевых кислот. Устойчива
только в очень разбавленных растворах (до 10 4 М). При концентрировании
происходят процессы поликонденсации:
H4SiO4 – слабая
кислота Ka1
10 10, Ka2 Ka3
10 12.
14.
Силикаты. Силикагель• В воде растворимы только силикаты щелочных металлов.
• В растворе силикаты сильно гидролизованы. Формально
процесс гидролиза описывается уравнением:
Na2SiO3 + (n+1)H2O ⇄ 2 NaOH + SiO2 nH2O.
Однако фактически в растворе присутствует смесь
полисиликатов. При подкислении полисиликатные анионы
образуют коллоидные растворы (золи), при старении
превращающиеся в гели поликремниевых кислот состава
[SiOx(OH)4 2x]n переменного состава.
При частичной дегидратации геля кремниевых кислот
образуются силикагели – материалы с развитой
поверхностью (750 800 м2/г). Они используются как
эффективные сорбенты и водопоглотители.
15.
СиликатыПолучение:
Na2CO3 + SiO2 (t,
сплавление) Na2SiO3 +
CO2 .
16.
ЦеолитыАлюмосиликатные материалы. Структура
цеолитов представлена тетраэдрами SiO44
и AlO45 , объединенными в полиэдры так,
что образуется система туннелей или
пересекающихся каналов определенного
размера. В пустотах располагаются
катионы, компенсирующие заряд
алюмосиликатных тетраэдров и молекулы
воды.
Молекулярные сита – цеолиты могут
поглощать молекулы тех веществ, которые
могут войти в их полости (0,3 1,3 нм).
17.
Галогениды кремнияПолучение
SiO2 + 4 HFг (250 400 С) SiF4 + 2 H2O
SiO2 + 2 CaF2 + 2 H2SO4 (t) SiF4 + 2 CaSO4 + 2 H2O
SiO2 + 2 C + 2 Cl2 (t) SiCl4 + 2 CO.
Si + 2 Br2 (620 700 C) SiBr4
SiO2 + 2 C + 2 Br2 (t) SiBr4 + 2 CO
Si + 2 I2 (500 C) SiI4.
В отличие от галогенидов углерода
H2[SiF6] сильная
подвержены гидролизу:
SiCl4 + (2+n)H2O SiO2 nH2O + 4 HCl. двухосновная кислота.
Координационное число кремния может быть
повышено до шести:
2 SiF4 + (2+n)H2O H2[SiF6] + SiO2 nH2O + 2 HF.
18.
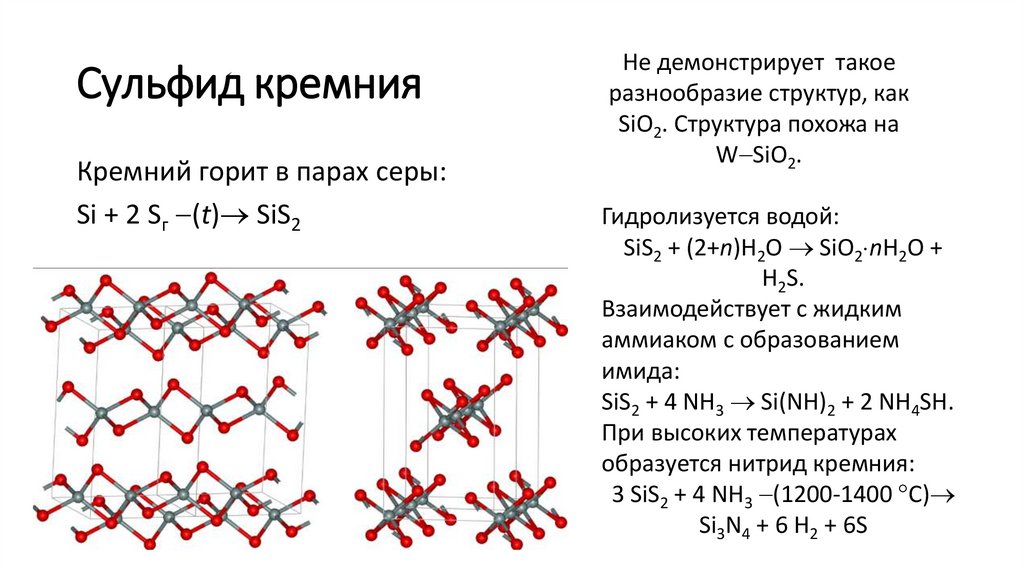
Сульфид кремнияКремний горит в парах серы:
Si + 2 Sг (t) SiS2
Не демонстрирует такое
разнообразие структур, как
SiO2. Структура похожа на
W SiO2.
Гидролизуется водой:
SiS2 + (2+n)H2O SiO2 nH2O +
H2S.
Взаимодействует с жидким
аммиаком с образованием
имида:
SiS2 + 4 NH3 Si(NH)2 + 2 NH4SH.
При высоких температурах
образуется нитрид кремния:
3 SiS2 + 4 NH3 (1200-1400 C)
Si3N4 + 6 H2 + 6S
19.
Нитрид кремнияКристаллическое вещество белого цвета (tпл =
1930 С), характеризующееся чрезвычайной
химической инертностью.
Получение:
3 Si + 2 N2 (1200 1500 C) Si3N4
3 SiO2 + 6 C + 2 N2 (t) Si3N4 + 6 CO
(термоуглеродное азотирование)
3 SiH4 + 4 NH3 (t) Si3N4 + 12 H2.
Реагирует только с расплавленными
щелочами, концентрированными горячими
растворами щелочей и горячей плавиковой
кислотой:
Si3N4 + 6 NaOH + 3 H2O 3 Na2SiO3 + 4 NH3
Si3N4 + 16 HF 2 (NH4)2[SiF6] + SiF4 .
Несколько модификаций ( , , ),
отличающиеся способом
сочленения тетраэдров SiN4.
20.
Применение кремния и его соединенийСтекло аморфный материал (переохлажденная жидкость). Можно
получить очень быстрым охлаждением расплава SiO2, однако на практике
применяют следующий способ:
Na2CO3 + CaCO3 + 6 SiO2 (t) Na2O CaO 6SiO2 + 2 CO2.
Замена CaO на PbO приводит к получению флинтгласа (искусственного
хрусталя).
Частичной заменой SiO2 на B2O3 получают химически стойкое стекло.
Боросиликатное стекло – пирекс имеет повышенное содержание B2O3 и
SiO .
21.
Германий, олово, свинец. Нахождение вприроде, получение
Германия в земной коре достаточно много (2,1 10 4 масс.%), но он
рассеян, сопутствует сульфидным рудам, силикатам. Получают из
пыли, образующейся при переработке цинковых руд. Финальная
стадия получения:
GeO2 + 2 H2 (530 C) Ge + 2 H2O.
Полученный металл очищают зонной плавкой.
Содержание олова в земной коре 1,5 10 4 масс. %. Минерал олова
касситерит (оловянный камень).
SnO2 + 2 C (t) Sn + 2 CO.
22.
Относительно большое содержание свинца в земной коре (1,3 10 4масс. %), что связано с тем, что его изотопы образуются как
конечный продукт радиоактивного распада природных урана и
тория. Основная свинцовая руда – галенит (PbS).
Для получения свинца галенит
обжигают:
2 PbS + 3 O2 (t) 2 PbO + SO2.
Образовавшийся при этом оксид
восстанавливают углем:
PbO + C (t) Pb + CO.
23.
Строение и физические свойства Ge, Sn, PbВ ряду Ge Sn Pb происходит нарастание металлических свойств.
Германий – полупроводник с шириной запрещенной зоны 0,66 эВ, что меньше,
чем у кремния (1,22 эВ). Германий образует серебристо-белые кристаллы со
структурой алмаза.
Олово существует в виде двух модификаций: белого тетрагонального олова,
устойчивого при комнатной температуре. При понижении температуры оно
превращается в олово с кубической алмазной структурой и свойствами
полупроводника (ширина запрещенной зоны 0,08 эВ, оловянная чума).
Свинец – ковкий низкоплавкий металл.
Структура –
гранецентрированная кубическая,
a = 0,49389 нм.
24.
Химические свойства Ge, Sn, Pb1) В ряду Ge Sn Pb происходит нарастание металлических свойств.
2) Для всех трех элементов возможны степени окисления +2 и +4, но устойчивость
соединений в этих степенях окисления различна. Для германия и олова более
характерна степень окисления +4. Соединения Sn+2 – восстановители. Для
свинца, наоборот, более характерна степень окисления +2 (инертность 6s2электронной пары). Соединения Pb+4 – сильные окислители.
Германий реагирует только с кислотами-окислителями (E (Ge2+/Ge 0 В (с.в.э.):
3 Ge + 4 HNO3 + 18 HCl 3 H2[GeCl6] + 4 NO + 8 H2O
Ge + 4 HNO3конц (медленно) GeO2 nH2O + 4 NO2 + (2 n)H2O
Ge + 4 H2SO4конц Ge(SO4)2 + 2 SO2 + 4 H2O.
В растворах щелочей германий растворяется только в присутствии окислителя
(пероксида водорода)
Ge + 2 H2O2 + 2 NaOH Na2GeO3 + 3 H2O.
25.
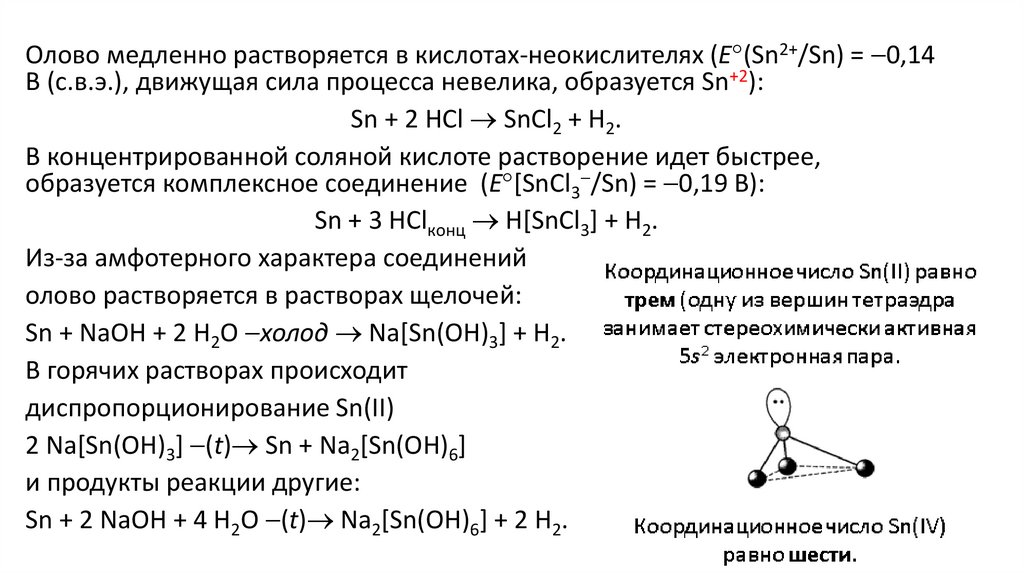
Олово медленно растворяется в кислотах-неокислителях (E (Sn2+/Sn) = 0,14В (с.в.э.), движущая сила процесса невелика, образуется Sn+2):
Sn + 2 HCl SnCl2 + H2.
В концентрированной соляной кислоте растворение идет быстрее,
образуется комплексное соединение (E [SnCl3 /Sn) = 0,19 В):
Sn + 3 HClконц H[SnCl3] + H2.
Из-за амфотерного характера соединений
олово растворяется в растворах щелочей:
Sn + NaOH + 2 H2O холод Na[Sn(OH)3] + H2.
В горячих растворах происходит
диспропорционирование Sn(II)
2 Na[Sn(OH)3] (t) Sn + Na2[Sn(OH)6]
и продукты реакции другие:
Sn + 2 NaOH + 4 H2O (t) Na2[Sn(OH)6] + 2 H2.
26.
Более сильные, чем H+1, окислители переводят олово в степеньокисления +4:
Sn + 4 H2SO4конц (t) Sn+4(SO4)2 + 2 SO2 + 4 H2O
Sn + 4 HNO3>60% Sn+4O2 nH2O ( оловянная кислота, n < 1) + 4 NO2 +
(2 n)H2O
3 Sn + 4 HNO3 30% 3 Sn+4O2 nH2O ( ) + 4 NO + (2 3n)H2O.
Очень разбавленная азотная кислота переводит олово в степень
окисления +2:
4 Sn + 10 HNO3 3% 4 Sn+2(NO3)2 + NH4NO3 + 3 H2O.
Олово реагирует с неметаллами: Sn + 2 Br2 SnBr4, Sn + O2 (200 C)
SnO2, Sn + 2 S (440 C, NH4Cl) SnS2.
Водяной пар действует на олово так же, как и на железо:
Sn + 2 H2O (t) SnO2 + 2 H2.
27.
У Pb(II) мало растворимых солей (только нитрат, ацетат, фторборат). По этой причине свинецпрактически не растворяется в разбавленных HCl и H2SO4, покрываясь пленкой нерастворимой
соли.
При повышении температуры растворимость PbCl2 возрастает и реакция становится
возможной:
Pb + 4 HСlконц (t) H2[PbCl4] + H2.
Свинец растворяется и в горячей концентрированной серной кислоте:
Pb + 3 H2SO4конц , >80% (t) H2[Pb(SO4)2] + SO2 + 2 H2O.
При обычных условиях свинец растворяется только в разбавленной азотной кислоте и в
уксусной кислоте в присутствии кислорода воздуха:
3 Pb + 8 HNO3 30% 3 Pb(NO3)2 + 2 NO + 4 H2O
2 Pb + O2 + 4 CH3COOH 2 Pb(CH3COO)2 + 2 H2O.
В растворах щелочей свинец почти не растворяется – реакция идет чрезвычайно медленно,
амфотерность свинца выражена слабо (образуется Na2[Pb(OH)4]).
При повышенных температурах свинец реагирует с неметаллами, но, в отличие от олова,
образуются соединения Pb+2:
Pb + Br2 (200 C) Pb+2Br2, Pb + S (800 C) Pb+2S.
Продукты, образующиеся при взаимодействии с кислородом, зависят от температуры:
3 Pb + 2 O2 (400 500 C) Pb3O4 (свинцовый сурик)
2 Pb + O2 (>600 C) 2 PbO.
28.
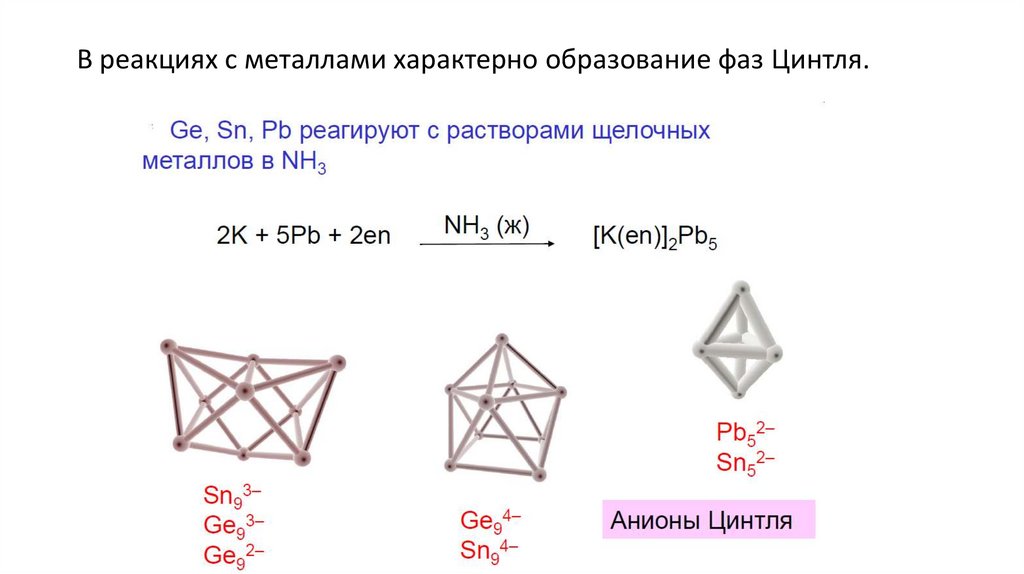
В реакциях с металлами характерно образование фаз Цинтля.29.
Гидриды элементов подгруппы германияГерманий, подобно кремнию, образует германоводороды.
Гомологический ряд GenH2n+2 существует до n = 10.
Моногерман GeH4, газ (tкип = 88 С), fH 298,15 = 92 кДж/моль, даже
несколько более стабильное соединение, чем силан – он устойчив на
воздухе в обычных условиях, не взаимодействует с водой.
Получение: 1) Mg2Ge + 4 HCl 2 MgCl2 + GeH4 , 2) GeO2 + Na[BH4] (водный
раствор) GeH4 + NaBO2, 3) GeCl4 + Li[AlH4] (Et2O) GeH4 + LiCl + AlCl3.
Станнан SnH4, газ, чрезвычайно токсичен, tкип = 52 С, fH 298,15 = 136
кДж/моль. На воздухе воспламеняется.
Получение: 1)SnCl2 + 3 Mg + 4 HCl SnH4 + 3 MgCl2, 2) SnCl4 + Li[AlH4]
(Et2O) SnH4 + LiCl + AlCl3.
Гидриды свинца очень неустойчивы, зафиксированы лишь в следовых
количествах.
30.
Оксиды германия, олова, свинцаСоединения в степени окисления +4
По мере движения по группе координационные числа в ряду диоксидов и
других кислородных соединений возрастают от 4 до 6, понижается
прочность связи M O, ослабевают кислотные и появляются основные
свойства.
PbO2 является сильным окислителем.
31.
GeO2 существует в виде нескольких модификаций:Гексагональный -GeO2 имеет такую же структуру как α-кварц, германий
имеет координационное число 4. Химически он более активен, чем
тетрагональный GeO2.
Тетрагональный α-GeO2 имеет структуру типа SnO2, подобен стишовиту
(модификации SiO2 высокого давления, германий имеет координационное
число 6).
Аморфный GeO2 похож на кварцевое стекло, состоит из слегка
искажённых тетраэдров с атомом германия в центре.
Для оксида германия(IV) характерно преобладание кислотных свойств.
GeO2 + H2O H2GeO3
H2GeO3 + H2O ⇄ H3O+ + HGeO3
pKa1 = 8,7
HGeO3 + H2O ⇄ H3O+ + GeO32
pKa2 = 12,7
GeO2 + 2 NaOHразб Na2GeO3 + H2O
GeO2 + 2 NaOHконц + 2 H2O Na2[Ge(OH)6]
GeO2 + Na2CO3 (1200 C) Na2GeO3 + CO2
GeO2 + 4 HClг (t) + 2 H2O, но
GeCl4 + (2+n) H2O GeO2 nH2O + 4 HCl
32.
SnO2 оловянный камень. Малореакционноспособное соединение.Пути перевода в растворимое состояние:
SnO2 + Na2CO3 (t, сплавление) Na2SnO3 + CO2
SnO2 + 2 K2S2O7 (t, сплавление) Sn(SO4)2 + 2 K2SO4.
Получение хлорида олова(IV) – оловянного масла
SnO2 + 2 C + 2 Cl2 (t) SnCl4 + 2 CO.
SnCl4 «дымит» на воздухе:
SnCl4 + (2+n) H2O SnO2 nH2O + 4 HCl.
Оловянные кислоты:
оловянная кислота:
H2[SnCl6] + 6 NH3 H2O SnO2 nH2O + 6 NH4Cl + (4 n) H2O
(n > 1).
оловянная кислота:
Sn + 4 HNO3конц SnO2 nH2O + 4 NO2 + (2 n) H2O.
(n < 1)
Со временем -оловянная кислота «стареет»,
отщепляя воду и превращаясь в менее
реакционноспособную форму.
33.
PbO2, в отличие от SnO2 и GeO2, является сильным окислителем.Получение:
Pb(CH3COO)2 + CaOCl2 + H2O PbO2 + CaCl2 + 2 CH3COOH.
Электрохимическое окисление в растворе Pb(NO3)2
( модификация):
Pb2+ + 2 H2O PbO2 + 4 H+ + 4 e.
Для получения PbO2 проводят электролиз горячего раствора
плюмбита Na2[Pb(OH)4].
PbO2 является сильным окислителем (E (PbO2/Pb2+) = 1,449 В
(с.в.э.), E (PbO2/PbSO4) = 1.685 В (с.в.э.)):
5 PbO2 + 2 MnSO4 + 6 HNO3 (t) 2 HMnO4 + 2 PbSO4 + 3 Pb(NO3)2 + 2
H2O.
PbO2 + 4 HClконц (t) PbCl2 + Cl2 + 2 H2O
2 PbO2 + 2 H2SO4 (t) 2 PbSO4 + O2 + 2 H2O.
34.
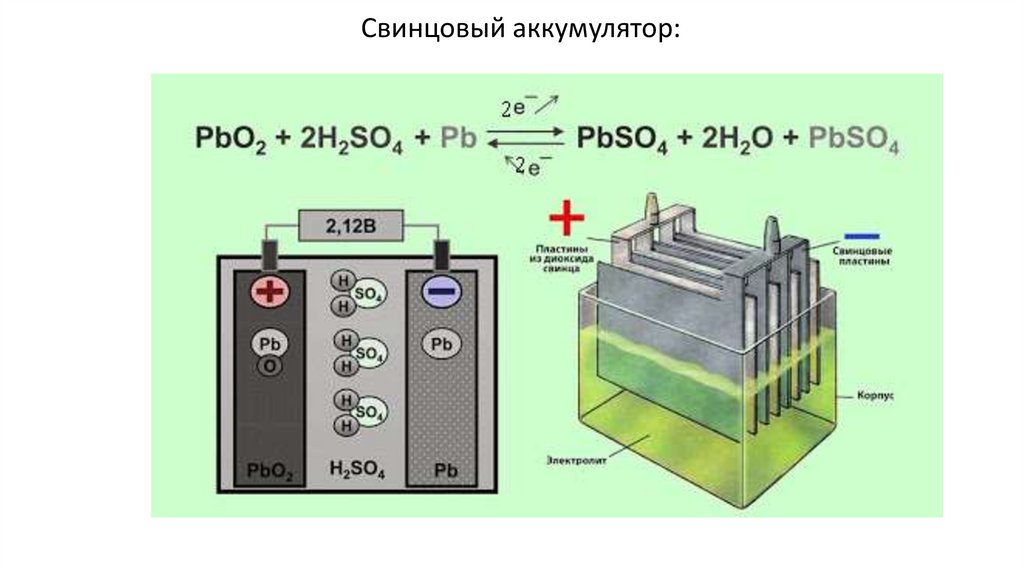
Свинцовый аккумулятор:35.
Оксиды элементов в степени окисления +2GeO неустойчив и диспропорционирует:
2 GeO ⇄ Ge + GeO2
SnO амфотерен, является восстановителем. Известен в нескольких модификациях.
Наиболее распространенная (сине-черная) образуется по реакции):
SnCl2 + 2 NH3 + H2O (t, атмосфера CO2) SnO + 2 NH4Cl.
PbO образует две модификации: красную тетрагональную (глет), устойчивую при
комнатной температуре и желтую ромбическую (массикот), стабильную выше 488
С.
Проявляет основный характер. Восстановителем почти не является.
36.
Смешанные оксиды свинцаPb2O3 (Pb+2O Pb+4O2) – черный
Pb3O4 (2 Pb+2O Pb+4O2) свинцовый сурик, красный.
3 Pb + 2 O2 (500 C) Pb3O4
3 PbO2 (300 500 C) Pb3O4 + O2.
«Разделение» степеней окисления свинца:
Pb3O4 + 4 HNO3 2 Pb(NO3)2 + PbO2 + 2 H2O
Pb3O4 + 8 CH3COOHледяная Pb(CH3COO)2 + Pb(CH3COO)4 + 4 H2O.
Окислитель благодаря наличию Pb+4:
Pb3O4 + 8 HСlконц 3 PbCl2 + Cl2 + 4 H2O.
37.
Соли Sn(II)Сильно гидролизованы, образуется мутный раствор из-за образования
основных солей:
SnCl2 + H2O ⇄ (SnOH)Cl + HCl.
Являются сильными восстановителями:
SnCl2 + 2 HgCl2 SnCl4 (условно) + Hg2Cl2
SnCl2 + Hg2Cl2 SnCl4 + Hg
2 H[AuCl4] + 3 SnCl2 + 4 HCl 2 Au + 3 H2[SnCl6]
10 SnCl2 + 4 KMnO4 + 16 H2SO4 5 SnCl4 + 5 Sn(SO4)2 + 4 MnSO4 + 2 K2SO4 + 16
H2O.
3 Na[Sn(OH)3] + 2 Bi(NO3)3 + 9 NaOH 2 Bi + 3 Na2[Sn(OH)6] + 6 NaNO3.
38.
Соли свинца (II)Малорастворимы, из простых солей растворимы
только нитрат, перхлорат и ацетат. Pb(CH3COO)2 3 H2O
свинцовый сахар.
Галогениды свинца (PbCl2, PbBr2, PbI2) нерастворимы в
холодной воде, но растворимы в горячей. PbI2 –
желтый (золотой дождь):
Pb(CH3COO)2 + 2 KI PbI2 + 2 CH3COOK.
Растворимые соли свинца сильно гидролизованы.
0,1 М
перхлорат
свинца
Окисление хлорида свинца до Pb+4:
PbCl2 + Cl2 + 2 NH4Cl (HClконц)
(NH4)2[PbCl6]
(NH4)2[PbCl6] + H2SO4 (0 C) PbCl4 +
(NH4)2SO4 + 2 HCl.
Свинцовые белила 2PbCO3 Pb(OH)2
39.
Сульфиды элементов подгруппы германияСтепень окисления +4
Pb+4S2 не существует.
Получение: 1) из простых веществ;
2) осаждение сероводородом из кислых растворов.
H2[SnCl6] + 2 H2S SnS2 + 6 HCl.
Кислотный характер сульфидов:
Образование тиосолей: SnS2 + (NH4)2S (NH4)2SnS3
Разрушение тиосолей: (NH4)2SnS3 + 2 HCl [H2SnS3] + 2 NH4Cl SnS2 + H2S + 2
NH4Cl.
Взаимодействие с щелочами в водном растворе: 3 SnS2 + 6 NaOH 2 Na2SnS3 +
Na2[Sn(OH)6].
Образование тиосолей в твердой фазе: SnO2 + 4 S + 2 Na2CO3 (t) Na2SnS3 +Na2SO4 +
2 CO2.
Окисление S 2: SnS2 + 16 HNO3конц (t) SnO2 nH2O + 2 H2SO4 + 16 NO2 +
(6 n) H2O.
40.
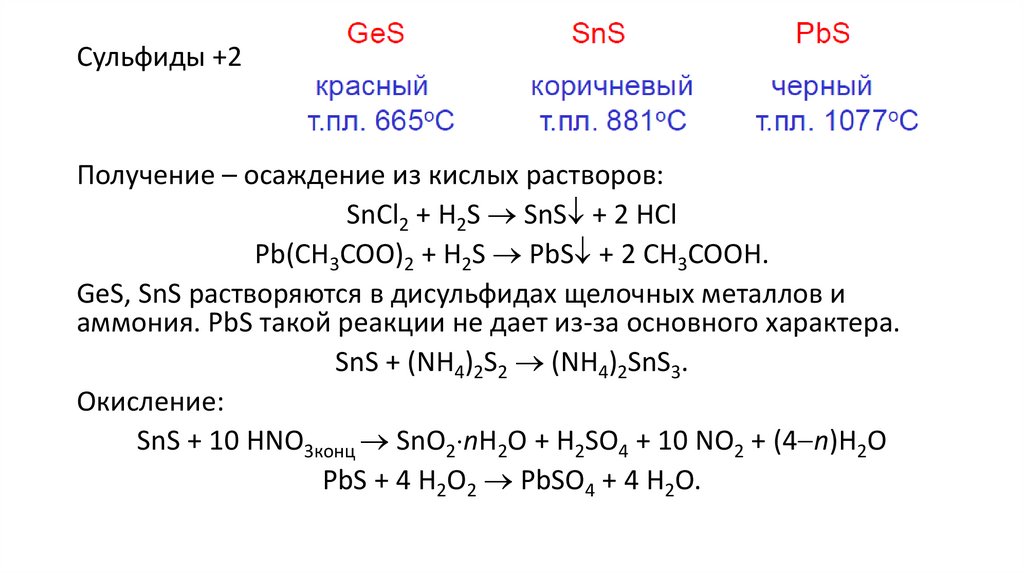
Сульфиды +2Получение – осаждение из кислых растворов:
SnCl2 + H2S SnS + 2 HCl
Pb(CH3COO)2 + H2S PbS + 2 CH3COOH.
GeS, SnS растворяются в дисульфидах щелочных металлов и
аммония. PbS такой реакции не дает из-за основного характера.
SnS + (NH4)2S2 (NH4)2SnS3.
Окисление:
SnS + 10 HNO3конц SnO2 nH2O + H2SO4 + 10 NO2 + (4 n)H2O
PbS + 4 H2O2 PbSO4 + 4 H2O.



































 chemistry
chemistry