Similar presentations:
Химия р-элементов
1.
Химия р-элементов2.
3.
р-Элементыр-элементы включают в себя все благородные
газы, кроме гелия, все неметаллы, кроме
водорода, все металлоиды, и даже
несколько металлов, в том числе Al, Sn и РЬ
O, Si и Al – наиболее распространенные
элементы в земной коре
C, N, O, P, S и Cl – среди элементов,
составляющих большую часть живой материи
C и S могут встречаться в свободном виде
4.
Общая характеристика p - элементовОбщая электронная формула:
[…] ns 2(n–2)f 14(n–1)d 10np 1 6
Степени окисления (от –IV до +VII).
Отличие свойств последнего элемента группы
(6 период): стабилизация низшей степени
окисления. Например, в IIIA-группе таллий (I);
в IVA-группе свинец (II); в VA-группе висмут
(III) и т.д.
Характерно образование кратных ( - и -)
связей; тип гибридизации атомных
орбиталей преимущественно sp3.
5.
р - элементы:Для простых и сложных веществ: катенация –
образование структур типа –Э—Э—Э– … (O3,
P4, S8, Na2Se5, HN3 …) и –Э—О—Э—О—Э– …
(H2S2O7, Na2B4O7 ...).
Неметаллические свойства: склонность к
образованию одноатомных анионов (S2–, Cl– и
т.д.), к образованию только сложных катионов
(NH4+, NO+ и т.д.), окислительные свойства.
С увеличением порядкового номера
элемента (сверху вниз по группе)
усиливается металличность.
6.
Металлический характер элементовуменьшается слева направо в периодах в связи с
увеличением энергии ионизации.
Максимальная степень окисления увеличивается в
периодах.
Ионный характер галогенидов и оксидов
уменьшается в каждом периоде.
Кислотный характер оксидов возрастает в каждом
периоде.
Ионный характер оксидов и галогенидов
увеличивается (сверху вниз по группе) и они
становятся более основными.
7.
Общая характеристика элементов13 группы.
8.
БОР9.
Открыт в 1808 г. Два известных французскихученых Жозеф Гей-Люссак и Луи Тенар
«отняли» воду у борной кислоты и на
полученный оксид подействовали
металлическим калием. Гей-Люссак и Тенар
объявили об открытии нового элемента.
Спустя несколько месяцев бор открыли
вторично. Великий английский химик
Хэмфри Дэви получил его при электролизе
расплавленного борного ангидрида.
Своим названием элемент обязан латинскому
слову borax, что значит бура.
10.
Жозеф Гей-ЛюссакЛуи Жак Тенар
11.
ПОЛУЧЕНИЕНаиболее чистый бор получают пиролизом:
B2H6 = 2B + 3H2
Термическое разложение паров бромида бора на
раскаленной (1000—1200°С) танталовой проволоке в
присутствии водорода:
2BBr3 + 3H2 = 2B + 6HBr
Метод металлотермии (чаще восстановление
магнием или натрием):
B2O3 + 3Mg = 3MgO + 2B
KBF4 + 3Na = 3NaF + KF + B
ΔG= −525 кДж
ΔG= −377 кДж
12.
Свойства бора1. Единственный неметалл в 13 группе
2. Очень высокие т.пл. (2573 оС) и т.кип. (3660 оС)
3. d = 2.35 г/см3 - черный, кристаллический бор
d = 1.73 г/см3 - коричневый, аморфный бор
4. Кристаллический бор очень твердый
(9.5 по шкале Мооса)
5. Кристаллический бор - полупроводник, Еg = 1.55 эВ
6. Бор имеет 2 стабильных изотопа 10В, 11В
10
1 n = 4 He + 7 Li
В
+
5
10
2
3
замедление нейтронов
7. Бор - восстановитель, Е0(Н3ВО3/В) = -0.87 В
13.
Строение бораВ основе кристаллического
строения бора лежит икосаэдр В12
d(B-B) = 173 пм
в икосаэдре В12
d(B-B) = 202 пм
между икосаэдрами В12
Новая форма бора - ионный бор
высокого давления ( В2 + В12 )
14.
АЛЮМИНИЙ15.
1808 году Хэмфри Дэви получил сплавалюминия с железом. Он писал: «Если бы
мне посчастливилось получить металлическое
вещество, которое я ищу, я бы предложил
для него название — алюминий».
Впервые алюминий был получен датчанином
Гансом Эрстедом в 1825 году действием
амальгамы калия на хлорид алюминия с
последующей отгонкой ртути.
Название
элемента
образовано
от латинского aluminis — квасцы.
16.
Ганс Эрстед17.
18.
Температуру ванны поддерживают впределах 950—970°С за счет тепла,
выделяющегося при прохождении
постоянного тока через электролит.
19.
Получение AlЭлектролиз Al2O3 в расплаве Na3AlF6 с графитовым электродом
Основной катодный процесс:
Al3+ + 3e- = Al
Основной анодный процесс:
Химические реакции:
2O2- - 4e- + C = CO2
2Al2O3= 4Al + 3O2
C + O2 = CO2
Суммарная: 2Al2O3 + 3C = 4Al + 3CO2
C + CO2 = 2CO
2Al+AlF3 = 3AlF
Al + 3NaF = AlF3 + 3Na
Обратная: Alраств + CO2 = Al2O3 + CO
Alраств.
20.
Производительность современныхэлектролизных ванн составляет
500—1200 кг алюминия в сутки. Для
получения 1 т алюминия расходуется:
1,95 т глинозема,
25 кг криолита,
25 кг фтористого алюминия,
0,5—0,6 т анодной массы,
14—16 МВт • ч электроэнергии.
21.
Галлий, индий, таллийВ 1875 году Лекок де Буабодран исследовал
спектр цинковой обманки. В этом спектре и была
обнаружена новая фиолетовая линия. После
длительных опытов удалось получить новый
элемент, но в очень небольшом количестве, что не
позволило изучить его физические и химические
свойства.
Он назвал элемент в честь своей родины Франции,
по её латинскому названию — Галлия (Gallia).
Символ Франции — петух (по-французски — le coq),
так что в названии элемента его первооткрыватель
неявно увековечил и свою фамилию. Кроме того на
латыни «петух» — gallus.
22.
Лекок де Буабодран23.
Индий был обнаружен Фердинандом Рейхом иТеодором Рихтером в 1863 году при
спектроскопическом исследовании цинковой
обманки. Спектроскопическая линия индия —
цвета индиго. Отсюда и происхождение
названия.
Таллий был открыт спектральным
методом в 1861 году английским
ученым Уильямом Круксом. Название элемент
получил по характерным зеленым линиям
своего спектра и зеленой окраске пламени.
От греч. θαλλος — молодая, зелёная ветвь.
24.
Распространение в природе. Минералы3. Al 7,57 % масс.
37. B 2·10–3 %. масс.
38. Ga
Редкие
65. Tl
рассеянные
элементы
68. In
25.
Боксит - FeO(OH) &Al2O3.2H2O
26.
Корунд - Al2O327.
Криолит - Na3[AlF6]28.
Нефелин - KNa3[AlSiO4]429.
Алунит - KAl(SO4)2 • 2Al(OH)330.
Полевой шпат (ортоклаз) —K2O×Al2O3×6SiO2
31.
Каолинит - Al2O3×2SiO2 ×2H2O
32.
B: бура Na2B4O7 . 10H2OКорунд
кернит Na2B4O7 . 4H2O
борацит Mg3(B7O13)Cl
сассолин B(OH)3
Сапфиры и
рубины
Кернит
Бура (тинкал)
Сассолин
33.
Элементы 13 группыОбщая электронная формула:
[…] ns 2 (n –1)d 10 np 1
nd 0
ns 2
np 1
Валентные возможности:
B 3, 4;
Al, Ga, In, Tl 3 6
Степени окисления: 0, +I, +III
(TlIII – с. ок-ль)
34.
Элементы 13 группыЭлемент B
Al
Ga
In
Tl
13
31
49
81
z
5
Ar
10,811 26,98
69,72
114,82 204,38
2,01
1,82
1,49
(ЭО)
Неметалл
1,47
1,44
Амфотерные элементы
35.
Элементы 13 группыB
Al
Неметалл
Ga
In
Tl
Амфотерные элементы
Рост металличности
Э2O3, Э(OH)3,
ЭХ3 …
Рост устойчивости ст. ок. +III
TlIII – окисл.
св-ва
Рост энергии связи ЭIII–X (для X – Cl,O)
Э2O3, Э(OH)3,
ЭХ3 …
Рост устойчивости ст. ок. +I
Tl2O, TlOH,
TlCl ...
36.
BAl
Ga
In
Tl
Рост акцепторной способности
BF3 + F– = [BF4]
(sp2)
(sp3)
AlF3 + 3F– = [AlF6]3
(sp2)
(sp3d 2)
t°
2AlCl3(т) = [Al2Cl6](г)
(sp2)
(sp3)
AlCl3·6H2O
Cl
: Cl
Al
Al
Cl
Cl
Cl :
Cl
КЧ (AlIII) 4 (валентность)
37.
Кислородные соединенияЭ2О3
Оксид алюминия
кислотный
амфотерные
B
Al Ga In Tl
кислотность увеличивается
Э2O3(т) + 2NaOH (т) = 2NaЭO2(т) + H2O(г)
(Э = B Tl, сплавление)
Э2O3(т) + 6H3O+(р) = 2Э3+(р) + 9H2O
(Э = Al Tl)
Tl2O – основный оксид, TlOH – сильное основание
38.
Кислородные соединенияЭ(OH)3
B
Al Ga In Tl
B(OH)3
кислота
амфотерные гидроксиды
Гидроксид алюминия
+ к-та
+ щел.
катион
анион
Вид катионов
[Э(H2O)6]3+
(КЧ 6)
Вид анионов
[ЭХ4]– (КЧ 4)
[ЭХ6]3– (КЧ 6)
39.
Водородныесоединения
BH3
не существует
(Э+IIIН3–I)n (Al, Ga)
(Э+IН–I)n (In, Tl)
B2H6 – диборан
Полимерные гидриды
40.
41.
Свойства диборанаH3B-CO
(HBNH)3
боразол
CO
p, to
LiBH4
B2H6
NaBH4 + NaB3H8 + …
B2H5Cl + H2
B(OCH3)3 + H2
42.
Строение B2H6E
E
*
sp2 sp2
1s1
несв
0
H
1
св
B0 B+
43.
44.
Гидридные комплексыЭН3 + H– = [ЭH4]
B Al Ga In Tl
Рост устойчивости комплексов
Na[BH4] – тетрагидридоборат натрия
Li[AlH4] – тетрагидридоалюминат лития
Восстановительные свойства
[AlH4] + 4H2O = [Al(OH)4] + 4H2
Li[AlH4] + RCHO = RCH2OH + LiOH + Al(OH)3
45.
Физические свойства простыхвеществ
B
Al
Ga
In
Tl
т. пл., С
2075
660,4 29,8
156,6 303,6
т. кип., С
3700
2500
2403
2024
1457
, г/см3
2,34
2,70
5,90 (т) 7,30
11,84
Индий
Бор
Алюминий
Галлий
Таллий
46.
Активность простых веществ, В
для Э3+ / Э
, В
для Э+ / Э
B
Al
–
–1,66 –0,53 –0,34
–
–
Для Tl3+ / Tl
Ga
–
In
–
= +1,25 В
(Tl3+ – сильн. окислитель)
Tl
–
–
0,336
47.
Химические свойства простыхвеществ
B + 3HNO3 = B(OH)3 + 3NO2
4B + 4NaOH(т) + 3 O2 = 4NaBO2 + 2H2O
(сплавление)
2Ga + 6H3O+ + 6H2O =
= 2[Ga(H2O)6]3+ + 3H2
2Ga + 2OH + 6H2O =
= 2[Ga(OH)4] + 3H2
48.
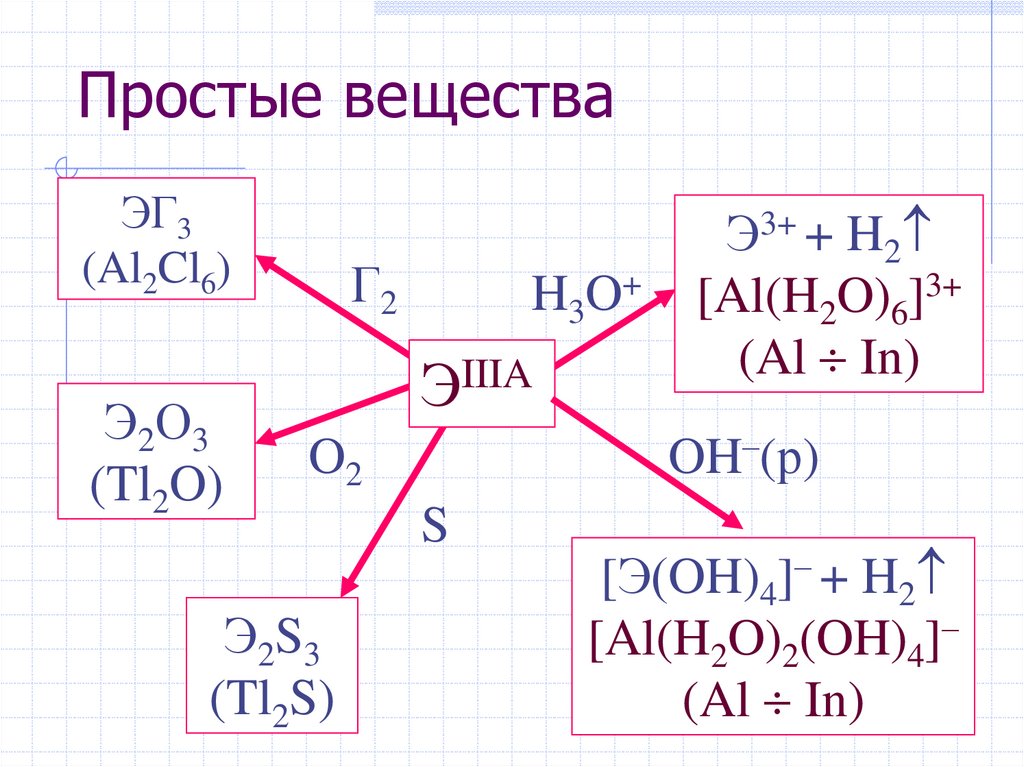
Простые веществаЭГ3
(Al2Cl6)
Э2О3
(Tl2O)
Г2
H3O+
ЭIIIA
OH–(р)
O2
Э2S3
(Tl2S)
Э3+ + H2
[Al(H2O)6]3+
(Al In)
S
[Э(OH)4]– + H2
[Al(H2O)2(OH)4]–
(Al In)
49.
Особенности химии бораB12 крист.
B аморф.
50.
Кислородные соединения бораB2O3 – кислотный оксид
B2O3 + 3H2O = 2B(OH)3
Гидроксид бора B(OH)3 (борная
кислота)
I. Растворение и гидратация:
B(OH)3(т) + H2O = [B(H2O)(OH)3](р)
II. Протолиз
[B(H2O)(OH)3] + H2O [B(OH)4] + H3O+;
KK = 5,75 · 10–10
51.
Строение B(OH)3 и [B(H2O)(OH)3]OH
OH
B
B
HO
OH
sp2-гибр.
t°
HO
: OH2
OH
sp3-гибр.
t°
t°
B(OH)3 (HBO2)3 (HBO2)n B2O3
–H2O
–H2O
–H2O
52.
Строение (HBO2)3 и (HBO2)nHO
OH
:O
B
HO
HO
O:
:O
B ..
B
O
B
B
:O
OH
Триметаборная кислота
HO
B
:O
Полиметаборная кислота
53.
Тетраборат натрия Na2B4O7·10H2O(бура)
Na2B4O7 + 2H2O = 2Na+ + [B4O72– · 2H2O]
(диссоциация и гидратация)
OH
[B4O5(OH)4] 2
O B O
HO
B
B
O
O
B
OH
O
OH
B sp3
B sp2
54.
Гидролиз тетраборатанатрия
[B4O5(OH)4] 2 + 2H2O 4B(OH)3 ·H2O + 2OH–
pH > 7
B(OH)3
+NaOH
Na3BO3
H2B4O7
HBO2
+HCl
Na2B4O7
NaBO2 (t)
Na[B(OH)4]
55.
Получение B(OH)3BCl3 + 3H2O = B(OH)3 + 3HCl (лаб.)
Na2B4O7 + H2SO4 + 5H2O =
= 4B(OH)3 + Na2SO4 (лаб., пром.)
56.
Обнаружение соединений бораNa2B4O7 + 12C2H5OH + 2H2SO4 =
= 4B(OC2H5)3 + 7H2O + 2NaHSO4
2B(OC2H5)3 + 18 O2 = B2O3 + 15H2O + 12CO2
Получение и горение борноэтилового эфира.
57.
Бориды1. Образуются большинством металлов
2. Бориды d-металлов тугоплавки,
часто нестехиометричны т.пл. (ZrB) = 2996оС
3. Получаются прямым взаимодействием при высокой t
4. По кристаллическому строению делятся на 2 группы:
- Образованные внедрением атомов B в структуру металла
- Содержащие кластеры В
MgB2
CaB6
58.
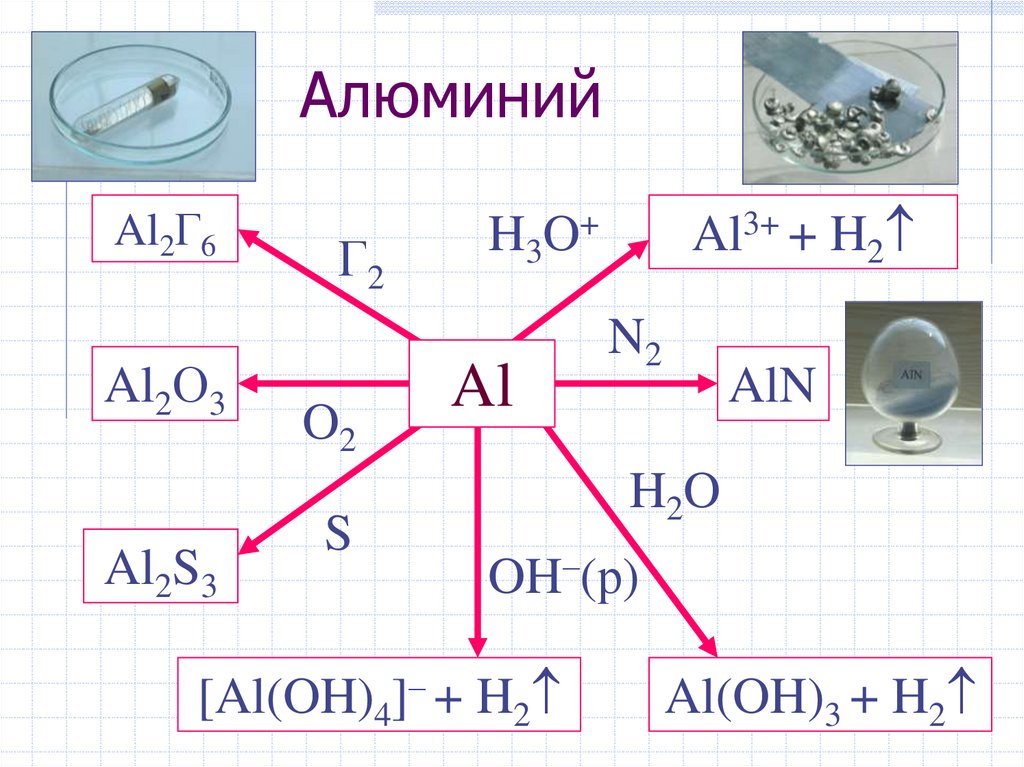
АлюминийAl2Г6
Al2О3
Al2S3
Г2
O2
S
Al3+ + H2
H3O+
Al
N2
AlN
H2O
OH–(р)
[Al(OH)4]– + H2
Al(OH)3 + H2
59.
Окисление амальгамированногоалюминия
Алюминиевая ложка,
погруженная в раствор
Hg(NO3)2, покрывается
амальгамой – сплавом Al и Hg.
Алюминий теряет защитную
оксидную плёнку и окисляется,
превращаясь в белые хлопья
Al(OH)3.
Термитная сварка
Самолеты
Изделия из алюминия в быту
60.
2Al + 6H3O+ + 6H2O = 2[Al(H2O)6]3+ + 3H2Al3+/Al = –1,70 B
2Al + 2OH + 6H2O = 2[Al(OH)4] + 3H2
[Al(OH)4]–/Al = –2,34 B
2Al + 6H2O = 2Al(OH)3 + 3H2
Al(OH)3 /Al = –1,54 B
В щелочной среде восст. св-ва сильнее:
8Al + 30 HNO3(оч. разб.) =
= 8Al(NO3)3 + 3NH4NO3 + 9H2O
8Al + 18H2O + 5KOH + 3KNO3 =
= 8K[Al(OH)4] + 3NH3
61.
Al2O3 и Al(OH)320 °C
Al3+ + 3 NH3·H2O
Al(OH)3 аморфный
+t; –H2O
80 °C
AlO(OH) кристал.
+t; –H2O
Al(OH)3 – амфолит:
Al2O3
Al(OH)3(т) + 3H2O [Al(H2O)3(OH)3](р)
[Al(H2O)3(OH)3] + H2O
[Al(H2O)2(OH)4]– + H3O+; Kк = 3,2·10–8
[Al(H2O)3(OH)3] + H2O
[Al(H2O)4(OH)2]+ + OH–; Kо = 7,4·10–9
62.
Формы существования AlIII в растворахрН < 4 (изб. к-ты): [Al(H2O)6]3+ sp3d 2
(октаэдр)
рН > 4 (гидролиз):
[Al(H2O)6]3+ + H2O [Al(H2O)5OH]2+ + H3O+
Kк = 9,55·10–5
рН > 7: [Al(H2O)2(OH)4 ] sp3d 2
(искаж. октаэдр)
рН > 7 (изб. щелочи): [Al(OH)4 ] sp3
(тетраэдр)
63.
64.
65.
66.
67.
ХИМИЧЕСКИЕ СВОЙСТВА Ga, In, TlХарактерная степень окисления Ga и In +3, для Tl
+1. От галлия к таллию увеличивается активность.
С углеродом и азотом эти элементы не
взаимодействуют.
Галлий растворяется в смеси азотной и
плавиковой кислот, легко растворяется в щелочах
и даже в аммиаке:
2Ga + 2NaOH + 6H2O = 2Na[Ga(OH)4] + 3H2
2Ga + 2NH4OH + 6H2O = 2NH4[Ga(OH)4] + 3H2
Индий хорошо растворим и в кислотах и щелочах:
2In + 6HCl = 2InCl3 + 3H2
68.
Таллий в щелочах не растворяется, хорошорастворим в кислотах:
Tl + 2HNO3 = TlNO3 + NO2 + H2O
3. Оксиды Ga2O3, In2O3, Tl2O получают
термическим разложением гидроксидов.
2Ga(ОН)3 = Ga2O3 + 3Н2О
Оксиды галлия и индия в воде не
растворимы, Tl2O при взаимодействии с водой
образует гидроксид TlOH - сильное основание
Tl2O + Н2О = 2TlОН
69.
В чистом виде галлий применяется дляизготовления высококачественных зеркал, в
полупроводниковой промышленности. Оксид
галлия при добавлении в стекло дает
эффект высокого блеска.
Индий применяется в полупроводниковой
технике и для изготовления сплавов особого
назначения.
Таллий – в виде соединений в приборах
ночного видения.
70.
Общая характеристикаэлементов 14 группы.
71.
Распространение в природеи важнейшие минералы
2. Si 25,80%
(27,72% в литосфере)
13. C 0,087%
(0,032% в литосфере)
31. Sn 0,0035%
35. Pb 0,0018%
46. Ge 6 ·10–4% (РРЭ)
Аметист
Агат
Кремний: кварц, яшма, агат, опал,
силикаты, алюмосиликаты
Кварц
Опал
Каолинит
72.
Углерод: графит, алмаз, каменный уголь,нефть, природный газ, орг. в-ва, карбонаты
Графит
Кальцит
Алмаз
Газодобыча
Каменный уголь
73.
Германий, олово и свинецКасситерит SnO2
Галенит PbS
Аргиродит
Германит (FeIICu6IGe2)S8
(Ag8IGeIV)S6
74.
КРЕМНИЙВ 1825 году шведский химик Йенс Якоб
Берцелиус действием металлического калия
на фтористый кремний SiF4 получил чистый
элементарный кремний.
Новому элементу было дано название
«силиций» (от лат. silex — кремень).
Русское название «кремний» введено в 1834
году российский химиком Германом
Ивановичем Гессом. В переводе c
греческого kremnos — «утес, гора».
75.
Кремний в природе содержится вомногих минералах в виде оксида SiO2,
из которого элементарный кремний
можно получить восстановлением
магнием или углеродом:
SiO2 + 2Mg = 2MgO + Si
В чистом виде кремний тверд, хрупок,
имеет алмазоподобную структуру.
76.
ГЕРМАНИЙЭлемент был предсказан
Д.И.Менделеевым (как эка-кремний) и
открыт в 1885 году немецким
химиком Клеменсом Винклером при
анализе минерала -аргиродита Ag8GeS6.
Германий выделяют в виде оксида
GeO2,который восстанавливают водородом
при 600 оС до простого вещества:
GeO2 + 2H2 = Ge + 2H2O
77.
Элементы 14 группыC
Si
Ge
Sn
Pb
z
Ar
6
14
32
50
82
12
28,1
72,6
118,7
207,2
2,50
2,25
2,02
1,72
1,55
Неметаллы
Амфотерные элементы
Рост металличности
78.
Общая электронная формула:[…] ns 2 (n–1)d 10np2
nd 0
ns 2
np 2
Валентные возможности:
С: 2, 4;
Si, Ge, Sn, Pb: 2 6
Степени окисления: –IV, 0, +II, +IV
Устойчивые ст.ок.: С, Si, Ge, Sn: +IV
(PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
79.
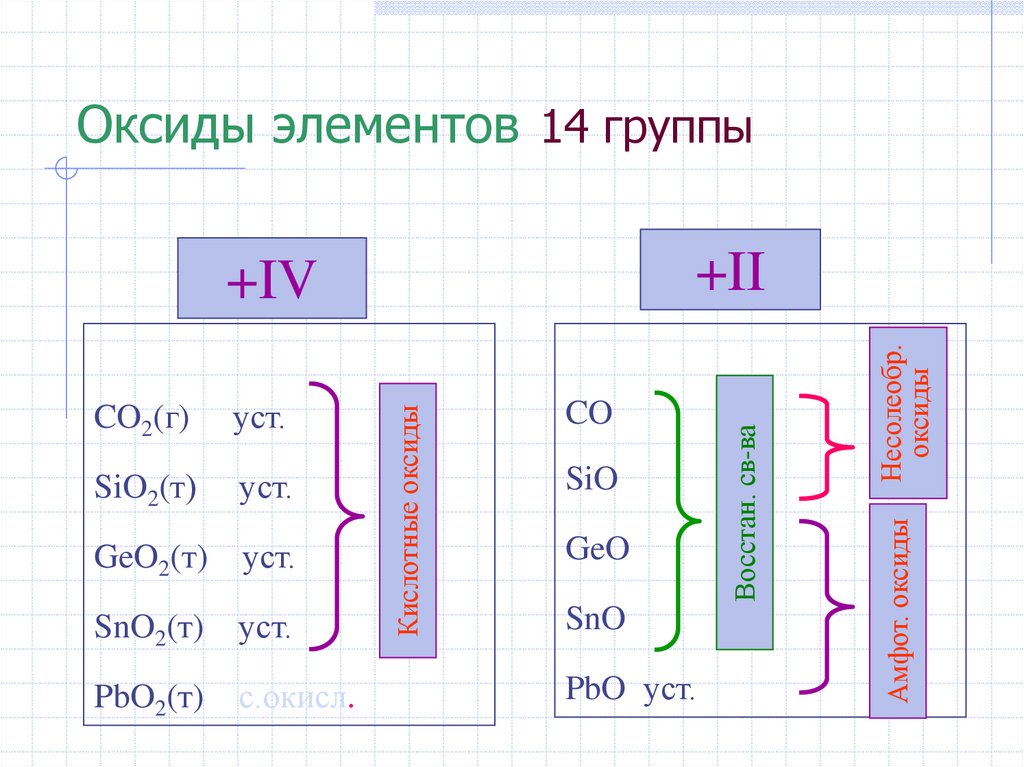
Оксиды элементов 14 группыуст.
GeO2(т)
уст.
SnO2(т)
уст.
PbO2(т)
с.окисл.
SiO
GeO
SnO
PbO уст.
Несолеобр.
оксиды
SiO2(т)
CO
Амфот. оксиды
уст.
Кислотные оксиды
CO2(г)
Восстан. св-ва
+II
+IV
80.
Водородные соединения элементов14 группы
СH4
SiH4
GeH4
SnH4
PbH4 неуст.
Склонность к катенации
(образование цепей состава
Э—Э—Э—Э—Э) в ряду
C
Si
Ge
Sn
уменьшается
Pb
81.
Простые веществаАллотропия
Углерод: алмаз (sp3),
графит (sp2), карбин
(sp), фуллерен.
Олово «белое» и
«серое».
Структура алмаза и графита
Олово белое
Олово серое
Алмаз
Графит
82.
Новые формы углеродаУглеродная нанотрубка
Длина до 10 мкм, диаметр 10-15 нм
+Н2
плазма
Графен - один слой графита
Графан - гидрированный графен
83.
Новые формы углеродаНобелевская премия по физике 2010 года
Андрей Гейм
Константин Новоселов
«За новаторские эксперименты с двумерным материалом - графеном»
84.
Химические свойстваПри комнатной температуре
С, Si, Ge + H2O
С, Si, Ge + H3O+
Sn, Pb + H2O
Sn + H3O+ Sn2+ + H2
Pb + H3O+ Pb2+ + H2
Кремний
Германий
Олово
Свинец
85.
Химические свойстваС(т) + KOH
Si + 4NaOH = Na4SiO4 + 2H2
Si + 8OH– –4e – = SiO44– + 4H2O
2H2O + 2e – = H2 + 2OH–
Ge + 2KOH + 2H2O2 = K2[Ge(OH)6]
Ge + 6OH– –4e – = [Ge(OH)6]2–
H2O2 + 2e – = 2OH–
Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2
Sn + 3OH– –2e – = [Sn(OH)3]–
2H2O + 2e – = H2 + 2OH–
86.
Простые веществаЭГ2, ЭГ4
(Sn, Pb)
+O2
+Г2
OH–
ЭIVA
SiO44–
+S
ЭS, ЭS2
H3O+
[Э(OH)3]– + H2
(Sn, Рb)
ЭO, ЭO2
(Sn, Pb)
HNO3
(конц)
CO2, Pb2+, SnO2 · nH2O
HNO3
(разб)
Э2+ + H2
(Sn, Pb)
Sn2+, Pb2+
87.
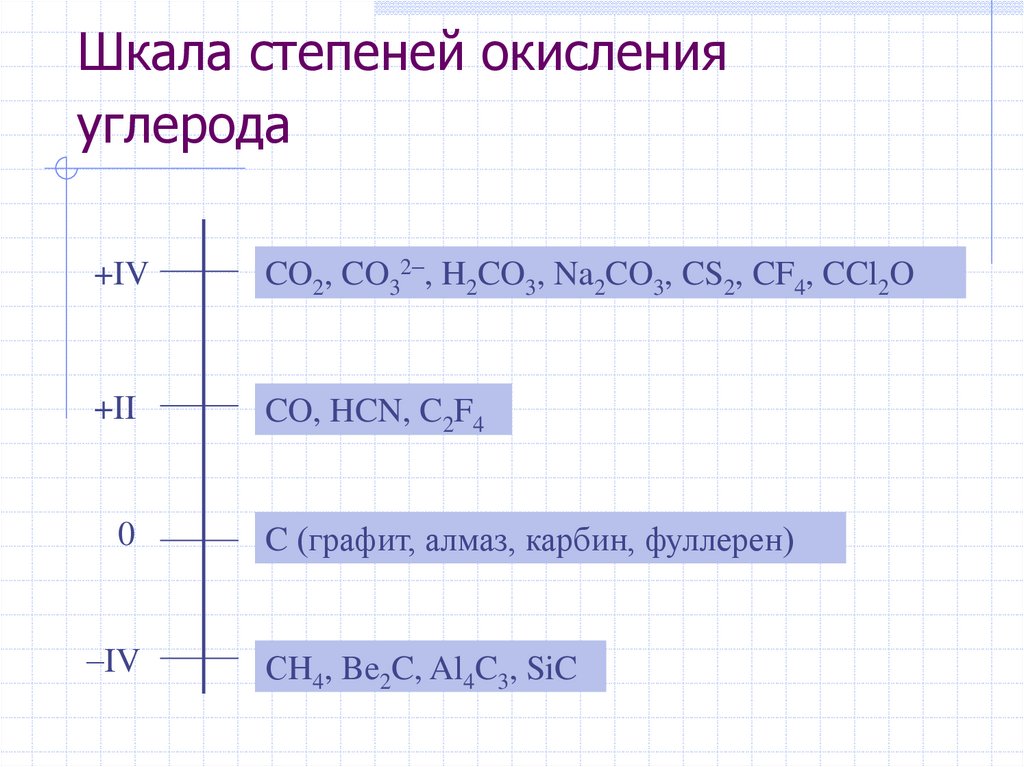
Шкала степеней окисленияуглерода
+IV
CO2, CO32 , H2CO3, Na2CO3, CS2, CF4, CCl2O
+II
CO, HCN, C2F4
0
C (графит, алмаз, карбин, фуллерен)
IV
СH4, Be2C, Al4C3, SiC
88.
ГрафитТ. пл. 3800 С, т. кип.
4000 С, плотность
2,27 г/см3,
электропроводен,
устойчив.
Типичный восст-ль
(реагирует с
водородом,
кислородом, фтором,
серой, металлами).
Кристаллическая
решетка слоистая (sp2гибридизация).
89.
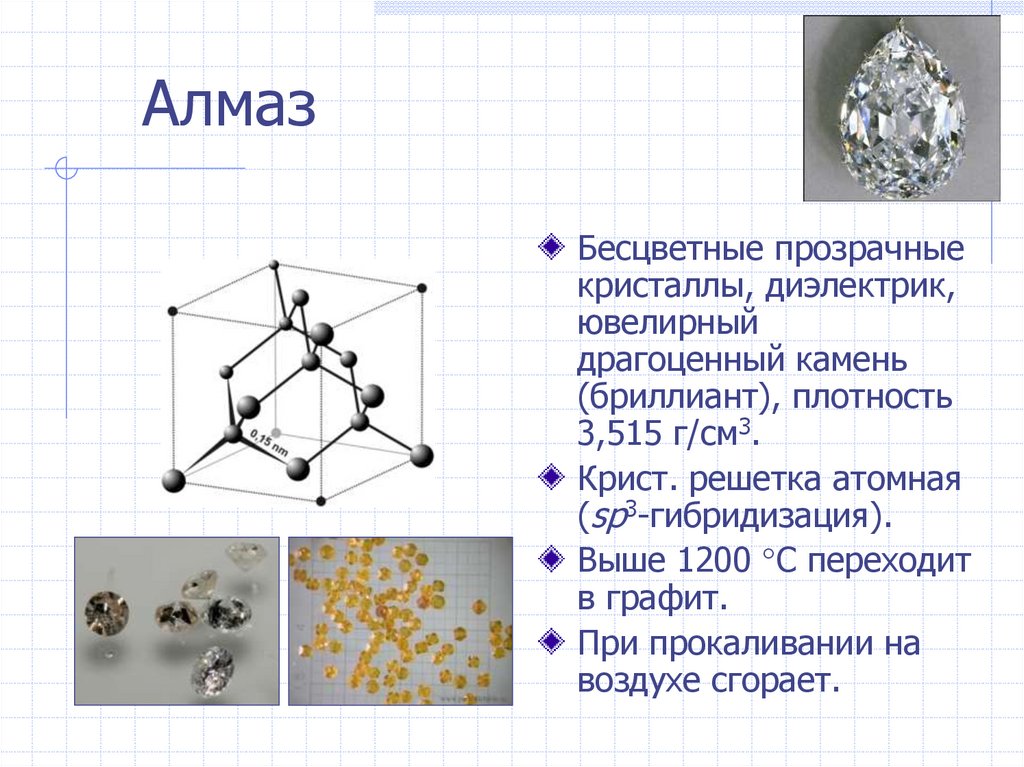
АлмазБесцветные прозрачные
кристаллы, диэлектрик,
ювелирный
драгоценный камень
(бриллиант), плотность
3,515 г/см3.
Крист. решетка атомная
(sp3-гибридизация).
Выше 1200 С переходит
в графит.
При прокаливании на
воздухе сгорает.
90.
Карбин и фуллеренКарбин: линейные макромолекулы (С2)n,
бесцветен и прозрачен, полупроводник; плотность
3,27 г/см3; выше 2300 С переходит в графит.
Фуллерен: С60 и С70
(полые сферы), темноокрашенный порошок,
полупроводник, т. пл.
500-600 C, плотность
1,7 г/см3 (С60).
Фуллерен С70
Фуллерен С60
91.
Поверхность сталипод микроскопом
Карбиды
Карбид кальция
Солеобразные (CaC2,
Al4C3)
Ковалентные
(SiC)
Металлоподобные
(Fe3C, WC)
CaC2 + 2H2O =
= Ca(OH)2 + C2H2
Al4C3 + 12H2O =
= 4Al(OH)3 + 3CH4
Карбид
кремния
Резец из победита
(сплав на основе
WC)
92.
Водородные соединения. Метан - CH4sp3
СН4 – газ без цвета и
запаха, горюч, главная
сост. часть природного
газа.
Получение в лаборатории:
CH3COONa + NaOH (+t) =
= Na2CO3 + CH4
Горение:
CH4 + O2 = С + 2H2O
CH4 + 2O2 (изб.) =
= СO2 + 2H2O
93.
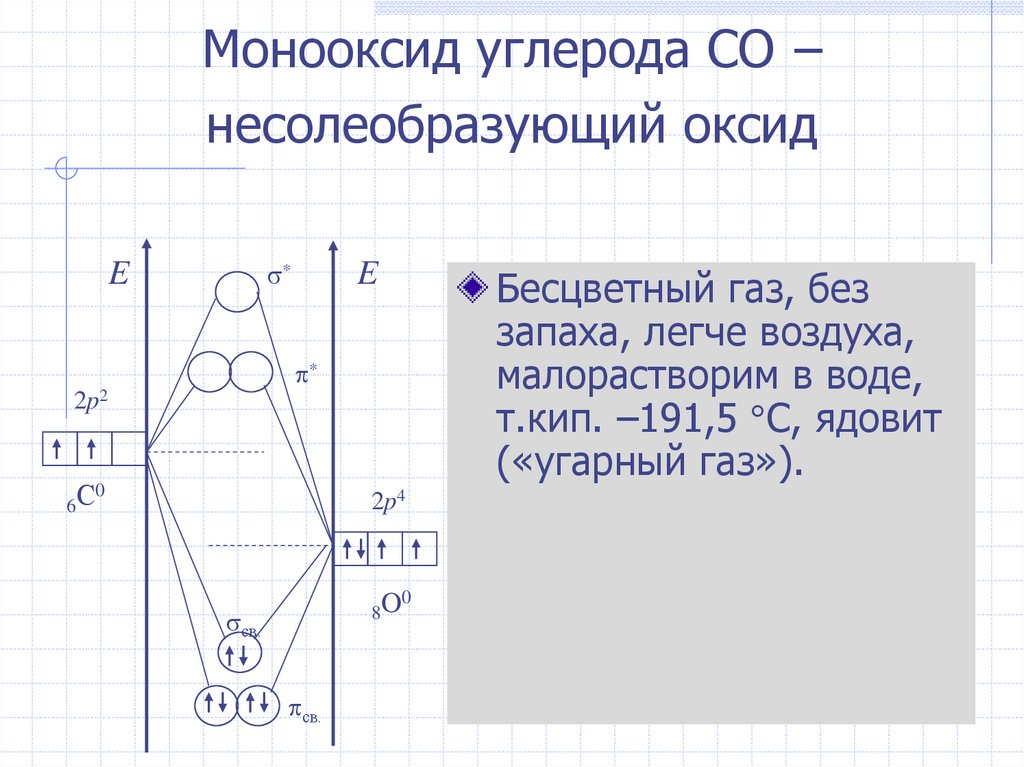
Монооксид углерода CO –несолеобразующий оксид
*
E
E
Бесцветный газ, без
запаха, легче воздуха,
малорастворим в воде,
т.кип. –191,5 С, ядовит
(«угарный газ»).
*
2p2
0
6С
2p4
8O
св.
св.
0
94.
Монооксид углерода COДонорные свойства:
CO образует прочные
комплексы, например
[Fe(CO)5].
Fe
: C ::: O
Обнаружение:
PdCl2 + CO + H2O = Pd + CO2 + 2HCl
I2O5 + 5CO = I2 + 5CO2
95.
Молекула СО очень прочна и способнавступать в реакции окисления восстановления только при высоких
температурах.
На воздухе СО горит голубоватым пламенем:
2СО + O2 = 2СO2
При нагревании он восстанавливает металлы
из их оксидов:
FеО + СО = Fе + СО2↑
В присутствии катализатора или под
действием облучения СО окисляется хлором,
образуя ядовитый газ фосген:
СО + Сl2 = СОСl2
96.
При взаимодействии с парами воды идетобратимая реакция с образованием СО2 и
водорода:
СО + Н2О ↔ СО2 + Н2
При нагревании с водородом при
повышенном давлении образуется
метиловый спирт:
СО + 2Н2 = СН3ОН
Со многими металлами СО образует летучие
карбонилы:
Ni + 4СО = Ni(СО)4
В природе оксид углерода (II) практически
не встречается.
97.
Диоксид углерода CO2 (кислотный оксид)O
,
С
,
O
sp-гибридизация
«Сухой лед»
Бесцветный газ, без
запаха, тяжелее
воздуха, умеренно
растворим в воде (при
комн. т-ре в 1 л воды –
около 1,7 л CO2).
В тв. сост. («сухой лёд»)
– молекулярная крист.
решетка; т. возгонки
–78 С, т.пл. –57 С
(р = 5 атм).
98.
Моногидрат CO2 . H2O иугольная кислота H2CO3
В водном растворе:
CO2 (г) + H2O CO2 . H2O H2CO3
H2CO3 – слабая двухосновная кислота:
H2CO3 + H2O HCO3– + H3O+ ; KK = 4,27 · 10–7
HCO3– + H2O CO32– + H3O+ ; KK = 4,68 · 10–11
Соли – карбонаты и гидрокарбонаты M2CO3 и MHCO3
подвергаются гидролизу (рН > 7).
Термическое разложение гидрокарбонатов:
2NaHCO3 = Na2CO3 + CO2 + H2O
99.
Строение: sp2-гибридизацияHO
O
O
C
C
OH
Угольная
кислота
O
–
2–
O
C
OH
Гидрокарбонат-ион
O
O
Карбонат-ион
100.
С азотом углерод образует дициан, газ сзапахом миндаля, хорошо растворимый в
воде:
2C + N2 = (CN)2
(CN)2 + 4H2O = (NH4)2C2O4
При взаимодействии дициана со щелочами
образуются два ряда солей цианиды и
цианаты:
(CN)2 + 2KOH = KCN + KNCO + H2O
KCN – соль цианистоводородной кислоты
(цианид калия), KNCO – соль циановой
кислоты (цианат калия).
101.
Карбамид и цианамидСинтез карбамида:
NH4NCO (NH2)2CO (+t)
(Фридрих Вёлер, 1828 г.)
O
sp2
C
H2N
Цианамид NH2CN и
цианамид кальция Ca(CN2)
– соль цианамида H2(CN2)
..
:N
Карбамид
NH2
sp
C
.. 2–
N:
Цианамид-ион CN22–
(сравн. строение CO2)
102.
ПсевдогалогенидыЦиановодород HCN –
бесцв.ж., т. пл. –13,3 С,
т.кип. +25,6 С).
В водн. р-ре – слабая
«синильная кислота»:
HCN + H2O CN– + H3O+
KK = 4,93 · 10–10
Цианид-ион CN :
донорные св-ва, образует
прочные комплексы,
ядовит.
Fe
: C:::N–
HCN – производное
дициана C2N2
103.
ПсевдогалогенидыТиоцианат водорода
HNCS («родановодород»)
не ядовит.
В водном растворе HNCS сильная к-та
Ион NCS : слабые
донорные свойства
.. sp
.. –
:N
C
H
N
C
sp2
sp
..
S:
HNCS – производное
дитиоциана (SCN)2
S:
Тиоцианат-ион NCS–
(сравн. строение CO2)
M
: NCS–
тиоцианато-N
M
: SCN–
тиоцианато-S
104.
105.
106.
107.
КремнийХимическое растворение
3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O
Si + 4NaOH = Na4SiO4 + 2H2
Получение кремния
SiO2 + 2Mg = 2MgO + Si
SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)
108.
Кристаллическая решетка кремния109.
ХИМИЧЕСКИЕ СВОЙСТВАПри низких температурах кремний очень
инертен. При высоких температурах :
Si + 2F2 = SiF4
Si + C = SiC (карборунд)
Si + 2Mg = Mg2Si (силицид)
С цинком, алюминием, оловом, свинцом,
серебром, золотом силициды не образуются.
Хорошо растворяется в щелочах и плавиковой
кислоте:
Si + 4NaOH = Na4SiO4 + 2H2
Si + 4HF = SiF4 + 2H2
SiF4 + 2HF = H2[SiF6]
110.
Водородные соединения SinH2n+2(силаны)
Моносилан SiH4:
SiH4 + 2O2 = SiO2 + 2H2O
Получение силанов:
SiO2 + 4Mg(изб) = Mg2Si + 2MgO
(силицид магния)
Mg2Si + 4H2O = 2Mg(OH)2 + SiH4
Mg2Si + 4H3O+ = 2Mg2+ + 4H2O + SiH4
Получение кремния
и силана
111.
Кислородные соединенияПолиморфизм диоксида кремния:
573 С
1470 С
1728 С
кварц тридимит кристобалит SiO2(ж) (расплав)
SiO2
GeO2
+ H2O
SiO2
GeO2
+ H3O+
SiO2 + 4NaOH(р) = Na4SiO4 + 2H2O (ортосиликат натрия)
GeO2 + 2NaOH(т) = Na2GeO3 + H2O (метагерманат натрия)
112.
Травление стеклаSiO2 + 4HF = SiF4 + 2H2O
SiO2 + 6HF (изб.) = H2[SiF6] +
2H2O (гексафторосиликат
водорода)
113.
При подкислении водных растворовсиликатов
SiO2 . nH2O ( n 300)
H4SiO4
Kк 10–10
дикремниевая к-та H6Si2O7
трикремниевая к-та H6Si3O10,
тетраметакремниевая к-та (H2SiO3)4,
полиметакремниевая к-та (H2SiO3)n
Na4SiO4(р) + 2CO2 + 2H2O = H4SiO4 + 2Na2CO3
Na2CO3 + SiO2(т) = Na2SiO3(т) + CO2 (сплавление)
114.
115.
116.
117.
ГЕРМАНИЙВыделяют в виде оксида GeO2,который
восстанавливают водородом при 600
оС до простого вещества:
GeO2 + 2H2 = Ge + 2H2O
118.
Письмо Клеменса Винклера Д.И.Менделееву:«Милостивый государь!
Разрешите мне при сем передать Вам оттиск
сообщения, из которого следует, что мной
обнаружен новый элемент «германий». Сначала я
был того мнения, что этот элемент заполняет пробел
между сурьмой и висмутом в Вашей замечательно
проникновенно построенной периодической системе
и что этот элемент совпадает с Вашей экасурьмой,
но все указывает на то, что здесь мы имеем дело с
экасилицием.
Преданный Клеменс Винклер Фрейберг, Саксония 26
февраля 1886 г.»
Менделеев ответил:
«Так как открытие Германия является венцом
периодической системы, то Вам, как «отцу»
германия, принадлежит этот венец; для меня же
является ценной моя роль предшественника и то
дружеское отношение, которое я встретил у Вас».
119.
ХИМИЧЕСКИЕ СВОЙСТВАХарактерная степень окисления в
соединениях для Ge +4.
При нагревании реагирует с кислородом,
серой, хлором, не реагирует с водородом,
углеродом, азотом, водой.
Ge + O2 = GeO2
Ge + 2S = GeS2
Ge + 2Cl2 = GeCl4
В ряду активности Ge стоит между Cu и Ag,
т.е. после водорода.
120.
Германий взаимодействует сконцентрированной азотной кислотой:
Ge + 4HNO3 = H2GeO3 + 4NO2 + H2O
Реагирует со щелочами в присутствии
окислителя:
Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]
С кислородом Ge дает два ряда оксидов и
гидроксидов. GeO - черный тугоплавкий
порошок, не растворимый в воде,
взаимодействует с кислотами и щелочами:
GeO + 2HCl = GeCl2 + H2O
GeO + 2NaOH = Na2GeO2 + H2O
германит натрия
121.
Гидроксид Ge (II) получаютвзаимодействием соли со щелочью:
GeCl2 + 2NaOH = Ge(OH)2 + 2NaCl
при избытке щелочи гидроксид, выпавший в
осадок растворяется:
Ge(OH)2 + 2NaOH = Na2[Ge(OH)4]
Гидролиз солей анионного типа идет до
конца:
Na2GeO2 + 2H2O = Ge(OH)2 + 2NaOH
Соли катионного типа гидролизуются только
по I ступени, т.к. получающийся основные
соли выпадают в осадок:
GeCl2 + H2O = GeOHCl + HCl
122.
Оксид GeO2 тугоплавкое белое вещество,получают получают окислением металла в
кислороде при нагревании.
Соответствующий гидроксид можно
получить при действии на соль щелочью:
GeCl4 + 4NaOH = Ge(OH)4 + 4NaCl
Гидроксид взаимодействует с кислотами и
щелочами:
Ge(OH)4 + H2SO4 = Ge(SO4)2 + H2O
Ge(OH)4 + 2NaOH = Na2[Ge(OH6)]
Соли анионного типа носят название
"германаты"
123.
Sn, PbАллотропия олова:
13,2 °С
-Sn
(порошок)
Серое олово
173 °С
232 °С
-Sn -Sn расплав
(металл)
Белое олово
124.
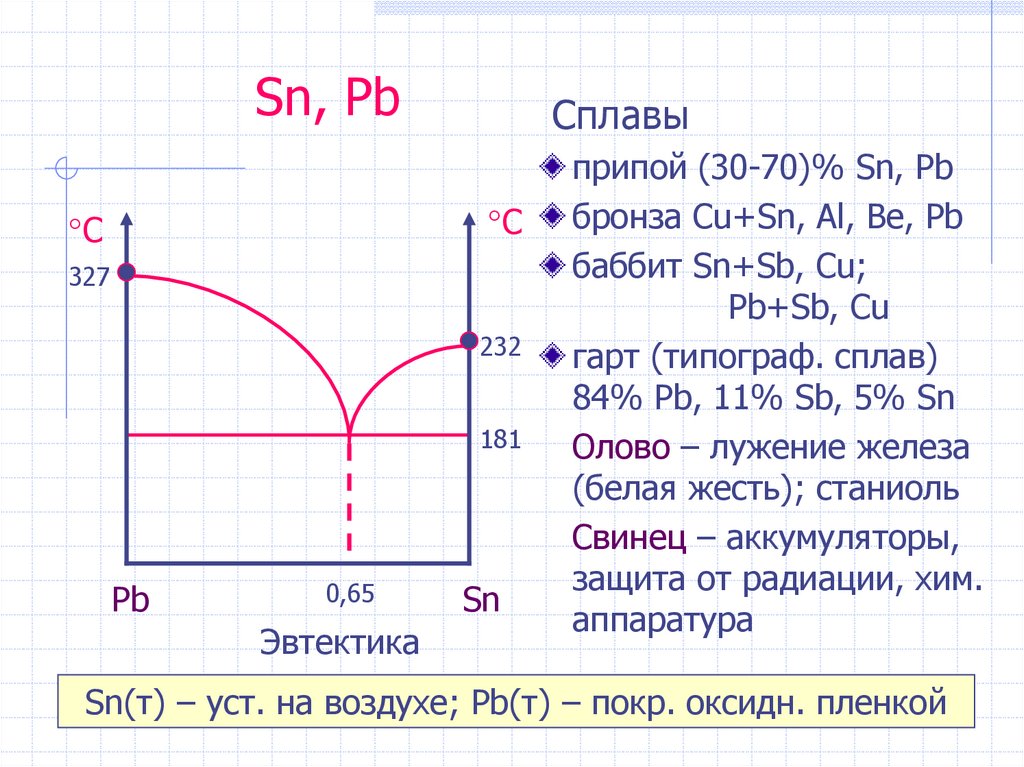
Sn, PbCплавы
°С
°С
327
232
181
Pb
0,65
Эвтектика
Sn
припой (30-70)% Sn, Pb
бронза Cu+Sn, Al, Be, Pb
баббит Sn+Sb, Cu;
Pb+Sb, Cu
гарт (типограф. сплав)
84% Pb, 11% Sb, 5% Sn
Олово – лужение железа
(белая жесть); станиоль
Свинец – аккумуляторы,
защита от радиации, хим.
аппаратура
Sn(т) – уст. на воздухе; Pb(т) – покр. оксидн. пленкой
125.
Олово полиморфно. В обычных условияхоно существует в виде β-модификации
(белое олово), устойчивой выше 13,2°C.
Белое олово — это серебристо-белый,
мягкий, пластичный металл. Температура
плавления 231,9°C, температура кипения
2270°C.
При охлаждении белое олово переходит
в α-модификацию (серое олово). Оно
имеет структуру алмаза.
126.
В ЭХРН: Zn… Al… Sn… Pb H Cu…Ag HgПолучение металлов
SnO2(т) + C(т) = Sn(ж) + CO2(г)
2PbS(т) + 3O2(г) = 2PbO(т) + 2SO2(г)
PbO(т) + C(т) = Pb(ж) + CO(г)
Регенерация Sn из покрытий
а) хим. растворение в NaOH, б) электролиз
а) хлорирование, б) восстановление SnCl4
127.
Химические свойстваПри комнатной температуре олово устойчиво
к воздействию воздуха и воды. Заметное
окисление олова на воздухе начинается при
температурах выше 150°C:
Sn + O2 = SnO2.
При нагревании олово реагирует с
большинством неметаллов. При этом
образуются соединения в степени окисления
+4:
Sn + 2Cl2 = SnCl4
С концентрированной соляной кислотой олово
медленно реагирует:
Sn + 4HCl = SnCl4 + H2
128.
В разбавленной серной кислоте олово нерастворяется, а с концентрированной —
реагирует очень медленно.
Состав продукта реакции олова с азотной
кислотой зависит от концентрации
кислоты. В концентрированной азотной
кислоте образуется оловянная кислота βSnO2·nH2O (иногда ее формулу записывают
как H2SnO3):
Sn + 4HNO3 (к) = β-SnO2·H2O + 4NO2 + H2O
129.
При взаимодействии с разбавленной азотнойкислотой олово проявляет свойства металла.
3Sn + 8HNO3 (р) = 3Sn(NO3)2 + 2NO + 4H2O
При нагревании олово может реагировать с
водными растворами щелочей, образуется
гидроксокомплекс Sn (II):
Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2
130.
Гидрид олова — станнан SnH4 — можнополучить по реакции:
SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.
Медленно разлагается уже при t=0°C.
Олову отвечают два оксида
SnO2 (образующийся при обезвоживании
оловянных кислот) и SnO. Последний можно
получить при слабом нагревании гидроксида
олова (II) Sn(OH)2 в вакууме:
Sn(OH)2 = SnO + H2O
При сильном нагреве оксид олова (II)
диспропорционирует:
2SnO = Sn + SnO2
131.
При хранении на воздухе монооксид SnOпостепенно окисляется:
2SnO + O2 = 2SnO2
При гидролизе растворов солей олова (IV)
образуется белый осадок — так
называемая a-оловянная кислота:
SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl
H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O
Свежеполученная a-оловянная кислота
растворяется в кислотах и щелочах:
a-SnO2·nH2O + KOH = K2[Sn(OH)6]
a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O
132.
С концентрированной серной кислотой (приконцентрации более 80%) свинец реагирует
с образованием растворимого гидросульфата
Pb(HSO4)2, а в горячей концентрированной
соляной кислоте растворение
сопровождается образованием комплексного
хлорида H4PbCl6. Разбавленной азотной
кислотой свинец легко окисляется:
Pb + 4HNO3 = Pb(NO3)2 + 2NO2 + H2O
Разложение нитрата свинца(II) при
нагревании - удобный лабораторный метод
получения диоксида азота:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
133.
Свинец медленно растворяется и вконцентрированных щелочах с выделением
водорода:
Pb + 2NaOH + 2H2O = Na2Pb(OH)4 + H2
Белый гидроксид свинца(II), легко
осаждаемый из растворов его солей, также
растворяется как в кислотах, так и в сильных
щелочах:
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Pb(OH)2 + 2NaOH = Na2Pb(OH)4
При стоянии или нагревании
Pb(OH)2 разлагается с выделением PbO. При
сплавлении PbO со щелочью образуется
плюмбит состава Na2PbO2.
134.
При продолжительном нагреваниирасплавленного свинца он постепенно
переходит сначала в желтый оксид PbO
(свинцовый глет), а затем (при хорошем
доступе воздуха) - в красный сурик
Pb3O4 или 2PbO·PbO2.
Диоксид образуется при обработке сурика
азотной кислотой:
Pb3O4 + 4HNO3 =
PbO2 + 2Pb(NO3)2 + 2H2O
135.
Если сильно нагревать коричневый диоксид,то при температуре около 300° С он
превратится в оранжевый Pb2O3 (PbO·PbO2),
при 400° С - в красный Pb3O4, а выше 530° С
- в желтый PbO (разложение
сопровождается выделением кислорода).
Диоксид свинца - сильный окислитель.
PbO2 + 4HCl = PbCl2 + Cl2 + H2O
PbO2 + SO2 = PbSO4
5PbO2 + 2MnSO4 + H2SO4 =
5PbSO4 + 2HMnO4 + 2H2O
136.
Соединения свинца(IV) обладаюттипичными амфотерными свойствами.
Pb(OH)4 + 6HCl = H2PbCl6
Pb(OH)4 + 2NaOH = Na2Pb(OH)6
Диоксид свинца, реагируя со щелочью,
также образует комплексный плюмбат(IV):
PbO2 + 2NaOH + 2H2O = Na2[Pb(OH)6]
137.
Соли SnIIмалорастворим только сульфид
Соли PbII
все малорастворимы в воде (кр.
нитрата, перхлората, ацетата)
[Pb2+]: PbSO4 > PbCrO4 > PbS
PbSO4(т) + CrO42– = PbCrO4(т) + SO42–
белый
желтый
PbCrO4(т) + S2– = PbS(т) + CrO42–
жёлтый
черный
Растворение осадков:
PbSO4(т) + H2SO4 = Pb(HSO4)2
2PbCrO4(т) + 4HNO3 =
= 2Pb(NO3)2 + H2Cr2O7 + H2O
PbCrO4(т) + 3NaOH = Na[Pb(OH)3] + Na2CrO4
138.
Разделение олова и свинца(сульфидный метод)
1. Осаждение сульфидов (+H2S):
SnS(т)
PbS(т)
+Na2S2
2. Растворение сульфида,
образование Na2[SnS3]
(тиокомплекс)
+ HCl
Na2S2: S–I +1e – = S–II
SnS [SnS3]2– :
Sn+II –2e – = Sn+IV
3. Осаждение [SnS3]2– + 2H+ SnS2(т) + H2S


































































































































 chemistry
chemistry