Similar presentations:
Негрыжевые варианты стойкой компрессии поясничных и крестцовых корешков
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕУЧРЕЖДЕНИЕ ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
На правах рукописи
МОХОВ
НИКИТА ВАЛЕРЬЕВИЧ
НЕГРЫЖЕВЫЕ ВАРИАНТЫ СТОЙКОЙ КОМПРЕССИИ ПОЯСНИЧНЫХ
И КРЕСТЦОВЫХ КОРЕШКОВ ПРИ ДЕГЕНЕРАТИВНО–
ДИСТРОФИЧЕСКИХ ПОРАЖЕНИЯХ ПОЗВОНОЧНИКА
(КЛИНИКО–НЕЙРОВИЗУАЛИЗАЦИОННЫЕ ПАРАЛЛЕЛИ)
14.01.18 – нейрохирургия
ДИССЕРТАЦИЯ
на соискание ученой степени
кандидата медицинских наук
Научный руководитель:
доктор медицинских наук, профессор
Данилов Валерий Иванович
Научный консультант:
доктор медицинских наук, профессор
Ибатуллин Мурат Масгутович
Казань
2019
2.
2ОГЛАВЛЕНИЕ
СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4
ВВЕДЕНИЕ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
5
ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
13
1.1 Факторы компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника и их роль в развитии рефлекторных и компрессионных синдромов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
13
1.2 Роль современных методов нейровизуализации в диагностике причин
стойкой компрессии поясничных и крестцовых корешков конского хвоста. . . . .
20
1.3 Клиническая картина компрессионной радикулопатии поясничных и
крестцовых корешков при дегенеративных поражениях позвоночника. . . . . . . . .
26
1.4 Эволюция хирургических методов лечения при стойкой компрессии
поясничных и крестцовых корешков. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
31
ГЛАВА II. МАТЕРАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ. . . . . . . . . . . . . . . . . . . .
41
ГЛАВА III. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ. . . . . . . . . . . . .
46
3.1 Нейровизуализационная семиотика негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
48
3.2 Частота негрыжевых факторов стойкой компрессии по результатам мультимодальной предоперационной нейровизуализации. . . . . . . . . . . . . . . . . . . . . . . .
56
3.3 Клиническая картина стойкой компрессии поясничных и крестцовых корешков у больных с негрыжевой и грыжевой компрессией. . . . . . . . . . . . . . . . . . .
63
ГЛАВА IV. ЗНАЧЕНИЕ ПРЕДОПЕРАЦИОННОЙ ДИАГНОСТИКИ ФАКТОРОВ КОМПРЕССИИ ПОЯСНИЧНЫХ И КРЕСТЦОВЫХ КОРЕШКОВ
ДЛЯ ОРГАНИЗАЦИИ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ. . . . . . . . . . . . . . . . . . . .
72
4.1 Варианты декомпрессии поясничных и крестцовых корешков у больных с
различными факторами сдавления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
72
4.2 Эффект декомпрессии поясничных и крестцовых корешков в раннем послеоперационном периоде. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
82
ЗАКЛЮЧЕНИЕ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
86
3.
3ВЫВОДЫ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
104
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
106
ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕЙ РАЗРАБОТКИ ТЕМЫ . . . . . . . . . . . .
107
СПИСОК ЛИТЕРАТУРЫ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
108
ПРИЛОЖЕНИЕ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. .
128
4.
4СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ
МПД – межпозвонковый диск
РСП – рубцово–спаечный процесс
ВРВ – варикозно расширенные вены
ГЖС – гипертрофия желтой связки
СПК – стеноз позвоночного канала
ОК – отечная клетчатка
ОФ – остеофиты
КФС – киста фасеточного сустава
СЛ – спондилолистез
РКТ – рентгеновская компьютерная томография
МРТ – магнитно–резонансная томография
ФПК и ППС – факультета повышения квалификации и переподготовки
профессиональных кадров
ВАШ – визуально–аналоговая шкала боли
5.
5ВВЕДЕНИЕ
Актуальность темы исследования
Проблема лечения дегенеративно-дистрофических поражений позвоночника уже на протяжении многих лет вызывает интерес исследователей. В клинической картине неврологических осложнений поясничного остеохондроза
выделяют две группы синдромов: рефлекторные и компрессионные. К первой
группе отнесены нейрососудистые (гипотония и гипертония кровеносных сосудов), мышечные (дистонические) и дистрофические – (нейроостеофиброз) синдромы, ко второй – вертебральные и нейрональные (патология спинномозговых
корешков и патология вегетативной нервной системы). Одной из актуальных
задач является определение тактики лечения пациентов со стойкими компрессионными синдромами поясничных и крестцовых корешков, нередко требующими хирургического лечения с целью их декомпрессии. По данным
Я.Ю.Попелянского, 1989; М.К. Михайлова, 2006; Н.А. Коновалова, 2010; В.А.
Мануковского 2017, А.О. Гуща, 2018 компрессионные синдромы составляют
10% вертеброневрологических заболеваний, и представляют существенную долю от всех больных с поясничной болью. Среди причин стойкой компрессии
поясничных и крестцовых корешков самой частой является грыжа межпозвонкового диска. Доказана существенная роль и «негрыжевых» форм стойкой компрессии
поясничных
и
крестцовых
корешков
при
дегенеративно-
дистрофических заболеваниях позвоночника (Шулёв Ю.А. и соавт., 2000; Луцик А.А. 2004; Данилов В.И., Филатов В.С., 2006; Коновалов Н.А., 2010; Назаренко А.Г., 2012; Древаль О.Н., 2014; Пташников Д.А., 2016; Beautie P.F. et al.,
Pfirmann C.W. et al., 2004). «Негрыжевые» варианты стойкой компрессии нервных корешков при дегенеративных поражениях позвоночника: гипертрофия
желтой связки, варикозно расширенные вены позвоночного канала, рубцовоспаечный процесс со стенозированием позвоночного канала, отек и воспаление
6.
6эпидуральной клетчатки, остеофиты, гипертрофия фасеточных суставов, киста
фасеточного сустава, стеноз позвоночного канала на фоне листеза позвонков.
В 2006 году на кафедре неврологии и нейрохирургии ФПК и ППС Казанского государственного медицинского университета было выполнено диссертационное исследование посвященное «негрыжевым» формам стойкой компрессии поясничных и крестцовых корешков при дегенеративно-дистрофических
поражениях поясничного отдела позвоночника на основании интраоперационных находок. Было установлено, что у 20,5% пациентов причиной стойкой
компрессии поясничных и крестцовых корешков являются «негрыжевые» факторы. Поэтому разработка диагностики «негрыжевых» факторов стойкой компрессии поясничных и крестцовых корешков на основании данных мультимодальной нейровизуализации позвоночника является актуальной задачей.
Степень разработанности темы исследования
Изучение литературы, посвященной проблемам дегенеративно-дистрофических поражений поясничного отдела позвоночника показало, что достаточно полно описана клинико-нейровизуализационная семиотика грыж диска.
Отдельных исследований, обобщающих классификацию и нейровизуализационную семиотику «негрыжевых» вариантов стойкой компрессии нервов позвоночного канала, не найдено. В клинических рекомендациях по диагностике и
лечению пациентов с компрессиоными радикулопатиями Северо-Американской
спинальной ассоциации (NASS) говорится о нехватке высококачественных исследований
по
нейровизуализации
позвоночника
при
дегенеративно-
дистрофических поражениях. Исследования, проведенные ранее разными группами авторов (Jackson et al. 1989; Jansenn et al. 1994; Pfirmann et al. 2004) были
выполнены на небольшой выборке пациентов, были без рандомизации и посвящены сравнительной оценке чувствительности разных методов диагностики
(МРТ, РКТ, КТ-миелографии и миелографии позвоночника) у пациентов с компрессиоными радикулопатиями (преимущественно грыжевого характера). Дан-
7.
7ный факт позволяет говорить о практической значимости избранной темы диссертационного исследования по описанию клинико-нейровизуализационной
семиотики «негрыжевых» вариантов стойкой компрессии поясничных и крестцовых корешков на большой выборке пациентов. Кроме того, разделение больных в зависимости от вариантов компрессии приобретает особый интерес в связи с развитием новых хирургических методов лечения, в последние годы к
стремлению к малоинвазивным и эндоскопическим хирургическим подходам
при операциях на позвоночнике.
Цель исследования
Улучшить результаты хирургического лечения больных с дегенеративными поражениями позвоночника при стойкой компрессии поясничных и
крестцовых корешков «негрыжевыми» факторами.
Задачи исследования
1. Разработать нейровизуализационную семиотику негрыжевых факторов
компрессии поясничных и крестцовых корешков.
2. Уточнить частоту негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков при дегенеративно-дистрофических поражениях
позвоночника с помощью нейровизуализации.
3. Провести сопоставление клинической картины стойкой компрессии поясничных и крестцовых корешков с данными предоперационной нейровизуализации пояснично-крестцового отдела позвоночника
4. Разработать критерии для определения объема декомпрессии структур
позвоночного канала в зависимости от варианта его стенозирования
5. Оценить ближайшие результаты хирургического лечения
стойкой
компрессии поясничных и крестцовых корешков при дегенеративных пораже-
8.
8ниях позвоночника в условиях дифференцированной диагностики компримирующих факторов.
Научная новизна результатов исследования
На основании плотностных характеристик патологических сигналов, их
локализации в позвоночном канале, варианта и степени его стенозирования по
результатам мультимодальной визуализации пояснично-крестцового отдела позвоночника разработаны критерии диагностики негрыжевых факторов компрессии поясничных и крестцовых корешков на большой выборке пациентов.
Описаны нейровизуализационные критерии «негрыжевых» факторов
стойкой компрессии поясничных и крестцовых корешков. Статистически достоверно определена частота встречаемости каждого из них на большой выборке пациентов.
При сопоставлении клинической картины стойкой компрессии поясничных и крестцовых корешков статистически достоверно показано отсутствие отличий в клинической картине стойкой компрессии поясничных и крестцовых
корешков при различных факторах компрессии.
Доказано, что отличные и хорошие результаты хирургического лечения
обеспечиваются адекватной декомпрессией содержимого позвоночного канала
в зависимости от факторов стойкой компрессии пояничных и крестцовых корешков.
Теоретическая и практическая значимость результатов исследования
Результаты собственных исследований подтвердили высокую частоту
встречаемости «негрыжевых» вариантов стойкой компрессии поясничных и
крестцовых корешков (13,75%), диагностированных с помощью дооперационной нейровизуализации поясничного отдела позвоночника. Статистически достоверно доказано отсутствие взаимосвязи между клинической картиной и ва-
9.
9риантом стойкой компрессии. Установлена статистически достоверная связь
между объемом хирургического вмешательства, результатами хирургического
лечения и преобладанием определенного или нескольких «негрыжевых» факторов стойкой компрессии поясничных и крестцовых корешков.
Установлено,
что показанием к операции с целью декомпрессии поясничных и крестцовых
корешков спинного мозга, является наличие клинических признаков их стойкого сдавления независимо от фактора компрессии. Знание особенностей клиниконейровизуализационной семиотики негрыжевых факторов компрессии поясничных и крестцовых корешков позволяет улучшить диагностику данной патологии и, в частности, интерпретацию данных нейровизуализации, что имеет
большое значение для определения объема необходимой операции.
Методология и методы исследования
Методы исследования базируются на современных теоретических и практических основах нейрохирургии и радиологии, включающих основные принципы диагностики и лечения больных со стойкой компрессией поясничных и
крестцовых корешков. Результаты исследования доказаны с помощью современных методов нейровизуализации (магнитно-резонансная томография (МРТ),
рентгеновская компьютерная томография (РКТ) и рентгенография позвоночника). Объект исследования пациенты со стойкой компрессией поясничных и
крестцовых корешков при дегенеративно-дистрофических заболеваниях позвоночника.
Предмет исследования негрыжевые факторы стойкой компрессии поясничных и крестцовых корешков при дегенеративно-дистрофических поражениях пояснично-крестцового отдела позвоночника, клиническая картина стойкой
компрессии поясничных и крестцовых корешков, ближайшие результаты хирургического лечения пациентов со стойкой компрессией поясничных и крестцовых корешков в условиях мультимодальной предоперационной нейровизуализации структур позвоночного канала.
10.
10Применялись общенаучный метод (сравнительно-сопоставительный), а
также частно-научные методы (клинический, инструментальный, статистический). Статистическая обработка данных выполнялась с помощью программы
Excel. Статистический анализ выполнен с помощью программы Statistica 10
soft.
На первом этапе исследования после изучения российской и зарубежной
литературы определены нейровизуализационные критерии для оценки факторов стойкой компрессии поясничных и крестцовых корешков. Обследованы 400
пациентов с дегенеративно-дистрофическими поражениями позвоночника, которым проводилось хирургическое лечение после нейровизуализации. На втором этапе исследования уточнена частота негрыжевых факторов компрессии и
их нейровизуализационная семиотика с примененеим шкал дегенеративного
процесса позвоночника Modic и Pfirmann. На третьем этапе изучена клиническая картина стойкой радикулопатии поясничных и крестцовых корешков в зависимости от варианта стойкой компрессии. На четвертом этапе исследования
изучены ближайшие результаты хирургического лечения пациентов в условиях
мульдимодальной предоперационной диагностики.
Положения, выносимые на защиту
1. Мультимодальная визуализация пояснично-крестцового отдела позвоночника позволяет определить грыжевые и негрыжевые факторы стойкой компрессии поясничных и крестцовых корешков.
2. Клиническая картина радикулопатии поясничных и крестцовых корешков не имеет существенных отличий при различных факторах стойкой компрессии поясничных и крестцовых корешков.
3. Дифференцированная предоперационная диагностика грыжевых и
негрыжевых факторов компрессии позволяет адекватно планировать объем декомпрессии структур позвоночного канала, что положительно влияет на бли-
11.
11жайшие результаты хирургического лечения пациентов с компрессионными
формами дегенеративного поражения поясничного отдела позвоночника.
Достоверность и обоснованность результатов исследования
Достоверность результатов проведенного диссертационного исследования подтверждена достаточным количеством высокоинформативных методов
клинической диагностики и лечения. Научные выводы и практические рекомендации основаны на достоверных результатах, представленных в таблицах и
схемах.
Апробация результатов исследования
Основные положения диссертации доложены и обсуждены на Всероссийской научно-практической конференции «Неотложные состояния в вертебрологии» (Санкт-Петербург, 2013), Образовательном цикле «Неотложная
нейрохирургия» (Казань, 2014), Национальном радиологическом обществе
(Москва, 2014), VII Всероссийском съезде нейрохирургов (Казань, 2015), заседании кафедры неврологии и нейрохирургии ФПК и ППС Казанского государственного медицинского университета (Казань, 2015), заседании комитета по
науке ГАУЗ «Межрегионального клинико-диагностического центра» (Казань,
2016), V Российско-Японском симпозиуме (Казань, 2016), Нейрофоруме «Неделя неврологии в Казани» (Казань, 2017).
Внедрение результатов исследования в практику
Результаты диссертационного исследования применяются в учебно–
педагогическом процессе на кафедре неврологии и нейрохирургии ФПК и ППС
Казанского государственного медицинского университета, а также внедрены в
12.
12клиническую практику нейрохирургического отделения ГАУЗ «Межрегиональный клинико–диагностический центр» Министерства здравоохранения Республики Татарстан.
Публикации
По материалам диссертационного исследования опубликовано 15 печатных работ, в том числе 3 статьи в рецензируемых научных журналах, рекомендованных Перечнем ВАК Минобрнауки РФ.
Личный вклад автора в получении результатов
Автор сформулировал цели и задачи исследования, самостоятельно собрал и изучил данные литературы, выполнил сбор и обработку материалов,
провел их обобщение и осуществил анализ полученных результатов. Им выполнено 67 операций пациентам со стойкой компрессией поясничных и крестцовых корешков в качестве оперирующего хирурга и 105 операций в качестве
ассистента. Вклад соискателя в сбор статистического материала – 100%, в статистическую обработку материала – 80%, в обобщение и анализ результатов
исследования – 100%.
Структура и объем диссертации
Диссертация изложена на 134 страницах машинописного текста, состоит
из введения, 4 глав, заключения, выводов, практических рекомендаций и приложений. Работа содержит 11 таблиц и 23 рисунков. Список литературы включает 186 источников, из которых 108 отечественных и 78 иностранных.
13.
13ГЛАВА I. ОБЗОР ЛИТЕРАТУРЫ
1.1 Факторы компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника и их роль в развитии рефлекторных и компрессионных синдромов
В литературе описана полифакторность компрессионной радикулопатии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях
позвоночника (Асе Я.К., 1971, Данилов В.И., Филатов В.С., 2006; Beautie P.F. et
al., 2000). Данные выводы были сделаны на основании интраоперационных
находок у пациентов со стойкой компрессией поясничных и крестцовых корешков. Выделены грыжевые (79,5%) и негрыжевые (20,5%) факторы компрессии. Описаны следующие негрыжевые формы стойкой компрессии поясничных
и крестцовых корешков: гипертрофированные желтые связки, рубцовоспаечный процесс эпидуральной жировой клетчатки позвоночного канала, застойные эпидуральные вены, отек эпидуральной клетчатки, анатомически узкий позвоночный канал, остеофиты тел позвонков [4,8,19,20,21,69,72,115,130].
По данным Ю.А.Шулёва и соавт., выделяют дискогенные, недискогенные
и комбинированные формы стойкой компрессии нервных структур позвоночного канала, которые в клинической практике встречаются соответственно в 74,4;
4,4 и 19,2% случаев [102]. По данным других авторов, недискогенная причина
развития стеноза позвоночного канала с клинической картиной стойкой компрессии нервных корешков составляет от 5 до 50% случаев [4,97,98,178].
Самая частая причина стойкой радикулопатии поясничных и крестцовых
корешков при дискогенном поражении позвоночника – грыжа межпозвонкового диска [4,19,20,21,103,104]. По данным литературы, грыжа межпозвонкового
диска встречается чаще всего в возрасте 30–45 лет. В этом возрасте по причине
высокого давления в полости межпозвонкового диска пульпозное ядро легче
проникает между поврежденными волокнами фиброзного кольца, что обусловливает более частое развитие дискогенной радикулопатии [60,64,68]. Учитывая
14.
14сложный динамический механизм дегенеративного поражения поясничного–
крестцового отдела позвоночника, еще в 1965 году А.И. Осна выделил 4 периода развития дегенеративного поражения позвоночника с преобладанием на
каждом из них определенного фактора компрессии. И поэтому неправильно
считать, что только грыжи межпозвонкового диска являются причиной стойкой
компрессии нервных корешков [19,20,21,40,77,92,104].
Преимущественно у лиц пожилого возраста причиной радикулопатии чаще является компрессия корешка в области межпозвонкового отверстия вследствие формирования остеофитов, гипертрофии суставных фасеток, желтых связок, варикозно расширенных эпидуральных вен, рубцово–спаечного процесса и
воспаление эпидуральной жировой клетчатки.
Многие авторы (Кузнецов В.Ф., Кариев М.Х., Маратканов Т.В., Porter
R.W., Rosenberg W.S., Крутько А.В.) одной из основных причин стойкой радикулопатии считают сочетание дегенеративного процесса позвоночника с конституциональной узостью позвоночного канала в результате врожденных особенностей строения позвоночного столба [32,43,51,167,170,174].
Термином позвоночный стеноз обозначают сужение позвоночного канала
(его центральной части, латерального части и межпозвонкового отверстия), вызывающее стойкую компрессию нервно–сосудистых образований позвоночного
канала: спинномозговых корешков, ганглиев, артериальных и венозных сосудов. Стенотические изменения могут быть: первичными – врожденными, конституциональными, вторичными (приобретенными в результате дегенератиных
процессов в позвоночнике) и комбинированными (как сочетание первичного и
вторичного стенозов).
Впервые описание стеноза позвоночного канала сделал в 1910 году Sumita [17]. По данным Sumita, частота позвоночного стеноза варьирует от 3 до
11,3% [25,74,83,132] и имеет тенденцию к увеличению [148]. Л.Э. Антипко [5]
предложил выделять стеноз позвоночного канала как патологию, существующую самостоятельно или являющуюся следствием ряда заболеваний или травм.
Onel и соавт. [163] охарактеризовали стеноз позвоночного канала как любую
15.
15форму сужения центральной части позвоночного канала, или корешкового канала в зоне межпозвонкового отверстия.
Выделяют центральный стеноз, латеральный стеноз, стеноз межпозвонкового канала (фораминальный стеноз).
Латеральные стенозы детально описаны и классифицированы Lee et al.
[149]. Зона входа в межпозвонковое отверстие является латеральным пространством позвоночного канала, и причинами стойкой компрессии структур позвоночного канала в этой зоне являются гипертрофия верхнего суставного отростка, врожденные пороки строения дугоотростчатых суставов и остеофиты края
тела позвонка [9,127].
Срединная зона позвоночного канала спереди ограничена задней продольной связкой, медиальные отделы этой зоны открыты в сторону центральной части позвоночного канала. Основными причинами стойкой компрессии
структур позвоночного канала здесь являются остеофиты тел позвонков или
остеофиты в месте прикрепления желтой связки [4,8,11,130,154], а также гипертрофия задней продольной или жёлтой связки. Более значимая роль в развитии
стойкой компрессии корешков конского хвоста при дегенеративном поражении
позвоночника отводится гипетрофии желтой связки (в литературе описаны
наблюдения, когда для декомпрессии корешка, достаточным было только удаление гипертрофированной желтой связки) [8,54,63,94,130,185]. Однако также
по литературным данным описана и стойкая «негрыжевая» компрессия структур позвоночного канала при оссификации задней продольной связки
[4,128,155,172]. В 41,7% случаев имеется так называемая интрафораминальная
связка, изменения которой могут быть причиной стойкой компрессии корешков
конского хвоста [89].
Зона межпозвонкового отверстия спереди ограничена нижележащим
межпозвонковым диском, сзади – наружными отделами дугоотростчатых суставов. Причинами стойкой «негрыжевой» компрессии в этой зоне служат гипертрофические изменения дугоотростчатых суставов, остеофиты верхнего
края межпозвонкового диска [10,42,121].
16.
16Среди факторов, вызывающих стойкую компрессию поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника, отдельно должен быть отмечен эпидурит, который развивается как реакция
эпидуральной клетчатки в форме хронического воспаления [24,134]. Уплотнения
заднего
и
переднего эпидуральных пространств приводит к развитию
рубцово–спаечных иземенений в эпидуральной клетчатки позвоночного канала
с развитием стойкой компрессии нервных корешков (Фарбер М.А., 1988; Сабуренко Ю.Ф., Перфильев С.В., 1990) как исход дискогенных эпидуритов, в том
числе аутоимунных (Зайцева Р.Л. и соавт., 1971).
Развитие таких факторов негрыжевой стойкой компрессии поясничных и
крестцовых корешков как рубцово–спаечные изменения, отек и хроническое
воспаление эпидуральной клетчатки, варикозно–расширенные вены позвоночного канала укладываются в рамки концепции дисгемического и асептико–
воспалительного механизма дегенеративного каскада поражения позвоночника,
достаточного подробно описанного в литературе [24,95].
Для дисгемического механизма дегенеративного-дистрофического поражения позвоночника характерны нарушения макроциркуляции (по типу миело–
и радикулоишемии) и микроциркуляции, которые являются следствием рефлекторных сосудистых реакций или непосредственной стойкой компрессии
структур позвоночного канала [58]. Большое значение имеет нарушение венозного кровообращения по причине наличия большого количества венозных
сплетений и анастомозов в позвоночном канале, а также отсутствие в эпидуральных венах клапанной системы регуляции [27]. Стойкая компрессия корешков конского хвоста может быть обусловлена сдавлением варикозно расширенными венами позвоночного канала как отдельного фактора стойкой компрессии, так и в сочетании с компрессией эпидуральных вен на уровне экструзии межпозвонкового диска или грыжевого секвестра [7,61,81,130].
Е.И. Слынько и соавтор. выделяли варикоз эпидуральных вен поясничного отдела позвоночника (ВЭВП) в отдельное заболевание позвоночного канала.
ВЭВП – приобретенное заболевание, которое проявляется расширением внут-
17.
17ренних венозных сплетений позвоночного канала. Выделяют сегментарный
ВЭВП (расширение межпозвонковых вен и вызывающий компрессию или ирритацию сегментарных корешков, проходящих вместе с этими венами через
межпозвонковые отверстия), локальный ВЭПВ (обусловленный ограниченным
расширением вентральных, реже – дорсальных продольных венозных стволов,
межпозвонковых вен на уровне 1 – 2 позвонков, что вызывает, как правило,
компрессию дурального мешка, сегментарных корешков) и распространенный
ВЭВП (связанный с обширным расширением эпидуральных вен, в первую очередь, вентральных, реже – дорсальных эпидуральных продольных венозных
стволов; этот тип ВЭВП обычно сочетается со значительным повышением венозного давления во всей эпидуральной и, соответственно, позвоночной венозной системе). Отличием ВЭВП от типично венозных мальформаций является
расширение неизмененных вен без образования дополнительных аномальных
венозных сплетений [83].
Нарушение венозного и ликворного оттока происходит, прежде всего, в
зоне межпозвонковых отверстий и корешковых каналов. Нарастающее давление в эпидуральном пространстве усугубляет нарушения микроциркуляции,
вызывая вторичную ишемию корешков конского хвоста [43,44]. Патологоанатомические исследования [136] показали, что при стойкой компрессии венозного сплетения в области межпозвоночных отверстий развивается демиелинизация спинномозгового корешка с фиброзом его оболочек. Переразгибание позвоночника еще больше увеличивает венозный застой. Повторяющаяся
травматизация, ишемия корешков конского хвоста, равширение вен, нарушений микроциркуляции в корешках и арахноидальной оболочке неминуемо
приводит со временем к развитию фиброза оболочек − арахноидиту [127].
Облитерация твердой мозговой оболочки корешков конского хвоста усугубляет метаболические и дистрофические нарушения в корешках, лишая их
возможности поддерживать питание путем диффузии спинномозговой жидкости.
18.
18Нарушение микроциркуляции в пораженном позвоночно–двигательном
сегменте также оказывает и большое влияние на формирование отека эпидуральной клетчатки и оболочек корешков конского хвоста [15,19,100]. Отек
эпидуральной клетчатки позвоночного канала поддерживается и асептическим
воспалительным процессом аутоимунного генеза [181].
Редкой причиной (с частотой 0,1–1,5% у пациентов с дегенеративно–
дистрофическими поражениями позвоночника) стойкой компрессии корешков
конского хвоста являются кисты фасеточных суставов. Периартикулярные кисты позвоночного канала впервые описаны в 1880 г. Первое сообщение
успешного оперативного лечения этой патологии датируется 1950 г. [120].
Термин «периартикулярная киста» может быть использован для всех кист,
расположенных поблизости от фасеточного сустава и исходящих из него
[26,117,126,171].
В эту группу включают синовиальные и ганглионарные кисты, которые дифференцируют по наличию или отсутствию синовиального эпителия в
полости кисты [26,117,146,152].
Кистозные образовaния, располагающиеся в боковых отделах позвоночного канала, имеющие связь с дугоотростчатым суставом и выстланные изнутри синовиальным эпителием, называют синовиальными кистами. Морфологическая эволюция синовиальных кист хорошо описана. Эти образования
со временем могут терять связь с синовиaльной полостью межпозвонкового
сустава. После этого кисты утрачивают синовиальную выстилку и могут оссифицироваться. Кистозные образования, располагающиеся в периaртикулярной зоне, но утрачивающие связь с полостью сустава и лишенные
внутренней синовиальной выстилки, назывaют ганглионарными (узловыми)
кистaми [26,117,146,152].
Считается, что синовиальная киста формируется в результате выпячивания синовиальной сумки межпозвоночного сустава. Образовавшаяся при этом
полость заполняется синовиальной жидкостью. Формировaнию синовиальной
кисты могут способствовать воспалительные изменения межпозвоночного
19.
19сустава, врожденные дефекты развития синовиaльной ткани, муцинозная дегенерация суставной сумки, пролиферация мультипотентных мезенхимaльных
клеток [117,157,171].
Синовиальные кисты долгое время могут быть aсимптомными. По мере
их роста в сочетании с развитием спаечного процессa в окружающих тканях
кисты приводят к стенозу позвоночного канала с компрессией невральных
структур и развитию клинической картины компрессионной радикулопатии
вплоть до синдрома порaжения конского хвоста [26,117]. Люмбaльные синовиальные кисты могут приводить к острому болевому синдрому в результате
кровоизлияний в полость кисты, которые встречаются у 2% пациентов [157].
Клиника стойкой компрессии поясничных и крестцовых корешков может
возникать при стенозе позвоночного канала не только за счёт мягкотканых или
костных структур позвоночника, но и вследствие сегментарной нестабильности, вызывая так называемый динамический стеноз позвоночного канала
[44,67,131,164].
Таким образом, подводя итоги анализа отечественной и мировой литературы, посвященной причинам стойкой радикулопатии корешков конского хвоста на поясничном уровне, следует отметить, что в контексте описания дегенеративного каскада поражения поясничного отдела позвоночника многими авторами упоминается полифакторность стойкой компрессии структур позвоночного канала. Однако литературных данных, обобщающих эти факторы стойкой
компрессии при дегенеративно–дистрофических поражениях позвоночника,
приводящих их классификацию, нейровизуализационные харастеристики,
очень мало. Наиболее полная научная работа, посвященная проблемам негрыжевой стойкой компрессии поясничных и крестцовых корешков, – это исследование, выполненное в 2006 году В.И. Даниловым и В.С. Филатовым. Авторами
работы была установлена взаимосвязь преобладания определенного негрыжевого фактора компрессии в зависимости от пола, возраста пациента, уровня поражения. Однако в условиях современного развивающегося медицинского комплекса (расширение использования новых методов диагностики позвоночника,
20.
20методов хирургического лечения пациентов с дегенеративными поражениями
позвоночника, прежде всего малоинвазивных и эндоскопических) очень актуальным становится вопрос описания и классификации нейровизуализационных
характеристик негрыжевых форм стойкой компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника с
целью более адекватного планирования декомпрессии структур позвоночного
канала на дооперационном уровне и улучшения результатов лечения данной
группы пациентов.
1.2 Роль современных методов нейровизуализации в диагностике причин
стойкой компрессии поясничных и крестцовых корешков конского хвоста
Диагноз стойкой радикулопатии поясничных и крестцовых корешков при
дегенеративно–дистрофических поражениях позвоночника, прежде всего, устанавливается на основе характерных клинических симптомов. Стойкая компрессия корешков при дегенеративных поражениях позвоночника – это компрессия,
которую не удается купировать нехирургическими методами, либо непосредственно после развития компрессии очевидна безальтернативность хирургического лечения.
Клиническая картина стойкой компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника характеризовалась сочетанием симптомов вертебрального, корешкового синдромов и
расстройства функции тазовых органов у больных с первичным и вторичным
стенозом позвоночного канала.
Данные нейровизуализации позвоночника необходимы для определения
характера, степени и уровня поражения структур позвоночного канала. Рентгенологическое исследование позвоночника должно быть максимально полным
(включающим в себя выполнение рентгенографии поясничного отдела позвоночника с функциональными пробами, РКТ и МРТ позвоночника, если есть
необходимость дополнение исследование специальными режимами (например,
21.
21режима гидрографии) или выполнение миелографии), так как каждый метод
имеет свою специфичность и чувствительность.
В диагностику дегенеративно–дистрофических изменений позвоночника
включают оценку снондилограмм, где можно установить смещение позвонка
кзади или кпереди, диагностировать остеофиты тел позвонков и фасеточных
суставов [52,153]. Выполнение функциональных рентгенограмм позвоночника,
полученных в положении максимального сгибания и разгибания позвоночника,
позволяет выявить признаки нестабильности
позвоночно–двигательного
сегмента [15,52,153].
Трaдиционное «бесконтрастное» рентгенологическое исследование не
способно полностью раскрыть пaтогенез неврологических синдромов дегенеративного поражения позвоночника [53,186]. Известно, что достоверными рентгенологическими признаками спондилоартроза является: выпрямление
поясничного лордоза, уменьшение высоты межпозвонкового диска, субхондральный склероз зaмыкательных пластинок тел позвонков, а также краевые
костные разрастания, локальный сколиоз, сужение межпозвонковых щелей
фасеточных суставов[70,72,88,153].
Выполнение компьютерной и магнитно–резонансной томографии позвоночника являются следующим этапом обследования больных со стойкой
радикулопатией корешков конского хвоста. Эти методы по причине их высокой информативности позволяют детально изучить структуру позвоночного
канала, измерить его размеры [4,137,138,153,166]. Кроме того, МРТ и РКТ поясничного отдела позвоночника позволяют уменьшить процент диагностических ошибок, хотя и не могут исключить их полностью [1,96,137,138,166]. МРТ
позволяет не только подтвердить диaгноз, но и выявить даже сaмые начальные
изменения не только в позвоночном кaнaле, но и в межпозвонковом диске и
фасеточных суставов (шкала Pfirmann) [96,138,166]. Достаточно полную информацию о характере и степени дегенеративного поражения позвоночного канала дает компьютерно–томографическое исследование со спиральным сканированием [137,153].
22.
22Рентгеновская компьютерная томография (РКТ) позвоночника является
более информативным методом диагностики в сравнении с рентгенографией
позвоночника. Она позволяет более детально изучать костные структуры позвоночника, получать количественную информацию о плотности тканей, измеряемую в единицах Хаунсфилда. Этот метод лучевой диагностики может
показать изменения, происходящие при поясничном остеохондрозе в костной
ткани позвонков, анализировать дистрофические изменения фасеточных суставов, степень стенозирования межпозвонковых отверстий. РКТ объективно
оценивает стеноз позвоночного канала, устанавливает степень сужения и его
причину. По сравнению со спондилограммами КТ более детально выявляет
состояние позвоночного канала, но нa РКТ не видны мягкие ткани позвоночного канала [108,153,169,177]. РКТ позволяет визуализировать проявления деформирующего спондилезa (оссификация продольных связок, наличие остеофитов по задней поверхности тел позвонков) и спондилоaртроза [108].
В настоящее время широко используется магнитно–резонансная томография, которая является «золотым стандартом» в визуализации позвоночника и дистрофических изменений межпозвонковых дисков [48,166,186]. В методике МРТ
удачно сочетаются высокая разрешaющая способность, чувствительность метода,
возможность получения многоплоскостных изобрaжений.. Этот метод диагностики позволяет получать дифференцированное изобрaжение костной ткани позвонков, спинного мозга, корешков конского хвостa, спинномозговой жидкости, межпозвонковых дисков, связочного аппарата, мышц, сосудистых образований, жировой ткaни [35,52,53,96,101,110,114]. На сaгиттальных срезах можно визуализировaть весь позвоночный столб на всем его протяжении. Кроме того, МРТ позволяет отличить грыжи диска от других патологических процессов, например, инфекционного и опухолевого генеза. Без дополнительного контрастирования МРТ
позволяет оценить степень стенозирования позвоночного канала, выраженность
рубцово–спаечного процесса [137,138,153,166].
Миелография является стандaртным информативным методом предоперационной диагностики стеноза грудного и поясничного отделов позвоночника.
23.
23Метод позволяет оценить проходимость субaрaхноидального пространства,
точно установить локализацию и степень деформации дурального мешка и
корешковых каналов, в том числе в результaте воздействия «некостных» элементов. С помощью миелогрaфии в положении флексии и экстензии наиболее
наглядно и просто определяется влияние динaмических факторов на структуры позвоночного кaнала. Миелография в 93,9% случаев полностью совпадает с операционными находками [34,50]. Но эта методика является инвазивной,
следовательно – травматичной. В настоящее время в хорошо оборудованных
медицинских центрах при наличии КТ и МРТ данный метод используется
редко.
В клинических рекомендациях North American Spine Society (Американского спинального общества) от 2012 года по диагностике и лечению пациентов со стойкой радикулопатией на поясничном уровне в разделе посвященному рентгенологической диагностике приведены обобщающие данные результатов нейровизуализации пациентов со стойкой радикулопатией трех авторов
Jackson R.P., Janssen M.E., Fries J.W. с определением чувствительности каждого из метода в диагностике стойкой радикулопатии [137,138] (таблица 1).
Таблица 1 - Диагностическая чувствительность различных методов
нейровизуализации позвоночника в диагностике стойкой радикулопатии поясничных и крестцовых корешков по данным North American Spine Society
(Американского спинального общества)
Методы нейровизуализации
Jackson R.P.
Janssen M.E.
Fries J.W.
76,5%
–
96%
76%
–
57%
РКТ
73,6%
92%
84%
Миелография
71,4%
87%
81%
МРТ
КТ–миелография
В 2005 году С.В. Топтыгин в ходе срaвнительного анaлиза результaтов
предоперационной лучевой диагностики и интраоперационной верификации у
24.
24пациентов с первичной и рецидивирующей дискогенной стойкой компрессией
на поясничном уровне определил диагностическую информативность современных методов лучевой диагностики (таблица 2).
Автором также был сделан вывод, что основными лучевыми методами
предоперационной диагностики пациентов с грыжами пояснично–крестцовых
межпозвонковых дисков являются МРТ или РКТ, а также спондилография. При
несоответствии клинической картины характеру и уровню компрессии, выявляемых с использованием неинвазивных методов нейровизуализации, а также при
стенозах позвоночного и (или) корешкового каналов целесообразно проводить
СКТ–миелографию или инвазивную миелографию [90].
В таблице 2 представлена чувствительность различных методов диагностики в зависимости от фактора компрессии.
Таблица 2 - Диагностическая информативность современных методов
нейровизуализации в диагностике наиболее значимых признаков компрессии
[90]
Методы
Спондилография
Миелография
Компьютерная
томография
Спиральная
компьютерная
томография
СКТ–
миелография
МРТ
Остеофиты
Спондилолистез
100
99,8
централь–
ный
88,4
94,9
98,6
100
Стеноз
латеральный
Гры– Эпидуральжа
ный фиброз
МПД
Миграция секвестра
49,4
8,3
0
0
97,7
94,0
99,5
19,6
92,7
100
96,1
88,2
98,7
27,6
97,1
100
100
100
100
100
51,7
96,6
100
100
100
100
100
44,2
100
88,0
97,7
98,0
99,7
100
42,9
99,5
25.
25По данным литературы, нейровизуализационная семиотика грыжи диска
описана полно. В большинстве работ, посвященных проблемам стойкой радикулопатии говорится, что только грыжа диска (как самая частая причина стойкой
компрессии структур позвоночного канала) четко коррелирует с клинической картиной и является единственным показанием для проведения МРТ поясничного
отдела позвоночника. МРТ выявляeт грыжи межпозвонкого диска на любом
уровне, любой локaлизации и позволяет детaльно изучать их размеры, структуру и
взаимосвязь
с
нервно–сосудистыми
образовaниями
позвоночного
кана-
ла[4,48,52,53,88,96,138,166,169,186]. Высокая частота встречаемости негрыжевых
вариантов стойкой радикулопатии еще раз доказывает актуальность описания и
систематизации знаний о их нейровизуализационной семиотике.
Наличие грыжи дискa на соответствующем уровне или «негрыжевого»
варианта стойкой компрессии поясничных и креcтцовых корешков может быть
уcтановлено при помощи компьютерной (РКТ) или магнитно–резонанcной томографии (МРТ). Однако многие авторы указывают на неcоответствие результатов лучевой диагностики с клинико–неврологической симптоматикой в 25–
40% cлучаев. В клинической практике результаты лучевой диaгностики часто
недооцениваются или не сопоставляются с клинико–неврологическими данными, что может служить причинами неудовлетворительных результатов оперативного лечения [52,114,123]. Наиболее вероятно это связано, прежде всего, с
недооценкой результатов предоперационной визуализации позвоночника (не
учитываются именно негрыжевые факторы стойкой радикулопатии). Поэтому
сопоставление результатов предоперационной нейровизуализации с клиническими данными и интраоперационными находками, как и описание нейровизуализационной семиотике является очень актуальной задачей.
26.
261.3 Клиническая картина компрессионной радикулопатии поясничных и крестцовых корешков при дегенеративных поражениях позвоночника
В современной литературе достаточно полно описана клиническая картина и
cиндромология стойкой компреccии поясничных, и крестцовых корешков при дегенеративно–диcтрофических поражениях позвоночникa.
В клинической картине пояcничного остеохондроза выделяют две группы
cиндромов: компрессионные и рефлекторные.
К первой группе отнесены вертебральные и нейрональные (патология
cпинномозговых корешков и пaтология вегетативной нервной системы), ко
второй нейрососудистые (гипотония и гипертония) и мышечные (дистонические и дистрофические) синдромы, а также проявления нейроостеофиброза
[93].
Несмотря на доказанный факт полифакторности причин стойкой компрессии поясничных и крестцовых корешков при дегенеративно–дистрофи–
ческих поражениях поясничного отдела позвоночника, стойкая компрессия поясничных и крестцовых корешков имеет свою характерную клиническую картину, существенно не зависящую от варианта стойкой компрессии и представленную сочетанием симптомов вертебрального, корешкового синдромов и
нарушением функции тазовых органов. При этом в структуре вертебрального и
корешкового синдромов обязательно присутствуют напряжение паравертебральных мышц с блокадой сегментов на поясничном уровне и симптомы
натяжения, что свидетельствует о компрессионном механизме радикулопатии
(Филатов В.С., Данилов В.И., 2006 год).
В ряде работ есть заключение о том, что клиникa стойкой компрессии корешков конского хвоcта определяется особенностями поражения корешка и
продолжительностью заболевания. Темп эволюции корешковых клинических
проявлений зaвисит от мехaнизмов и вариантов повреждения корешка, которые
могут cлужить патофизиологической основой различия клинической cимптоматики [22,130].
27.
27Хaрaктер клинической кaртины и темп развития заболевания определяются взаимодействием многих фaкторов [67]. Понятно, что дегенеративный
cтеноз корешкового канала, вызванный гипертрофией фасеточных суставов,
циркулярный моносегментарный стеноз при экструзии (грыжи) диска или
спондилолистез будут представлены синдромами, имеющими определенные
различия. Локализация и распространенность дегенеративно-дистрофического
процесса в пределах позвоночного канала также вносят разнообразие в манифестацию клинических проявлений заболевания. Однако существуют симптомы и неврологические признаки, позволяющие заподозрить данную патологию. Они обладают относительной специфичностью, что связано с единством
патогенетических механизмов различных типов стенозирования позвоночного
канала [74,130].
Стойкая радикулопатия поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника проявляется болевыми
нарушениями, вертебральными деформациями, расстройствами в двигательной
и чувствительных сферах, а также нарушениями трофических функций и вертебро–висцеральными расстройствами. Клинические проявления поражения
нервного корешка протекают остро или хронически, часто резистентно по отношению к используемым методам консервативной терапии [15,19,38,39,92,93].
Большинство авторов, изучающих клинические проявления дегенерaтивно-дистрофических поражений позвоночника, выделяют основной симптомокомплекс в виде болевого синдрома различной локaлизации, интенсивности и
длительности [29,38,39].
Структуры позвоночного столба являются обширной рефлексогенной зоной вследствие богaтой иннервации. Менингеальная ветвь (синувертебральный
нерв Люшкa) является основным источником иннервации надкостницы, стенок
позвоночного канала, твердой мозговой оболочки, периоста, задней продольной
и желтой связок, дуг и задней поверхности тел позвонков. Зaпускает боль ирритация вышеперечисленных структур [15,33,79,87], вызывающая рефлекторные
28.
28болевые синдромы, в частности миофасциальный, на долю которого приходится до 80% случаев обращения пациентов за медицинской помощью [86,178].
По данным клинико–нейровизуализационных сопоставлений, интенсивность боли, как правило, не коррелирует со степенью экструзии межпозвонквого диска или механической деформацией корешка [161]. Экспериментальные
данные показывают, что ключевую роль в развитии корешковой боли могут играть воспалительные изменения в компримировaнном корешке и спинномозговом ганглии, связанные с выделением фосфолипизы А2, оксида aзота, простагландина Е2, ФНО–а, интерлейкинов [47].
Болевой синдром при вертеброгенной радикулопатии имеет смешанный
характер. Ноцицептивный механизм связан с раздражением ноцицепторов в
наружных cлоях поврежденного диска и окружающих его тканях, в том числе
твердой мозговой оболочке, а также в спазмированных мышцах, иннервируемых ветвями синувертебрaльного нерва. Невропaтический же компонент болевого синдрома связан с ирритацией нервных волокон корешка вследствие его
компрессии, воспаления, отекa, ишемии, демиелинизации и акcональной дегенерации [165].
Клинически пояснично–крестцовая радикулопатия характеризуется остро
или подостро развивающейся пароксизмальной (стреляющей или пронизывающей), постоянной интенсивной болью, которая иррадиирует по дерматому пораженного нервного корешка. Боль в ноге обычно возникает на фоне боли в пояснице, ограничивает движения в пораженном отделе позвоночника.
Боль может развиться внезапно: после резкого неправильного движения в
позвоночно–двигательном сегменте, подъема тяжести или падения. Поначалу
боль может быть умеренной (обычно тупой или ноющей), но постепенно нарастает, становясь стреляющей или пронизывающей, реже сразу же достигает максимальной интенсивности. Боль, как правило, усиливается при движении, особенно при наклоне вперед, натуживании, подъеме тяжести, сидении, длительном пребывании в одной позе, кашле и чиханье, и ослабевает в покое, особенно
если больной лежит на здоровом боку, согнув больную ногу в коленном и тазо-
29.
29бедренном суставах [4,19,38,39,45,47,72]. Нередко боль проходит спонтанно в
течение двух–трех месяцев с восстановлением трудоспособности; только у 5–
10% пациентов боль становится хронической [16].
Отмечается выраженное напряжение паравертебральной мускулатуры,
уменьшающееся в положении лежа. При неврологическом осмотре спина часто
фикcирована в анталгических уcтановках. Нередко выявляется cколиоз, усиливающийся при нaклоне вперед, но обычно регрессирующий в положении лежa.
Он чаще всего обусловлен сокращением паравертебральной квадратной мышцы
поясницы.
Для клинической картины стойкой радикулопатии характерно нарушение
чувствительности (болевой, темперaтурной, вибрaционной) в cоответствующем
дерматоме (в том числе в виде пареcтезий, гипер– или гипалгезии, аллодинии,
гиперпатии), снижение или выпадение сухожильных рефлексов, гипотонии и
слабости мышц, иннервируемых пораженым корешком. Локализация парестезий более точно указывает на пораженный корешок, чем зона иррадиации боли,
которая отличается большой вариативностью [4,47,60,66,69,71].
Типично наличие симптомов натяжения и прежде всего симптома Ласега,
однако данный симптом неспецифичен для радикулопатии. Вместе с тем он оптимален при оценки тяжести и динамики вертеброгенного болевого синдрома.
При вовлечении корешка L4 возможен «передний» симптом натяжения cимптом Вассермана.
Cлабость мышц при дискогенных радикулопатиях чаще всего бывает легкой. Но иногда на фоне резкого усиления корешковых болей может остро возникать выраженный парез стопы (парализующий ишиас), вызванный, как правило, сдавлением питающих корешок сосудов (радикулоишемии).
Оcтрый двусторонний корешковый синдром (cиндром конского хвоста)
возникает редко. Синдром проявляется быстро нарастающими двусторонними
асимметричными болями в ногах, онемением и гипестезией промежности, нижним вялым парапарезом, задержкой мочеиспускания, недержанием кала. Эта
30.
30клиническая ситуация требует неотложной операции по декомпрессии структур
позвоночного канала [60,66,92,93,108,145,178].
Неврологические признаки рефлекторных, корешковых и ишемических
cиндромов оцениваются по характеру и распространенности болей и вовлечению в процесс различных нервно–cоcудистых образований позвоночного канала [6,7]. По данным Albeck M.J., в 93% случаев клинические cиндромы позволяют определить локализацию и возможный морфологический cубстрат клинических проявлений [111]. Однако определение синдромов поражения отдельных корешков далеко не всегда означает точную постановку топического
диaгноза [45].
Отдельного описания заслуживает синдром каудогенной хромоты, который очень характерен и специфичен для стеноза позвоночного канала как первичного (анатомического), так и при гипертрофии фасеточных суставов. Наличие этого синдрома свидетельствует о поздней стадии дегенеративных изменений позвоночника. У пациентов со стенозом поясничного отдела позвоночного
канала наиболее постоянными симптомами являются боли в ноге и явления
перемежающейся каудогенной хромоты. Синдром перемежающейся хромоты,
как правило, cостоит из комбинации двигательных нарушений с болью или
раccтройствами чувствительности. Для купирования каудогенной хромоты
пациенту обычно требуется не только прекратить ходьбу, но и одновременно
принять специфическую позу с легким сгибанием ног в тазобедеренных и коленных суставах и наклоном туловища вперед [5,44,130].
Дегенеративный стеноз корешкового канала представлен, как правило,
монорадикулярным синдромом, заключающийся в преобладании чувствительных нарушений в дерматоме иннервации корешка, боли и фасцикуляции постурального характера, слабой выраженности симптомов натяжения и двигательного дефицита [43,44,59].
По литературным данным, четкой корреляции между данными нейровизуализации поясничного отдела позвоночника и клинической картины не описано. Известно, что выраженная картина рентгенологических изменений при
31.
31дегенаративных поражениях позвоночника далеко не всегда имеет адекватную
по выраженности клиническую симптоматику, и, наоборот, возможнa адаптация нервного корешка к новым анатомическим условиям в позвоночном канале
[45,47,51,110,161]. По мнению А.Ф. Смеяновича и соавторов, в 60–70% случаев
даже остро выпавшая грыжа межпозвонкового диска может протекать клинически асимптомно. Поэтому очень актуальным является выполнение комплексной
нейровизуализации поясничного отдела позвоночника пациентам с характерной
клинической картиной стойкой радикулопатии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника.
Несомненно, прогреcc в вертеброневрологии связан с использованием
МРТ и РКТ позвоночника ввиду их большой информативности. Эти методики
позволяют уменьшить процент диaгностических ошибок, однако не могут
иcключить их полноcтью [96,137,138,166]. Однако при сопоставлении данных
МРТ позвоночника со степенью выраженности стойкой радикулопатии прямой
зависимости не обнаружено [99].
1.4 Эволюция хирургических методов лечения при стойкой компрессии
поясничных и крестцовых корешков
Несмотря на большие возможности консервативной терапии, по данным
разных исследователей, в хирургическом лечении нуждаются от 5% до 33%
больных [1,3,18,25,37,49,55,56,59,73,107].
Показания к оперативному лечению делят на абcолютные и отноcительные. К абcолютным показаниям относятся наличие у пациента клиники стойкой компрессии корешков конского хвоста, сопровождающейся двигательными
(парезы и параличи) и чувствительными расстройствами, а к относительным –
длительный или часто рецидивирующий болевой корешковый или вертебральный синдром при неэффективности консервативного лечения, наличие нестабильности
позвоночного–двигательного
[19,20,21,31,65,92,93,109,112,159].
сегмента
32.
32Некоторые авторы считают, что немедленного оперативного лечения требуют только больные с быcтро прогрессирующими тяжелыми неврологическими расстройствами. Операция, по их мнению, – это конечный этап комплекса
противоболевых мероприятий [18,107,109,147].
До сих пор остается актуальным вопрос об оптимальных сроках хирургического лечения пациентов и продолжительности консервативной терапии.
Спорной является позиция на каких сроках считать клиническую картину радикулопатии стойкой или фармакорезистентной. Продолжительность cреднего
cрока конcервативного лечения при отсутствии его эффекта должна составлять,
по мнению разных авторов, от двух–трех недель до двух–трех месяцев. Средний срок консервативного лечения по данным литературы составляет 2 месяца,
так как существующая стойкая компрессия корешков конского хвоста более 2
месяцев может привести к необратимым изменениям в самом корешке и развитию стойкого неврологического дефицита [1,18, 41,49,55,56,106,109]. Научная
работа, выполненная Щуровой Е.Н. и Ефимовым А.В. в 2012 года, посвящена
изучению влияния длительности стойкой компрессии корешков конского хвоста на результат хирургического лечения по декомпрессии компримированного
корешка. Авторы, изучив кровоток в компримированном нервном корешке до
операции и после декомпрессии у пациентов с различным стажем заболевания,
пришли к выводу, что чем больше длительность заболевания, тем меньше прирост кровотока в артерии копмримированного корешка после его декомпрессии. При увеличении длительности заболевания от 2 месяцев до 3 лет проиcходит снижение прироста кровотока, а затем кривая выходит на плaто. После 8
лет течения патологического процеccа отcутствует прироcт кровотока корешкa,
через 10 лет после начала заболевания наблюдается cнижение кровотока поcле
декомпрессии корешкa [106].
Выбор хирургической тактики при лечении больных со стойкой компрессией поясничных и крестцовых корешков до сих пор остается дискутируемым
вопросом среди специалистов занимающимся дегенеративной патологией поясничного отдела позвоночника. Основные споры ведутся по поводу объема
33.
33декомпрессии структур позвоночного канала, доступа к структурам позвоночного канала (передний, задний, боковой), профилактики рецидива грыжи диска
и профилактики развития сегментарной нестабильности после выполнения широкой декомпрессии. При изучении литературы посвященной хирургическим
методикам лечения пациентов с дегенеративными поражениями позвоночника,
в основном, описываются результаты лечения пациентов с грыжами межпозвонкового диска и стенозом позвоночного канала. Работ проводивших установление взаимосвязи между объемом декомпрессии и вариантами негрыжевой
стойкой компрессии поясничных и крестцовых корешков в литературе не
найдено.
Золотым стандартом хирургического подхода к структурам позвоночного
канала на поясничном уровне является задний доступ. Первоначально ламинэктомия считалась оптимальным вариантом декомпрессии структур позвоночного
канала. Иcпользование этого доступа позволяет провести полноценную ревизию поясничных и крестцовых корешков с удалением компримирующих факторов и кюретаж полости диска. Но, по мнению некоторых авторов, ламинэктомия имела большое количество осложнений чаще всего в виде неполного регресса стойкой радикулопатии. Морфологическим субстратом этих расстройств
в основном является рубцово–спаечный процесс с вторичной компрессией
нервно–сосудистых образований позвоночного канала, нестабильность в оперированном сегменте [5,37,44,49,55,109,159].
В литературе описан ятрогенный стеноз позвоночного канала как осложнение хирургического вмешательства (постламинэктомный стеноз), который
связан с оссификацией эпидуральных рубцов, компенсаторной гипертрофией и
кальцификацией задней продольной связки и усилением дегенеративных процессов в межпозвонковом диске после разрушения задних опорных структур
[37,75,76,167]. Поэтому начались поиски более щадящих хирургических подходов с целью сохранения заднего опорного комплекса позвоночного столба и
ламинэктомия была заменена менее инвазивными доступами – гемиламинэктомией, а затем интерламинэктомией [18,49,109, 119, 159].
34.
34Распространенным
подходом
в
хирургии
позвоночника
является
микрохирургический – интерламинэктомия или междужковый хирургический
доступ с использованием операционного микроскопа. Интерламинарный или
междужковый доступ заключается в резекции желтой связки с сохранением
костных
структур.
W.
Dandy
технически
дополнил
эту
операцию
выскабливанием (кюретажем) полости диска. Тщательный кюретаж является
залогом формирования фиброзного блока и профилактики рецидивов грыж
межпозвонкового диска.
Важен также полноценный гемостаз, благодаря
которому осуществляется профилактика рубцово–спаечного процесса в зоне
корешка и дурального мешка [19,104,122].
Интерламинэктомия для декомпрессии сосудисто–нервных структур позвоночного канала является щадящим вмешательством, при котором минимально
травмируются ткани эпидурального пространства при сохранении нормальной
анатомии костно–суставного аппарата позвоночника [36,46,180]. С помощью интерламинэктомии можно достаточно хорошо визуализировать корешок, оценить
состояние кровеносных сосудов, связочного аппарата, отделить корешок от
грыжи диска или от рубцово–спаечных сращений, сместить его с грыжи диска,
сохранить целостность верхней и нижней замыкательных пластинок [80,159].
Противопоказанием для использования интерламинэктомии как микрохирургического доступа, описанного в литературе, является распространенный
рубцово–спаечный процесс в позвоночном канале, требующий широкой декомпрессии структур позвоночного канала [123,129].
Одним из самых грозных осложнений после выполнения широких задних
декомпрессий структур позвоночного канала на которое обращают внимание
многие авторы является развитие сегментарной нестабильности со вторичным
стенозированием позвоночного канала. При выполнении задних декомпрессий
структур
позвоночного
канала
особо
подчеркивается
необходимость
сохранения функционально важных структур позвоночного канала: суставных
отростков и межсуставной части дужки с целью сохранения достигнутого
положительного результата и профилактики развития нестабильности в
35.
35позвоночно–двигательном сегменте. До сих пор нет и единого мнения о
показаниях к проведению дополнительной фиксации структур позвоночника
при операциях при дегенеративно–дистрофических поражениях позвоночника,
поскольку подобные операции могут сопровождаться дополнительным риском
оперативного вмешательства, особенно у пациентов пожилого и старшего
возраста. Определение нестабильности очень важно при планировании
оперативного лечения по поводу дегенеративных заболеваний позвоночника
[37,125,129]. Работы Johnsson K.E. и Sanderson P.L. по изучению развития
нестабильности после выполнения задних декомпрессий показали, что
появление или развитие признаков нестабильности после задней декомпрессии
не влияет на оперативные результаты. По данным Johnson и Sanderson, одной
декомпрессией можно достичь хороших результатов у пожилых пациентов без
дополнительного выполнения спондилодеза [139,175].
Ряд авторов рекомендуют проводить фиксирующие операции лицам с
сегментарной нестабильностью не старше 50–60 лет, с высокой физической
активностью [37,162]. Однако эти же авторы отмечают, что выполнение
фиксирующей операции необходимо при значительной резекции фасеточных
суставов.
Поэтому дальнейшее развитие хирургической техники было связано с
разработкой доступов к структурам позвоночного канала предназначенные для
максимального сохранения задних костных структур поясничного отдела
позвоночника и одновременно позволяющие достичь адекватной декомпрессии
нервно–сосудистых структур и избежать необходимости дополнительной
стабилизации
методик
позвоночно–двигательного
декомпрессивных
операций
из
сегмента.
заднего
Усовершенствование
доступа
связано
с
использованием таких хирургичесих доступов как микрохирургическая
гемиламинэктомия [49,62,82,84,129,150], фораминотомия [14,124,158], частиная
фасетэктомия [75,76,158,179], трансверсо–артропедикулоэктомия [129,151].
Однако попытки минимизировать объём хирургического вмешательства
далеко не всегда обоснованы.
Одну из ведущих ролей в формировании
36.
36негрыжевой
позвоночника
стойкой
занимает
радикулопатии
при
стенозирование
в
дегенеративном
области
поражении
начальной
части
корешкового канала или субартикулярный стеноз (между заднее–боковой
поверхноcтью тела позвонка и верхним cуставным отростком), который чаcто
является частью cтеноза центрального канала [129,127,149,175]. По данным
Burton с соавторами в «синдроме неудачно оперированного позвоночника» в
58% случаев играет неустраненный стеноз боковых рецессусов, а центральный
стеноз лишь в 10% случаев [116].
По классификации Lee, основанной на хирургической анатомии этой области cубартикулярный стеноз − это cтеноз «зоны входа» в межпозвонковое отверстие. «Зона входа» в межпозвонковое отверстие является латеральным карманом и причинами радикулярной компрессии здесь являются гипертрофия
верхнего суставного отростка, врожденные особенности развития фасеточного
сустава (форма, размеры, ориентация), остеофиты края тела позвонка. Данные
изменения являются фактором грубой компрессии корешков, артерий и вен.
Поэтому чтобы добиться адекватной декомпрессии в области латеральных карманов, порой приходится резецировать фасетки до внутреннего края дужек позвонков. В своем руководстве Howard рекомендует производить полную резекцию фасеточных суставов при проведении декомпрессии в латеральном кармане. Неадекватность декомпрессии во время первичной операции является
причиной неудачного оперативного вмешательства на позвоночнике, что может
быть следствием неточного диагноза, неэкономного отношения к анатомическим структурам, вызывающим компрессию нервного корешка и неоправданного ограничения декомпрессии из–за страха дестабилизации позвоночно–
двигательного сегмента [127,113,135,149,158].
В литературе имеются данные о лучших результатах хирургического лечения позвоночных стенозов при использовании широкой многоуровневой ламинотомии [113,168]. Kawaguchi с соавторами на основании данных своего
сравнительно исследования сделал заключение, что лучшими показателями для
37.
37поясничной ламинопластики являются молодой возраст и нормальная физическая активность пациентов с центральным стенозом позвоночного канала [144].
С целью сохранения структур заднего опорного комплекса и его функций
некоторые авторы при декомпрессии позвоночного канала использовали широкую фенестрацию с удалением части межпозвонковой дужки с жёлтой связкой
и сохранением суставных и остистых отростков [12,59,141,158].
Результаты хирургического лечения пациентов со стойкой компрессией
корешков поясничных и крестцовых корешков разнообразны по данным различных авторов. Во многих сообщениях указывается, что декомпрессивная хирургия структур позвоночного канала эффективна приблизительно у 85% пациентов [113,175]. По данным других авторов, количество хороших результатов
находится в пределах 65– 67% случаев [133,159,182]. По данным Katz с соавторами, доля успешных исходов лечения составила в среднем 57%. Изучая отдаленные результаты декомпрессивной хирургии, Katz пришел к выводу, что
функциональные результаты ухудшились спустя 4 года у 43% пациентов
[142,143]. Nakagama et al [160], подвергнув анализу отдаленные результаты
операций из заднего доступа, проведенных большим числом хирургов, сообщили о неудовлетворительных исходах декомпрессивных вмешательств в 28,3 –
53,0% наблюдений.
В связи с развитием хирургической техники и эндоскопии в последние
десятилетия все чаще речь идет о малоинвазивных доступах в хирургии дегенеративно–дистрофических поражений позвоночника.
Применяются малоинвазивные методики с использованием лазерной,
ультразвуковой нуклеотомии, холодно–плазменной нуклеопластики. Эти оперативные вмешательства выполняют обычно под контролем интраоперационной рентген навигации. Техника малоинвазивной хирургии постоянно совершенствуется, для нее разрабатывается специальный инструментарий и предлагаются более современные технологии. Данные методики занимают промежуточную позицию между консервативными методиками лечения и «открытыми»
38.
38хирургическими вмешательствами и может проводиться в амбулаторных условиях [28,78,118].
После пункционной чрезкожной дискэктомии уменьшается объем межпозвонкового диска, снижается внутридисковое давление и уменьшается степень
протрузии диска. Это приводит к купированию клинической картины ирритации
корешков конского хвоста. Операция считается целесообразной лишь при наличии у пациентов небольших протрузий, то есть на ранних стадиях дегенерации
межпозвонкового диска в условиях отсутствия грубого стенозирования позвоночного канала и, как правило, у пациентов молодого возраста. Поэтому показания к пункционным методикам нуклеопластики имеются только у 10–15% пациентов с дегенеративными поражениями позвоночника [2,105,140,156]. Часто
внутренняя декомпрессия только уменьшает степень выпячивания межпозвонкового диска и поэтому в последствии часть больных подвергают «открытым»
дискэктомиям [105,173]. Некоторые авторы отдают предпочтение монопортальной или бипортальной эндоскопической микродискэктомии при грыжах пояснично–крестцового отдела позвоночника с вторичным стенозированием позвоночного канала [91,176,184]. Одной из модификаций транскутанной дискэктомии является чрезкожная видеоэндоскопическая лазерная дискэктомия, при которой хирургический инструмент заменен лазерным пучком [13,23]. Она оправдана при рефлекторно–болевых синдромах и при гидрофильной протрузии диска
с ирритативным болевым синдромом. Транскутанная дискэктомия считается
также несостоятельной при полирадикулярном синдроме, экструзии диска более
6 мм, секвестрированных грыжах и стенозах позвоночного канала [30,105,140].
Таким образом, можно сделать вывод, что малоинвазивная хирургия позвоночника имеет ограниченные возможности и не показана при негрыжевых вариантах
(грубых дегенеративных изменений поясничного отдела позвоночника) стойкой
радикулопатии поясничных и крестцовых корешков.
Абсолютно индивидуальный подход применяется при лечении пациентов
с кистами фасеточных суставов. В лечении синовиальных кист фасеточных суставов на первом этапе применяют консервативную терапию, включающую не-
39.
39стероидные противовоспалительные препараты, физиолечение, инъекцию
НПВС. Описана аспирация кисты под флюороскопическим контролем у больных пожилого возраста, с наличием сопутствующей патологии являющейся
противопоказанием к операции [146].
Радикальным способом лечения синовиальных кист является их хирургическое удаление. Стенку кисты рекомендуется удалять полностью, чтобы избежать рецидива. При условии полного иссечения кистозной стенки
рецидивы кисты встречаются редко. Во многих публикациях подчеркивается необходимость полного удаления синовиальной ткани фасеточного сустава, чтобы избежать рецидива кисты, развитие которого возможно из остатков синовиальной оболочки. Однако
эта процедура не может рассматри-
ваться как обязательная, так как может приводить к грубому нарушению функции сустава [26,117,152,171].
Тaким образом, на данный момент нет единого представления о тактике
хирургического лечения больных со стойкой компрессией поясничных и крестцовых корешков конского хвоста. До сих пор ведутся споры об оптимальных
оперативных доступах, объеме и способах декомпрессии структур позвоночного канала. В литературе имеются указания, что эффект хирургических вмешательств связан с характером компримирующих агентов. Однако статистически
достоверных работ по изучению зависимоcти объема декомпрессии структур
позвончного канала от компримирующих факторов в литературе не найдено.
Большие споры ведутся о целесообразности проведения стабилизации позвоночно–двигательного сегмента после декомпрессивных операций, однако недостаточное внимание уделено адекватности декомпрессии в зависимости от
компримирующих факторов. Отсутствуют работы, посвященные особенностям
диагностики остеохондроза у пациентов с дегенеративными поражениями позвоночника и дифференцированному лечению пациентов с сочетанием различных компрессионных и некомпрессионных синдромов.
40.
40Хирургическое лечение больных со стойкой компрессией поясничных и крестцовых корешков является лишь одним из этапов комплексной терапии, включающей обязательное использование консервативных методов лечения как в
дооперационном, так и в послеоперационном периодах.
41.
ГЛАВА II. МАТЕРИАЛЫ И МЕТОДЫПроанализированы материалы историй болезни 400 пациентов, оперированных по поводу компрессионных форм дегенеративно–дистрофической патологии пояснично–крестцового отдела позвоночника. Все больные находились
на стационарном лечении в нейрохирургической клинике ГАУЗ «Межрегиональный клинико–диагностический центр» Министерства здравоохранения
Республики Татарстан в период с января 2012 по декабрь 2013 гг.
Для проведения исследования использовали клинический метод, метод
предоперационной мультимодальной нейровизуализации, непосредственную
интраоперационную визуализацию, ретроспективный анализ.
Всем пациентам проводился неврологический осмотр в дооперационном
и раннем послеоперационном периодах с оценкой основных вертебральных и
неврологических нарушений. Критерием выбора пациентов была стойкая компрессия поясничных и крестцовых корешков. Стойкой компрессией корешков
конского хвоста считалось сочетание симптомов вертебрального, корешкового
синдромов и расстройства функции тазовых органов при неэффективности консервативной терапии у больных с первичным и вторичным стенозом позвоночного канала. Основным синдромом, который значительно снижал качество
жизни пациента, был стойкий болевой синдром в спине и нижних конечностях.
Именно поэтому при исследовании эффективности и исходов оперативного лечения отдельно проводилась оценка болевого синдрома по шкале ВАШ в дооперационном и раннем послеоперационных периодах.
Предоперационная визуализация включала рентгенографию пояснично–
крестцового отдела позвоночника, в том числе и с функциональными пробами
для оценки нестабильности в позвоночно–двигательном сегменте. МРТ и РКТ
поясничного отдела позвоночника давностью не более 1 месяца до операции.
Магнитно–резонансное исследование проводилось на томографах с напряженностью магнитного поля не менее 1,5 тесла (марка Signa General Electric) в аксиальной, сагитальной и коронарной проекциях, а также в режиме гидрографии
42.
42для оценки ликвородинамики на исследуемом уровне. В случаях дифференциальной диагностики между опухолью позвоночного канала и секвестрированной грыжей диска выполнялось МРТ поясничного отдела позвоночника с контрастным усилением. РКТ (марка Toshiba Aquilion 64) позвоночника выполнялась с целью оценки костных изменений, рентгено–анатомических особенностей позвоночного канала и степени его стеноза. Также при оценке данных
рентгеновской компьютерной томографии обязательно проводилось измерение
плотности фактора стойкой компрессии в единицах HU (Хаунсфилда).
Основными нейровизуализационными критериями семиотики негрыжевых факторов стойкой компрессии были:
1. Плотностные характеристики компримирующего агента в единицах
рентгеновской радиоденсивности HU (Хаунсфилда).
2. Степень сужения (стеноза) позвоночного канала (форма и размер позвоночного канала). Для оценки степени выраженности стеноза позвоночного
канала использовалась шкала Harwod Nash и Petersson 1992 года: нет стеноза –
площадь позвоночного канала более 250 кв.мм.; стеноз 1 степени – от 170 до
249 кв. мм.; стеноз 2 степени – от 100 до 169 кв. мм.; стеноз 3 степени – от 1 до
99 кв. мм. Важное значение имеет форма позвоночного канала: при средней
площади позвоночный канал может быть сужен только в переднезаднем
направлении. Так стенозом позвоночного канала считается его сужение в переднезаднем направлении менее 11,5 мм.
3. Локализация фактора в позвоночном канале по отношению к корешкам
4. Стеноз корешкового канала - фораминальной зоны (рисунок 1).
1
2
3
4
5
Рисунок 1 - Grade 1 (Норма)
Grade 2 (Легкий) Grade 3 (Средний) Grade 4
(Выраженный) Grade 5 (Критический) (стеноз показан стрелками).
43.
43Стадию дегенеративного процесса пояснично–крестцового отдела позвоночника оценивали по шкале Pfirrmann (Рисунок 2) и Модик (Рисунок 3).
Рисунок 2 - Стадии течения дегенеративного процесса на МРТ (Pfirrmann
C.W., 2001): A– Grade 1; B– Grade 2; С – Grade 3; D– Grade 4; E– Grade 5 [160]
Т-1
Т-2
Модик–1
Модик–2
Модик–3
Рисунок 3 - Фокальные изменения в телах позвонков по Модику (1–
Аваскулярный фиброз (Т2+ и Т1–); 2–Жировая дистрофия (Т2+ и Т1+); 3–
Склероз (Т2– и Т1–) (Изменения выделены белым кругом)
Оперативные вмешательства выполнялись задним доступом с ревизией
позвоночного канала. Положение пациента на операционном столе лежа на животе с умеренным сгибанием в поясничном отделе позвоночника. Положение
хирургов лицом к лицу. Все операции выполнялись с использованием операци-
44.
44онного микроскопа (Carl Zeiss OPMI Vario NC33) и микрохирургической техники. Основная цель операции: оптимальная визуализация нервных структур
позвоночного канала и адекватная декомпрессия структур позвоночного канала.
Выявленные интраоперационные находки (компримирующие факторы) подробно описывались в протоколе операции. Данные операционных находок
сравнивались с данными предоперационной нейровизуализации.
В раннем послеоперационном периоде активизация пациента проводилась на 2–е сутки с детальной оценкой вертебрального и неврологического статуса.
Выполнен анализ клинической картины у всех больных, разделенных на
группы в зависимости от характера и содержания факторов компрессии: 1ая (55
(13,75%) пациентов) – пациенты с негрыжевой компрессией; 2 ая (27 (6,75%)
пациентов) – пациенты с грыжей диска в сочетании с негрыжевыми факторами;
3 ая группа (318 (79,5%) – пациенты с грыжевой компрессией. Осуществлено
сравнение выраженности симптомов вертебрального, корешкового синдромов,
а также нарушения функции тазовых органов у пациентов разных групп.
Определена зависимость объема декомпрессивной операции от вида компримирующих агентов в условиях предоперационной мультимодальной нейровизуализации. Также проанализированы ближайшие результаты хирургического лечения в раннем послеоперационном периоде. При их сравнении в первую
очередь учитывали динамику болевого синдрома, степень и сроки восстановления двигательной активности пациента.
Обработка данных нейровизуализации поясничного отдела позвоночника,
данных клинической картины, интраоперационных находок проводилось с помощью программы Excel. Статистическая обработка данных выполнена с помощью программы Statistica 10 soft. Достоверно статистическими данными
считались данные при коэффициенте критерия ошибки p<0,05 (высокий уровень статистической значимости). При сравнении групп пациентов для установления статистической значимой взаимосвязи между группами применялся
корреляционный коэффициент Спирмена. Для выполнения второй задачи дис-
45.
45сертационного исследования по оценки частоты негрыжевых факторов стойкой
компрессии
поясничных
и
крестцовых
корешков
при
дегенеративно–
дистрофических поражениях позвоночника выполнен частотный статистический анализ.
46.
46ГЛАВА III. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Из 400 наблюдений пациенты мужского пола составили 227(57%) человек, женского – 173(43%). Приведенные цифры свидетельствуют о преобладании патологического процесса у мужчин. Возраст обследованных больных варьировал от 19 до 81 лет. Большинство оперированных – практически ¾ (73%)
– независимо от пола, составили больные в наиболее трудоспособном возрасте
– от 31 до 60 лет (таблица 3).
Таблица 3 - Распределение больных по полу и возрасту
Возраст
Пол
0–19
лет
%
20–29
лет
%
муж
жен
Всего
2
0
2
0,5
0
0,5
20
8
28
5
2
7
30–39
лет
%
50–59
40–49
%
лет
лет
%
68 17 92 23 28
7
52 13 68 17 34 8,5
120 30 160 40 62 15,5
60–69
70–80
%
% всего %
лет
лет
12
8
20
3
2
5
6 1 227 57
2 0,5 173 43
8 2 400 10
0
Уровнями преимущественной локализации компримирующих агентов
явились L4–L5 и L5 – S1 (р<0,05) (рисунок 4).
%
58,5
60
58
50
40
28,5
30
18,3
20
10
2 2,4
4,53,65
Грыжевая компрессия
17
Негрыжевая компрессия
7
0
L1-L2
L2-L3
L3-L4
L4-L5
L5-S1
Рисунок 4 - Распределение пациентов с компрессией грыжевого и негрыжевого характера в зависимости от уровня поражения.
47.
47Грыжевая компрессия преобладала на уровне L5–S1, а локализацией
негрыжевой компрессией был преимущественно уровень L4–L5 (р<0,05).
На основании данных мультимодальной предоперационной нейровизуализации выделены следующие негрыжевые факторы стойкой компрессии: первичный стеноз позвоночного канала, отёк и спаечные изменения эпидуральной
клетчатки, гипертрофированные желтые связки, варикозно расширенные эпидуральные вены, остеофиты тел позвонков, кисты фасеточных суставов, спондилолистез. Для каждого негрыжевого варианта стойкой компрессии произведен статистический анализ частоты встречаемости фактора компрессии и подробно описана нейровизуализационная семиотика (рисунок 5).
1
2
5
4
2
6
3
7
Рисунок 5 - Факторы негрыжевой компрессии по результатам нейровизуализации: 1– рубцово–спаечный процесс; 2 – варикозно расширенные вены; 3 –
гипертрофия желтой связки; 4 – первичный стеноз позвоночного канала; 5 отечная клетчатка: 6 – остеофиты; 7 – киста фасеточного сустава (показаны
стрелками).
48.
483.1 Нейровизуализационная семиотика негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков
В этом разделе представлено описание нейровизуализационной семиотики негрыжевых факторов компрессии с помощью нейровизуализационных критериев описанных ранее.
Рубцово–спаечный процесс по результатам нейровизуализации более
плотный фактор компрессии, чем грыжа диска. Плотность данного фактора
компрессии составляет от 100 до 130 HU, что выше плотности грыжи диска
(70–110 HU). Преимущественная локализация патологического процесса – фораминальная зона в сочетании со стенозом корешкового канала. Поэтому при
нейровизуализационном описании данного фактора важно оценить степень
стеноза корешкового канала. Оценка степени стеноза корешкового канала проводилась по шкале стенозов корешковых каналов (Grade1–Grade5)
(Рисунок
6).
Степень стеноза корешкового канала у
пациентов с рубцово-спаечным процессом
28
Колическтво пациентов
24
20
16
12 (44%)
12
10 (38%)
8
4 (12%)
4
2 (6%)
0
0
Grade 1
Grade2
Grade 3
Grade 4
Grade 5
Рисунок 6 - Распределение пациентов с рубцово–спаечным процессом по
степени стеноза корешкового канала
49.
49У пациентов с рубцово–спаечным процессом эпидуральной клетчатки
наблюдался стеноз корешкового канала преимущественно средней и выраженной степени. У 23 (82%) пациентов степень дегенеративного процесса поясничного отдела позвоночника Модик–1; у 5 (18%) пациентов Модик–2. По шкале
Pfirmann у 3 (8%) пациентов степень дегенеративного процесса Grade 3; у 24
(86%) пациентов Grade 4; и у 1 (6%) пациента Grade 5.
Варикоз эпидуральных вен наиболее часто наблюдается в сочетании с
другими факторами компрессии (грыжа диска, стеноз позвоночного канала).
Наиболее чувствительным методом диагностики является МРТ, однако при
проведении РКТ также можно диагностировать образование 40–70 HU по плотности, локализующееся преимущественно на вентральной поверхности в центральной или субартикулярной зонах. У 18 (83%) пациентов степень дегенеративного процесса поясничного отдела позвоночника Модик–1; у 4 (17%) Модик–2. По шкале Pfirmann у 2 (10%) пациентов степень дегенеративного процесса Grade 3; у 18 (80%) Grade 4 и у 2 (10%) больных Grade 5.
По результатам нейровизуализации плотностные характеристики гипертрофированных желтых связок могут быть различными от 70 до 140 HU. Это
зависит от стадии дегенеративного процесса и степени их обызвествления и
оссификации. Гипертрофированные желтые связки вызывают дорзальную компрессию, приводящую к стенозу позвоночного канала и изменению его формы
в переднезаднем направлении. Степень стеноза позвоночного канала в группе
пациентов с гипертрофией желтых связок оценивали по шкале Harwod Nash и
Petersson (рисунок 7).
Оценка степени стенозирования позвоночного канала у пациентов с гипертрофией фасеточных суставов также проводилась по этой шкале, так как эти
две группы пациентов похожи по «механизму» стенозирования позвоночного
канала – стенозирование в переднее–заднем направлении с изменением формы
позвоночного канала.
50.
50Общее количество пациентов
Степень стеноза позвоночного канала при
гипертрофии желтой связки
26
24
22
20
18
16
14
12
10
8
6
4
2
0
15 (59%)
5 (19%)
6 (22 %)
0%
нет стеноза
1 степень
2 степень
3 степень
Степень стенозирования позвоночного канала по шкале Harwod Nash и
Peterson
Рисунок 7 - Распределение пациентов с гипертрофией желтой связки по
степени стеноза позвоночного канала.
В группе пациентов с гипертрофией желтой связки преобладали пациенты со стенозом позвоночного канала 2 степени (15 больных). Пациентов со стенозами позвоночного канала 1 степени (5) и 3 степени (6) пациентов было примерно равное количество.
У 20 (76%) больных степень дегенеративного процесса поясничного отдела позвоночника Модик–1; у 4 (14%) Модик–2 и у 2 (10%) пациентов Модик–3. По шкале Pfirmann у 3 (12%) больных степень дегенеративного процесса
Grade 3; у 19 (74%) Grade 4; и у 4 (14%) пациентов Grade 5.
В группе пациентов со стенозированием позвоночного канала за счет гипертрофии фасеточных суставов наиболее чувствительным методом в диагностике стеноза позвоночного канала является РКТ и МРТ в режиме гидрографии
(Muyr). По данным нейровизуализации, можно видеть гипертрофию фасеточных суставов, измерить площадь позвоночного канала, уточнить форму и деформацию позвоночного канала и фораминальной зоны, а в режиме МРТ–
гидрографии уточнить ликвородинамику.
51.
51В группе пациентов со стенозом позвоночного канала при гипертрофии
фасеточного сустава преобладали пациенты с более выраженными стенозами
по шкале Harwod Nash и Petersson: 1 степени (5 пациентов), 2 степени (9 пациентов) и 3 степени (10 пациентов) (Рисунок 8).
Колическтво пациентов
Степень стеноза позвоночного канала
при гипертрофии фасеточных суставов
24
20
16
12
8
4
0
9 (38 %)
10(43 %)
5(19 %)
0%
нет стеноза
1 степень
2 степень
3 степень
Степень стеноза позвоночного канала по шкале Harwod Nash и
Peterson
Рисунок 8 - Распределение пациентов по степени стеноза позвоночного
канала при гипертрофии фасеточных суставов.
Это связано с тем, что при гипертрофии фасеточных суставов компрессия
осуществляется в дорзальном и боковом направлениях. Более грубое изменение формы позвоночного канала приводит к более выраженному его стенозу по
сравнению со стенозированием позвоночного канала при гипертрофии желтых
связок, когда компрессия осуществляется только в переднезаднем направлении.
У 9 (38%) пациентов степень дегенеративного процесса поясничного отдела позвоночника Модик–1; у 10 (42%) пациентов Модик–2; у 5 (20%) пациентов Модик–3 . По шкале Pfirmann у 5 (20%) пациентов степень дегенеративного процесса Grade 3; у 9 (38%) пациентов Grade 4; и у 10 пациентов (42%) Grade 5.
Локализация зоны отека эпидуральной клетчатки совпадает с локализацией грыжи диска. Однако по результатам РКТ зона отека эпидуральной клетчатки имеет иные от грыжи диска плотностные характеристики 40–60 HU (менее плотная, чем грыжа диска).
52.
52В группе пациентов, у которых был выявлен отек эпидуральной клетчатки у 7(85%) пациентов степень дегенеративного процесса поясничного отдела
позвоночника Модик–1; у 1 (15%) пациента Модик–2. По шкале Pfirmann у 2
(25%) пациентов степень дегенеративного процесса Grade 3, у 5 (60%) - Grade 4
и у 1 (15%) пациента Grade 5.
Наиболее чувствительным методом в диагностике остеофитов является
РКТ позвоночника, по результатам которой выявляется патологическое образование костной плотности, расположенное в парамедианной или субартикулярной зонах, приводящее к стенозу позвоночного или корешкового канала с компрессией нервных корешков.
У 3 (33%) пациентов степень дегенеративного процесса поясничного отдела позвоночника Модик–1, у 3 (33%) Модик–2 и у 3 (33%) больных Модик–
3 . По шкале Pfirmann у 1 (11%) пациента степень дегенеративного процесса
Grade 3, у 4 (44,5%) Grade 4 и у 4 (44,5%) больных Grade 5.
Киста фасеточного сустава - экстрадуральное объемное образование однородной структуры, плотно прилежащее к медиальной стенке фасеточного сустава или распространяющееся из нее, компримирующее невральные структуры с единичными жировыми включениями, средней плотности 40–60 HU по
данным РКТ, гипоинтенсивное в Т1–взвешенном изображении или изоинтенсивное в Т2–взвешенном изображении по данным МРТ.
У 3 (50%) пациентов степень дегенеративного процесса поясничного отдела позвоночника Модик–2, у 3 (50%) Модик–3 . По шкале Pfirmann у 3 (50%)
больных Grade 4 и у 3 (50%) пациентов Grade 5.
С целью оценки нестабильности в позвоночно–двигательном сегменте на
уровне спондилолистеза проводилась рентгенография с функциональными
пробами. Наиболее часто клиника стойкой компрессии нервных корешков при
нестабильном спондилолистезе обусловлена деформацией и стенозом начальных отделов корешкового канала. Поэтому важное диагностическое значение
имеет проведение РКТ с целью оценки фораминальной зоны и определения
степени стеноза корешкового канала. У всех пациентов степень стеноза ко-
53.
53решкового канала была выраженной (Grade 4). По шкале Модик стадия дегенеративного процесса Модик–1 у всех пациентов; по шкале Pfirmann у 2 больных
Grade–3 и у одного пациента Grade–4.
На следующем этапе исследования проведен анализ зависимости преобладания определенного фактора негрыжевой стойкой компрессии поясничных
и крестцовых корешков от стадии дегенеративных изменений пояснично–
крестцового отдела позвоночника по шкалам Модик и Pfirmann (данные шкалы
определены нами, как универсальные при описании нейровизуализационных
протоколов позвоночника). При статистической обработки данного этапа использовался корреляционный коэффициент межгрупповой зависимости Спирмена. Учитывались только статистически достоверные данные при уровне статистической ошибки p<0,05.
Выявлена зависимость преобладания определенного негрыжевого фактора стойкой компрессии поясничных и крестцовых корешков от стадии дегенеративного процесса поясничного–кретсцового отдела позвоночника по шкалам
Модик и Pfirmann (таблица 4; рисунки 9, 10).
Таблица 4 - Ранговые корреляции Спирмена – зависимость преобладания
стадии дегенеративного процесса поясничного отдела позвоночника по шкале
Модик и Pfirmann от негрыжевого фактора компрессии
Фактор компрессии
Рубцово-спаечный процесс
Гипертрофия желтой связки
Варикозно-расширенные вены
Стеноз позвоночного канала
Отек жировой клетчатки
Остеофиты
Киста фасеточного сустава
Спондилолистез
Шкала Модик
(коэффициент
Спирмена)
0,505235
0,495264
0,444607
0,523181
0,259831
0,320477
0,282055
0,153495
Шкала Pfirmann
(коэффициент
Спирмена)
0,518843
0,507051
0,459680
0,505374
0,265883
0,310714
0,260698
0,143814
54.
54Из таблицы 4 видно, что в группах пациентов с рубцово–спаечным процессом, гипертрофией желтой связки и первичным стенозом позвоночного канала коэффициент корреляции Спирмена выше 0,5. Это говорит о том, что зависимость этих факторов негрыжевой стойкой компрессии от стадии дегенеративного процесса пояснично–крестцового отдела позвоночника по шкалам Модик и Pfirmann очень высока. Из этого можно сделать вывод, что при описании
данных нейровизуализации поясничного–крестцового отдела позвоночника
особое внимание при учете негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков стоит делать на 3 основных преобладающих
фактора: рубцово–спаечный процесс эпидуральной клетчатки позвоночного канала, гипертрофия желтой связки и стенозу позвоночного канала. Также и особое внимание надо уделять этим факторам и при планировании оперативного
лечения для более адекватной декомпрессии структур позвоночного канала.
Отдельно следует отметить, что каждый из этих факторов преобладает на
определенной стадии дегенеративного поражения позвоночника по шкалам
Pfirmann и Модик. Так рубцово–спаечный процесс может встречаться уже и
начальных стадиях дегенеративного поражения позвоночника (особенно у лиц
молодого возраста оперированный повторно), гипертрофия желтой связки преимущественно на 2–3 стадиях, а стеноз позвоночного канала является последней стадией дегенеративного поражения позвоночника (исключением является
врожденный узкий позвоночный канала). Из этого можно заключить, что по
шкалам Модик и Pfirmann нет преобладающей нейровизуализационной стадии
дегенеративного поражения позвоночника при стойкой компрессии поясничных и крестцовых корешков.
На рисунках 9 и 10 представлены гистограммы распределения пациентов
в каждой группе негрыжевых вариантов стойкой компрессии поясничных и
крестцовых корешков по шкалам Модик и Pfirmann в процентном соотношении.
55.
55100
Общееколическтво пациентов в
процентах
100
90
85
83
82
76
80
68,75
70
60
50 50
50
37
40
30
20
18
10
23
17
0
42
18,75
12,5
15
11 13
0
Модик-1
Модик-2
Модик-3
0
0
00
КФС
СЛ
0
РСП
ВРВ
ГЖС
СПК
ОК
ОФ
Факторы негрыжевой компрессии
Рисунок 9 - Распределение пациентов с негрыжевой компрессией по стадии дегенеративного процесса в позвонках по шкале Модик. (РСП – рубцово–
спаечный процесс; ВРВ – варикозно расширенные вены; ГЖС – гипертрофия
желтой связки; СПК – стеноз позвоночного канала; ОК – отечная клетчатка:
ОФ – остеофиты; КФС – киста фасеточного сустава; СЛ – спондилолистез)
%
100
100
90
86
81
80
75
74
70
65
60
50
40
Grade4
37
30
20
10
Grade 3
50 50
46
8
6
10
9
11
15
19
Grade5
25
18,75
10
6,25
0
РСП
ВРВ
ГЖС
СПК
ОК
ОФ
0
00
КФС
СЛ
Рисунок 10 - Распределение пациентов с негрыжевой компрессией по
стадии дегенеративного процесса в дисках по шкале Pfirmann (РСП – рубцово–
спаечный процесс; ВРВ – варикозно расширенные вены; ГЖС – гипертрофия
желтой связки; СПК – стеноз позвоночного канала; ОК – отечная клетчатка:
ОФ – остеофиты; КФС – киста фасеточного сустава; СЛ – спондилолистез)
56.
56При более ранних стадиях дегенеративного процесса (Модик–1, Pfirmann
3–4) отмечается преобладание рубцово–спаечного процесса, отечной клетчатки,
варикозно расширенных вен, а на более поздних стадиях (Модик 2–3, Pfirmann–
5) преобладают такие факторы компрессии как остеофиты, кисты фасеточных
суставов, стенозы позвоночного канала, спондилолистезы. Данную зависимость
можно использовать при описании нейровизуализационной семиотики негрыжевых факторов компрессии (в качестве универсальных шкал Модик и Pfirmann) (p<0,05).
3.2 Частота негрыжевых факторов стойкой компрессии по результатам
мультимодальной предоперационной нейровизуализации
На втором этапе исследования проведен статистический анализ частот
встречаемости негрыжевых вариантов стойкой компрессии поясничных и
крестцовых корешков при дегенеративно–дистрофических поражениях поясничного отдела позвоночника. Установлена частота встречаемости негрыжевых
факторов стойкой компрессии с помощью ранее описанной нейровизуализационной семиотики, потвержденных данными интраоперационных находок. Для
описания частот применялся прямой статистический метод обработки данных
при уровне статистической ошибки p<0,05 с расчетом средне–статистического
отклонения (таблица 5).
Таблица 5 - Частота встречаемости негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков p<0,05
Факторы стойкой
компрессии
Среднее
Среднее
ст. отклонение
3
1
2
Рубцово–спаечный про0,070000 0,255467
цесс
Отек жировой клетчатки 0,020000 0,140175
Минимум
Макси–
мум
4
5
Общее
число пациентов в
выборке
6
0,00
1,000000
400
0,00
1,000000
400
57.
57Продолжение таблицы 5
5
6
1
2
3
4
Гипертрофия желтой
0,065000 0,246835
0,00
связки
Варикозно–
0,055000 0,228266
0,00
расширенные вены
Стеноз позвоночного
0,060000 0,237784
0,00
канала
Остеофиты
0,022500 0,148489
0,00
Киста фасеточного су0,015000 0,121705
0,00
става
Спондилолистез
0,007500 0,086385
0,00
Представленные данные таблицы 5 показывают,
1,000000
400
1,000000
400
1,000000
400
1,000000
400
1,000000
400
1,000000
400
что среднее статистиче-
ское отклонение для каждого фактора негрыжевой стойкой компрессии поясничных и крестцовых корешков составляет менее 1 при уровне статистической
ошибки p<0,05. Можно резюмировать, что показатель частоты встречаемости
негрыжевых форм стойкой компрессии поясничных и крестцовых корешков
является статистически достоверным показателем.
Произведен расчет частоты встречаемости факторов стойкой компрессии
поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника в процентах (рисунок 11).
Общее колическтво пациентов в %
100
90
80
70
60
50
40
30
20
10
0
79,5
7
6,5
6
5,5
2,25
2
1,5
0,75
Грыжа РСП
ГЖС
ГФС
ВРВ
ОФ
ОК
КФС
МПД
СЛ
Факторы стойкой компрессии поясничных и крестцовых корешков
по частоте встречаемости в процентах
Рисунок 11 - Факторы компрессии поясничных и крестцовых корешков:
МПД – межпозвонковый диск; РСП – рубцово–спаечный процесс; ГЖС – гипертрофия желтой связки; ГФС – гипертрофия фасеточного сустава; ВРВ – варикозно расширенные вены; ОФ – остеофиты; ОК – отечная клетчатка; КФС –
киста фасеточного сустава; СЛ – спондилолистез
58.
58Грыжа межпозвонкового диска является самой частой причиной стойкой
компрессии поясничных и крестцовых корешков (79,5%). Однако выявлена
значительная группа пациентов 55 (13,75%) со стойкой компрессией корешков
негрыжевыми факторами. У 27 (6,75%) больных негрыжевые факторы встречались в сочетании с грыжей диска.
Подтверждено, что у 371 (92,75%) пациента компрессия нервных структур обусловлена только одним фактором (монофакторная: 318 (79,5%) больных
с грыжевой монофакторной компрессией и 53 (13,25%) с негрыжевой монофакторной компрессией, в то время как у других 29 (7,25%) пациентов компрессия
явилась следствием воздействия нескольких факторов (полифакторная), причем
наблюдались как комбинации грыж межпозвоночных дисков с негрыжевыми
факторами, так и сочетание нескольких факторов негрыжевой природы
(p<0,05).
Самой частой причиной среди негрыжевых факторов явился спаечный
процесс тканей эпидурального пространства в результате реакции эпидуральной клетчатки на хроническое воспаление 28 (7%) наблюдений (рисунок 12).
Рубцовый
процесс
Артроз фасеточного
сустава
Рисунок 12 - По данным МРТ выявляется рубцовая ткань у пациента с
клиникой стойкой компрессии корешков конского хвоста (показана стрелкой).
59.
59У 9 (2,25%) пациентов компрессия рубцами и воспаленной эпидуральной
клетчаткой была монофакторной, у 19 (4,75%) пациентов наблюдалась полифакторная компрессия в сочетании с другими факторами компрессии.
Гипертрофия желтой связки явилась причиной стойкой компрессии корешков у 26 (6,5%) пациентов, у 7 (1,75%) из них – в качестве единственной
причины стойкой компрессии поясничных и крестцовых корешков при дегенеративном поражении пояснично–крестцового отдела позвоночника (рисунок.
13).
Гипертрофированные желтые связки
Рисунок 13. - На МРТ в сагиттальных и аксиальных проекциях: Гипертрофированные желтые связки приводят к стенозу позвоночного канала на
грудном и поясничном уровне (выделены цветом и указаны стрелками)
Стенозирование позвоночного канала за счет гипертрофии фасеточного
сустава наблюдалось у 24 пациентов (6,%), из них как монофакторная компрессия в 18 (4,5%) наблюдениях (рисунок 14).
60.
60Стеноз позвоночного канала
Рисунок 14 - РКТ в сагиттальной и аксиальной плоскостях, МРТ в режиме
гидрографии: за счет гипертрофии фасеточных суставов стенозирован и деформирован позвоночный канал с полной блокадой ликворотока (показано
стрелками).
Варикозно расширенные вены, оказывающие патологическое воздействие
на нервные структуры, диагностированы в 22 (5,5%) наблюдениях, причем в 7
(1,75%) из них они оказались единственной причиной сдавления нервных корешков (рисунок 15).
Рисунок 15 - Расширенные эпидуральные вены на МРТ и РКТ на уровне
L4–5, создающие масс–эффект со смещением дурального мешка кзади за счет
распространения вен в сторону задних отделов тела вышележащего позвонка
L3 и фораминальных отверстий (показано стрелками).
61.
61Задние остеофиты оказались причиной сдавления нервных корешков в 9
(2,25%) наблюдениях, в трех (0,75%) из них – в качестве единственной причины (рисунок 16.)
Остеофиты
Рисунок 16 - РКТ в сагиттальной и аксиальной плоскостях: грубые костные изменения (показано стрелками).
Отек эпидуральной клетчатки был выявлен у 8 (2%) пациентов и только
при полифакторной компрессии в сочетании с грыжей диска (рисунок. 17).
Отек эпидуральной клетчатки
Рисунок 17 - МРТ в сагиттальной и аксиальной плоскостях: отек эпидуральной клетчатки в области грыжи диска (показано стрелками).
62.
62У 6 (1,5%) пациентов клиника стойкой компрессии нервных корешков
была обусловлена кистой фасеточного сустава. Кисты могут быть синовиальными и ганглионарными. Кистозные образования, располагающиеся в боковых отделах позвоночного канала, имеющие связь с дугоотростчатым суставом
и выстланные изнутри синовиальным эпителием, называют синовиальными
кистами. Эти образования со временем могут терять связь с синовиальной
полостью межпозвоночного сустава. После этого кисты утрачивают синовиальную выстилку и могут оссифицироваться. Образования, располагающиеся
в периартикулярной зоне, но утрачивающие связь с полостью сустава и
лишенные внутренней синовиальной выстилки, называют ганглионарными
(узловыми) кистами (рисунок 18).
Рисунок 18 - На МРТ в аксиальной проекции (слева) ганглионарная киста
фасет очного сустава; на РКТ в аксиальной проекции (справа) киста синовиальная. На обоих рисунках видна связь образования с фасеточным суставом (показано стрелками).
У 3 (0,75%) пациентов с клинической картиной стойкой компрессии
нервных корешков был диагностирован спондилолистез с гипермобильностью
в позвоночно–двигательном сегменте (Рисунок 19).
63.
63Деформация межпозвонковых отверстий
Рисунок 19 - На серии компьютерных томограмм в сагитальной и аксиальной плоскости видна деформация межпозвонковых отверстий приводящая к
стенозу позвоночного канала (показано стрелками).
3.3. Клиническая картина стойкой компрессии поясничных и крестцовых корешков у больных с негрыжевой и грыжевой компрессией
Стойкая компрессия корешков при дегенеративных поражениях позвоночника – это компрессия, которую не удается купировать нехирургическими
методами, либо непосредственно после развития компрессии очевидна безальтернативность хирургического лечения.
Клиническая картина стойкой компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника характеризовалась сочетанием симптомов вертебрального, корешкового синдромов и
расстройства функции тазовых органов у больных с первичным и вторичным
стенозом позвоночного канала.
При описании клинических групп и симптомов была использована классификация симптомов, разработанная В.И. Даниловым и В.С. Филатовым в
диссертационном исследовании 2006 года по изучению негрыжевых форм
стойкой компрессии поясничных и крестцовых корешков при дегенеративно–
дистрофических поражениях позвоночника по результатам интраоперационной
визуализации. Клиническая картина стойкой компрессии поясничных и крестцовых корешков различными факторами была изучена с учетом данных интра-
64.
64операционных находок. В данной работе изучена клиническая картина негрыжевых вариантов компрессии с учетом данных предоперационной нейровизуализации на основании разработанной авторами диссертации ранее описанной
семиотики компримирующих агентов. Все нейровизуализационные находки
были также подтверждены и интраоперационно.
Проанализирована клиническая картина 400 пациентов со стойкой компрессией корешков конского хвоста. Пациенты разделены на 3 группы: 1–я (55
(13,75%) пациентов) – пациенты с негрыжевой компрессией; 2–я (27 (6,75%)
пациентов) – пациенты с грыжей диска в сочетании с негрыжевыми факторами;
3–я группа – пациенты с грыжевой компрессией (таблица 6).
Таблица 6 - Выраженность симптомов компрессионного синдрома у пациентов с поясничными и крестцовыми радикулопатиями, обусловленными различными компримирующими факторами
Группа
Синдром
1–я –
2–я – негрыженегрыжевая вая+грыжа диска
компресия
(n=27)
(n=55)
Вертебральный синдром
1
3–я – грыжевая компрессия
(n=318)
2
3
4
Выпрямленный лордроз
36 (65%)
15 (55%)
168 (53%)
Сколиоз
10 (18%)
8 (29,7%)
104 (33%)
Кифосколиоз
6 (11%)
6 (22%)
111 (35%)
36 (65%)
24 (89%)
260 (82%)
36 (65%)
24 (89%)
260 (82%)
36 (65%)
24 (89%)
260 (82%)
Болезненность при пальпации
остистых отростков и межостистых промежутков
Болезненность при пальпации
проекциионных зон межпозвоночных суставов
Болезненность при перкуссии
остистых отростков и межостистых промежутков
65.
65Продолжение таблицы 6
1
2
3
4
Болезненность при перкуссии
проекциионных зон межпозвоночных суставов
Ограничение движений
36 (65%)
24 (89%)
260 (82%)
41 (74%)
20 (74%)
251 (79%)
Вынужденное положение
22 (40%)
27 (100%)
273 (86%)
Корешковый синдром
33 (60%)
27 (100%)
295 (93%)
Монорадикулопатия
Полирадикулопатия
22 (40%)
–
23 (7%)
Односторонняя корешковая
боль
Двусторонняя
корешковая
боль
Антальгические позы
33 (60%)
27 (100%)
295 (93%)
22 (40%)
–
23 (7%)
41 (74%)
25 (96,2%)
298 (94%)
38 (69%)
25 (92,6%)
276 (87%)
3 (5,4%)
2 (7,4%)
–
16 (29%)
10 (37%)
120 (38%)
Умеренный парез
16 (29%)
13 (48%)
67 (21%)
Грубый парез
2 (3,6%)
4 (15%)
22 (7%)
Снижение КР
9 (16%)
7 (26%)
48 (15%)
Снижение АР
13 (23,6%)
12 (44,4%)
241 (76%)
Отсутствие АР
23 (42%)
15 (55,5%)
67 (21%)
41 (74,5%)
27 (100%)
302 (95%)
Нарушение поверхностных
видов
чувствительности
Нарушение глубоких видов
чувствительности
Легкий парез
Симптом Ласега
Нарушение функций тазовых
4 (7,3%)
2 (7,4%)
4 (1,5%)
органов
Синдром каудогенной хромо26 (47%)
–
–
ты
Примечание: n– число пациентов; КР – коленные рефлексы; АР – ахилловы рефлексы (p<0,02).
Группа 1 (пациенты с негрыжевой компрессией, n=55). Вертебральный
синдром в виде выпрямления поясничного лордоза был представлен у 36 (65%)
66.
66пациентов; у 16 (29%) он проявлялся выраженными рефлекторно–тоническими
установками (искривлениями) позвоночника, из них у 10 (18%) больных определялся сколиоз, в том числе в комбинации с кифотической установкой у 6
(11%) пациентов. Ограничение движений в поясничном отделе позвоночника
отмечено у 41 (74%) пациента. Болезненность при пальпации остистых отростков, межостистых промежутков и зон, расположенных в проекции межпозвонковых суставов, отмечена у 36 (65%) больных. В таком же количестве наблюдений выявлена болезненность при перкуссии остистых отростков; локальная
болезненность при перкуссии межостистых промежутков и зон, расположенных в проекции межпозвонковых суставов. Боли в соответствующих дерматомах были выражены у всех больных, односторонняя локализация отмечена у 33
(60%) пациентов, двусторонняя – у 22 (40%). Симптом Ласега зафиксирован у
41 (74,5%) пациентов. Расстройства чувствительности среди анализируемой
группы выявлены у 41 (74%) больных. У 35 пациентов (64% наблюдений) отмечено снижение силы в различных мышечных группах нижних конечностей.
У 16 (29%) больных выявлен легкий парез, у 16 (29%) - умеренный парез, у 2
(3,6%) – грубый парез. Изменения коленных рефлексов отмечены в 15 (27%)
наблюдениях, ахилловых - в 36 (66%). Клинические проявления расстройств
вегетативной иннервации оценивались по наличию или отсутствию нарушений
функции тазовых органов, как наиболее тяжелому проявлению вегетативной
дисфункции. Расстройства мочеиспускания выявлены у 4 (7,3%) пациентов;
синдром каудогенной хромоты наблюдался у 26 (47%) больных.
Группа 2 (пациенты, у которых компрессия была обусловлена комбинацией грыжи межпозвонкового диска и негрыжевых факторов, n=27). Выпрямление поясничного лордоза выявлено у 15 (55%) пациентов; у 8 (29,7%) определялся сколиоз, в том числе в комбинации с кифотической установкой у 6
(22%) пациентов. Ограничение движений в поясничном отделе позвоночника
отмечено у 20 (74%) больных. Болезненность при пальпации остистых отростков, межостистых промежутков и зон, расположенных в проекции межпозвонковых суставов, отмечена у подавляющего числа пациентов 24 (89%), в таком
67.
67же количестве наблюдений выявлена болезненность при перкуссии остистых
отростков; локальная болезненность при перкуссии межостистых промежутков
и зон, расположенных в проекции межпозвонковых суставов. Боли в соответствующих дерматомах присутствовали у всех больных и были односторонними. Симптом Ласега зафиксирован у всех пациентов. Расстройства чувствительности выявлены у всех больных, причем у 2 (7,4%) из них имело место
нарушение глубоких видов чувствительности.
У всех больных отмечено снижение силы в различных мышечных
группах нижних конечностей, из них у 10 (37%) пациентов в форме
легкого пареза, у 13 (48%)
в форме умеренного пареза, у 13 (48%) больных
грубый парез вплоть до плегии.
Изменения коленных рефлексов отмечены в
12 (44%) наблюдениях, ахилловых в 27 (100%). Расстройства мочеиспускания
выявлены у 2 (7,4%) пациентов.
Как и в первой группе, отмечено преобладание искривлений позвоночника над более легкими формами рефлекторно–тонических установок. Однако во
второй группе выявлены более грубые нарушения в двигательной и чувствительной сфере пациенты с нарушениями глубоких видов чувствительности,
более грубыми парезами в мышечных группах. Боли корешкового характера,
симтомы натяжения присутствовали у всех больных.
Группа 3 (пациенты с грыжевой монофакторной компрессией n=318).
Выпрямление поясничного лордоза отмечено у 168 (53%) пациентов; у 104
(33%) больных определялся сколиоз. Ограничение движений в поясничном отделе позвоночника отмечено у 251 (79%) пациента. Болезненность при пальпации остистых отростков, межостистых промежутков и зон, расположенных в
проекции межпозвонковых суставов, отмечена у большей части пациентов 260
(82%), в таком же количестве наблюдений выявлена болезненность при перкуссии остистых отростков; локальная болезненность при перкуссии межостистых
промежутков и
зон,
расположенных
в
проекции межпозвонковых су-
ставов. Боли в соответствующих дерматомах присутствовали у всех больных,
односторонняя локализация отмечена у 295 (93%) пациентов, двусторонняя – у
68.
6822 (7%). Симптом Ласега выявлен у 302 (95%)больных. Расстройства чувствительности отмечены у 276 (87%) пациентов, во всех наблюдениях имело место
нарушение поверхностной чувствительности. В 209 (66%) наблюдениях отмечено снижение силы в различных мышечных группах нижних конечностей, в
120 (38%) в форме легкого пареза, в 67 (21%) – в форме умеренного пареза и в
70 (22%) наблюдениях – в форме грубого пареза. Изменения коленных рефлексов отмечены у 54 (17%) пациентов, ахилловых – у 308 (97%). Задержка мочеиспускания обнаружена у 4 (1,5%) больных. В данной группе наблюдалось преобладание более легких форм рефлекторно–тонических установок, отсутствие в
клинической картине нарушений глубоких видов чувствительности, в двигательной сфере – отсутствие нарушений движений в форме грубых парезов. Боли корешкового характера, симптомы натяжения обнаружены практически у
всех пациентов.
Во всех трех группах клиническая картина была представлена сочетанием
симптомов следующих основных синдромов: вертебрального, корешкового,
нарушения функций тазовых органов, синдромом каудогенной хромоты. Анализ клинической картины, обусловленной негрыжевыми факторами, существенно не отличается от клинической картины грыжи межпозвонкого диска. В
структуре вертебрального и корешкового синдромов у всех пациентов установлено напряжение паравертебральных мышц с блокадой сегментов на поясничном уровне, нередко с нарушением осанки и всегда с наличием симптома Ласега, особенно на стороне корешковой компрессии. Установлены несущественные отличия в выраженности отдельных симптомов в зависимости от факторов
сдавления. В группе с негрыжевой компрессией (особенно при полифакторном
варианте сдавления) чаще встречается полирадикулопатия и синдром каудогенной хромоты, обнаружены более грубые формы чувствительных и двигательных нарушений. Также при негрыжевых вариантах компрессии болевой
синдром характеризовался более медленным нарастанием интенсивности боли
и дебютом заболевания с боли в спине. При грыже диска в большинстве случаев болевой синдром характеризовался острой умеренно или интенсивно выра-
69.
69женной болью в ноге в зоне пораженного дерматома. При грыжевой полифакторной компрессии установлены более выраженные нарушения функции тазовых органов.
Проведен статистический анализ клинических симптомов стойкой компрессии
поясничных
и
крестцовых
корешков
при
дегенеративно–
дистрофических поражениях поясничного отдела позвоночника методом факториальной нагрузки (квартимаксимальной нормализации) (таблица 7, p<0,05).
Таблица 7 - Факториальный анализ клинических симптомов стойкой компрессии поясничных и крестцовых корешков
Клинические симптомы компрессии
1
Выпрямленный лордоз
Сколиоз
Кифосколиоз
Боль остистых отростков при пальпации
Боль в суставах при пальпации
Боль остистых отростков (перкуссия)
Боль в суставах (перкуссия)
Ограничение движений в поясничном отделе
Вынужденное положение
Монорадикулопатия
Полирадикулопатия
Односторонняя корешковая боль
Двусторонняя корешковая боль
Антальгические позы
Нарушение поверхностной чувствительности
Нарушение глубокой чувствительности
Легкий парез
Умеренный парез
Грубый парез
Снижение КР
Оживление КР
Снижение АР
Отсутствие АР
Симптом Ласега
Нарушение функции тазовыз органов
Синдром каудогенной хромоты
фактор
фактор
2
3
–0,048784
–0,070384
–0,007304
0,967326
0,967326
0,967326
0,967326
0,827294
0,661158
0,028686
–0,028686
0,028686
–0,028686
0,446817
0,150513
–0,055144
–0,032001
0,078830
0,047113
0,107785
–0,020497
0,189617
–0,111464
0,240892
0,043038
–0,001882
–0,017287
0,339909
0,356710
–0,051043
–0,051043
–0,051043
–0,051043
0,067477
–0,116634
0,963170
0,963170
0,963170
0,963170
0,051631
–0,521304
0,283544
–0,345815
0,154976
0,232088
0,149061
0,175480
–0,183905
0,115612
–0,050897
0,048939
0,536153
70.
70Из таблицы 7 видно, что основными клиническими симптомами (выделены жирным цветом) при оценке стойкой компрессии поясничных и крестцовых
корешков является болевой вертебральный синдром (боль в остистых отростках
и проекции фасеточных суставов при пальпации и перкуссии, ограничение
движений в поясничном отделе позвоночника), корешковый болевой синдром и
радикулопатия.
На следующем этапе было проведено сопоставление клинических симптомов и клинических групп с помощью ранговых корреляций Спирмена (таблица 8) p<0,05.
Таблица 8 - Взаимосвязь преобладания клинического симптома в различных клинических группах (ранговая корреляция Спирмена) p<0,05
Клинический симптом
1
Выпрямленный лордоз
Сколиоз
Кифосколиоз
Боль остистых отростков (пальпация)
Боль в суставах (пальпация)
Боль остистых отростков (перкуссия)
Боль в суставах (перкуссия)
Ограничение движений в позвоночнике
Вынужденное положение
Монорадикулопатия
Полирадикулопатия
Односторонняя корешковая боль
Двусторонняя корешковая боль
Антальгические позы
Нарушение поверхностной чувствительности
Нарушение глубокой чувствительности
Легкий парез
Умеренный парез
Грубый парез
Снижение КР
Оживление КР
Коффициент Спирмена взаимосвязи с клиническими
группами
2
–0,080063
0,099425
0,181921
0,099587
0,099587
0,099587
0,099587
0,043734
0,298946
0,277855
–0,277855
0,277855
–0,277855
0,440608
0,126175
–0,216261
0,054032
–0,124158
0,003740
–0,042405
–0,220741
71.
711
Снижение АР
Отсутствие АР
Симптом Ласега
Нарушение функции тазовыз органов
Синдром каудогенной хромоты
Продолжение таблицы 8.
2
0,395280
–0,223400
0,270558
–0,155573
0,560053
На основании представленных данных таблицы 8 можно констатировать,
что статистически значимый коэффициент Спирмена 0,560053 (выделен жирным цветом) выявлен только у синдрома каудогенной хромоты. Этот симптом
преобладал в 1 клинической группе пациентов с негрыжевыми вариантами
стойкой компрессии (преимущественно у пациентов со стенозом позвоночного
канала). У всех других клинических симптомов достоверной статистической
связи с клинической группой выявлено не было. Из этого можно сделать вывод,
что стойкая компрессия поясничных и крестцовых корешков имеет свою характерную клиническую картину, существенно не зависящую от варианта и характера факторов компрессии и представленна сочетанием симптомов вертебрального, корешкового синдромов, нарушением функции тазовых органов и
синдромом каудогенной хромоты. Клиническая картина негрыжевых вариантов
стойкой компрессии поясничных и крестцовых корешков имеет несущественные отличия в выраженности отдельных симптомов от клинической картины
грыжи межпозвонкового диска.
72.
72ГЛАВА IV. ЗНАЧЕНИЕ ПРЕДОПЕРАЦИОННОЙ ДИАГНОСТИКИ
ФАКТОРОВ КОМПРЕССИИ ПОЯСНИЧНЫХ И КРЕСТЦОВЫХ
ДЛЯ ОРГАНИЗАЦИИ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
4.1 Варианты декомпрессии поясничных и крестцовых корешков у больных с различными факторами сдавления
Хирургический метод лечения пациентов с дегенеративным поражением
позвоночника эффективен при стойкой компрессии поясничных и крестцовых
корешков. Показанием к хирургическому лечению является наличие у пациента
клинических симптомов стойкой компрессии корешков конского хвоста при
неэффективности консервативной терапии. Стойкой компрессией корешков
конского хвоста мы считаем сочетание симптомов вертебрального, корешкового синдромов, синдрома каудогенной хромоты в сочетании с признаками развития первичного и вторичного стеноза позвоночного канала. Нарушения функции тазовых органов – показание к неотложной операции.
Основная цель операции - адекватная декомпрессия поясничных и крестцовых корешков. На первом этапе операции хирург находит компримированный корешок, а во время второго этапа устраняет все факторы компрессии вне
зависимости от операционных находок, проследив свободный пробег корешка
от места выхода последнего из дурального мешка до входа в корешковый канал. При стенозе фораминальной зоны свободный ход корешка должен быть
прослежен до его экстрафораминальной части. Хорошим прогностическим признаком является улучшение пульсации корешка после его декомпрессии.
Оперативные вмешательства проводились в положение пациента лежа на
животе с максимальным разгибанием поясничного отдела позвоночника с использованием операционного микроскопа (Carl Zeiss OPMI Vario NC 33) и заднего доступа на пояснично–крестцовом отделе позвоночника.
В исследовании определено 5 групп пациентов по вариантам декомпрессии структур позвоночного канала при стойкой компрессии поясничных и
73.
73крестцовых корешков при дегенеративных поражениях пояснично–крестцового
отдела позвоночника: 1ая группа – пациенты, которым была выполнена интерламинэктомия (304 пациента 76%), 2ая группа – пациенты, которым выполнена
односторонняя расширенная интерламинэктомия (25 пациентов 6,25%), 3ая
группа двусторонняя расширенная интерламинэктомия (16 пациентов 4%) ,
4ая группа – гемиламинэктомия (24 пациента, 6%), 5ая группа –
ламинэктомия
(31 пациент 7,75%) (рисунок 20).
Число пациентов по объему декомпрессии
структур позвоночного канала при стойкой
компрессии поясничных и крестцовых
корешков
31; 8%
24; 6%
16; 4%
25; 6%
304; 76%
Интерламинэктомия
Односторонняя расширенная интерламинэктомия
Двусторонняя расширенная интерламинэктомия
Гемиламинэктомия
Ламинэктомия
Рисунок 20 - Число пациентов по объему декомпрессии структур позвоночного канала при стойкой компрессии поясничных и крестцовых корешков.
74.
74На этом этапе исследования целью было определить взаимосвязь между
объемом декомпрессии структур позвоночного канала и вариантами стойкой
компрессии поясничных и крестцовых корешков по результатам предоперационной мультимодальной нейровизуализации поясничного отдела позвоночника.
Для выполнения поставленной цели проведено сравнение групп пациентов с
негрыжевыми вариантами стойкой компрессии поясничных и крестцовых, ранее
описанных клинических групп с группами пациентов по объему оперативного
вмешательства. При статистической обработки использовался коэффициент
ранговой корреляции Спирмена для сравнительного анализа групп и установления взаимосвязи в группах. Статистически достоверными считались данные при
уровне статистической ошибки p<0,05.
Самый частый выполняемый доступ при грыжевой монофакторной компрессии была интерламинэктомия. Данного хирургического подхода было
вполне достаточно для адекватной декомпрессии корешка при его стойкой
компрессии грыжей диска. В клинической группе 3 (пациенты с грыжевой монофакторной компрессией – 318) было выполнено 304 интерламинэктомии, 7
односторонних расширенных интерламиектомий и 7 гемиламинэктомий.
Негрыжевые факторы компрессии и их полифакторность (также и в сочетании с грыжей диска) выявленных по данным предоперационной мультимодальной визуализации диктовали выполнение более широкой декомпрессии
структур позвоночного канала.
Объем оперативного доступа зависел от преобладания факторов компрессии, возраста пациента, клинической картины, моно– или полифакторности
компрессии. Расширенной интреламинэктомией считалось увеличение объема
декомпрессии структур позвоночного канала при дополнительной резекции
дужки позвонка или выполнении медиальной фасетотомии.
В клинической группе 1 (пациенты с негрыжевой монофакторной компрессией - 55 пациентов) выполнялись следующие по объему оперативные
вмешательства: наиболее частой выполняемой операцией по объему хирургического доступа была ламинэктомия – 22 пациента (40%), на втором месте рас-
75.
75ширенная двусторонняя интерламинэктомия и гемиламинэктомия – по 12 пациентов (22%), на третьем односторонняя расширенная интерламинэктомия – 9
Число пациентов
пациентов (16%) (рисунок 21).
55
50
45
40
35
30
25
20
15
10
5
0
22
9
12
12
Односторонняя расширенная интерламинэктомия
Двусторонняя расширенная интерламинэктомия
Гемиламинэктомия
Ламинэктомия
Рисунок 21 - Распределение пациентов с негрыжевой монофакторной
компрессией (клиническая группа 1) в зависимости от хирургического доступа
(варианта декомпрессии).
В клинической группе 2 (пациентов с полифакторной компрессией (сочетание негрыжевых факторов и в сочетании с грыжей диска – 27 пациента) распределение по варианту декомпрессии было следующим: наиболее часто выполняемой операцией была ламинэктомия и односторонняя расширенная интерламинэктомия (при сочетании грыжи диска с отеком перидуральной клетчатки) – по 9 (33%) пациентов, на втором месте гемиламинэктомия – 5(18%)
76.
76пациентов, на третьем месте – двусторонняя расширенная интерламинэктомия
Число пациентов
– 4(15%) пациента (рисунок 22).
27
24
21
18
15
12
9
6
3
0
9
9
4
5
Односторонняя расширенная интерламинэктомия
Двусторонняя расширенная интерламинэктомия
Гемиламинэктомия
Ламинэктомия
Рисунок 22 - Распределение пациентов с негрыжевой полифакторной
компрессией (клиническая группа 2) в зависимости от хирургического доступа
(варианта декомпрессии).
У пациентов с рубцово–спаечным процессом распределение по варианту
декомпрессии было следующим: 9 (32%) пациентам выполнена ламинэктомия;
8 (28,5%) – расширенная односторонняя интреламинэктомия с резекцией медиальной части фасеточного сустава и части выше– и нижележащей дужки позвонков в пораженном межпозвонковом промежутке; 6 (21%) – выполнялась
гемиламинэктомия и 5(18%) пациентам – расширенная двусторонняя интерламинэктомия.
В группе пациентов, у которых были диагностированы варикозно расширенные вены позвоночного канала, выполнены следующие операции: 7 (32%)
пациентам – ламинэктомия; 7 (32%) – гемиламинэктомия; 6 (27%) - двусторон-
77.
77няя расширенная интерламинэктомия и 2 (9%) пациентам – односторонняя
расширенная интерламинэктомия.
Распределение пациентов в группах с рубцово–спечным процессом и варикозно расширенными венами по объему оперативного вмешательства примерно равное. Это связано с тем, что локализация данных факторов компрессии
в позвоночном канале может быть разной (и в фораминальной зоне, и в центральной части позвоночного канала, и парамедианно, приводя к его стенозу).
Наиболее часто данные факторы встречаются при полифакторном варианте
сдавления нервных корешков в сочетании с грыжей и другими негрыжевыми
факторами. Именно поэтому и объем оперативного вмешательства определяется для каждого пациента индивидуально на основании данных предоперационной нейровизуализации и интраоперационных находок.
При гипертрофии желтой связки 14 (54%) пациентам выполнена ламинэктомия; 5 (19%) – двусторонняя расширенная интерламинэктомия; 4 (15%)
– гемиламинэктомия и 3 (11%) пациентам - односторонняя расширенная интерламинэктомия. Односторонняя расширенная интерламинэктомия и гемиламинэктомия выполнялась преимущественно при сочетании гипертрофии желтой связки с грыжей. Ламинэктомия и двусторонняя расширенная интерламинэктомия выполнялись при монофакторной гипертрофии желтой связки и
полифакторной компрессии в сочетании с другими негрыжевыми факторами
компрессии.
У пациентов со стенозированием позвоночного канала за счет гипертрофии фасеточных суставов наиболее часто выполняемой операцией была ламинэктомия – 18 (75%) пациентов; 5 (21%) была выполнена двусторонняя расширенная интерламинэктомия и 1 (4%) пациенту гемиламинэктомия.
В группах пациентов с гипертрофией желтой связкой и гипертрофией фасеточных суставов самой часто выполняемой операцией была ламинэктомия.
При данных факторах компрессии стенозирование позвоночного канала происходит преимущественно в переднезаднем направлении, именно поэтому необ-
78.
78ходимо выполнять широкую двустронную заднюю декомпрессию при данном
виде сдавления корешков конского хвоста.
При гипертрофии фасеточных суставов компрессия структур позвоночного канала происходит преимущественно в начальных отделах фораминальной
зоны. Двусторонней расширенной интерламинэктомии с резекцией медиальной
части фасеточных суставов и желтой связки бывает достаточно для достижения
адекватной декомпрессии (данный вид операции занимает второе место по частоте ее выполнения в группах пациентов с гипертрофией желтой связки и стенозом позвоночного канала). Однако более быстрый регресс неврологической
симптоматики (особенно регресс синдрома каудогенной хромоты) наступал в
группе пациентов, которым выполнялась ламинэктомия.
У пациентов с отеком и воспалением жировой перидуральной клетчатки
характер компрессии был полифакторным, преимущественно в сочетании с
грыжей диска. В этой группе пациентов было отмечено самое большое количество наблюдений несовпадения данных предоперационной нейровизуализации
с данными интраоперационных находок. У 4 (50%) пациентов по данным нейровизуализации диагностирована грыжа диска, а интраоперационно выявлена
измененная перидуральная клетчатка сероватового цвета плотно охватывающая нервный корешок и компримируя его. Интраоперационные находки в данных случаях приводили к расширению объема операции с целью более адекватной декомпрессии нервных структур. Наиболее часто выполняемой операцией в данной группе пациентов была односторонняя расширенная интерламинэктомия – 5 (62,5%) больных; на втором месте гемиламинэктомия – 3
(37,5%) пациента.
В группе пациентов, у которых по данным РКТ были диагностированы
остеофиты, распределение по объему оперативного вмешательств было следующим: 4 (44%) пациентам выполнена ламинэктомия; 3 (33%) выполнена гемиламинэктомия и по 1 (11%) пациенту – выполнялась односторонняя и двусторонняя расширенная интерламинэктомия. Следует отметить, что у этой группы
79.
79пациентов данные предоперационной нейровизуализации полностью совпадали с интраоперационными находками.
Киста фасеточного сустава – образование, распространяющееся из медиальной части фасеточного сустава в полость позвоночного канала и приводящее
к компрессии нервного корешка преимущественно в начальных отделах фораминальной зоны. Для адекватной декомпрессии структур позвоночного канала
необходимо выполнение резекции медиальной части фасеточного сустава. 4–м
пациентам из 6 с выявленной кистой фасеточного сустава выполнялась односторонняя расширенная интерламинэктомия. 2–м пациентам (у которых отсутствовал междужковый промежуток в результате аномально построенного фасеточного сустава) для достижения декомпрессии потребовалось выполнение гемиламинэктомии.
Наблюдение пациентов со спондилолистезом в нашей клиники мало в
связи с тем, что пациенты из данной нозологической группы наблюдаются и
оперируются в другой нейрохирургической клинике Республики Татарстан. Во
всех трех случаях пациентов со спондилолистезом наблюдаемых в нейрохирургической клиники ГАУЗ МКДЦ выполнялась двусторонняя расширенная интерламинектомия с имплантацией системы для межостистого спондилодеза Diam.
Исследована зависимость варианта декомпрессивной операции от негрыжевого варианта стойкой компрессии поясничных и крестцовых корешков с
учетом данных мультимодальной дооперационной нейровизуализации (рисунок
23, таблица 9).
80.
8080
Ламинэктомия
70
60
50
Гемиламинэктомия
40
30
Двусторонняя расширенная
интерламинэктомия
20
Поликомпрессия
Монокомпрессия
СЛ
КФС
ОФ
ОК
СПК
ГЖС
ВРВ
0
РСП
10
Расширенная односторонняя
интерламинэктомия
Рисунок 23 - Распределение пациентов по объему хирургического вмешательства в зависимости от характера негрыжевого варианта стойкой компрессии корешков конского хвоста: РСП – рубцово–спаечный процесс; ВРВ – варикозно расширенные вены; ГЖС – гипертрофия желтой связки; СПК – стеноз
позвоночного канала; ОК – отечная клетчатка: ОФ – остеофиты; КФС – киста
фасеточного сустава; СЛ – спондилолистез
Таблица 9 - Ранговые корреляции Спирмена зависимости негрыжевых вариантов стойкой компрессии поясничных и крестцовых корешков от объема
декомпрессии структур позвоночного канала
Рубцово–спаечный процесс
Гипертрофия желтой связки
Варикозно–расширенные вены
Стеноз позвоночного канала
Отек жировой клетчатки
Остеофиты
Киста фасеточного сустава
Спондилолистез
Ранговый коэффициент
Спирмена
0,5
0,5
0,4
0,5
0,2
0,3
0,2
0,1
81.
81Самые высокие и статистически значимые коэффициенты корреляции
(выделены жирным цветом) между вариантом стойкой компрессии и объемом
операции получены в группах пациентов с рубцово–спаечным процессом позвоночного канала, гипертрофией желтой связки и стенозом позвончного канала.
При сравнении клинических групп пациентов с группами по объему декомпрессии структур позвоночного канала коэффициент корреляции Спирмена
составил 0,905199 при уровне статистической ошибки p<0,05. Так объем декомпрессии статистически значимо вырастал в группе пациентов с негрыжевыми вариантами стойкой компрессии поясничных и крестцовых корешков. Из
этого следует, что существует прямая зависимость необходимого объема декомпрессии нервных структур от содержания и характера компримирующих
факторов. Можно заключить, что полифакторная компрессия и негрыжевые
формы сдавления в большинстве наблюдений диктуют необходимость более
широкой декомпрессии (геми –, ламинэктомия) структур позвоночного канала.
Так ламинэктомия чаще выполнялась у пациентов с негрыжевой полифакторной компрессией с преобладанием таких факторов как первичный стеноз позвоночного канала, гипертрофия желтых связок, рубцово–спаечный процесс.
Данные факторы компрессии встречаются при более поздних стадиях дегенеративного процесса поясничного отдела позвоночника по шкале Pfirmann и Модик. Можно сделать вывод, что объем оперативного вмешательства увеличивается на более поздних стадиях дегенеративного процесса позвоночника.
Нейровизуализационные находки были также подтверждены и интраоперационно. В 76% данные протокола нейровизуализации полностью совпадали с
интраоперационными находками. В 24 % интраоперационно были обнаружены
дополнительные факторы компрессии, которые не были диагностированы на
дооперацинном уровне с помощью нейровизуализации, преимущественно в
группе пациентов с полифакторной компрессией.
82.
824.2 Эффект декомпрессии поясничных и крестцовых корешков в раннем
послеоперационном периоде
Проанализированы ближайшие исходы оперативных вмешательств: в
раннем послеоперационном периоде и перед выпиской пациента из стационара
(в среднем на 7–10 сутки после операции). Проанализированы результаты регресса болевого синдрома по визуально–аналоговой шкале ВАШ в зависимости
от объема декомпрессии структур позвоночного канала. На втором этапе оценены результаты лечения в группах по объему декомпрессии структур позвоночного канала.
Корешковые боли разрешились у всех пациентов, причем у 95%– в первые сутки после операции; у всех оперированных подверглись регрессу вертебральный синдром и синдром каудогенной хромоты; регресс вынужденного
положения в постели и симптомов натяжения отмечен также у всех больных.
Регресс болевого синдрома оценивали по 10–балльной визуально–аналоговой
шкале (ВАШ). В послеоперационном периоде отмечалось значительное уменьшение интенсивности болевого синдрома по шкале ВАШ (таблица 10).
Таблица 10 - Динамика интенсивности болевого синдрома по визуально–
аналоговой шкале (ВАШ) p<0,03
Объем декомпрессии
Интенсивность болевого синдрома по ВАШ
(в баллах)
После опе- После операции
До операрации (1
(7 сутки)
ции
сутки)
Интерламинэктомия
5,52±1,05
1,64±0,72
1,52±0,68
Односторонняя расширен–
ная интерламинэктомия
5,24±0,83
1,50±0,77
1,48±0,65
Двусторонняя расширен–
ная интерламинэктомия
Гемиламинэктомия
5,56±1,03
1,76±0,80
1,75±0,85
5,58±0,82
1,77±0,62
1,70±0,55
Ламинэктомия
4,77±0,76
2,15±0,84
2,09±0,65
83.
83Данные таблицы 10 показывают, что во всех группах наступал значительный регресс болевого синдрома, при этом у всех больных разрешились корешковые боли. У части пациентов сохранялся незначительный болевой синдром, преимущественно в области операционной раны и в результате рефлекторных синдромов. Также из таблицы видно, что более выраженный болевой
синдром до операции наблюдался в группе пациентов, которым выполнялась
интерламинэктомия (пациенты преимущественно с грыжевой монофакторной
компрессией). А менее выраженный болевой синдром до операции у пациентов,
которым выполнялась ламинэктомия (пациенты наблюдаемые на более поздних
стадиях дегенеративного поражения позвоночника с полифакторной негрыжевой компрессией). При грыжевой монофакторной компрессии более выраженный болевой синдром обусловлен острым его началом (обычно после резкой
физической нагрузки) с острым стенозированием структур позвоночного канала при котором не успевают развится компенсаторные механизмы. Поэтому и в
послеоперационном периоде мы наблюдаем более выраженный регресс болевого синдрома у данной группы пациентов. На более поздних стадиях дегенеративного поражения позвоночника, при которых преобладают негрыжевые формы стойкой компрессии, стенозирование структур позвоночного канала развивается постепенно с включением компенсаторных механизмов и «хронизацией»
болевого синдрома. У данной группы пациентов наблюдалось менее выраженное снижение интенсивности болевого синдрома по шкале ВАШ.
Комплексную оценку результатов лечения проводили с учетом ВАШ, характера и выраженности неврологических расстройств (регресс чувствительных
нарушений, синдрома каудогенной хромоты, вертебрального болевого синдрома, ограничения движений в поясничном отделе позвоночника). На основании
этих факторов выделены три группы результатов лечения:
I – отличный: полный регресс неврологических нарушений, незначительное ограничение движений в поясничном отделе позвоночника, обусловленное
наличием операционной раны, возвращение к прежнему (до начала или послед-
84.
84него обострения болезни) уровню физической активности, незначительное
ограничение физических нагрузок;
II − хороший результат: неполный регресс неврологических нарушений
(неполный регресс чувствительных расстройств, сохранение негрубого вертебрального синдрома и незначительного ограничения движений в поясничном
отделе позвоночника) физическая активность восстановлена, возможны только
небольшие физические нагрузки;
III − удовлетворительный результат: неполный регресс неврологических
нарушений (отсутствие регресса чувствительных нарушений, сохранение
вертебрального болевого синдрома и умеренного ограничения движений в
поясничном отделе позвоночника) физическая активность восстановлена не
полностью (таблица 11).
Таблица 11 - Ближайшие результаты хирургического лечения (p<0,05;
коэффициент Спирмена 0,31).
Объем декомпрессии
Интерламинэктомия
Результаты лечения: число пациентов Число па(%)
циентов
I
II
III
61 (15,25%)
197
(49,25%)
46
(11,5%)
Односторонняя
расширенная интерламинэктомия
8 (2%)
11 (2,75%)
Итого
(%)
304
76%
25
6%
16
4%
24
6%
6 (1,5%)
Двусторонняя
расширенная интерламинэктомия
8 (2%)
5 (1,25%)
3 (0,75%)
Гемиламинэктомия
9 (2,25%)
13 (3,25%)
2 (0,5%)
Ламинэктомия
10 (2,5%)
16 (4%)
5 (1,25%)
31
8%
96 (24%)
242 (60,5%)
62
(15,5%)
400
100%
ВСЕГО
Примечание: Результаты лечения: I – отличные, II – хорошие, III –
удовлетворительные
85.
85Из таблицы 11 видно, что лучшие результаты (преимущественно за счет
регресса чувствительных нарушений) в раннем послеоперационном периоде
получены
в
группе
пациентов,
которым
выполнялась
двусторонняя
расширенная интерламинэктомия. По нашему мнению это обусловлено тем, что
данный вид операции выполнялся пациентам на более поздних
стадиях
дегенеративного процесса в поясничном отделе позвоночника и негрыжевых
формах стойкой компрессии при котором стенозирование позвоночного канала
развивается
на
протяжении
длительного
времени
с
формированием
компенсаторных механизмов. Лучший результат по совокупности отличных и
хороших исходов оперативного лечения отмечен в группе пациентов, которым
была выполнена гемиламинэктомия. В этой группе пациентов соответственно
отмечено
и
самое
низкое
количество
удовлетворительных
исходов
оперативного лечения.
Не
отмечено
ни
одного
обострения
имеющейся
сопутствующей
патологии, тромбоэмболических осложнений, летального исхода. Ни в одном
налюдении не встречалось общехирургических осложнений: поверхностное
или
глубокое
нагноение
послеоперационной
раны,
некроз
краев
послеоперационной раны. Ни одному пациенту, как во время, так и после
операции, не потребовалось переливания гемотрансфузионных сред.
На 7–10–е сутки пациенты выписывались из стационара на амбулаторное
долечивание, включающее в себя охранительный режим на поясничный отдел
позвоночника, лечебную физкультуру в щадящем режиме, рефлексотерапию.
Полный курс реабилитации с момента операции 1,5–2 месяца с полным
восстановлением работоспособности.
Таким образом, при адекватной декомпрессии структур позвоночного
канала
положительный
купирования
болевого
эффект
оперативного
синдрома,
симптомов
вмешательства
натяжения,
в
виде
значительного
регресса деформаций позвоночного столба в раннем послеоперационном
периоде отмечен у всех пациентов вне зависимости от операционных находок.
86.
86ЗАКЛЮЧЕНИЕ
Проблема дегенеративно–дистрофических заболеваний позвоночника
очень актуальна в связи с большим количеством пациентов с данной патологией. Также актуальность данной проблемы существует в связи с отсутствием
четкого понимания диагностики дегенеративных изменений позвоночника, затруднена оценка объема патологических изменений позвоночника и выделение
морфологического субстрата, послужившего причиной развития стойкой компрессии поясничных и крестцовых корешков.
В результате нашего исследования также было установлено, что описание
нейровизуализационных протоколов поясничного–крестцового отдела позвоночника только на 76% совпадают с данными интраоперационных находок. В
24% случаев интраоперационно выявлены дополнительные факторы стойкой
компрессии поясничных и крестцовых корешков конского хвоста, которые потребовали изменение предоперационного плана оперативного лечения в пользу
выполнения более широкой декомпрессии структур позвоночного канала.
Также отсутствует единый протокол и понимание в описании нейровизуализации поясничного отдела позвоночника, что в свою очередь, приводит к
ошибкам в предоперационной диагностике и определению показаний к оперативному лечению. Это диктует необходимость совершенствования знаний по
нейровизуализационной семиотики различных факторов стойкой компрессии
поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях поясничного отдела позвоночника.
В литературе (Попелянский Я.Ю. 1985; Рагимов О.З. 1993; Lee C.K. 1995;
Кариев М.Х. 2001; Алтунбаев Р.А. 2002; Efstathios J.B. 2008; Kawaguchi Y.
2010; Mamisch 2012) описан дегенеративный каскад позвоночника. Определены
этапы дегенеративного поражения позвоночника и на каждом из этапов установлены дегенеративные изменения, которые происходят с позвоночником.
Так, на первом этапе дегенеративного каскада происходят изменения в межпозвонковом диске с дегенерацией студенистого вещества и фиброзного кольца.
87.
87Затем при значимом снижении высоты диска происходят изменения в межпозвонковом суставе и их деформация. На последних этапах происходят изменения в кровеносных сосудах, нервах, мышцах позвоночно–двигательного сегмента и развитие нейро–васкулярного конфликта. Позвоночно–двигательный
сегмент отдельная единица позвоночного столба, участвующая в его правильной работе. Любые изменения в одном из составляющих сегмента неминуемо
ведут к изменениям и в других структурах. В конечном итоге дегенеративный
каскад приводит к стенозу позвоночного канала и стойкой компрессии его содержимого.
На каждом из этапов дегенеративного каскада преобладают определенные факторы стойкой компрессии поясничных и крестцовых корешков конского хвоста. Несмотря на многообразие форм дегенеративных поражений позвоночного столба, клиническим проявлением, определяющим показания к хирургическому лечению, является стойкая компрессия нервных структур позвоночного канала. Это необходимо учитывать при планировании оперативного лечения и определения объема хирургического доступа с целью адекватной декомпрессии структур позвоночного канала.
Высокую частоту встречаемости «недискогенных» (негрыжевых) факторов стойкой компрессии подтверждают многие авторы (Шулев Ю.А. 2000; Худяев А.Т. 2001; Асе Я.К., 1971, Beautie P.F. et al., 2000). Так, по данным
Ю.А.Шулёва и соавт., выделяют дискогенные, недискогенные и комбинированные формы компрессии, которые в клинической практике встречаются соответственно в 74,4; 4,4 и 19,2% случаев.
В ходе нашего исследования были изучены негрыжевые варианты стойкой компрессии поясничных и крестцовых корешков на основании данных
предоперационной мультимодальной нейровизуализации с целью улучшения
результатов лечения больных с дегенеративно–дистрофическими поражениями
пояснично–крестцовго отдела позвоночника. В результате исследования были
выявлены следующие негрыжевые варианты стойкой компрессии поясничных
и крестцовых корешков: отёк и рубцово–спаечные изменения эпидуральной
88.
88клетчатки, гипертрофированные желтые связки, варикозно расширенные эпидуральные вены, остеофиты тел позвонков, гипертрофия фасеточных суставов,
кисты фасеточных суставов, дегенеративный спондилолистез. Частота встречаемости негрыжевых вариантов стойкой компрессии поясничных и крестцовых
корешков по данным предоперационной мультимодальной нейровизуализации
составила 13,75%. Все данные нейровизуализации были подтверждены интраоперационными находками. В том случае, если данные интраоперационных
находок не совпадали с данными нейровизуализации (в нашем исследовании
это было выявлено у 24% пациентов), клинический случай статистически не
фиксировался. Это было в группе пациентов с полифакторной компрессией, где
во время операции были выявлены дополнительные факторы компрессии, не
выявленные по результатам предоперационной нейровизуализации. Однако хочется также отметить, что полифакторность стойкой компрессии поясничных и
крестцовых корешков, диагностированная по данным предоперационной нейровизуализации, диктовала хирургу выполнение более широких декомпрессивных хирургических подходов и позволяла выявлять дополнительные факторы
компрессии. Таким образом, распределение наших пациентов выглядело так
дискогенные, недискогенные и комбинированные формы компрессии по данным предоперционной нейровизуализации встречались соответственно у 86,25;
13,75 и 6,75% пациентов.
Учитывая различную чувствительность методов нейровизуализации к
разным факторам компрессии поясничных и крестцовых корешков, предоперационная диагностика должна быть комплексной (Кузнецов В.Ф. 1992; Коновалов А.Н. 1997; Маратканов Т.В. 1999; Дулаев А.К. 2000; Левин О.С. 2012;
Pfirmann C.W. 2004). МРТ пояснично–крестцового отдела позвоночника позволяет оценить мягкотканные компоненты и структуры позвоночного канала.
РКТ оценить костные структуры и анатомические параметры, размеры позвоночного канала. Рентгенография поясничного отдела позвоночника оценить
аномалию тропизма и угол фасеточного сустава, костные изменения, счет позвонков, что необходимо для интраоперационной рентгенографической навига-
89.
89ции. Дополняя рентгенографию функциональными пробами возможна оценка
степени нестабильности в позвоночно–двигательном сегменте на дооперационном уровне, что очень актуально при планировании оперативного лечения и
степени резекции структур заднего опорного комплекса.
На первом этапе исследования необходимо было определить нейровизуализационные критерии, по которым оценивались негрыжевые факторы стойкой
компрессии поясничных и крестцовых корешков. И на основании разработанных критериев описать нейровизуализационную семиотику негрыжевых вариантов стойкой компрессии поясничных и крестцовых корешков при дегенеративно–дистрофических поражениях позвоночника, а также уточнить частоту
встречаемости каждого из них.
Во время проведения хирургических вмешательств было установлено, что
различные факторы компрессии имеют различную плотность. Также было
определено, что грыжи межпозвонковых дисков при их удалении имели различную плотность в зависимости от стажа заболевания и сроков хирургического лечения. На более ранних сроках хирургического лечения, при стаже заболевания до 1 месяца, грыжи и факторы стойкой компрессии корешков конского
хвоста имели меньшую плотность, чем у пациентов с более длительным стажем
заболеванием. На основании этих данных первым нейровизуализационным
критерием, по которому оценивались все факторы стойкой компрессии поясничных и крестцовых корешков, было плотность в единицах HU (единицы
Хаунсфильда) по данным рентгеновской компьютерной томографии. В современной литературе не было найдено исследования по измерению плотности
факторов компрессии корешков конского хвоста. По результатам нашего исследования установлено, что плотность в единицах Хаунсфильда у каждого из
факторов стойкой компрессии поясничных и крестцовых корешков имеет определенное значение: грыжа межпозвонкового диска (70–110 HU), рубцово–
воспалительный процесс эпидуральной клетчатки (100–130 HU), варикозно–
расширенные вены (40–70HU), гипертрофированные желтые связки (70–140
HU).
90.
90Следующим критерием, наиболее актуальным для оценки факторов компрессии структур позвоночного канала, была оценка формы, размеров и площади позвоночного канала поясничного отдела позвоночника. По данным разных авторов (Рагимов О.З. 1993; Антипко Л.Э. 2002; Крутько А.В. 2004; Sumita
1910; Lange M. 1993; Gardner A. 1993; Onel D. 1993) частота позвоночного стеноза варьирует от 3 до 11,3% случаев и имеет тенденцию к увеличению. Стеноз позвоночного канала – диффузное или ограниченное патологическое
уменьшение размеров позвоночного канала, вызывающее стойкую компрессию
корешков конского хвоста при дегенеративном поражении поясничного отдела
позвоночника. При оценки площади позвоночного канала была использована
шкала Harwod Nash и Petersson 1992 года, которая нам показалась наиболее оптимальной.
Практический интерес представляет форма позвоночного канала. Фронтальный и сагиттальный размеры канала на поясничном уровне подвержены
значительным колебаниям. Физиологическое сужение его определяется в зоне
3–4–го поясничных позвонков. По мнению А.В. Крутько, М.Х. Кариев, Т.В.
Маратканов, R.W., Porter Rosenberg, M. Samii, основной причиной стенозирования позвоночного канала является сочетание дегенеративного процесса с конституциональной узостью позвоночного канала в результате врожденных особенностей строения позвоночного столба. Некоторыми авторами анатомическая
узость позвоночного канала описана как первичный стеноз позвоночного канала. Поперечное сечение позвоночного канала имеет 2 варианта по форме.
Наиболее распространенный физиологичный из них напоминает по форме полуовал. Во втором, наименее благоприятном в клиническом отношении варианте, поперечное сечение напоминает трилистник, образованный за счет гипертрофии фасеточных суставов. В таком случае начальные отделы фораминальных каналов оказываются суженными и как бы погруженными в латеральные
отделы передней стенки канала. Указанная особенность на фоне дегенеративных изменений может явиться причиной компрессии нервных корешков и сосудов. В нашем исследовании в данную группу были включены пациенты со
91.
91стойкой радикулопатией корешков конского хвоста при латеральном стенозе
позвоночного канала на фоне гипертрофии фасеточных суставов. Оценка формы позвоночного канала на дооперационном уровне, прежде всего, необходима
для решения вопроса о планировании резекции медиальных частей фасеточных
суставов для более адекватной декомпрессии поясничных и крестцовых корешков при их стойкой радикулопатии.
По результатам нашего исследования было выявлено 24 пациента (6%,
p<0,05) со стенозом позвоночного канала на фоне гипертрофии фасеточных суставов (анатомически узкий позвоночный канал). Форма позвоночного канала у
пациентов данной группы была преимущественно «трилистник» с 3 степенью
стеноза по шкале Nash и Peterson.
Локализация фактора стойкой компрессии поясничных и крестцовых корешков следующий нейровизуализационный критерий. Анатомия пояснично–
крестцового отдела позвоночника в литературе описана полно. Приведенный
обзор анатомического строения поясничного отдела позвоночника в диссертации В.С. Филатова позволяет еще раз убедиться в том, что каждый фактор
стойкой компрессии корешков конского хвоста имеет строго определенную локализацию в позвоночном канале.
Задняя продольная связка тянется вдоль передней стенки позвоночного
канала, расширяется на уровне каждого диска и прочно соединяется с их фиброзными кольцами. Из этой анатомической особенности задней продольной
связки видно, что при ее гипертрофии на фоне дегенеративного процесса поясничного отдела позвоночника возникнет стенозирование позвоночного канала в
переднезаднем направлении с компрессией структур позвоночного канала на
вентральной поверхности.
Соединение тел позвонков осуществляется также системой связок и межпозвонковыми суставами. Дужки позвонков соединены желтыми связками, в
составе которых выделяются две порции. Более широкая часть, междужковая,
прикрепляется к верхнему краю дуги вышележащего позвонка с заходом на ее
внутреннюю поверхность, нижние порции связки прикрепляются к верхнему
92.
92краю дуги нижерасположенного позвонка. Вторая капсулярная часть связки
располагается латеральнее первой, она тоньше предыдущей и имеет с ней общую верхнюю линию прикрепления. Внизу волокна капсулярной порции связки прикрепляются тотчас каудальнее и вентральнее капсулы межпозвонкового
сустава. Анатомия желтой связки позволяет рассматривать ее как фактор боковой дорзальной компрессии корешков конского хвоста. В нашем исследовании
гипертрофия желтой связки выявлена у 26 пациентов (6,5%, p<0,05), у 7 (1,75%)
в качестве единственной причины стойкой радикулопатии. Гипертрофия желтых связок приводила к менее грубым формам стеноза позвоночного канала
(преимущественно 2 степени по шкале Nash и Peterson), также менее грубо меняя форму позвоночного канала, чем при гипертрофии фасеточных суставов.
Кровоснабжение корешков конского хвоста и каудальных отделов
спинного
мозга
осуществляется
артерией
Адамкевича,
нижней
дополнительной радикуло–медуллярной артерией. Последняя сопровождает 5–
й поясничный или 1–й крестцовый корешки, наиболее часто подвергающиеся
компрессии при дегенеративно–дистрофических поражениях пояснично–
крестцового отдела позвоночного столба (Бротман М.К., 1965; Богородинский
Д.К.,1966, 1973; Герман Д.Г., 1972). В нашем исследовании также было установлено, что длительно существующая компрессия корешка конского хвоста
приводила к вторичной ишемии нерва с формированием стойкой радикулопатии и вторичным рубцово–спаечным изменениям в позвоночном канале со стенозированием преимущественно латеральных отделов позвоночного канала и
начальных отделов корешковых каналов. Это концепция укладывается в механизм дисгемического варианта развития дегенеративного процесса процесса
поясничного отдела позвоночника детально описанного в литературе (Хелимский А.М. 1996; Олейник А.Д. 2001).
При оценки дегенеративного процесса поясничного отдела позвоночника
очень важно учитывать состояние корешкового канала, так как это клинически
значимая анатомическая зона.
Фораминальный канал имеет сложное анато-
мическое строение. Межпозвонковые отверстия в поясничном отделе позво-
93.
93ночника с большим основанием могут быть названы каналами, длина которых
колеблется в пределах 6–16 мм и увеличивается в каудалыюм направлении. Передняя стенка канала образована заднелатеральными отделами фиброзного
кольца и прилежащими участками тел смежных позвонков. Верхняя и нижняя
стенки представлены корнями дуг позвонков, задняя образована суставными
отростками, капсулой суставов и капсулярной порцией желтой связки. Сагиттальное сечение межпозвонковых отверстий имеет неправильную форму,
напоминающую овал, суженный в нижней половине. Наибольшие размеры
имеют отверстия, расположенные между 3 и 4 поясничными позвонками.
Спинномозговые нервы, окутанные жировой клетчаткой с расположенными в
ней сосудами и нервными веточками, целиком занимают верхние, широкие части межпозвонковых отверстий. Соотношение поперечных сечений межпозвонковых отверстий и соответствующих нервов колеблется в пределах 1,3–2.
При этом наименьшая величина их отмечается у двух нижних пар. Такое строение корешкового канала позволило выделить его, как отдельный нейровизуализационный критерий при оценки негрыжевых факторов стойкой компрессии поясничных и крестцовых корешков.
Очень подробное описание и классификацию латеральных и фораминальных стенозов провел радиолог S.W.Lee с соавторами J.W.Lee, J.S.Yeom,
H.S.Kang. По их мнению, зона входа в межпозвонковое отверстие является латеральным пространством позвоночного канала, и причинами радикулярной
компрессии здесь являются гипертрофия верхнего суставного отростка, врожденные пороки строения дугоотростчатых суставов и остеофиты края тела позвонка. Также авторами была разработана шкала градации степени стеноза
межпозвонкового отверстия (Grade1–Grade5). Наиболее частой причиной фораминального стеноза по результатам нашего исследования являлся патологический рубцово–спаечный процесс в этой зоне. В большинстве случаев причинами фораминального стеноза была полифакторная компрессия в сочетании с
грыжей диска фораминальной локализации. Это еще раз доказывает дискогенный механизм развития фораминального стеноза, который на более поздних
94.
94стадиях дегенеративного процесса поясничного отдела позвоночника приводит
к вторичным изменениям связочного аппарата, кровеносных сосудов, рубцеванию периневральной жировой клетчатки и облитерации оболочек самого нерва.
Так было установлено, что у 28 (7%; p<0,05) пациентов причиной стойкой радикулопатии корешков конского хвоста является рубцово–измененная жировая
эпидуральная клетчатка (у 9 пациентов выступает как монофакторная компрессия). Это фактор негрыжевой компрессии является самым частым среди всех
негрыжевых вариантов стойкой компрессии поясничных и крестцовых корешков при дегенеративных поражениях позвоночника. Преимущественная локализация этого фактора корешковый канал.
Варикозно расширенные эпидуральные вены, как фактор компрессии, заслуживают отдельного внимания. Многими авторами (Антонов И.П. 1986; Скоромец А.А. 1997; Панувцев Г.К. 2001; Fu К.М. 2010) описывают варикозно
расширенные вены позвоночного канала как один из факторов негрыжевой
стойкой компрессии корешков конского хвоста. В 2006 году авторами Е.И.
Слынько, В.В. Вербов, В.В. Мороз, С.С. Шинкарюк варикозное расширение вен
позвоночного канала было выделено в отдельное заболевание позвоночника с
описанием ее классификации. Эпидуральные вены на уровне поясничного отдела представлены двумя сплетениями, расположенными на передней и задней
стенках позвоночного канала. Основные венозные стволы занимают передне–
латеральные отделы позвоночного канала. Из внутренней венозной сети на
уровне каждого корешка формируется вена, проходящая через межпозвонковое
отверстие. Здесь же она анастомозирует с венами наружного позвоночного
сплетения. Варикозно–расширенные вены, как видно из их анатомического
строения, могут являться универсальным фактором стойкой компрессии поясничных и крестцовых корешков, вызывающим центральный, латеральный и
фораминальный стеноз позвоночного канала. Варикозно расширенные вены
могут осуществлять и вентральную и дорзальную компрессию структур позвоночного канала. В одном клиническом случае варикозная болезнь позвоночного
канала стала причиной развития фиброза оболочек нервного корешка и стойкой
95.
95радикулопатии корешка S1. Ревизия позвоночного канала и декомпрессия корешка S1 от гипертрофированных вен не привела к полному регрессу радикулопатии, а лишь незначительно купировала болевой синдром в послеоперационном периоде.
В нашем исследовании варикозно расширенные вены являлись фактором
стойкой компрессии поясничных и крестцовых корешков у 22 (5,5%, p<0,05)
пациентов преимущественно в вентральном направлении с развитием центрального стеноза позвоночного канала или в случае латерального стеноза в сочетании с грыжей диска как полифакторная компрессия.
Таким образом, причинами центрального и латерального стеноза позвоночного канала являются гипертрофированные желтые связки, отек и рубцово–
спаечный процесс эпидуральной клетчатки, варикозно расширенные вены позвоночного канала, остеофиты тел позвонков.
Редким негрыжевым вариантом стойкой компрессии поясничных и
крестцовых корешков являются периартикулярные кисты фасеточных суставов.
Первое описание кисты фасеточного сустава датируется 1880 годом. Первое
успешное хирургическое лечение выполнено в 1950 году. Периартикулярная
киста фасеточного сустава эстрадуральное образование позвоночного канала,
оказывающее дорзальную компрессию структур позвоночного канала (Евзиков
Г.Ю. 2011; Sabo R.A. 1996; Cohen–Gadol A.A. 2004; Efstathios J.B. 2008; Bydon
A. 2013). Так как происхождением кисты является синовиальная выстилка фасеточного сустава, большое значение имеет тропизм суставной щели фасеточного сустава по отношению к структурам позвоночного канала. При более горизонтальном расположении суставной щели фасеточного сустава киста будет
локализоваться в центральной или парамедианной части позвоночного канала.
При вертикальной ориентации суставной щели локализации кисты будет стремиться к начальной части корешкого канала или фораминальной зоны. Частота
встречаемости кист фасеточного сустава по результатам нашего исследования
составила 1,5% (p<0,05), что соответствует данным литературы. Однако хочется отметить, что с развитием в последние годы нейровизуализационной диа-
96.
96гностики поясничного отдела позвоночника частота выявляемости данной патологии имеет тенденцию к увеличению.
Огромное значение при описании любого заболевания имеет классификация стадий патологического процесса. Это необходимо для унификации протоколов описания патологического состояния. При дегенеративных заболеваниях
позвоночника универсальными нейровизуализационными шкалами при оценки
стадии дегенеративных изменений поясничного отдела позвоночника является
шкала Pfirmann (оценка стадии по результатам МРТ) и шкала Modik. Данные
шкалы в нашем исследовании являются одним из нейровизуализационных критериев при описании семиотики негрыжевых вариантов стойкой компрессии
поясничных и крестцовых корешков.
Каждый негрыжевой фактор стойкой
компрессии оценивался по этим шкалам. Данная оценка позволила выявить зависимость преобладания определенного фактора компрессии от стадии дегенеративного процесса поясничного отдела позвоночника (зависимость описана в
результатах исследования). 26–27октября 2017 года в Казани на базе центра высоких медицинских технологий проходила конференция «Оперативное лечение
дегенеративных заболеваний поясничного отдела позвоночника: принципы выбора тактики лечения и роль современных технологий», посвященная дегенеративным заболеваниям позвоночника. Одним из актуальных вопросов, обсуждаемых на конференции, был вопрос унификации описания нейровизуализационных протоколов при оценки стадий и факторов стойкой компрессии поясничных и крестцовых корешков. Выявленная высокая статистически достоверная зависимость преобладания определенного фактора стойкой компрессии
поясничных и крестцовых корешков от стадии дегенеративного процесса по
нейровизуализационным шкалам Modik и Pfirmann позволяет рассматривать
данные шкалы в качестве универсальных при описании нейровизуализаций позвоночника. Однако самая высокая корреляционная зависимость установлена
при рубцово–воспалительных изменениях эпидуральной клетчатки позвоночного канала, гипертрофии желтой связки, и первичной стенозе позвоночного
канала (коэффициент корреляции Спирмена выше 0,5; p<0,05). Эти же факторы
97.
97негрыжевой компрессии наиболее часто встречаются при описании дегенеративного процесса поясничного отдела позвоночника при анализе отечественной
и мировой литературы. Указание стадии дегенеративного процесса поясничного отдела позвоночника по шкалам Modik и Pfirmann в протоколе нейровизуализации позволит «говорить на одном языке» неврологам, рентгенологам,
нейрохирургам и специалистам другого профиля. А нейрохирургам позволит
более детально планировать объем оперативного лечения.
Клиническая картина стойкой компрессии корешков конского хвоста в
литературе представлена достаточна полно. Однако нами не найдено работ, посвященных установлению взаимосвязи особенностей клинической картины
стойкой компрессии поясничных и крестцовых корешков от варианта компрессии и данных предоперационной нейровизуализации поясничного отдела позвоночника. Поэтому следующей актуальной задачей диссертационного исследования стало определение зависимости клинической картины пациентов со
стойкой компрессией поясничных и крестцовых корешков конского хвоста при
дегенеративных поражениях позвоночника от варианта негрыжевой компрессии.
В литературе отмечено, что стойкая компрессия поясничных и крестцовых корешков имеет свою характерную клиническую картину, существенно не
зависящую от варианта стойкой компрессии и представленную сочетанием
симптомов вертебрального, корешкового синдромов и нарушением функции
тазовых органов (Коржавин Г.М. 1995; Иваничев Г.А. 1997; Корнилов Н.В.
1998; Полищук Н.Е. 2000; Данилов В.И., Филатов В.С. 2006;Nygaard 1997).
Некоторые авторы считают, что клиника стойкой компрессии корешков
конского хвоста определяется особенностями поражения корешка и продолжительностью заболевания. Темп эволюции корешковых клинических проявлений
зависит от механизмов и вариантов повреждения корешка, которые могут служить патофизиологической основой различия клинической симптоматики. Характер клинической картины и темп развития заболевания определяются взаи-
98.
98модействием многих факторов (Демичев Н.П. 1991; Рагимов О.З 1993; Fu
K.M. 2010).
По результатам нашего исследования при сопоставлении клинической
картины с данными предоперационной визуализации позвоночника и интраоперационными находками статистически достоверно было установлено, что зависимости клинической картины стойкой радикулопатии от варианта компрессии корешков конского хвоста нет. Еще раз было доказано, что стойкая компрессия поясничных и крестцовых корешков имеет свою характерную клиническую картину, существенно не зависящую от варианта и характера факторов
компрессии и представлена сочетанием симптомов вертебрального, корешкового синдромов, нарушением функции тазовых органов и синдромом каудогенной
хромоты.
В клинической картине негрыжевых вариантов стойкой компрессии поясничных и крестцовых корешков нет отличий в выраженности отдельных
симптомов от клинической картины грыжи межпозвонкового диска. В группе с
негрыжевой компрессией чаще встречается полирадикулопатия, синдром каудогенной хромоты, более грубые формы чувствительных и двигательных
нарушений, менее интенсивный болевой вертебральный синдром. При грыже
диска в большинстве случаев болевой синдром характеризовался острой умеренно или интенсивно выраженной болью в ноге в зоне пораженного дерматома. При грыжевой полифакторной компрессии установлены более выраженные
нарушения функции тазовых органов. Также хочется отметить, что клиническая картина дорзальной компрессии структур позвоночного канала более
«мягкая» (менее интенсивный болевой синдром и темп прогрессирования заболевания) по сравнению с клиникой стойкой компрессии поясничных и крестцовых корешков при локализации факторов компрессии на вентральной поверхности позвоночного канала. По нашему мнению, это объясняется особенностями строения позвоночного канала (вентральная поверхность меньших размеров
по сравнению с дорзальной, а также на вентральной поверхности содержится
большое количество венозных сплетений). Так, вентральная компрессия (как
99.
99правило, дискогенная – преимущественно грыжевая) в более ранние сроки приводит к варикозному расширению вен позвоночного канала, развитию отека и
вторичных ишемических нарушений в корешках конского хвоста при их стойкой компрессии.
По данным разных исследователей, также нет и единого мнения о сроках, показаниях и вариантах оперативного лечения дегенеративной патологии
поясничного отдела позвоночника. До сих пор очень актуальным остается вопрос об оптимальных сроках хирургического лечения пациентов и продолжительности консервативной терапии. Спорной является позиция, на каких сроках
считать клиническую картину радикулопатии стойкой или фармакорезистентной. Продолжительность среднего срока консервативного лечения при отсутствии его эффекта должна составлять, по мнению разных авторов, от двух–трех
недель до двух–трех месяцев. Средний срок консервативного лечения по данным литературы составляет 2 месяца, так как существующая стойкая компрессия корешков конского хвоста более 2 месяцев может привести к необратимым
изменениям в самом корешке и развитию стойкого неврологического дефицита.
Научная работа, выполненная Щуровой Е.Н. и Ефимовым А.В. в 2012 года на
базе Российского научного центра «Восстановительная травматология и ортопедия» имени академика Г.А. Илизарова (г. Курган), посвящена изучению влияния длительности стойкой компрессии корешков конского хвоста на результат
хирургического лечения по декомпрессии компримированного корешка. Авторы, изучив кровоток в компримированном нервном корешке до операции и после декомпрессии у пациентов с различным стажем заболевания, пришли к выводу, что чем больше длительность заболевания, тем меньше прирост кровотока компримированного корешка после его декомпрессии. Проводилось исследование доплерографического кровотока в корешке конского хвоста при его
стойкой компрессии до и после устранения компрессии на разных сроках заболевания. При увеличении длительности заболевания от 2 месяцев до 3 лет происходит снижение прироста кровотока, а затем кривая выходит на плато. После
8 лет течения патологического процесса отсутствует прирост кровотока кореш-
100.
100ка, через 10 лет после начала заболевания наблюдается снижение кровотока после декомпрессии (научная статья журнал «Регионарное кровообращение и
микроциркуляция», 2012 год, стр. 26–29).
Однако эта позиция также является спорной, так как прирост кровотока в
компримированном корешке после его декомпрессии не всегда коррелирует с
полным восстановлением неврологического дефицита в послеоперационном
периоде. Так, например, в США оптимальным сроком консервативного лечения
является 19 дней. В случае неэффективности консервативного лечения в течении этого времени рекомендуют оперативное лечение.
При наличии симптомов стойкой компрессии структур позвоночного канала и согласии пациента на оперативное лечение декомпрессия структур позвоночного канала показана в максимально ранние сроки. При несогласии на
оперативное лечение пациент направлялся к вертеброневрологу на консервативную терапию с рекомендацией повторного обращения к нейрохирургу при
неэффективности консервативного лечения в течение 1,5 месяцев.
В случае установления у больного с клиникой стойкой компрессии корешков конского хвоста явлений локального эпидурита по данным нейровизуализации поясничного отдела позвоночника пациенту рекомендовалось проведение на первом этапе консервативного лечения, включая противоотечную и
противовоспалительную терапию.
Специфика дегенеративных поражений позвоночника диктует необходимость дифференцированного подхода к их хирургическому лечению. Такой
подход должен базироваться на принципе клинико–морфологического соответствия при определении клинически значимых и требующих хирургической
коррекции анатомических изменений позвоночника и на принципе минимальной хирургической достаточности при планировании вида и объёма хирургического вмешательства.
Следующей актуальной задачей было сопоставление объема выполненной декомпрессии структур позвоночного канала от характера факторов стойкой компрессии нервных корешков и оценка ближайших результатов хирурги-
101.
101ческого лечения пациентов со стойкой компрессией поясничных и крестцовых
корешков при дегенеративных поражениях поясничного отдела позвоночника в
условиях выполненной мультимодальной предоперационной нейровизуализации поясничного отдела позвоночника.
При исследовании литературы не было найдено работ проводящих сопоставление между объемом хирургической декомпрессии структур позвоночного
канала (вариантом хирургического подхода к структурам позвоночного канала)
и преобладанием определенных факторов стойкой радикулопатии. Однако в
литературе описано, что в синдроме неудачного оперированного позвоночника
ключевую роль составляет неустраненный стеноз позвоночного канала и неадекватная декомпрессия нервных структур позвоночного канала при первичных операциях из–за недооценки всех факторов стойкой радикулопатии и боязни дестабилизации структур позвоночного столба (Epstein J.A. 1972; Burton
C.V. 1981; Lee C.K. 1988; Sanderson P.L. 1996; Howard S.A. 1998; Atlas S.J. 2005;
Fehlings M.G. 2011). K.E. Работы Johnsson и P.L. Sanderson по изучению развития нестабильности после выполнения задних декомпрессий показали, что появление или развитие признаков нестабильности после задней декомпрессии не
влияет на оперативные результаты. По данным Johnson и Sanderson, одной декомпрессией можно достичь хороших результатов у пожилых пациентов без
дополнительного выполнения спондилодеза.
По результатам нашего исследования статистически достоверно (коэффициент корреляции Спирмена 0,905199; p<0,05) доказано, что объем декомпрессии статистически значимо вырастал в группе пациентов с негрыжевыми
вариантами стойкой компрессии поясничных и крестцовых корешков. Полифакторная компрессия и негрыжевые формы сдавления требовали выполнения
более широкой декомпрессии структур позвоночного канала. Так ламинэктомия чаще выполнялась у пациентов с негрыжевой полифакторной компрессией
с преобладанием таких факторов как первичный стеноз позвоночного канала,
гипертрофия желтых связок, рубцово–спаечный процесс. Также была выявлена
и статистически достоверная связь между объемом декомпрессии структур по-
102.
102звоночного канала и стадией дегенеративного процесса по по шкале Pfirmann и
Модик. Объем оперативного вмешательства увеличивается на более поздних
стадиях дегенеративного процесса позвоночника по этим шкалам.
Можно сделать вывод, что основной задачей при планировании хирургического лечения является комплексная оценка факторов стойкой радикулопатии поясничных и крестцовых корешков с адекватной интраоперационной декомпрессией структур позвоночного канала.
Результаты хирургического лечения пациентов со стойкой компрессией
корешков поясничных и крестцовых корешков разнообразны по данным различных авторов. Декомпрессивная хирургия структур позвоночного канала эффективна приблизительно у 85% пациентов (Sanderson P.L. 1996; Atlas S.J.
2005). По данным других авторов, количество хороших результатов находится
в пределах 65– 67% случаев (Turner J.A. 1992; Herno A. 1993; Munting E. 2015).
По данным J.N. Katz (1996) доля успешных исходов лечения за 10 лет наблюдений составила в среднем 57%. Nakagama, подвергнув анализу отдаленные результаты операций из заднего доступа, проведенных большим числом хирургов, сообщил о неудовлетворительных исходах декомпрессивных вмешательств
в 28,3 – 53,0% случаев. По результатам нашего исследования при разделении
пациентов на 5 групп (в зависимости от варианта декомпрессии структур позвоночного канала) были получены следующие результаты: отличные составили 24%; хорошие 60,5%; удовлетворительные 15,5%, что совпадает с данными мировой литературы. Хочется отметить также, что во всех группах пациентов в раннем послеоперационном периоде значимо регрессировал болевой
корешковый и вертебральный синдром по визуально–аналоговой шкале. Лучший результат по совокупности отличных и хороших исходов оперативного лечения отмечен в группе пациентов, которым была выполнена гемиламинэктомия. В этой группе пациентов соответственно отмечено и самое низкое количество удовлетворительных исходов оперативного лечения. Данные выводы являются статистически достоверными, так как уровень статистической ошибки
составил менее 0,05 (p<0,05).
103.
103При сопоставлении результатов хирургического лечения в зависимости от
варианта декомпрессии коэффициент корреляции Спирмена составил 0,31, а
при сопоставлении с клиническими группами составил 0,22. Из этого можно
заключить, что результаты хирургического лечения статистически не зависят от
объема декомпрессии структур позвоночного канала и варианта стойкой радикулопатии. А статистически достоверная взаимосвязь между объемом декомпрессии и вариантом стойкой радикулопатии еще раз подтверждает положительный результат хирургического лечения пациентов с компрессионными
формами остеохондроза поясничного отдела позвоночника при адекватной декомпрессии структур позвоночного канала и строго индивидуального подхода
при планировании оперативного лечения у конкретного пациента.
104.
104ВЫВОДЫ
1. Негрыжевые факторы стойкой компрессии поясничных и крестцовых
корешков имеет свою характерную нейровизуализационную семиотику: различные плотностные характеристики, локализацию в позвоночном канале; вызывают различную степень стенозирования позвоночного канала и преобладают на определенной стадии дегенеративного процесса позвоночника по шкалам
Модик и Pfirmann.
2. Компрессия поясничных и крестцовых корешков при дистрофической
патологии позвоночника полифакторна. Причинами стойкой радикулопатии
являются грыжи межпозвонковых дисков, гипертрофированные желтые связки,
отёк и спаечные изменения эпидуральной клетчатки со стенозированием позвоночного канала, варикозно расширенные эпидуральные вены, остеофиты тел
позвонков, гипертрофия и кисты фасеточных суставов, анатомически узкий позвоночный канал, спондилолистез и их сочетание.
3. Среди факторов компрессии поясничных и крестцовых корешков при
дистрофической патологии позвоночника высока доля негрыжевых вариантов
компрессии (13,75%). Совпадение протоколов нейровизуализации с интраоперационными находками при проведении микрохирургической декомпрессии
позвоночника на 76% диктует необходимость совершенствования знаний по
нейровизуализационной семиотике факторов стойкой компрессии поясничных
и крестцовых корешков.
4. Клиническая картина стойкой компрессии поясничных и крестцовых
корешков не зависит от характера факторов и представлена сочетанием вертебрального, корешкового синдромов, нарушением функции тазовых органов и
синдромом каудогенной хромоты. Установить фактор компрессии на основании клинической картины невозможно.
5. Показанием к оперативному лечению является наличие клинической
картины стойкой компрессии поясничных и крестцовых корешков. Объем де-
105.
105компрессии структур позвоночного канала определяется дифференцировано в
зависимости от факторов стойкой компрессии поясничных и крестцовых корешков и их сочетании.
6. Адекватная декомпрессия нервных структур позвоночного канала с
учетом всех факторов стойкой компрессии поясничных и крестцовых корешков
позвоночника позволяет добиться преимущественно отличных и хороших результатов хирургического лечения пациентов с дегенеративным поражением
позвоночника.
106.
106ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Пациентам с клинической картиной стойкой компрессии поясничных и
крестцовых корешков показана мультимодальная нейровизуализация (МРТ,
РКТ, рентгенографии с функциональными пробами).
2. Оценивать результаты нейровизуализации поясничного отдела позвоночника необходимо по разработанным нейровизуализационным критериям с
оценкой дегенеративного процесса по шкалам Pfirmann и Modik. При исследовании данных нейровизуализации поясничного отдела позвоночника основное
внимание надо обращать на форму и размер позвоночного канала, локализацию
фактора компрессии в позвоночном канале, его плотность, более детально оценивать фораминальную зону позвоночного канала.
3. При планировании оперативного вмешательства важно оценивать все
факторы стойкой компрессии структур позвоночного канала. При наличии
негрыжевых или полифакторных вариантов стойкой радикулопатии необходимо выполнять более широкие декомпрессии структур позвоночного канала. При
интраоперационной ревизии позвоночного канала необходимо убедиться в свободном пробеге ранее компримированного корешка, особенно в фораминальной зоне.
107.
107ПЕРСПЕКТИВЫ ДАЛЬНЕЙШЕЙ РАЗРАБОТКИ ТЕМЫ
Перспективным является изучение результатов хирургического лечения
пациентов с компрессионными формами дегенеративных поражений позвоночника выявленной с помощью предоперационной нейровизуализации на более
поздних сроках послеоперационного лечения (катамнез от 2 месяцев до 2–х
лет). Совпадение протоколов нейровизуализации с интраоперационными
находками при проведении микрохирургической декомпрессии позвоночника
на 76% также диктует необходимость повторного проведения исследования по
их сопоставлению после введения в практику унифицированных протоколов
нейровизуализационной семиотики факторов стойкой компрессии поясничных
и крестцовых корешков.
108.
108СПИСОК ЛИТЕРАТУРЫ
1.
Абелева, Г.М. Хирургическое лечение остеохондроза поясничного
отдела позвоночника / Г.М. Абелева // Сборник научных трудов. – СПб., 1993. –
С. 105–119.
2.
Алексеев, Г.Н. Пункционная лазерная вапоризация пульпозного ядра
как минимально–инвазивный метод хирургического лечения поясничного остеохондроза с компрессионно–радикулярным дискогенным синдромом / Г.Н. Алексеев, А.Н. Любимов, Н.Г. Борисова и соавт. // Современные минимально–
инвазивные технологии: Докл. VI межд. симп. – СПб., 2001. – С. 290–291
3.
Алексеев, О.И. Дегенеративные стенозы пояснично–крестцового
отдела позвоночника. Хирургическое лечение: Автореф. дис. … канд. мед. наук
/ О.И. Алексеев – СПб., 2003. – 23 с.
4.
Алтунбаев, Р.А. Клинико–визуальные параллели вертеброгенных
пояснично–крестцовых менинго–радикулярных поражений / Р.А. Алтунбаев,
Э.И. Богданов, В.И. Данилов и соавт. // Казанский медицинский журнал. – 2002.
– № 4. – С. 280–285.
5.
Антипко, Л.Э. Хирургическое лечение стеноза позвоночного канала
/ Л.Э. Антипко // III съезда нейрохирургов России: Докл. – СПб., 2002. – С. 233–
234.
6.
Антонов, И.П. К патогенезу остеохондроза позвоночника и обу-
словленных им неврологических нарушений / И.П. Антонов, Г.Г. Шанько, Б.В.
Дривотинов // Современные принципы лечения дегенеративно–дистрофических
заболеваний позвоночника. – М., 1980. – С. 8–14.
7.
Антонов, И.П. Патогенез и диагностика остеохондроза позвоночни-
ка и его неврологических проявлений: состояние проблемы и перспективы изучения / И.П. Антонов // Журн. невропатол. и психиатр. им. С.С. Корсакова. –
1986. – Т.86, вып. 4. – С.481–488.
8.
Асе, Я.К. Пояснично–крестцовый радикулит (клиника и хирургиче-
ское лечение) /Я.К. Асе. – М.: Медицина, 1971. – 135 с.
109.
1099.
Ахадов, Т.А. Магнитно–резонансная томография в диагностике
ранних постоперационных осложнений после хирургического лечения дегенерации межпозвонковых дисков / Т.А. Ахадов, Г.А. Оноприенко, В.Ю. Шантырь
// Нейрохирургия. – 1999. – № 3. – С. 19–25.
10.
Болгов, М.А. Поясничный стеноз: клиника и диагностика / М.А.
Болгов // Актуальные вопросы неврологии и нейрохирургии детского и подросткового возраста: Докл. науч.–практ. конф. – Уфа, 2000. – С. 37.
11.
Болтунов, М.А. Рентгенологическое исследование больных пояс-
ничным остеохондрозом до и после операции: Автореф. дис. ... канд. мед. наук /
М.А. Болтунов. – Казань, 1975. – 28 с.
12.
Борщенко, И.А. Спинальный поясничный дегенеративный стеноз:
билатеральная декомпрессия из одностороннего доступа / И.А. Борщенко, С.Л.
Мигачев, А.В. Басков // Нейрохирургия. – 2011. – № 1. – С. 54–60.
13.
Васильев, А.Ю. Чрезкожная лазерная вапоризация в лечении грыж
межпозвонковых дисков / А.Ю. Васильев, В.М. Казначеев, Г.А. Пахомов и соавт. // III съезд нейрохирургов России: Докл.– СПб., 2002. – С. 237–238.
14.
Вербицкая, Г.Д. Хирургические аспекты вертебральной патологии /
Г.Д. Вербицкая, В.Н. Дышловой, В.Г. Зинченко // Бюл. Укр. ассоц. нейрохир. –
1998. – № 6. – С. 156.
15.
Веселовский, В.П. Диагностика синдромов остеохондроза позво-
ночника / В.П. Веселовский, М.К. Михайлов, О.Ш. Самитов. – Казань: Изд–во
Казан. ун–та, 1990. – 288 с.
16.
Гельфенбейн, М.С. Международный конгресс, посвященный лече-
нию хронического болевого синдрома после операций на поясничном отделе
позвоночника / М.С. Гельфенбейн // Pain manadgment. – 2000. – № 1–2. – С.65.
17.
Гиоев, П.М. Анализ хирургического лечения больных со стенозами
позвоночного канала / П.М. Гиоев, А.В. Омельченко // III съезд нейрохирургов
России: Докл. – СПб., 2002. – С. 240–241.
110.
11018.
вых
Гуща, А.О. Современные подходы к лечению грыж межпозвонко-
дисков
пояснично-крестцового
отдела
позвоночника/
А.О.
Гуща,
С.О.Арестов, А.А. Кащеев // Нервные болезни. – 2018. –№3 - С. 19–25.
19.
Данилов,
В.И.
Вертеброгенные
компрессионные
пояснично–
крестцовые радикулопатии / В.И. Данилов, B.C. Филатов // III съезд нейрохирургов России: Докл. – СПб., 2002. – С. 243.
20.
Данилов, В.И. Компримирующие факторы и показания для хирур-
гического лечения у больных со стойкими компрессионными поясничными и
крестцовыми радикулопатиями при дистрофических поражениях позвоночника
/ В.И. Данилов, В.С.Филатов // Вертеброневрология. – 2006. – №3–4 – С. 58–64.
21.
Данилов, В.И. Факторы стабильной компрессии корешков конского
хвоста у больных остеохондрозом поясничного отдела позвоночника / В.И. Данилов, B.C. Филатов // Актуальные вопросы неврологии и нейрохирургии детского и подросткового возраста: Докл. науч.–практ. конф. – Уфа, 2000. – С. 9.
22.
Демичев, Н.П. Полиморфизм неврологических проявлений пояс-
ничного остеохондроза и их динамика при хирургическом лечении / Н.П. Демичев, С.В. Дианов // Ортопед., травматол. и протезир. – 1991. – № 5. – С. 1–4.
23.
Долженко, Д.А. Видеоэндоскопия в оптимизации хирургического
лечения посничных межпозвонковых грыж / Д.А. Долженко, Ш.А. Аул // Хирургия позвоночника. – 2004. – № 4. – С.97–102.
24.
Древаль, О.Н. Метод профилактики эпидурального фиброза при по-
ясничной микродискэктомии биодеградируемой мембраной / О.Н. Древаль //
Хирургия позвоночника. – 2014. – № 2. – С.67–73.
25.
Дулаев, А.К. Хирургическое лечение больных с дегенеративным
стенозом позвоночного канала на пояснично–крестцовом уровне / А.К. Дулаев,
Ю.А. Шулев, А.В. Теремшонок // Человек и его здоровье: Докл. Рос. нац. конгр.
– СПб., 2000. – С. 182.
26.
Евзиков, Г.Ю. Поясничные периартикулярные кисты: серия наблю-
дений и обзор литературы / Г.Ю. Евзиков, О.Е. Егоров, Ю.В. Горбачева //
Нейрохирургия. – 2011. – № 2. – С. 51–54.
111.
11127.
Заблоцкий, Н.У. Клиника нарушений спинального кровообращения
при грыжах поясничных межпозвонковых дисков и их хирургическое лечение:
Автореф. дис. ... канд. мед. наук / Н.У. Заблоцкий. – Л., 1983. – 24 с.
28.
Зорин, Н.А. Пункционное лазерное выпаривание секвестрирован-
ных грыж межпозвонковых дисков / Н.А. Зорин, Ю.И. Кирпа, В.А. Сабодаш //
Укр. нейрохир. журн. – 2000. – №1(9). – С. 65–67.
29.
Иваничев, Г.А. Мануальная терапия / Г.А. Иваничев. – Казань,
1997. – 448 с.
30.
Ишмухамедов, С.Н. Показания к перкутанной дискэктомии и бли-
жайшие послеоперационные результаты / С.Н. Ишмухамедов, Ю.Ф. Сабуренко,
С.А. Коробко // III съезд нейрохирургов России: Докл. – СПб., 2002. – С. 254.
31.
Казьмин, А.И. Оперативное лечение поясничного остеохондроза /
А.И. Казьмин, С.Т. Ветрилэ, Я.Р. Джамилов // Ортопед., травматол. и протезирование. – 1986. – № 10. – С. 17–20.
32.
Кариев, М.Х. Особенности клинического течения грыж межпозвон-
ковых дисков при дегенеративном поясничном стенозе / М.Х. Кариев, А.У. Норов, С.Н. Ишмухамедов // Журн. Вопр. нейрохир. им. Н.Н. Бурденко. – 2001. –
№ 3. – С. 14–15.
33.
Качков, И.А. Боль в нижней части спины / И.А. Качков, Б.А. Фили-
монов, А.В. Кедров // Рус. мед. журн. – 1997. – Т. 5, № 15. –
С. 12–16.
34.
Клюшкин, А.Н. Контрастная миелография в диагностике грыжевых
выпячиваний межпозвоночного диска при поясничном остеохондрозе / А.Н.
Клюшкин // Вестн. рентгенол. и радиол. – 1997. – № 6. – С. 47–51.
35.
Коновалов, А.Н. Магнитно–резонансная томография в нейрохирур-
гии / А.Н. Коновалов, В.Н. Корниенко, И.Н. Пронин.– М.:Видар, 1997. – 472 с.
36.
Коновалов, Н.А. Прогнозирование микрохирургического лечения
грыж межпозвонковых дисков на поясничном уровне: Автореф... дис. канд.
мед. наук / Н.А. Коновалов. – М., 1999. – 21 с.
112.
11237.
Коновалов, Н.А. Сегментарная нестабильность позвоночника: не-
решенные вопросы / Н.А. Коновалов, А.В. Крутько, Е.С. Байков, А.Г. Назаренко // Журнал «Хирургия позвоночника» – 2017. – № 3. – С. 74–83.
38.
Коржавин, Г.М. Ортопедические аспекты поясничного межпозвон-
кового остеохондроза / Г.М. Коржавин, Г.П. Карауловская, А.В. Гладков // Боль
и ее лечение. – 1995. – № 1. – С. 19–22.
39.
Корнилов, Н.В. Значение комплексного подхода в лечении остео-
хондроза позвоночника / Н.В. Корнилов, Б.М. Рачков, В.П. Макаров // Вертебрология – проблемы, поиски, решения: Материалы науч.–практ. конф. – М.,
1998. – С. 116–117.
40.
Краснов, Д.Б. Общие принципы нейрохирургического лечения
больных с осложненными формами остеохондроза поясничного отдела позвоночника / Д.Б. Краснов, А.Е. Горенштейн, Н.В. Ларютин и соавт. // Поленовские чтения: Материалы юбилейной Всерос. науч.–практ. конф. – СПб., 2006.–
С. 103–104.
41.
Крутько, А.В. Декомпрессивная ламинопластика в лечении дегене-
ративного стеноза позвоночного канала: Автореф. дис. ... канд. мед. наук / А.В.
Крутько. – Новосибирск, 2006. – 45 с.
42.
Крутько, А.В. Декомпрессивная ламинопластика с использованием
пористого никелида титана при дегенеративных стенозах позвоночного канала:
экспериментально–клиническое исследование / А.В. Крутько, А.Е. Симонович,
А.М. Зайдман и соавт. // Хирургия позвоночника. – 2004. – № 4. – С. 47–57.
43.
Кузнецов, В.Ф. Диагностика стеноза позвоночного канала / В.Ф.
Кузнецов //Здравоохранение Беларуси. – 1992. – № 3. – С.26–29.
44.
Кузнецов, В.Ф. Стеноз позвоночного канала / В.Ф. Кузнецов // Мед.
новости. – 1997. – № 5. – С. 22–29.
45.
Курбангалиев, Р.И. Острые вертеброгенные болевые синдромы по-
яснично–крестцовой локализации, дифференцированное лечение, прогноз: Автореф. дис. … канд. мед. наук / Р.И. Курбангалиев. – СПб., 2000. – 25 с.
113.
11346.
Лантух, А.Р Хирургическое лечение грыж дисков в поясничном от-
деле позвоночника / А. Р Лантух, Р. А Ахмадиев, В. Г Банашкевич и соавт. // IY
съезд нейрохирургов России. – М., 2006. – С. 66–67.
47.
Левин, О.С. Диагностика и лечение вертеброгенной пояснично–
крестцовой радикулопатии / О.С. Левин, М.М. Жезлов // Современная терапия в
психиатрии и неврологии. – 2012. – № 4 – С. 31–35.
48.
Луцик,
А.А.
Диагностика
и
нейрохирургическое
лечение
остеохондроза позвоночника: рекомендательный протокол / А.А. Луцик. –
Новокузнецк, 2004. – С 55-59.
49.
Мануковский, В.А. Централизованная система оказания специали-
зированной хирургической помощи пациентам с острой нетравматической патологией позвоночника в современном мегаполисе / В.А. Мануковский // Журнал «Хирургия позвоночника» – 2017. – № 2. – С. 41–49.
50.
Маратканов, Т.В. Контрастная миелография в диагностике задних
грыж поясничных межпозвонковых дисков / Т.В. Маратканов, Т.Д. Морозова //
Вестн. рентгенол. и радиол. – 1997. – № 1. – С. 30–34.
51.
Маратканов, Т.В. Роль нейрорадиологических методов визуализа-
ции при пояснично–крестцовых радикулитах / Т.В. Маратканов, В.О. Панов //
Новые технологии в неврологии и нейрохирургии на рубеже тысячелетий:
Докл. Рос. конгр. – Ступино, 1999. – С. 27–128.
52.
Михайлов, А.Н. Выбор метода визуализации при дегенеративно–
дистрофических поражениях позвоночника / А.Н. Михайлов // Новые технологии в медицине: диагностика, лечение, реабилитация: Материалы конф. –
Минск, 2002. – Т. 2. – С. 34–42.
53.
Михайлов, А.Н. Средства и методы современной рентгенографии /
А.Н. Михайлов. – Минск: Бел. Наука, 2000. – 242 с.
54.
Мусалатов, Х.А. Классификация задней продольной связки и ее
роль в формировании корешкового синдрома при остеохондрозе поясничного
отдела позвоночника / Х.А. Мусалатов, А.Г. Аганесов, М.Н. Елизаров и соавт. //
Вестн. травматол. и ортопед. им. Н.Н. Приорова. – 1996. – № 1. – С.16–18.
114.
11455.
Мусалатов, Х.А. О показаниях к хирургическому лечению грыжи
межпозвонкового диска при поясничном остеохондрозе / Х.А. Мусалатов, А.Г.
Аганесов, Н.Е. Хорева // Нейрохирургия. – 1999. – № 2. – С. 29–30.
56.
Назаренко, А.Г. Выбор оптимальной хирургической тактики при
дегенеративных заболеваниях пояснично-крестцового отдела позвоночника с
использованием информационно-аналитической системы и компьютерного моделирования: Дисс. док. мед. наук / А.Г. Назаренко. – М., 2012. – 121 с.
57.
Некрасов, А.К. Анализ причин неудовлетворительных клинических
исходов хирургического лечения грыж межпозвонковых дисков поясничного
отдела позвоночника / А.К. Некрасов, М.А. Некрасов // Актуальные вопросы
повреждения и заболев. нервной системы: Матер. конф. – Иваново, 2001.–
С. 124.
58.
Олейник, А.Д. Структурно–измененный очаг остеохондроза пояс-
нично–крестцового отдела позвоночника / А.Д. Олейник, В.В. Ульянов, С.И.
Овчаренко // Новые технологии в медицине: Материалы науч.–практ. конф. –
СПб., 2001. – С. 22.
59.
Омельченко, А.В. Стенозы поясничного отдела позвоночного
канала: типы клинического течения, результаты хирургического лечения:
Автореф. дис. … канд. мед. наук / А.В. Омельченко. – СПб., 2003. – 24 с.
60.
Осна, А.И. Периодизация остеохондроза позвоночника: методиче-
ские рекомендации / А.И. Осна. – Новокузнецк, 1984. – 17с.
61.
Панунцев, Г.К. Роль варикозов в структуре сосудистой аномалии
спинного мозга / Г.К. Панунцев // Поленовские чтения: Сб. науч. тр. – СПб.,
2001. – С. 44–46.
62.
Певзнер, К.Б. Микродискэктомия в лечении дискогенного радику-
лита / К.Б. Певзнер, М.С. Гельфенбейн, С.А. Васильев // Нейрохирургия. –
1999. – № 3. – С. 59–64.
63.
Педаченко, Ю.Е. Стеноз поясничного отдела позвоночника / Ю.Е.
Педаченко // Укр. нейрохир. журн. – 2009. – №4. – С.9–12.
64.
Погожева, Т.И. Сравнительный анализ возрастных и дегенератив-
115.
115но–дистрофических изменений при остехондрозе поясничного отдела позвоночника: методические рекомендации / Т.И. Погожева.– Новокузнецк, 1984.–
17с.
65.
Погожева, Т.И. Сравнительный анализ возрастных и дегенератив-
но–дистрофических изменений при остеохондрозе поясничного отдела позвоночника / Т.И. Погожева // Вертебрология – проблемы, поиски, решения: Материалы науч.–практ. конф. – М., 1998. – С. 146–147.
66.
Подчуфарова, Е.В. Боль в пояснично–крестцовой области: диагно-
стика и лечение / Е.В. Подчуфарова // Рос. мед. журн. – 2004. – № 10. – C. 581–
584.
67.
Полищук,
Н.Е.
Клиника
и
дифференциальная
диагностика
поясничного стеноза / Н.Е. Полищук, Л.А. Исаенко // Укр. мед. журн. – 2001. –
№ 2 (22). – С. 106–109.
68.
Полищук, Н.Е. Структура больных остеохондрозом пояснично–
крестцового отдела позвоночника / Н.Е. Полищук, Е.И. Слынько, А.Е. Косинов
и соавт. // Материалы 3–го Всероссийского съезда нейрохирургов.—СПб.,
2002.—С.273.
69.
Попелянский, А.Я. Пропедевтика вертеброгенных
заболеваний
нервной системы /А.Я. Попелянский, Я.Ю. Попелянский – Казань, 1985. – 86 с.
70.
Попелянский, Я.Ю. Болезни периферической нервной системы /
Я.Ю. Попелянский. – М.: Медицина. – 1989.– 464 с.
71.
Попелянский, Я.Ю. Вертеброгенные заболевания нервной системы /
Я.Ю. Попелянский // Вертеброгенные синдромы поясничного остеохондроза. –
Казань, 1974. – Т.1. – С. 285.
72.
Продан, А.И. Клинико–ренгенологические особенности и диагно-
стика артроза дугоотросчатых суставов при поясничном остеохондрозе /
А.И. Продан // Ортопед., травматол. и протез. – 1991. – № 2. – С. 10–15.
73.
Пташников, Д.А. Роль основных факторов риска в раннем разви-
тии синдрома смежного уровня у пациентов после спондилодеза поясничного
116.
116отдела позвоночника/ Д.А. Пташников // Журнал «Хирургия позвоночника» –
2016. – № 3. – С. 60–67.
74.
Рагимов, О.З. Стеноз поясничного отдела позвоночного канала
(клиника, диагностика и лечение): Автореф. дис. … д–ра мед. наук / О.З. Рагимов. – М., 1993. – 35 с.
75.
Радченко, В.А. Алгоритмы выбора оптимального оперативного
вмешательства при различных клинических вариантах поясничного остеохондроза / В.А. Радченко // Вертебрология – проблемы, поиски, решения: Докл.
науч.–практ. конф. – М., 1998. – С. 151–152.
76.
Радченко, В.А. Оптимизация хирургической тактики и техники при
дистрофических заболеваниях поясничного отдела позвоночника: Автореф.
дис. ... д–ра мед. наук / В.А. Радченко. – Харьков, 1996. – 44 с.
77.
Руденко, А.В. Особенности неврологических проявлений при ши-
роком позвоночном канале у больных с остеохондрозом пояснично–
крестцового отдела позвоночника в сочетании с грыжами дисков / А.В. Руденко
// Материалы 3–го Всероссийского съезда нейрохирургов.— СПб., 2002.—
С.276–277.
78.
Сак, Л.Д. Малоинвазивная хирургия позвоночника: первый опыт
перкутанных артроскопических трансспинальных экстрадуральных герниоэктомий в России / Л.Д. Сак, Е.Х. Зубаиров // Повреждение мозга: Докл. межд.
симп. – СПб., 1999. – С. 259–260.
79.
Сапин, М.Р. Анатомия человека. В 2 кн.: учеб. для студ. биол. и
мед. спец. вузов / М.Р. Сапин, Г.Л. Билич. – М.: ОМНИКС 21 век; Альянс–В,
2001. – Кн. 2. – 432 с.
80.
Семенов, В.В. Некоторые аспекты микрохирургической декомпрес-
сии нервно–сосудистых образований позвоночного канала при поясничном
остеохондрозе / В.В. Семенов, Б.Н. Восьмирко, А.В. Дубовой и соавт. // Журн.
Вопр. нейрохир. – 2001. – № 3. – С. 11–13.
117.
11781.
Скоромец, А.А. Остеохондроз дисков: новые взгляды на патогенез
неврологических синдромов / А.А. Скоромец, Т.А. Скоромец // Неврол. журн. –
1997. – № 6. – С. 53–55.
82.
Слиняков, Л.Ю. Хирургическое лечение синдрома межпозвонковых
суставов, осложненного компрессией спинно–мозгового корешка, при остеохондрозе поясничного отдела позвоночника: Автореф. дис. ... канд. мед. наук /
Л.Ю. Слиняков. – М., 2001. – 25 с.
83.
Слынько, Е.И. Диагностика и хирургическое лечение эпидурально-
го варикоза поясничного отдела позвоночника / Е.И. Слынько, В.В. Вербов,
В.В. Мороз и соавт. // Укр. нейрохир. журн. – 2006. – №2. – С.89–97.
84.
Смеянович, А.Ф. Диагностика и лечение стабильных форм стеноза
позвоночного канала / А.Ф. Смеянович, Ю.Г. Шанько, И.С. Любищев // Здравоохранение. – 1998. – № 2. – С. 3–5.
85.
Смеянович, А.Ф. Диагностика и лечение стабильных форм стеноза
позвоночного канала / А.Ф. Смеянович, Ю.Г. Шанько, И.С. Любищев // Здравоохр. – 1998. – № 2. – С. 33–35.
86.
Соколонский, А.В. Спондилогенные нервно–мышечные синдромы /
А.В. Соколонский. – СПб.: Политехника, 1997. – 117 с.
87.
Стояновский, Д.Н. Боль в области спины и шеи / Д.Н. Стояновский.
– Киев.: Здоровье, 2002. – 392 с.
88.
Тагер, И.Л. Рентгенодиагностика заболеваний позвоночника / И.Л.
Тагер. – М., 1983. – 208 с.
89.
Тельпухов, В.И. Диагностика корешкового синдрома при стенозе
межпозвонковых каналов пояснично–крестцового отдела позвоночника с использованием магнитно–резонансной томографии / В.И. Тельпухов, Л.Ф. Пестерева, М.Т. Сампиев // Новые технологии в неврологии и нейрохирургии на
рубеже тысячелетий: Матер. Рос. конгр. – Ступино, 1999. – С. 204.
90.
Топтыгин, С.В. Алгоритм диагностики дифференцированного мик-
рохирургического лечения первичных и рецидивирующих грыж поясничных
118.
118межпозвонковых дисков / С.В. Топтыгин // Хирургия позвоночника. – 2005. –
№ 3. – С. 71–77.
91.
Топтыгин, С.В. Использование дифференцированных микрохирур-
гических доступов и интраоперационного эндовидеомониторинга для предупреждения рецидивов пояснично–крестцовых радикулитов / С.В. Топтыгин,
В.Е. Парфенов, Ю.А. Щербук // III съезд нейрохирургов России: Докл. – СПб.,
2002. – С. 287–288.
92.
Филатов, В.С. Компримирующие факторы и показания к хирурги-
ческому лечению у больных со стойкими компрессионными поясничными и
крестцовыми радикулопатиями при дистрофических поражениях позвоночника:
Дис. канд. мед. наук / В.С. Филатов. – Казань, 2006 – С. 20-27.
93.
Филатов, В.С. Компримирующие факторы и показания к хирурги-
ческому лечению у больных со стойкими компрессионными поясничными и
крестцовыми радикулопатиями при дистрофических поражениях позвоночника:
Дис. канд. мед. / В.С. Филатов. – Казань, 2006 – С. 87-94.
94.
Фраерман, А.П. О роли гипертрофии желтой связки в происхожде-
нии корешковых поясничных болей / А.П. Фраерман, Н.А. Звонков, Г.В. Токмаков // Остеохондроз позвоночника. – Новокузнецк, 1973. – С.48–52.
95.
Хелимский, А.М. Нейрохирургичекое лечение хронических диско-
генных болевых синдромов шейного и поясничного остеохондроза: Дис. ... д–ра
мед. наук / А.М. Хелимский. – Хабаровск, 1996. – 378 с.
96.
Холин, А.В. Магнитная резонансная томография позвоночника и
спинного мозга / А.В. Холин. – СПб.: Гиппократ, 2007. – 256 с.
97.
Худяев, А.Т. Нейроортопедическая тактика лечения больных с де-
генеративно–дистрофическим спондилолистезом / А.Т. Худяев, С.В. Люлин,
С.Н. Вакуленко // Проблемы нейрохирургии: Сб. науч. тр. МАПО. – СПб., 2000.
– С. 249–250.
98.
Худяев, А.Т. Особенности диагностики врожденного стеноза по-
звоночного канала и его роль при лечении больных с грыжами поясничных
межпозвонковых дисков / А.Т. Худяев, О.В. Васильева // Актуальные вопросы
119.
119ортопедии, травматологии и нейрохирургии: Докл. итог. науч.–практ. конф. –
Казань, 2001. – С. 117–119.
99.
Черненко, О.А. Соотношение клинических данных и результатов
магнитно–резонансной томографии при болях в пояснице / О.А. Черненко, Т.А.
Ахадов, Н.Н. Яхно // Неврол. журн. – 1996. – № 2. – С. 12–16.
100. Шевцов, В.И. Значение интраоперационного мониторинга состояния микроциркуляции дурального мешка и спинномозгового корешка при хирургическом лечении больных поясничной межпозвонковой грыжей диска /
В.И. Шевцов, Е.Н. Щурова, А.Т. Худяев // Нейрохирургия. – 2001. – № 3. – С.
26–30.
101. Шмырев, В.И. Клинико–нейровизуализационное сопоставление и
комплексное лечение компрессионных радикулопатий при поясничном остеохондрозе / В.И. Шмырев, И.Г. Шевелев, П.П. Васильев // Неврол. журн. – 1999.
– № 1. – С. 12–18.
102. Шулев, Ю.А. Комплексное хирургическое лечение больных с дегенеративными поражениями пояснично–крестцового отдела позвоночника /
Ю.А. Шулев, А.К. Дулаев, В.А. Хилько // Вестн. хир. им. И.И. Грекова. – 2000.
– Т. 159. – № 3. – С. 31–36.
103. Шульман, Х.М. Динамика прочностных свойств межпозвонковых
дисков поясничного отдела позвоночного столба человека в возрастном аспекте
/ Х.М. Шульман, В.И. Данилов // Биомеханика. – Рига, 1975.– С.68–72.
104. Шульман, Х.М. Хирургическое лечение компрессионных форм
остеохондроза поясничного отдела позвоночника с протезированием межпозвонковых дисков / Х.М. Шульман. – Казань, 1980. – 238 с.
105. Щедренок, В.В. Малоинвазивная хирургия дегенеративных заболеваний позвоночника / В.В. Щедренок, И.В. Яковенко, Н.В. Аникеев и соавт. –
СПб., 2011. – С. 27-32.
106. Щурова, Е.Н. Влияние длительности заболевания на состояние кровообращения корешков конского хвоста у больных поясничной межпозвонковой грыжей диской / Е.Н. Щурова, А.В. Ефимов// Региональное кровообраще-
120.
120ние и микроциркуляция. – 2012. – Т.11, № 1. – С. 26–29.
107. Юмашев, Г.С. Остеохондрозы позвоночника / Г.С. Юмашев, М.Е.
Фурман. – М.: Медицина, 1984. – 382 с.
108. Яхно, Н.Н. Болезни нервной системы: руководство для врачей /
Н.Н. Яхно, Д.Р. Штульман. – М.: Медицина, 2001. – 480 с.
109. Adogwa, O. Revision lumbar surgery in elderly patients with symptomatic pseudarthrosis, adjacent–segment disease, or same–level recurrent stenosis.
Part 1. Two–year outcomes and clinical efficacy: clinical article / O. Adogwa, K.R.
Carr, K. Kudyba et al. // J neurosurg.: Spine. – 2013. – Vol.18. – P. 139–146.
110. Albeck, M.J. A controlled comparison of myelography, CT and magnetic
resonance imaging in clinically suspected lumbar disc herniation / M.J. Albeck,
J. Hilden // Spine. – 1996. – Vol. 20, № 4. – P. 443–448.
111. Albeck, M.J. A Critical assessment of clinical diagnosis of disc herniation in patients with monoradicular sciatica / M.J Albeck // J neurosurg. – 1996. –
Vol. 138, №1. – P. 40–44.
112. Asch, L.H. Prospective multiple outcomes study of outpatient lumbar
microdiscectomy: should 75 to 80% success rates be the norm? / L.H. Asch, P.J.
Lewis, D.B. Moreland // J neurosurg.: Spine. – 2002. – Vol. 96, suppl., № 1. – P. 34–
44.
113. Atlas, S.J. Long–term outcomes of surgical and nonsurgical management
of lumbar spinal stenosis: 8 to 10 year results from the main lumbar spine study / S.J.
Atlas, R.B. Keller, Y.A. Wu et al. // Spine. – 2005. – Vol. 30. – P. 936–943.
114. Bartinski, W.S. Lumbar root compression in the lateral recess: MR imaging, conventional myelography, and CT myelography comparision with surgical confirmation / W.S. Bartinski, L. Lin // Am j neuroradiol. – 2003. – Vol. 24, №3. – P.
348–360.
115. Beautie, P.F. Assotiations between report of simptoms anatomic impairment visible on lumbar magnetic resonance imaging / P.F. Beattie, S.P.Meyers, P.
Stratford et al. // Spine. – 2000. – Vol.25, № 7. – P.819– 828.
121.
121116. Burton, C.V. Causes of failure of surgery on the lumbar spine / C.V. Burton, W.H. Kirkaldy–Willis, K. Yong–Hing et al. // Clin orthoped. – 1981. – Vol. 157. –
P. 191–199.
117. Bydon, A. Treatment of Spinal Synovial Cysts / A. Bydon, M. Bydon, K.
Papadimitriou et al. // World neurosurg. – 2013. – Vol. 79 (2). – P. 375–380.
118. Candi, A. Percutaneous laser decompression of the lumbar disk guided by
a combination of fluoroscopy and CT / A. Candi, B.A. Kastler, J.M. Hanequin et. al. //
Radiology: 79–th scientific assembly aannual meet. – Seatle, 1993. – P. 387.
119. Caspar, W. The Caspar microsurgical discectomy and comparison with a
conventional standard lumbar disk procedure / W. Caspar, В. Campbell, D. Barbier
et. al. // Neurosurgery. – 1991. – Vol. 28, № 1. – P. 78–87.
120. Cohen–Gadol, A.A. Synovial cysts of the thoracic spine / A.A. Cohen–Gadol, J.B. White, J.J. Lynch et al. // J neurosurg.: Spine. – 2004. – Vol. 1.
P. 52—57.
121. Cormac, O.M. Lateral exit–zone stenosis and lumbar radiculopathy /
O.M. Cormac, F.C. Henderson // J neurosurg.: Spine. –1999. – Vol. 90, № 1. – P. 52–
58.
122. Dandy, W.E. Recent advances in the diagnosis and treatment of ruptured
intervertebral disks / W.E. Dandy // Ann surg. – 1942. – Vol. 115, № 4. – P. 514–520.
123. Davis, R.A. A long–term outcome analysis of 984 surgically treated herniated lumbar discs / R.A. Davis // J neurosurg. – 1994. – Vol. 80. – P. 415–421.
124. Dowd, G.C. Herniated lumbar disc evalution and management / G.C.
Dowd, G.P. Rusich, E.S. Connolly // Neurosurg quart. – 1998. – Vol. 8, № 2. – P.
140–160.
125. Dupuis, P.R. Radiologic diagnosis of degenerative lumbar spinal instability / P.R. Dupuis, K. Young–Hing, J.D. Cassidy et al. // Spine. – 1985. – Vol. 10.–
P. 262–276.
126. Efstathios, J. B. Spinal synovial cysts: pathogenesis, diagnosis and
surgical treatment in a series of seven cases and literature review / J. Efstathios,
122.
122C. Lampis, A.T. Kouyalis et al. // Eur spine j. – 2008. – Vol. 17, № 6. – P. 831–
837.
127. Epstein, J.A. Sciatica caused by nerve root entrapment in the lateral recess: The superior facet syndrome / J.A. Epstein, B.S. Epstein, A.D. Rosenthal // J
neurosurg. – 1972. – Vol. 36, № 5. – P. 584–589.
128. Epstein, N. Diagnosis and surgical management of ossification of the
posterior longitudinal ligament / N. Epstein // Contemp neurosurg. – 1992. – Vol.14.–
P. 1–6.
129. Fehlings, M.G. Surgery for lumbar stenosis / M.G. Fehlings, N.K. Jha //
J neurosurg: Spine. – 2011. – Vol. 14 (3).– P. 303–304.
130. Fu, K.M. Morbidity and mortality in the surgical treatment of 10,329
adults with degenerative lumbar stenosis / K.M. Fu, J.S. Smith, D.W. Polly et al. // J
neurosurg: Spine. – 2010. – Vol. 12 (5). – P. 443–446.
131. Fuster, S. Lumbar radicular canal stenosis. 43 cases / S. Fuster, P.
Tomer, A. Serra // 3th Congress Association Orthopedic and Traumatic – Barcelona,
1997. – P. 571.
132. Gardner, A. Graf ligamentoplasty: a 7–year follow–up / A. Gardner,
K.C. Pande // Eur spine j. – 2002. – Vol. 11. – S. 157–163.
133. Herno, A. Long–term results of surgical treatment of lumbar spinal stenosis / A. Herno, O. Airaksinen, T. Saari // Spine. – 1993. – Vol. 18. – P. 1471–1474.
134. Hogan, Q.H. Lumbar epidural anatomy. A new look by cryomicrotome
section / Q.H. Hogan // Anesthesiology. – 1991. – Vol.75. – P.767–775.
135. Howard, S. An. Techniques of spine surgery / S. An. Howard // Williams
Wilkins. Section IV. – California, 1998. – P. 401–474.
136. Hoyland, J.A. Retained surgical swab debris in post–laminectomy arachnoiditis and peridural fibrosis / J.A. Hoyland, A.J. Freemont, J. Denton et al. // J bone
jt surg. Br. – 1988. – Vol. 70, № 4. – P. 659–662.
137. Jackson, R.P. The neuroradiographic diagnosis of lumbar herniated nucleus pulposus: II. A comparison of computed tomography (CT), myelography, CT–
123.
123myelography, and magnetic resonance imaging / R.P. Jackson, J.E. Cain, R.R. Jacobs
et al. // Spine. – 1989. – Vol. 14(12). – P. 1362–1367.
138. Janssen, M.E. Lumbar herniated disk disease: comparison of MRI, myelography, and postmyelographic CT scan with surgical findings / M.E. Janssen, S.L.
Bertrand, C. Joe et al. //Orthopedics. – Vol. 1994. – Vol. 17 (2). – P. 121–127.
139. Johnsson, K.E. Preoperative and postoperative instability in lumbar spinal stenosis / K.E. Johnsson, I. Redlund–Johnell, A. Uden et al. // Spine. –1989. –
Vol. 14. – P. 591–593.
140. Kahanovilz, N. Milticenter analysis of percutaneous discectomy /
N. Kahanovilz, K. Viola, T.A. Goldstein // Spine.–1990.–Vol.15.–P. 713–717.
141. Kaneda, K. Follow–up study of medical facetectomies and posterolateral
fussion with instrumentation in unstable degenerative spondylolisthesis / K. Kaneda,
H. Kazama, Sh. Savon et al. // Clin orthop rel res. – 1986. – Vol. 203. – P. 159–167.
142. Katz, J.N. Seven to 10–year outcome of decompressive surgery for degenerative lumbar spine disorders / J.N. Katz, S.J. Lipson, L.C. Chang et al. // Spine.
– 1996. – Vol. 21. – P. 92–98.
143. Katz, J.N. The outcome of decompressive laminectomy for degenerative
lumbar stenosis / J.N. Katz, S.J. Lipson, M.G. Larson et al. // J bone j surg (Am). 1991. – Vol. 73. – P. 809–816.
144. Kawaguchi, Y. Clinical and radiographic results of expansive lumbar
laminiplasty in patients with spinal stenosis / Y. Kawaguchi, M. Kanamori, H. Ishihara, et al. // J bone j surg (Am). - 2004. – Vol. 86.– P. 1698–703.
145. Khan, T.A. Treatment of acute lumbago; low dose diclofenac sodium
with vitamin–B complex compared with diclofenac alone / T.A. Khan, A. Ahmad,
I.Z. Haider // Professional med j. - 2008. – Vol. 15. – P 440–444.
146. Koenigsberg, R.A. Percutaneous aspiration of lumbar synovial cyst:
CT and MRI considerations / R.A. Koenigsberg // Neuroradiology. – 1998. – Vol.
40. - P. 272—273.
147. Kramer, J. Natural course and prognosis of intervertebral disc diseases /
J. Kramer // Spine. – 1995. – Vol. 20, № 6. – P. 635–644.
124.
124148. Lange, M. Surgical treatment and results in patients sufferung from lumbar spinal stenoses / M. Lange, C. Hamburger, E. Waidhauser // Neurosurg rev. –
1993. – Vol. 16, № 1. – P. 27–33.
149. Lee, C.K. Lateral lumbar spinal canal stenosis: classification, pathologic
anatomy and surgical decompression / C.K. Lee, W. Rauschning, W. Glenn // Spine.
–1988.–Vol. 13, № 3. – P. 313–320.
150. Lehto, M. Factors influencing the outcome of operative treatment for
lumbar spinal stenosis / M. Lehto, P. Honkanen // J neurosurg. – 1995. – Vol. 137, №
1–2. – P. 25–28.
151. Lesoin, F. Bilateral posterolateral approach to the thoracolumbar spine
througt transversoarthropediculectomy with corporectomy / F. Lesoin, L. Villette //
Surg neurol. – 1986. – Vol. 26, № 1. – P. 17–23.
152. Lyons, M.K. Surgical evaluation and management of lumbar synovial
cysts: the Mayo clinic experience / M.K. Lyons, J.L. Atkinson, R.E. Wharen et al.
// J neurosurg. – 2000. – Vol. 93, suppl. 1. - P. 53-57.
153. Mamisch, N. Radiologic criteria for the diagnosis of spinal stenosis: results of a Delphi survey / N. Mamisch, M. Brumann, J. Hodler et al. // Radiology. –
2012. – Vol. 264. – P. 174–179.
154. Matsumoto, M. Extraforaminal entrapment of the fifth lumbar spinal
nerve by osteophytes of the lumbosacral spine: anatomic study and a report of four
cases / M. Matsumoto, K. Chiba, K. Nojiri et al. // Spine. - 2002. - Vol.27, № 6. - P.
169 - 173.
155. Matsunaga, S. Genetic analysis of ossification of the posterior longitudinal ligament / S. Matsunaga, M. Yamaguchi, K. Hayashi et al. // Spine. - 1999. Vol.24. - P.937–939.
156. Mayer, H. M. Percutaneous endoscopic discectomy: surgical technique and preliminary results compared to microsurgical discectomy / H.M. Ma –
yer, M. Brock // J neurosurg. – 1993. – Vol.21. – P.21.
125.
125157. Miyatake, N. Facet cyst haematoma in the lumbar spine: a report of
four cases / N. Miyatake, T. Aizawa, H. Hyodo et al. // J orthopaedic surg. – 2009. –
Vol. 17, № 1. - P. 80—84.
158. Morgalla, M.H. Lumbar spinal stenosis in elderly patients: is a unilateral
microsurgical approach sufficient for decompression? / M.H. Morgalla, N. Noak, M.
Merkle et al. // J neurosurg: Spine. – 2011. – Vol. 14(3). – P. 305–312.
159. Munting, E.
Patient outcomes after laminotomy, hemilaminectomy,
laminectomy and laminectomy with instrumented fusion for spinal canal stenosis: a
propensity score–based study from the Spine Tango registry / E. Munting, C. Roder,
R. Sobottke et al. // Eur spine j. – 2015. - Vol. 24. – P. 358–368.
160. Nakagama, K. Medial facetectomy for persistent pain after the lumbar
spine surgery / K. Nakagama, M. Hayaisi // 3th Congress Association Orthopedic
and Traumatic – Barcelona, 1997. – P. 561.
161. Nygaard, O.P. The inflammatory properties of contained and noncontained lumbar disc herniation / O.P. Nygaard, S.I. Mellgren, B. Osterud // Spine –
1997. – Vol. 22. – P. 2484–2488.
162. Nygaard. O.P. Duration of leg pain as a predictor of outcome after surgery for lumbar disc herniation: a prospective cohort study with 1–year follow–up /
P.О. Nygaard, R. Kloster, T. Solberg // J neurosurg. – 2000. – Vol. 92, suppl. 2. – P.
131.
163. Onel, D. Lumbar spinal stenosis: clinical radiologic therapeutic evaluation in 145 patients. Conservative treatment of surgical intervention? / D. Onel, M.
Sari, C. Donmes // Spine. – 1993. – Vol. 18, № 2. – P. 291–298.
164. Onkey, R.G. Lumbar spinal stenosis / R.G. Onkey, M. Tile, W.H.
Kirkaldy–Willis // AAOS Instructional Course Lectures. – 1979. – № 28. – P. 237–
245.
165. Peul, W.C Prolonged conservative care versus early surgery in patients
with sciatica caused by lumbar disc herniation: two year results of a randomised controlled trial / W.C. Peul, W.B. van den Hout, R. Brand et al. // BMJ. - 2008. – Vol.
336. – P. 1355–1358.
126.
126166. Pfirrmann, C.W. MR image–based grading of lumbar nerve root compromise due to disk herniation: reliability study with surgical correlation / C.W.
Pfirrmann, C. Dora, M.R. Schmid et al. // Radiology. – 2004. – Vol. 230 (2). – P.
583–588.
167. Porter, R.W. Management of back pain / R.W. Porter. – Edinburgh,
1993. – 460 p.
168. Postacchini, F. The surgical treatment of central lumbar stenosis. Multiple laminotomy compared with total laminectomy / F. Postacchini, G. Cinotti, D. Perugia // J bone jt surg. – 1993. – Vol. 75–B, № 3. – P. 386–392.
169. Ramos, A. Lumbar disc herniation: CT imaging assessment and clinical
outcome / A. Ramos // 11th European Congress Radiology. – Viena, 1999. – P. 29.
170. Rosenberg, W.S. Transforaminal lumbar interbody fusion: Technique,
complications, and early results / W.S. Rosenberg, P.V. Mummaneni // Neurosurgery.
– 2001. – Vol. 48. – P. 569–574.
171. Sabo, R.A. A series of 60 juxtafacet cysts: clinical presentation the
role of spinal instability and treatment / R.A. Sabo, P.T. Tracy, J.M. Weinger // J
neurosurg.: Spine. – 1996. – Vol. 85. P. 560—565.
172. Saetia, K. Ossification of the posterior longitudinal ligament: a review /
K. Saetia, D. Cho, S. Lee et al. // Neurosurg focus. – 2011. – Vol. 30 (3). – P 232234.
173. Sahlstrand, T. A prospective study of preoperative and postoperative sequential magnetic resonance imaging and early clinical outcome in automated percutaneosus lumbar discectomy / T. Sahlstrand, M. Lonntoft // J spinal discord. – 1999. –
Vol.12. – P. 368–374.
174. Samii, M. Surgical treatment of myeloradiculopathy in cervical spondylosis: a report on 438 operations / M. Samii, D. Volkening, A. Sepehrnia // Neurosurg
rev. – 1989. – Vol. 12. – P. 285–290.
175. Sanderson, P.L. Long–term results of partial undercutting facetectomy
for lumbar lateral recess stenosis / P.L. Sanderson, C.M. Getty // Spine. - 1996. - Vol.
21(11). – P. 1352 – 1356.
127.
127176. Sclireiber, A. Biportal percutaneous lumbar nucleotomy: development,
technique and evolutions / A. Sclireiber, I. Leu // Arthroscopic microdiscectomy.–
Baltimore; USA, 1991. – P. 101–108.
177. Sheldon, J.J. Computed tomography of the lower lumbar vertebral column normal anatomy and stenotic canal / J.J. Sheldon, J. Serland, J. Leborgne // Radiology. – 1977. –Vol. 124, №1. – P. 113–118.
178. Silveri, C.P. Lumbar disc disease / C.P. Silveri, F.A. Simeone // Spine. –
Munich, Williams and Wilkins, 1998. – P. 213.
179. Spetzger, U. Unilateral laminotomy for bilateral decompression of lumbar spinal stenosis. Part I: Anatomical and surgical considerations / U. Spetzger, B.H.
Naujokat // J neurosurg. – 1997. – Vol. 139, № 5. – P. 392–396.
180. Suk, K.S. Recurrent lumbar disc herniation: results of operative management / K.S. Suk, H.M. Lee, S.H. Moon et. al. // Spine. – 2001. – Vol. 26. – P. 672–676.
181. Tolonen, J. Basic fibroblast growth factor immunoreactivity in blood
vessels and cells of disc herniatons / J. Tolonen // Spine. – 1995. – Vol. 20, №3. – P.
271–276.
182. Turner, J.A. Surgery for lumbar spinal stenosis: An attempted meta–
analysis of the literature / J.A. Turner, M. Ersek, L. Herron et al. // Spine. – 1992. –
Vol. 17. – P. 1–8.
183. Vaccaro, A.R. Indications for instrumentation in degenerative lumbar
spinal disorders / A.R. Vaccaro, T.B. Scott // Orthopedics. – 2000. – Vol. 23, № 3. –
P. 260–271.
184. Williams, R.W. Lumbar disc disease. Microdiscectomy / R.W. Williams
// Neurosurg clin N Am. – 1993. – Vol. 4, № 1. – P. 101–108.
185. Yoshida, M. Hypertrophied ligamentum flavum in lumbar spinal canal
stenosis. Pathogenesis and morphologic and immunohistochemical observation / M.
Yoshida, K. Shima, Y. Taniguchi et al. // Spine. – 1992. – Vol. 7. – P.1353–1360.
186. Zimmerman, W. Neuroimaging. Clinical and Phisical Principles / W.
Zimmerman, A. Gibby, R.F. Carmody // Neuroimaging. Clinical and Phisical Principles. – Springer Verlag; New York, 2000. – P. 615–656.
128.
128ПРИЛОЖЕНИЕ 1.
129.
129ПРИЛОЖЕНИЕ 2.
130.
130№
п.п.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
Фамилия Пол Воз- № И.Б.
раст пациента
А-ва
ж
46
9637
А-ин
м
32
10123
А-на
ж
40
3063
А-ов
м
71
195
А-ов
м
44
304
А-ов
м
36
3167
А-ев
м
50
11250
А-ва
ж
60
5487
А-на
ж
57
6926
А-ин
м
47
8276
А-ва
м
47
2398
А-ва
ж
66
10203
А-ов
м
38
4063
А-ов
м
26
4249
А-ва
ж
45
7378
А-ов
м
52
4264
А-на
ж
39
4257
А-ов
м
47
8488
А-ов
м
28
6986
А-ин
м
49
8294
А-ва
ж
43
8381
Б-ин
м
53
4871
Б-на
ж
29
12038
Б-ов
м
63
11986
Б-ев
м
34
3881
Б-ва
ж
42
2996
Б-ва
ж
29
4436
Б-ов
м
45
11383
Б-ов
м
64
7099
Б-ов
м
55
144
Б-ов
м
62
10928
Б-ов
м
42
4198
Б-ов
м
42
4140
Б-ов
м
26
7182
Б-ов
м
28
7177
Б-на
ж
29
1145
Б-ин
м
43
3311
Б-на
ж
22
7904
Б-ва
ж
37
7461
В-ва
ж
41
4341
ПРИЛОЖЕНИЕ 3 (список пациентов).
№ Фамилия Пол Воз- № И.Б.
п.п.
раст пациента
41 В-ев
м
38
1787
42 В-ев
м
39
5075
43 В-на
ж
41
10645
44 В-на
ж
37
10470
45 В-ко
м
35
10371
46 В-ев
м
35
12163
47 В-ев
м
39
9961
48 В-ва
ж
65
5553
49 В-ва
ж
26
6584
50 В-на
ж
25
9733
51 Г-ов
м
42
5212
52 Г-ов
м
49
5697
53 Г-ва
ж
25
4124
54 Г-ов
м
45
9205
55 Г-ва
ж
55
4621
56 Г-ов
м
39
4316
57 Г-ва
ж
52
633
58 Г-ов
м
52
11098
59 Г-ов
м
28
7788
60 Г-ва
ж
57
7849
61 Г-ин
м
36
9937
62 Г-ва
ж
52
662
63 Г-ев
м
59
1371
64 Г-ва
ж
54
9211
65 Г-ва
ж
32
3815
66 Г-ин
м
45
10489
67 Г-ин
м
46
12193
68 Г-ин
м
61
4590
69 Г-ин
м
45
4430
70 Г-ов
м
36
7708
71 Г-ва
ж
34
4066
72 Г-ев
м
20
8618
73 Г-ин
м
63
9429
74 Г-ев
м
66
8466
75 Г-ов
м
38
5655
76 Г-ва
ж
38
12049
77 Г-ин
м
53
5241
78 Г-ин
м
41
6828
79 Г-ов
м
54
5793
80 Г-ов
м
36
12217
131.
13181
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
106
107
108
109
110
111
112
113
114
115
116
117
118
119
120
121
122
123
Г-ов
Г-ов
Г-ов
Г-ов
Г-ва
Г-ов
Г-ов
Г-ов
Г-ва
Г-ов
Г-ин
Г-на
Г-ев
Г-ий
Г-ов
Г-ко
Г-ов
Д-ов
Д-ов
Д-ов
Е-ов
Е-ов
Е-ев
Е-ва
Е-ва
Е-ва
Е-ов
Е-ов
Ж-ев
Ж-ин
З-ов
З-ов
З-ва
З-ев
З-ва
З-ов
З-ва
З-ва
З-ин
З-ин
З-ин
З-на
З-ов
м
м
м
м
ж
м
м
м
ж
м
м
ж
м
м
м
ж
м
м
м
м
м
м
м
ж
ж
ж
м
м
м
м
м
м
ж
м
ж
м
ж
ж
м
м
м
ж
м
54
34
47
51
28
42
58
53
42
63
48
52
74
56
65
62
33
35
43
36
28
61
52
28
71
39
39
34
80
61
21
58
39
58
33
43
75
44
57
54
51
39
48
4363
11089
10257
8469
10416
7474
2722
5323
5513
6406
7326
2702
2298
5262
3187
11573
796
1468
6134
1182
11824
9969
1822
5749
5946
1693
6531
9500
11843
4283
1537
7241
5279
2803
3652
4994
10019
4870
5168
3031
7930
6651
7253
124
125
126
127
128
129
130
131
132
133
134
135
136
137
138
139
140
141
142
143
144
145
146
147
148
149
150
151
152
153
154
155
156
157
158
159
160
161
162
163
164
165
166
З-ов
З-ва
З-ов
И-ин
И-ов
И-ва
И-ва
И-ов
И-ов
К-ов
К-ов
К-ев
К-ый
К-на
К-ев
К-ва
К-ва
К-ов
К-ва
К-ва
К-ин
К-на
К-ев
К-ов
К-ов
К-ич
К-ов
К-ов
К-ин
К-ва
К-ов
К-ев
К-ев
К-ва
К-на
К-ин
К-ко
К-ин
К-ев
К-ва
К-ов
К-ов
К-ин
м
ж
м
м
м
ж
ж
м
м
м
м
м
м
ж
м
ж
ж
м
ж
ж
м
ж
м
м
м
ж
м
м
м
ж
м
м
м
ж
ж
м
ж
м
м
ж
м
м
м
65
56
44
46
75
47
34
38
29
63
39
58
29
29
30
44
35
40
50
43
37
27
33
41
50
43
44
39
46
45
42
39
43
55
30
35
35
67
57
40
32
43
27
687
10618
11128
5428
6211
6762
3071
9036
2634
5836
8259
150
1293
3407
8113
8994
8763
5573
5551
6856
846
818
6385
7240
7523
8320
3900
142
3292
9845
10293
10820
6954
782
10308
6915
3152
9452
9054
11083
9270
2016
8505
132.
132167
168
169
170
171
172
173
174
175
176
177
178
179
180
181
182
183
184
185
186
187
189
190
191
192
193
194
195
196
197
198
199
200
201
202
203
204
205
206
207
208
209
210
К-ин
К-ов
К-ва
К-ва
Л-на
Л-ва
Л-ва
Л-ов
Л-ва
Л-на
Л-ов
Л-ва
Л-ко
Л-ин
Л-ва
Л-ин
М-ов
М-ов
М-ов
М-ий
М-ва
М-ва
М-ин
М-ва
М-ва
М-ук
М-ва
М-ин
М-ев
М-ва
М-ва
М-ва
М-ев
М-ев
М-ев
М-ин
М-ин
М-ев
М-ин
М-ов
М-ов
М-ин
М-ов
м
м
ж
ж
ж
ж
ж
м
ж
ж
м
ж
ж
м
ж
м
м
м
м
м
ж
ж
м
ж
ж
м
ж
м
м
ж
ж
ж
м
м
ж
м
м
м
м
м
м
м
м
30
59
40
29
45
36
38
43
57
35
74
49
65
37
32
50
30
53
41
47
39
32
68
35
31
65
47
37
40
72
38
61
40
32
58
34
33
44
66
59
63
29
68
7225
8524
6899
9495
7388
7508
9683
8574
3545
8376
332
7805
12135
1045
8414
4349
6050
4376
2660
2368
2619
939
2991
3903
11931
11301
7430
1737
8484
11792
7704
3228
932
1672
1223
3825
2705
826
11032
6879
2581
2589
1325
211
212
213
214
215
216
217
218
219
220
221
222
223
224
225
226
227
228
229
230
231
232
233
234
235
236
237
238
239
240
241
242
243
244
245
246
247
248
249
250
251
252
253
М-ва
М-ва
М-ин
М-ов
М-ов
М-ов
М-ев
М-ва
М-на
М-ин
М-ин
М-ов
М-ик
Н-на
Н-ев
Н-ва
Н-ов
Н-ва
Н-ов
Н-ва
Н-ов
Н-ва
Н-ва
Н-на
Н-на
Н-ва
Н-ов
П-ва
П-на
П-ва
П-ов
П-ов
П-ов
П-ай
П-ая
П-ов
П-ло
П-ов
П-на
П-ва
П-ва
П-ая
Р-ов
ж
ж
м
м
м
м
м
ж
ж
м
м
м
м
ж
м
ж
м
ж
м
ж
м
ж
ж
ж
ж
ж
м
ж
ж
ж
м
м
м
м
ж
м
ж
м
ж
ж
ж
ж
м
48
59
74
32
60
34
69
58
61
61
62
74
50
29
55
28
50
29
50
53
27
57
49
63
62
31
61
55
38
32
76
74
32
63
26
81
67
63
30
71
57
80
36
4607
10615
8810
4937
4743
5666
10985
8433
844
2135
2820
5028
5088
665
5398
6399
7951
5504
6659
4446
6430
4558
7414
4561
2553
11960
214
10837
3035
12159
9534
673
3419
3406
4145
5611
7261
11113
2254
5117
8077
2076
3711
133.
133254
255
256
257
258
259
260
261
262
263
264
265
266
267
268
269
270
271
272
273
274
275
276
277
278
279
280
281
282
283
284
285
286
287
288
289
290
291
292
293
294
295
296
Р-ва
Р-ов
Р-на
Р-ий
Р-ов
Р-ва
С-ов
С-ов
С-ев
С-ов
С-на
С-ва
С-ов
С-ов
С-ин
С-на
С-ва
С-ов
С-на
С-ов
С-ов
С-ов
С-ва
С-ин
С-на
С-на
С-на
С-ин
С-на
С-на
С-на
С-ов
С-ов
С-ев
С-на
С-ва
С-ин
С-на
С-ов
С-ва
С-ва
С-ва
С-ев
ж
м
ж
м
м
ж
м
м
м
м
ж
ж
м
м
м
ж
ж
м
ж
м
м
м
ж
м
ж
ж
ж
м
ж
ж
ж
м
м
м
ж
ж
м
ж
м
ж
ж
ж
м
46
38
44
55
34
36
63
35
54
25
52
72
60
39
23
47
39
44
53
74
50
66
30
49
42
43
57
54
42
24
24
78
30
39
53
53
57
70
34
44
61
73
38
9883
11540
11099
2916
2439
5423
1297
11950
8365
6171
6922
196
6909
6776
10576
3308
5393
8334
610
8350
9537
8304
1125
7415
4056
2390
1181
6159
10129
10730
11828
1797
1277
5965
5351
8114
4091
2449
7879
11943
8855
8188
6392
297
298
299
300
301
302
303
304
305
306
307
308
309
310
311
312
313
314
315
316
317
318
319
320
321
322
323
324
325
326
327
328
329
330
331
332
333
334
335
336
337
338
339
С-ев
С-ва
С-на
С-на
С-ин
С-ва
С-ко
С-ов
С-ев
С-ва
Т-ва
Т-ва
Т-ва
Т-ва
Т-ев
Т-ев
Т-ов
Т-ов
Т-ов
Т-ва
Т-пп
Т-ев
Т-ва
Т-ин
Т-ин
Т-ин
Т-на
Т-на
У-ин
У-ов
У-ов
Ф-ов
Ф-на
Ф-ин
Ф-ва
Ф-на
Ф-ин
Ф-ин
Ф-ва
Ф-ва
Ф-ва
Ф-ев
Ф-ва
м
ж
ж
ж
м
ж
м
м
м
ж
ж
ж
ж
ж
м
м
м
м
м
ж
ж
м
ж
м
м
м
ж
ж
м
м
м
м
ж
м
ж
ж
м
м
ж
ж
ж
м
ж
36
38
43
36
39
73
50
33
37
42
54
31
43
62
51
50
33
62
51
41
64
36
48
32
20
57
48
40
73
37
80
68
58
56
37
46
46
47
37
46
34
19
28
8762
3407
7396
9763
6077
5934
11080
591
2416
7168
5352
10515
8185
1557
5456
10295
1111
9378
6164
9948
1611
2940
1644
9487
2960
5830
1130
1656
1022
10062
12145
6243
12081
6746
12050
7496
2989
8558
9498
4152
9773
1499
4002
134.
134340
341
342
343
344
345
346
347
348
349
350
351
352
353
354
355
356
357
358
359
360
361
362
363
364
365
366
367
368
369
370
371
372
373
374
375
376
377
378
379
380
381
Ф-ов
Ф-ов
Х-ва
Х-ов
Х-ов
Х-ов
Х-ин
Х-на
Х-на
Х-на
Х-ва
Х-ов
Х-ва
Х-ва
Х-на
Х-на
Х-на
Х-на
Х-ин
Х-ин
Х-ва
Х-ва
Х-ов
Х-ов
Х-ов
Х-ов
Х-ян
Х-ва
Х-ва
Х-ин
Х-ли
Х-на
Х-ва
Х-ов
Х-ов
Х-ва
Ц-ер
Ч-ва
Ш-ва
Ш-на
Ш-на
Ш-ов
м
м
ж
м
м
м
м
ж
ж
ж
ж
м
ж
ж
ж
ж
ж
ж
м
м
ж
ж
м
м
м
м
м
ж
ж
м
м
ж
ж
м
м
ж
м
ж
ж
ж
ж
м
35
55
51
28
35
50
33
34
36
35
36
35
30
31
35
40
23
57
54
55
29
35
60
55
30
34
35
33
49
53
49
41
28
50
48
50
48
73
50
62
49
51
10947
8846
9550
3539
9751
6318
3617
9616
8544
11949
4452
1037
4551
5216
7520
2241
6488
336
12211
4602
194
11247
3030
5962
3507
6521
3448
6663
11129
1449
6234
7863
7841
7101
2366
1613
9882
7908
3976
11307
7470
2294
382
383
384
385
386
387
388
389
390
391
392
393
394
395
396
397
398
399
400
Ш-ов
Ш-ва
Ш-ва
Ш-ва
Ш-ва
Ш-ев
Ш-ва
Ш-ва
Ш-ва
Ш-ин
Ш-на
Ш-ва
Ш-ва
Ш-на
Ю-ов
Ю-ва
Ю-ва
Я-на
Я-ва
м
ж
ж
ж
ж
м
ж
ж
ж
м
ж
ж
ж
ж
м
ж
ж
ж
ж
55
43
58
42
60
43
55
57
58
57
44
42
35
65
65
54
33
50
42
5518
4580
11786
11391
10674
6654
6471
9732
9442
9204
9787
6658
1124
3173
7711
11100
10739
8275
7552























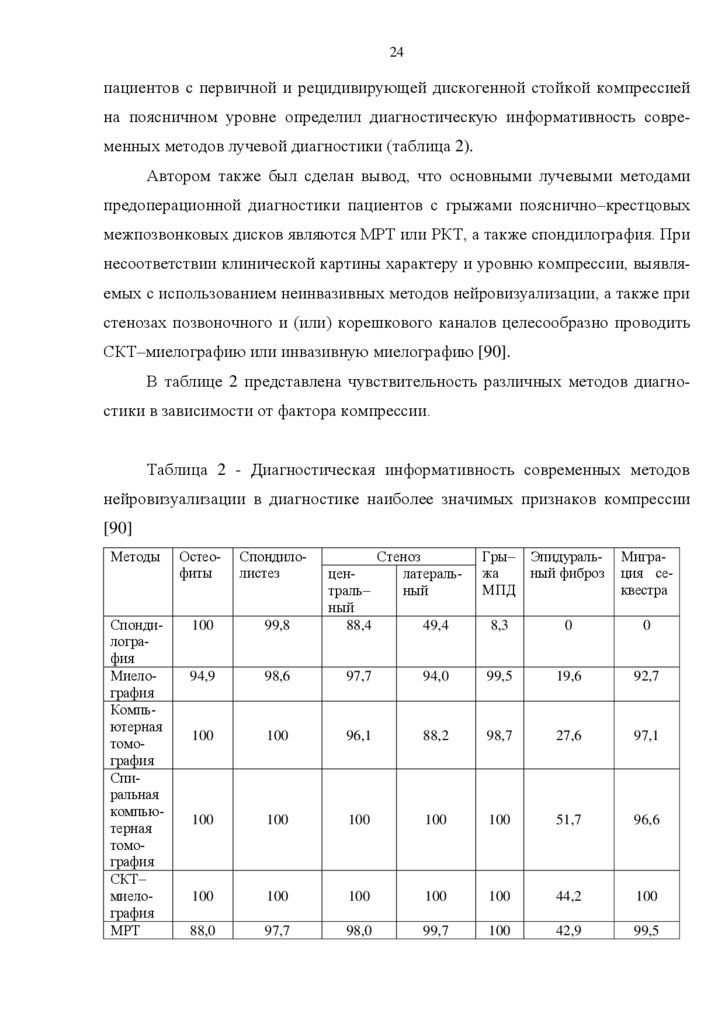





























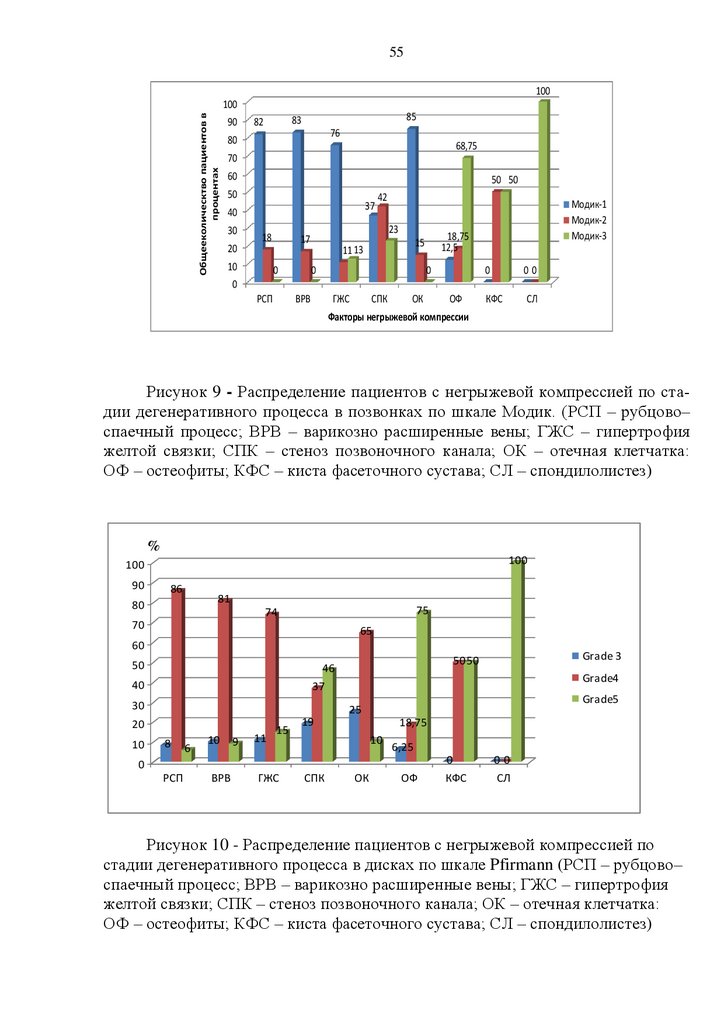

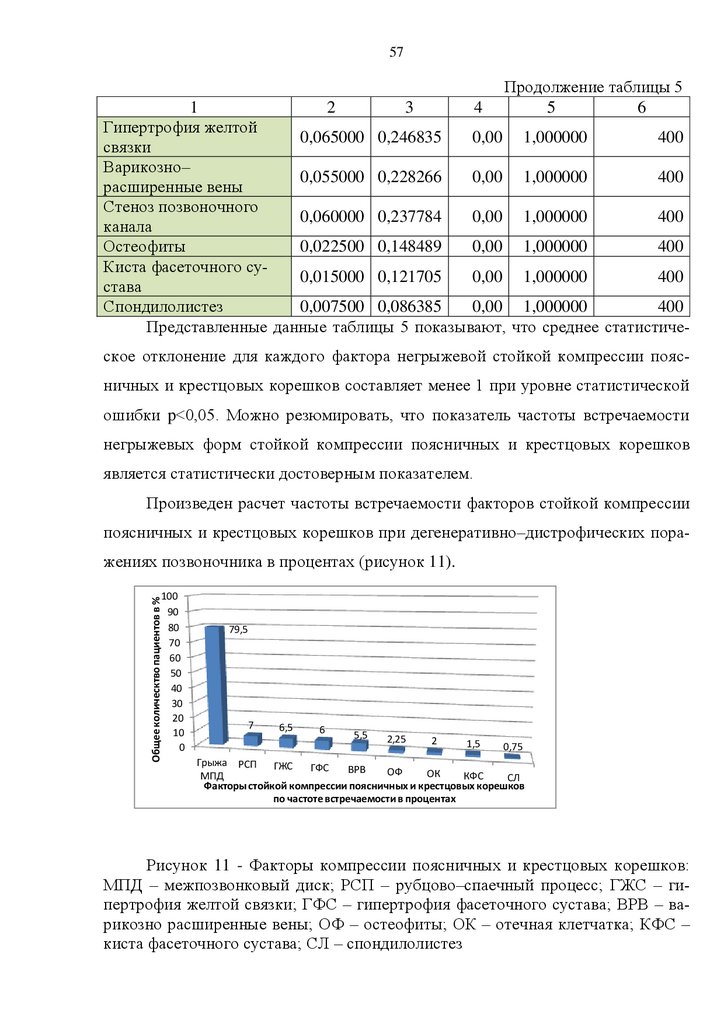
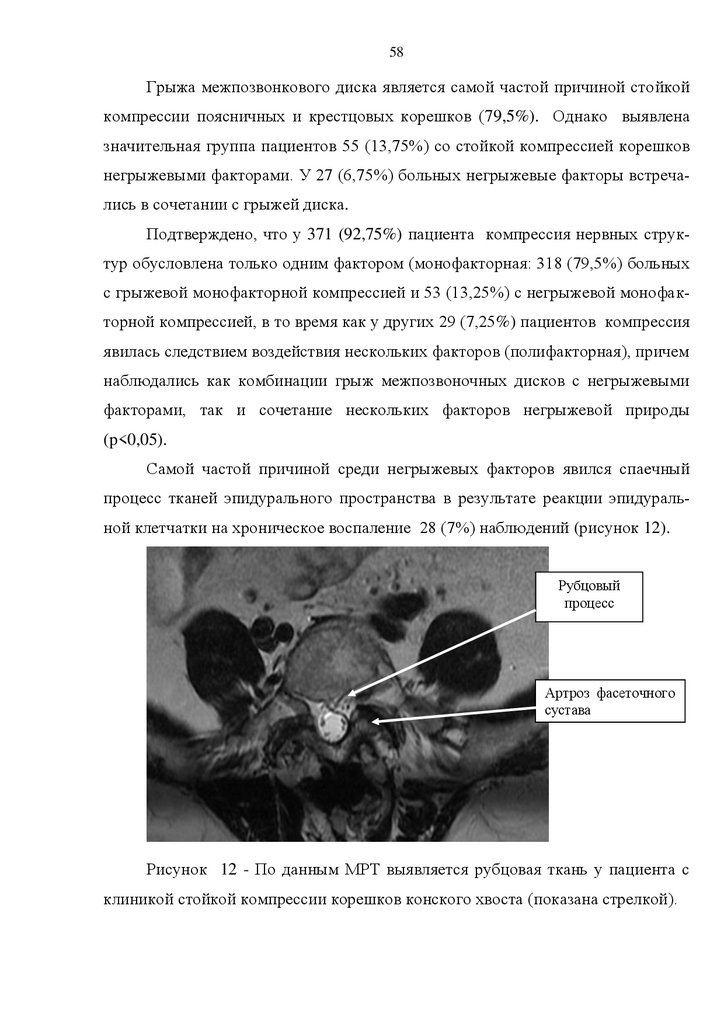
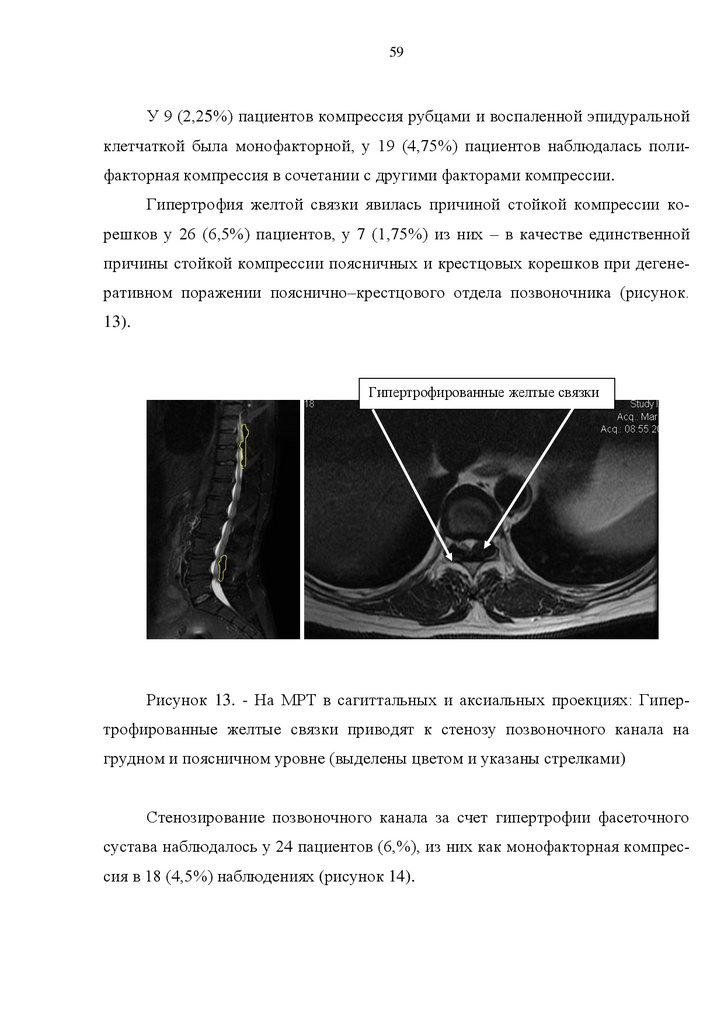
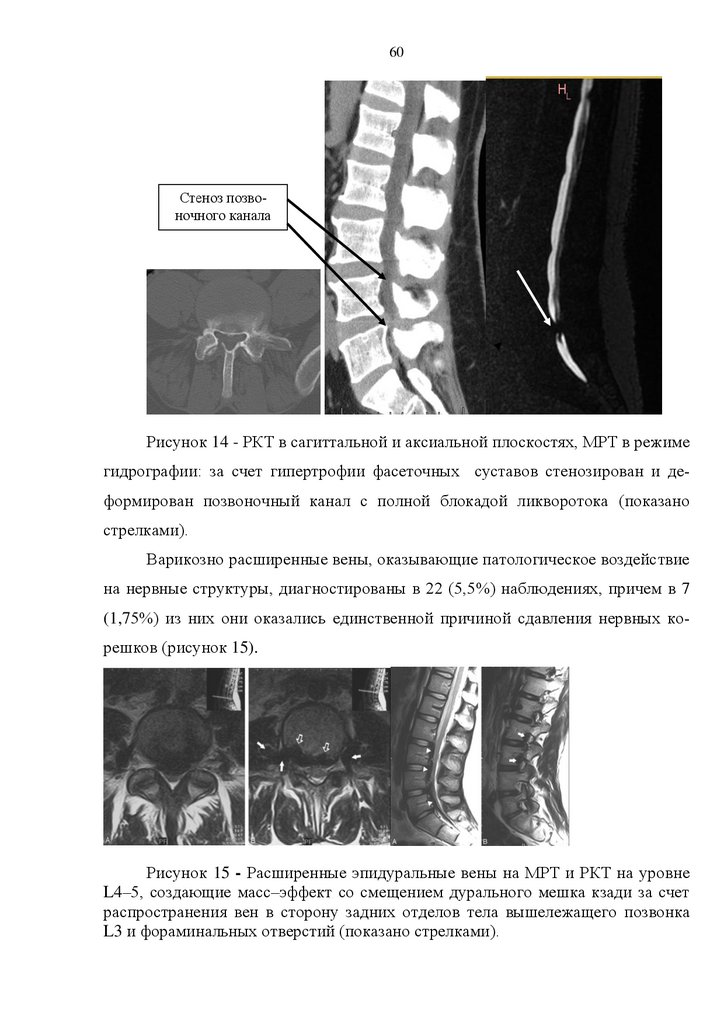
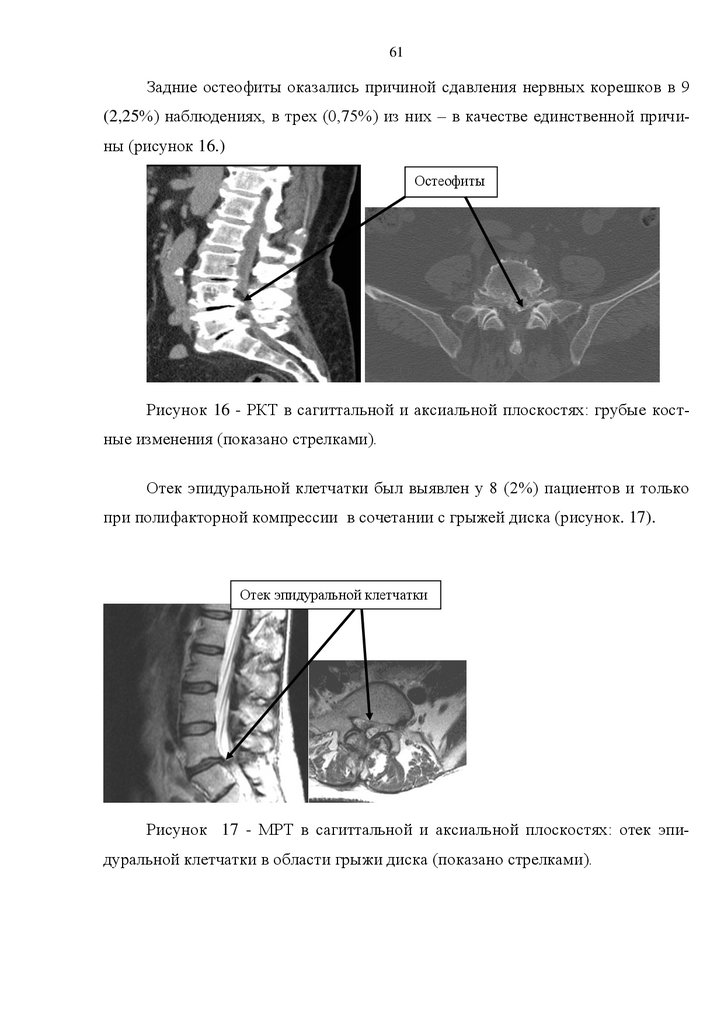
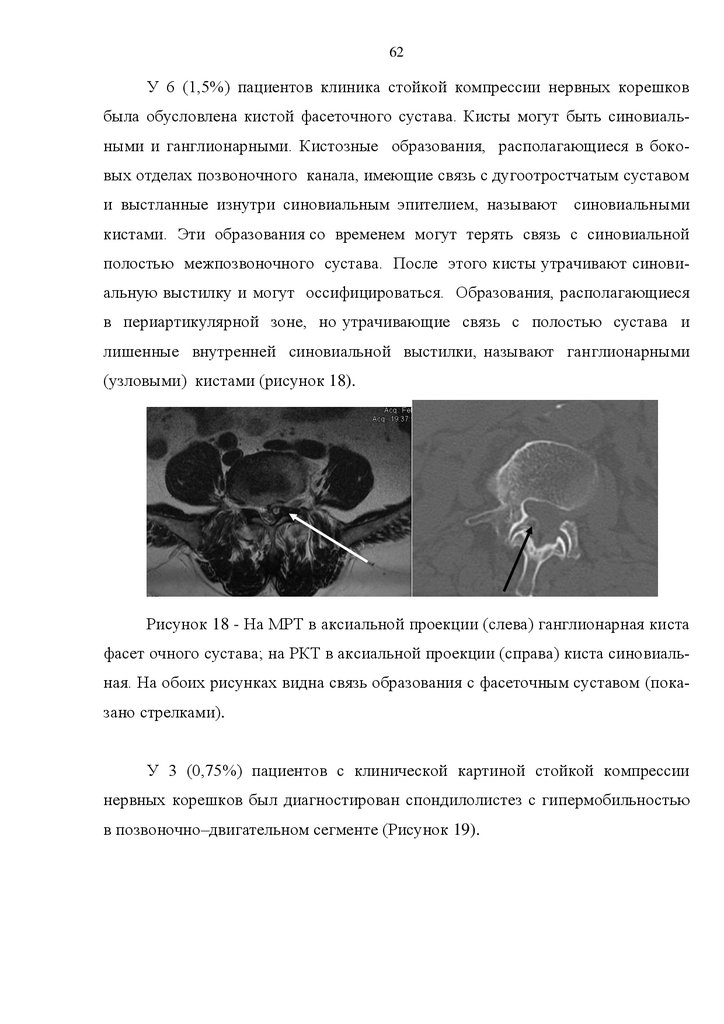

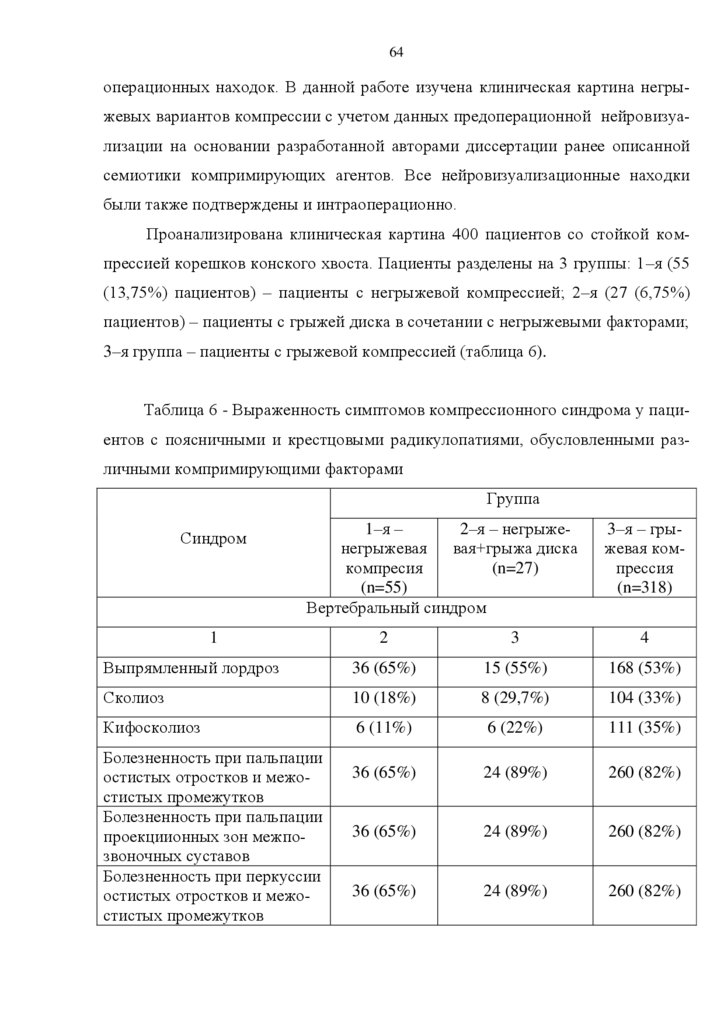




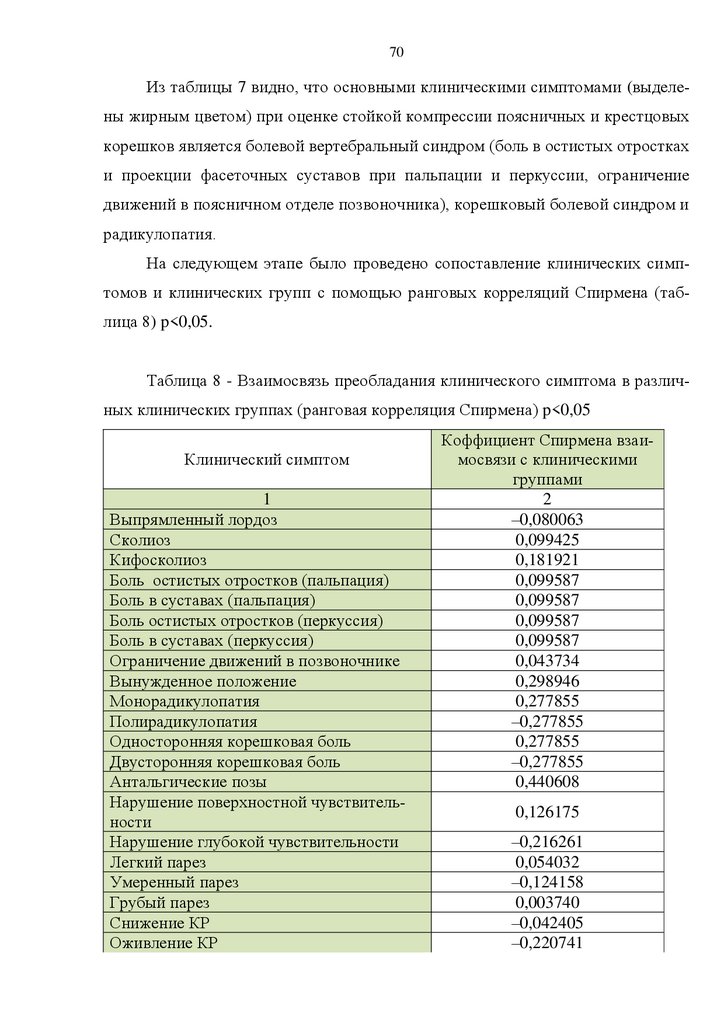


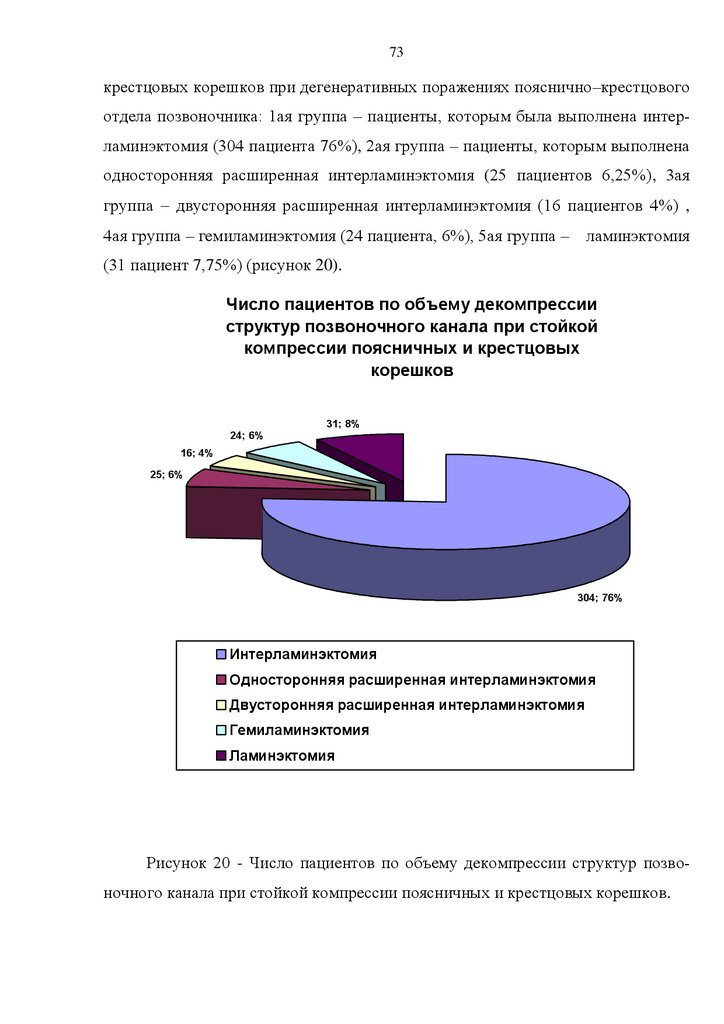

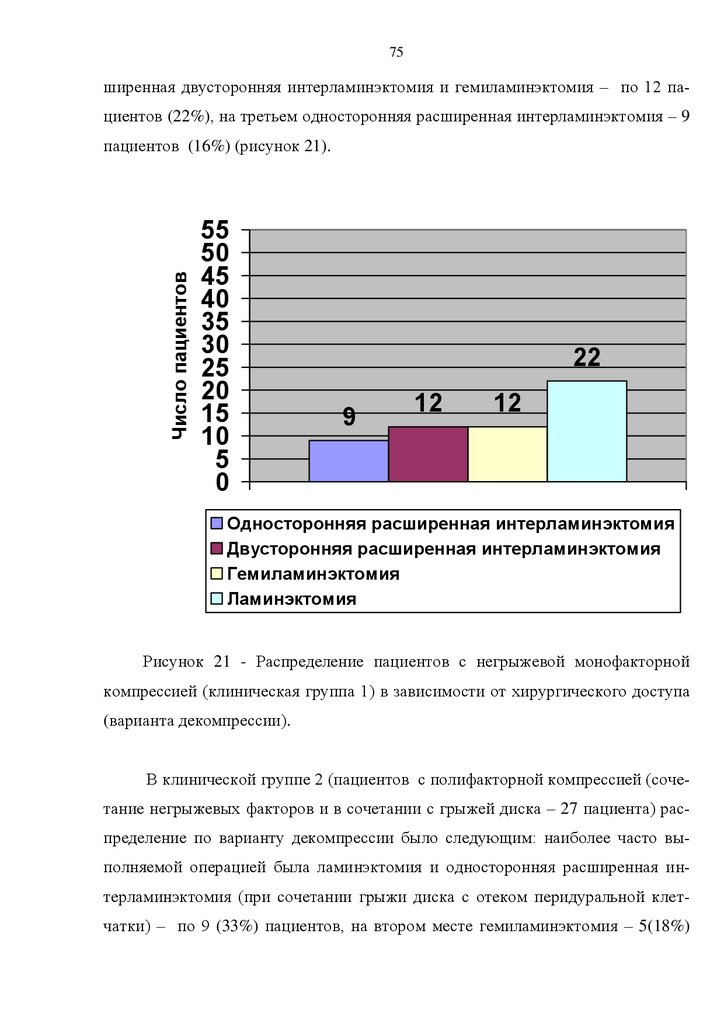
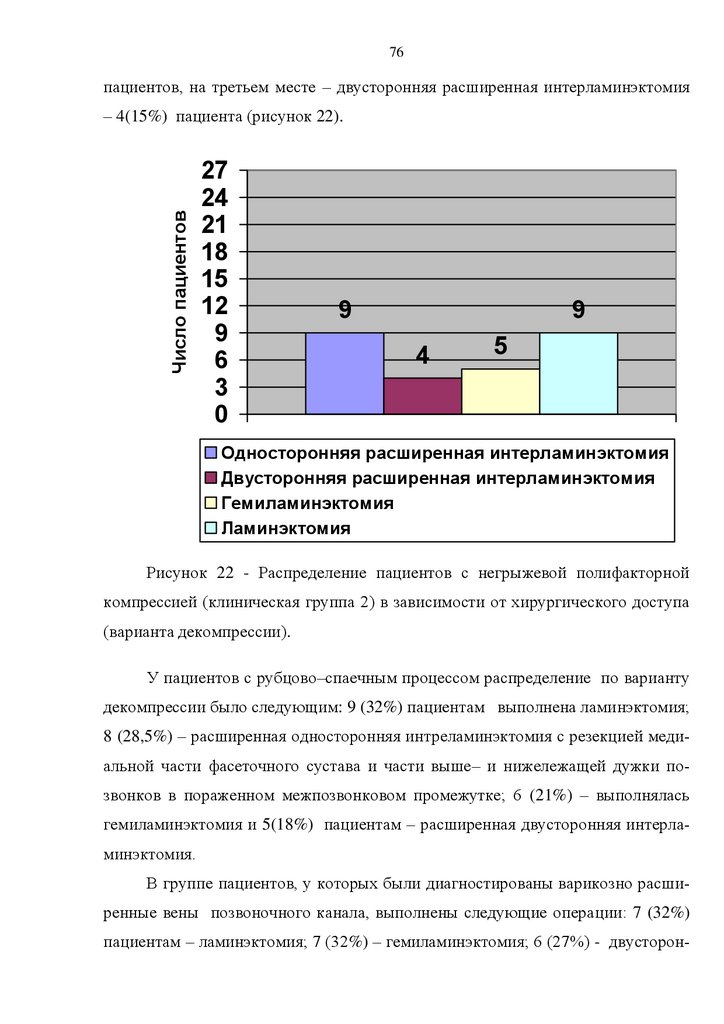





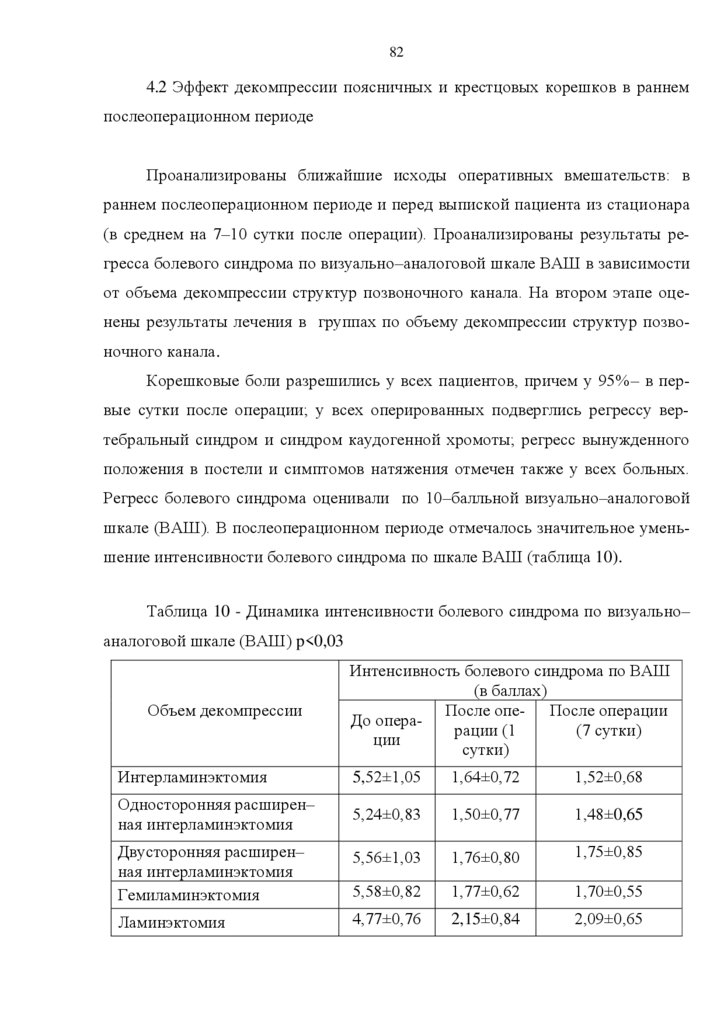

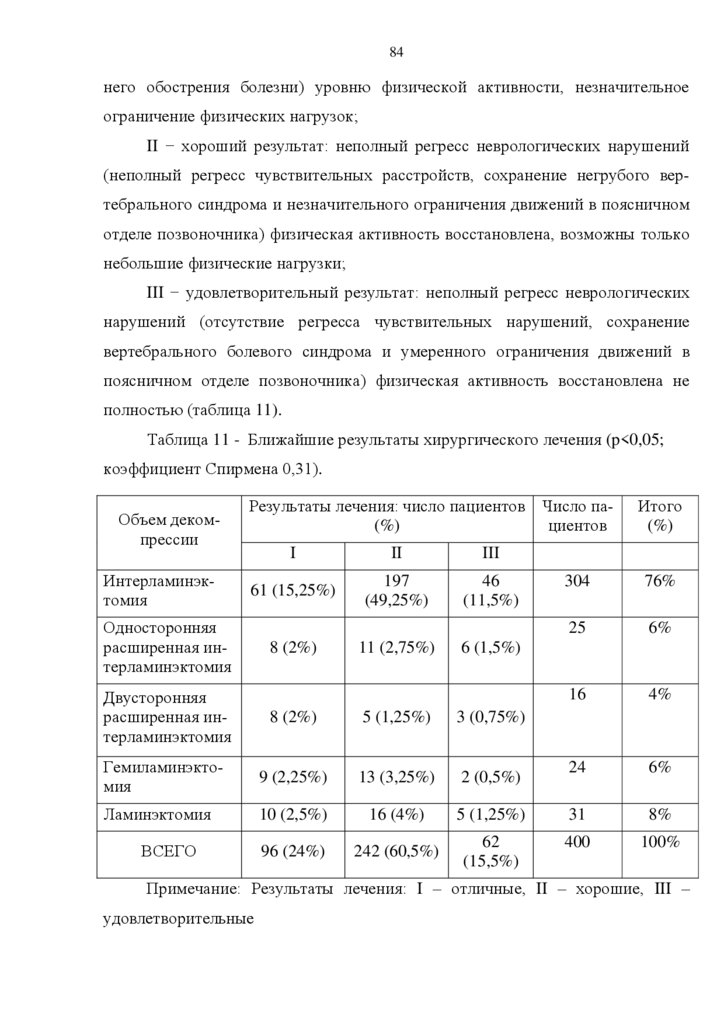













































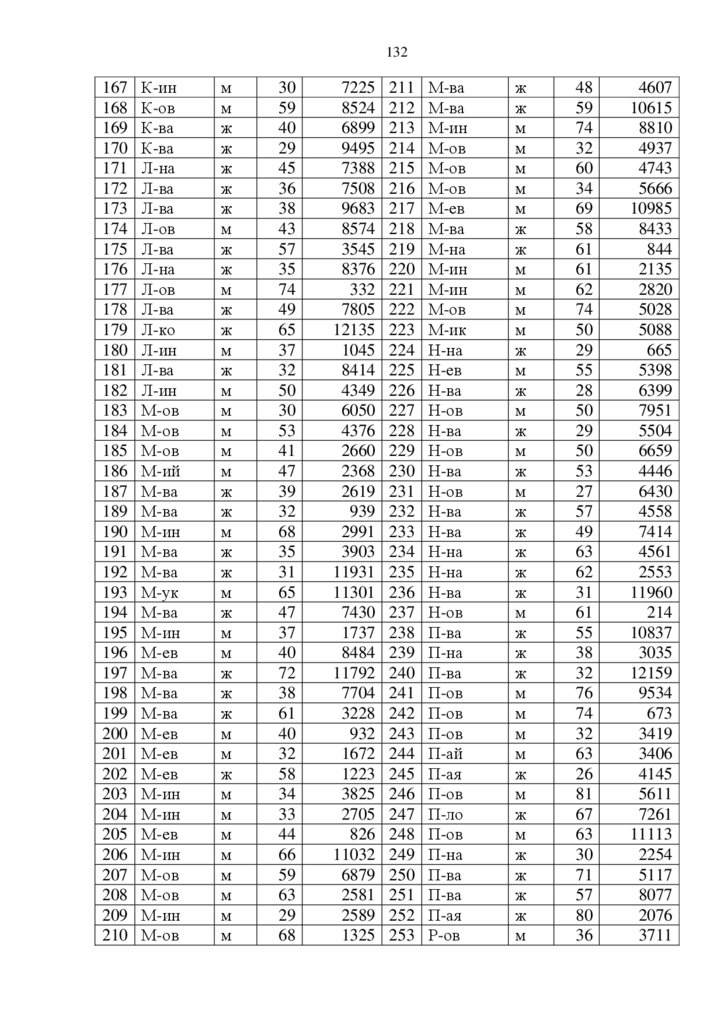
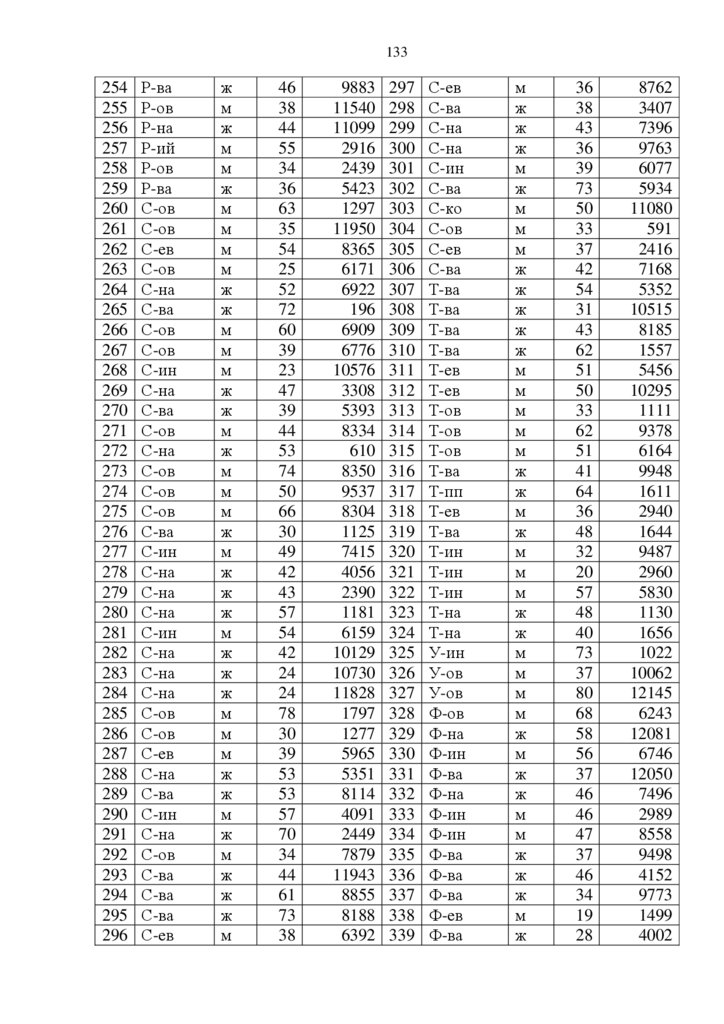
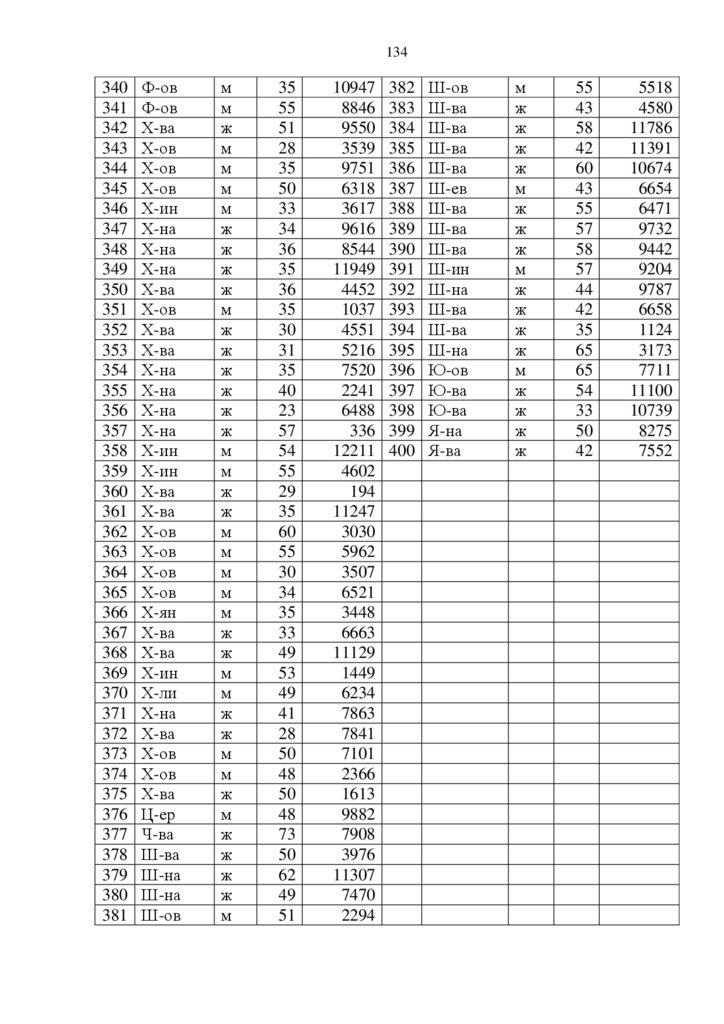
 medicine
medicine