Similar presentations:
Теплоносители и их свойства. Реальные газы. Уравнения состояний. Тройная точка воды. (Тема 5)
1. ТНиС 05
● Реальные газы● Уравнения состояний
● Тройная точка воды
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
1
2. Реальные газы
В реальных газах молекулы представляют собой упругиетела, имеют собственный объем и взаимодействуют между
собой.
Исторически первое уравнение состояния реальных газов
было получено Ван-Дер-Ваальсом.
Из уравнения состояния идеальных газов (Клапейрона)
pv=RT; v=RT/p,
то есть при p=∞: v=0,
что не соответствует действительности.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
2
3. К выводу уравнения Ван-Дер-Ваальса
Обозначим собственный объем молекул реального газабуквой b,
тогда:
v-b=RT/p,
то есть при p=∞: (v-b)
0; v
b,
где b – константа Ван-Дер-Ваальса.
Выразим из полученного уравнения давление
p=RT/(v-b)
и учтем взаимодействие между молекулами.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
3
4. Константа Ван-Дер-Ваальса
Давление – это результат ударов молекул о
стенки сосуда.
Притяжение других молекул ослабляет силу
удара молекулы на поправку Δp, которая пропорциональна
числу притягиваемых и притягивающих молекул,
то есть:
Δp=aρ2=a/v2,
где а – константа Ван-Дер-Ваальса.
C учетом этого:
p=RT/(v-b)-Δp=RT/(v-b)-a/v2.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
4
5. Уравнение Ван-Дер-Ваальса
Итак, уравнение состояния реальных газов Ван-Дер-Ваальса:( p a2 )(v b) RT
.
v
Ван-Дер-Ваальс учел только два фактора, отличающих
реальные газы от идеальных, поэтому его уравнение не очень
точное.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
5
6. Уравнение состояния реальных газов
Более точным является уравнение Вукаловича-Новикова, вкотором учтены дополнительно ассоциация (объединение в
многомолекулярные комплексы) и диссоциация
(раздробление) комплексов.
С учетом ассоциации и диссоциации 2-х молекулярных
комплексов уравнение Вукаловича-Новикова, имеет вид:
a
c
( p 2 )(v b) RT (1 (3 2m) / 2 )
v
vT
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
.
6
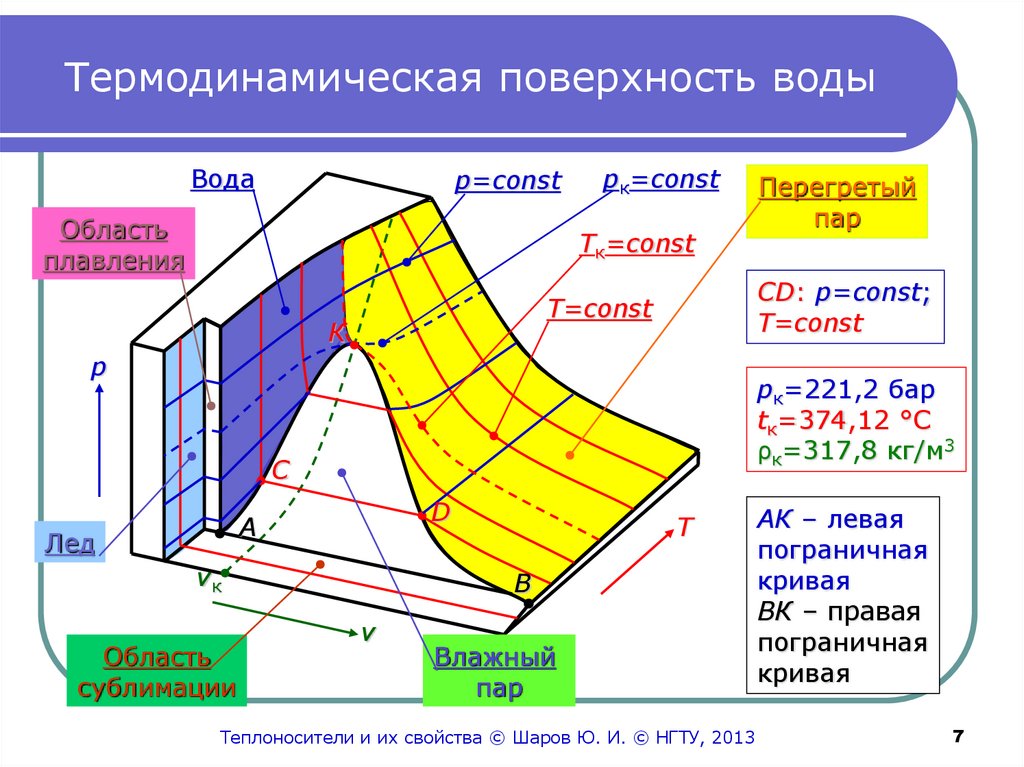
7. Термодинамическая поверхность воды
Водаp=const
Область
плавления
pк=const
Tк=const
СD: p=const;
T=const
T=const
К
р
рк=221,2 бар
tк=374,12 °С
ρк=317,8 кг/м3
С
D
А
Лед
vк
Область
сублимации
Перегретый
пар
Т
В
v
Влажный
пар
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
АК – левая
пограничная
кривая
ВК – правая
пограничная
кривая
7
8. Парообразование на поверхности воды (испарение)
Испарение – это парообразование на поверхностиводы,которое происходит при любой температуре.
Явление заключается в том, что молекулы воды с повышенной
кинетической энергией преодолевают силу притяжения
соседних молекул и вылетают в воздух.
Интенсивность испарения возрастает с увеличением
температуры воды, так как при этом растет кинетическая
энергия движения молекул и уменьшается сила
взаимодействия между ними.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
8
9. Воздушно-испарительное охлаждение
При вылете из воды самых быстрых молекул уменьшаетсясредняя кинетическая энергия движения молекул воды, то есть
температура воды падает.
Это так называемое воздушно-испарительное охлаждение
широко используется в технике (брызгальные бассейны,
градирни, барботажные теплообменники).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
9
10. Парообразование во всем объеме воды (кипение)
Когда вода нагрета до температуры кипения (насыщения),начинается парообразование во всем объеме (кипение).
При кипении температура воды остается постоянной.
Центрами парообразования являются шероховатости
поверхности нагрева, пылинки и пузырьки воздуха в воде.
С повышением давления растет температура кипения (вода
атмосферного давления кипит при температуре 100 °С).
Идеально чистая вода в сосуде с полированными стенками
может быть перегрета до температуры, превышающей
температуру кипения (нет центров парообразования).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
10
11. Конденсация пара. Насыщенный пар
При охлаждении пара происходит его конденсация, то естьпревращение пара в воду.
Образовавшаяся при этом вода называется конденсатом.
При парообразовании в закрытом сосуде часть молекул из
парового пространства могут снова вернуться в жидкость.
При динамическом равновесии: число молекул, вылетающих
из воды, равно числу молекул пара, возвращающихся в воду,
пар называется насыщенным.
Сухой насыщенный пар получается при переходе в пар всей
воды.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
11
12. Влажный насыщенный пар
При неполном испарении воды пар называется влажнымнасыщенным.
Массовая доля пара во влажном паре (смеси пара с
капельками воды) называется степенью сухости пара «х».
Для сухого насыщенного пара х=1.
Степень сухости пара х=0 соответствует воде на линии
насыщения (закипающей воде).
Если сухой насыщенный пар подогревать, он становится
перегретым с температурой t, степень перегрева которого
равна разности температур t-tн.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
12
13. Водяной пар
Водяной пар является рабочим телом паротурбинныхустановок (ПТУ).
Водяной пар – это реальный газ, состояние которого
можно описать уравнением состояния Вукаловича-Новикова.
Для удобства, состояния пара были просчитаны в большом
диапазоне параметров, а результаты представлены в виде
таблиц термодинамических свойств воды и пара и в форме
pv-, Ts-, hs-диаграмм.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
13
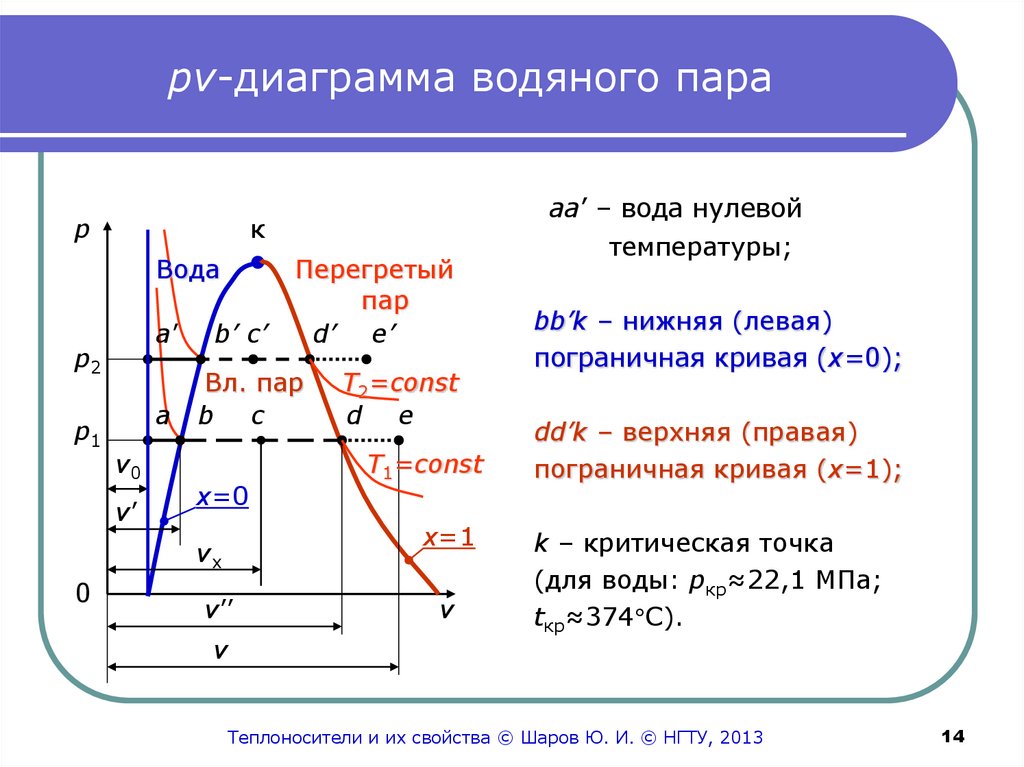
14. рv-диаграмма водяного пара
pк
Вода
a’
p2
p1
a
v0
v’
b’ c’
Перегретый
пар
d’ e’
Вл. пар
b c
x=0
T2=сonst
d e
T1=сonst
x=1
vx
0
aa’ – вода нулевой
v’’
v
v
температуры;
bb’k – нижняя (левая)
пограничная кривая (х=0);
dd’k – верхняя (правая)
пограничная кривая (х=1);
k – критическая точка
(для воды: pкр≈22,1 МПа;
tкр≈374 С).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
14
15. К pv-диаграмме
Слева от пограничной кривой – вода;между пограничными кривыми – влажный пар;
правее верхней пограничной кривой – перегретый пар.
На верхней пограничной кривой – сухой, насыщенный пар.
Точка а(v0) – вода нулевой температуры;
процесс ab – изобарный нагрев воды от 0 С до температуры
кипения (насыщения) tн;
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
15
16. Процессы и состояния воды и пара
точка b (v’; х=0) – вода на линии насыщения (закипающая);процесс bd – изобарно-изотермическое парообразование
(кипение воды) при tн=Const;
точка d (v”; х=1) – сухой, насыщенный пар;
точка c – влажный, насыщенный пар (х – степень сухости
пара: массовая доля пара во влажном паре);
процесс de – изобарный перегрев пара;
точка e (v) – перегретый пар.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
16
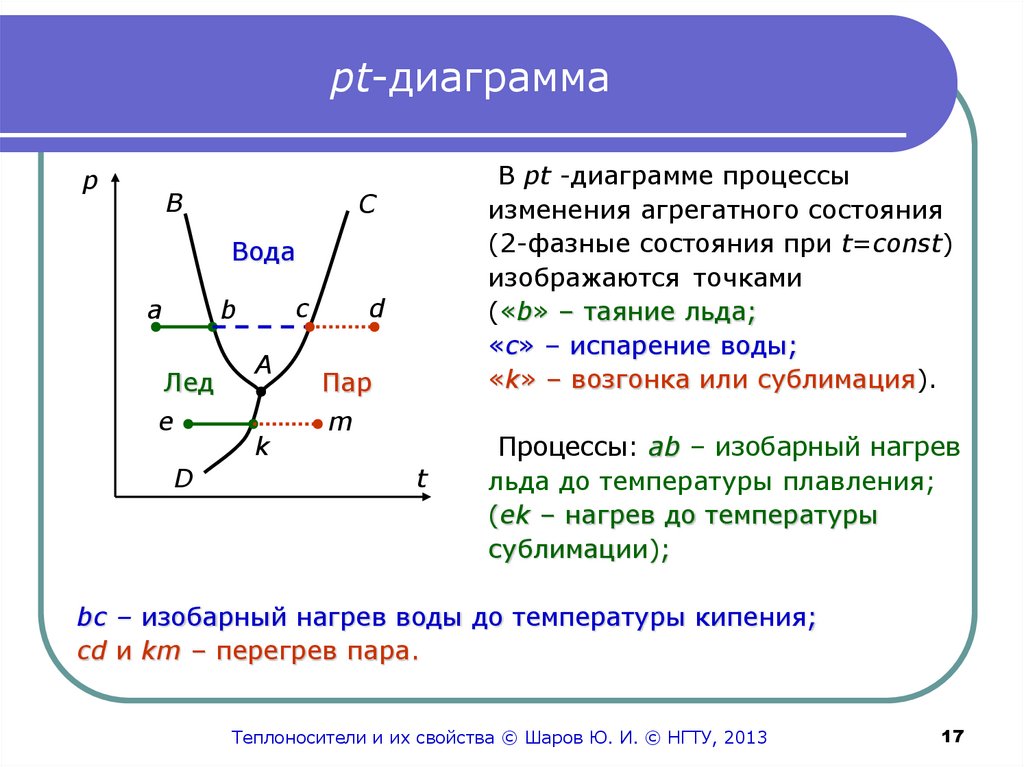
17. pt-диаграмма
рB
В pt -диаграмме процессы
изменения агрегатного состояния
(2-фазные состояния при t=const)
изображаются точками
(«b» – таяние льда;
«c» – испарение воды;
«k» – возгонка или сублимация).
C
Вода
a
c
b
Лед
e
A
k
D
d
Пар
m
t
Процессы: аb – изобарный нагрев
льда до температуры плавления;
(ek – нагрев до температуры
сублимации);
bс – изобарный нагрев воды до температуры кипения;
cd и km – перегрев пара.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
17
18. Тройная точка воды
Линия АВ – зависимость температуры плавления льда отдавления; она является границей твердой и жидкой фаз.
Линия АС – зависимость температуры кипения воды от
давления; она разделяет жидкую и газообразную фазы.
При снижении давления эти две линии сходятся в точке «А»,
которая называется тройной точкой воды (рА=613 Па; tA=0,0075
°С).
В тройной точке воды все три фазы воды (твердая, жидкая и
газообразная) находятся в состоянии равновесия.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
18
19. Возгонка или сублимация. Параметры состояния
Если лед нагревать при p<pA, то он сразу переходит в пар,минуя жидкое состояние (воду). Такой процесс называется
возгонкой или сублимацией.
Линия АD – зависимость температуры сублимации льда от
давления; она разделяет твердую и газообразную фазы.
Так как при практических расчетах находятся изменения
параметров состояния, а не их абсолютные значения, то за
начало отсчета калорических параметров состояния принята
температура 0 °С и соответствующее ей давление насыщения
рН=611 Па (u’0=0; h’0=0; s’0=0).
Индекс «‘» относится к воде на линии насыщения.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
19
20. Теплота нагрева воды до температуры насыщения
Для изобарного нагрева bc 1 кг воды от t0=0 °C до температурынасыщения (кипения) tн к ней надо подвести теплоту, Дж/кг:
(1)
q ' c ðâ(tí t0 ) c ðâtí
или из I закона термодинамики:
q ' u ' u '0 l '
.
(2)
Но u’0=0, а работа расширения воды при умеренных давлениях
ничтожна:
l ' p(v ' v ' ) 0 .
0
В изобарном процессе теплоту можно выразить также через
разность энтальпий:
,
(3)
0
то есть из (1…3) следует:
.
(4)
q' u ' h'
q ' h ' h ' h '
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
20
21. Изменение энтропии
Увеличение энтропии воды в изобарном процессе в интервалетемператур t=0…tн (Т=273…Тн) можно найти по формуле,
Дж/(кг·К):
Tí
dq Tí
dT
s s ' s '0
(c pâ )
T
273 T
273
.
(5)
При t0=0 °С (273 К) энтропия воды нулевой температуры
s’0=0, а теплоемкость воды срв=4187 Дж/(кг·К), тогда из (5)
энтропия воды на линии насыщения, Дж/(кг·К):
Tí
Tí
s ' c ðâ ln
4187ln
273
273
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
.
21
22. Парообразование
Изобарно-изотермическое парообразование происходитв точке «b», при этом теплота, затраченная на преобразование
1 кг воды в пар, называется скрытой теплотой парообразования;
по I закону термодинамики:
.
(6)
r u l (u " u ') l "
Здесь: u”-u’=ρ – внутренняя теплота парообразования,
пошедшая на изменение внутренней энергии;
l”=p(v”-v’)=ψ – внешняя теплота парообразования,
израсходованная на работу против внешних сил (на работу
расширения).
Таким образом:
r
.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
(7)
22
23. Энтальпия и энтропия воды и пара
В изобарном процессе r=h”-h’;значения энтальпий сухого насыщенного пара h” и воды на
линии насыщения h’ приведены в термодинамических таблицах,
а значения u”, ρ и ψ находятся по формулам (6…8).
Изменение энтропии в процессе парообразования:
r
s " s '
Tí
то есть:
s " s '
,
T
r
r
c ðâ ln í
Tí
273 Tí
(9)
.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
(10)
23
24. Влажный пар
Удельный объем влажного пара находится как для смеси водыи сухого насыщенного пара, м3/кг:
vx (1 x)v ' xv"
,
(11)
где х – степень сухости пара (массовая доля сухого насыщенного
пара во влажном паре).
Энтальпия влажного пара, Дж/кг:
hx h ' rx
;
(12)
.
(13)
энтропия влажного пара, Дж/(кг·К):
rx
sõ s '
Tí
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
24
25. Перегрев пара
Теплота перегрева пара до температуры Т, Дж/кг:q ñðï (Ò Òí )
,
(13)
где срп – средняя теплоемкость перегретого пара (в диапазоне
от Тн до Т, Дж/(кг·К).
Энтальпия перегретого пара, Дж/кг:
h h" q h ' r q h ' r c ðï (T Tí )
,
(14)
или по I закону термодинамики для изобарного процесса:
q h u l (u u ") p(v v")
.
(15)
Из выражения (15) можно найти внутреннюю энергию пара u.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
25
26. Энтропия перегретого пара
Изменение энтропии при перегреве пара, Дж/(кг·К):dq T dT
T
(s s ")
cð
c ðï ln
T
Tí
T T
T
T
í
,
(16)
.
(17)
í
откуда энтропия перегретого пара:
Tí
T
r
T
s s " c ðï ln c ðâ ln
c ðï ln
Tí
273 Tí
Tí
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
26
27. К Ts-диаграмме
Начало отсчета параметров состояния:внутренней энергии u0=0;
энтальпии h0=0;
и энтропии s0=0
принимаем при 0 С (273 К) – точка а.
Процесс abcde при p=const тот же, что был описан в
pv-диаграмме.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
27
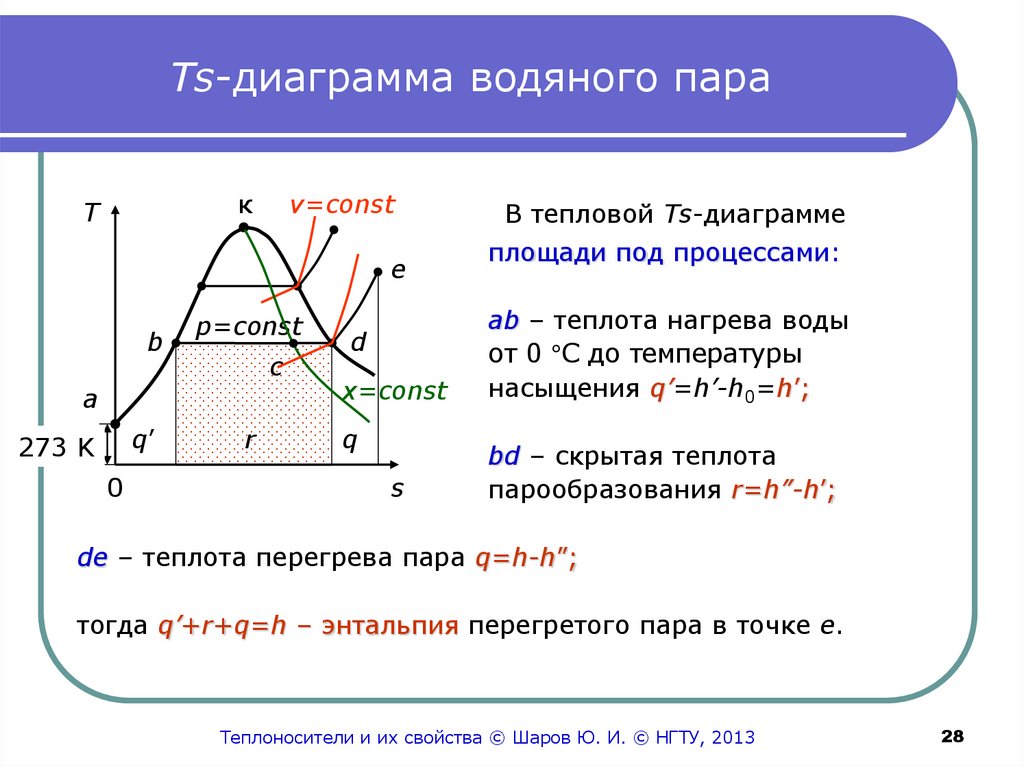
28. Ts-диаграмма водяного пара
кT
v=const
e
b
p=const
c
a
q’
273 K
0
r
d
x=const
q
s
В тепловой Ts-диаграмме
площади под процессами:
аb – теплота нагрева воды
от 0 С до температуры
насыщения q’=h’-h0=h’;
bd – скрытая теплота
парообразования r=h”-h’;
de – теплота перегрева пара q=h-h”;
тогда q’+r+q=h – энтальпия перегретого пара в точке е.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
28
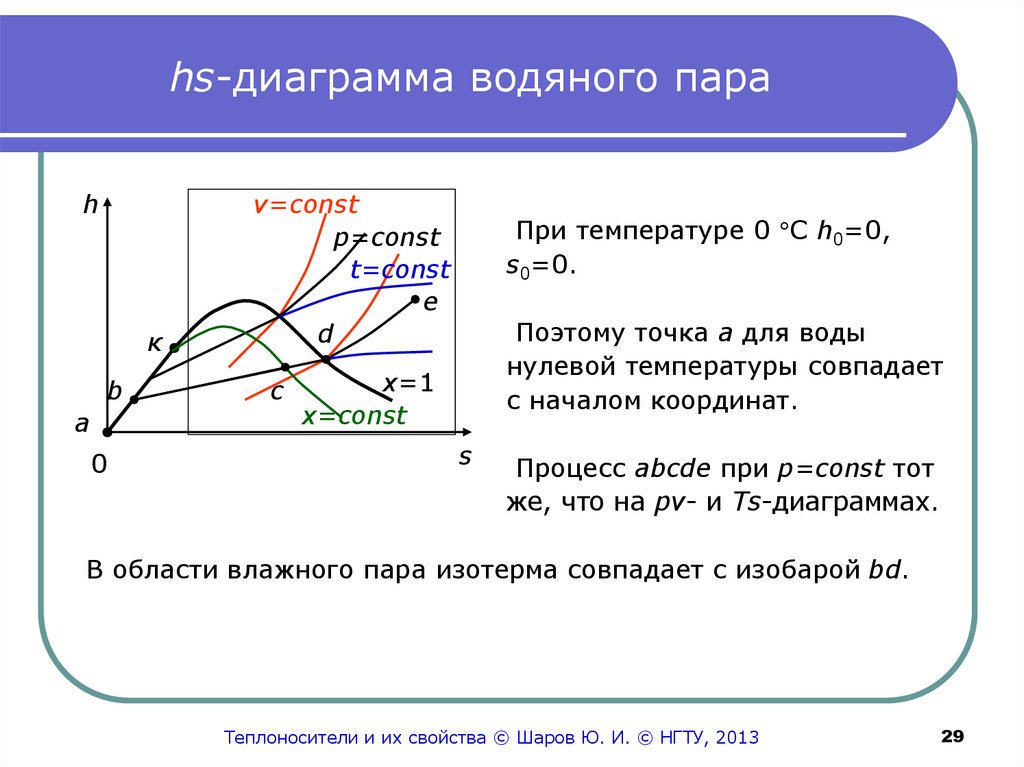
29. hs-диаграмма водяного пара
hк
b
a
0
v=const
p=const
t=const
e
d
c
При температуре 0 С h0=0,
s0=0.
Поэтому точка а для воды
нулевой температуры совпадает
с началом координат.
x=1
x=const
s
Процесс abcde при p=const тот
же, что на pv- и Ts-диаграммах.
В области влажного пара изотерма совпадает с изобарой bd.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
29
30. Расчеты процессов водяного пара
В практических расчетах обычно используются областиперегретого пара и влажного с высокими степенями сухости.
Поэтому изображается в большем масштабе выделенная
рамкой часть диаграммы.
Более точные расчеты процессов водяного пара выполняется
по таблицам.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
30
31. Таблицы термодинамических свойств воды и водяного пара
Бывают таблицы термодинамических свойств водына линии насыщения и сухого насыщенного пара:
(tн, v’, v”, h’, h”, r, s’, s”)=f(pн)
(pн, v’, v”, h’, h”, r, s’, s”),=f(tн)
где
pн, tн – давление и температура насыщения;
v, h, s – удельный объем, энтальпия и энтропия;
индексы ’, ” относятся к воде на линии насыщения и
сухому насыщенному пару.
Таблицы термодинамических свойств перегретого пара:
(v, h, s)=f (p, t).
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
31
32. Внутренняя энергия
В таблицах и диаграммах нет внутренней энергии воды и пара.Она находится через энтальпию, Дж/кг:
u’=h’-pv’;
ux=hx-pvx;
u”=h”-pv”;
u=h-pv,
где давление подставляется в Па.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
32
33. Влажный пар
Параметры состояния влажного пара находятся по смесевымформулам:
vx=v’(1-x)+v”x;
hx=h’(1-x)+h”x;
sx=s’(1-x)+s”x.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
33
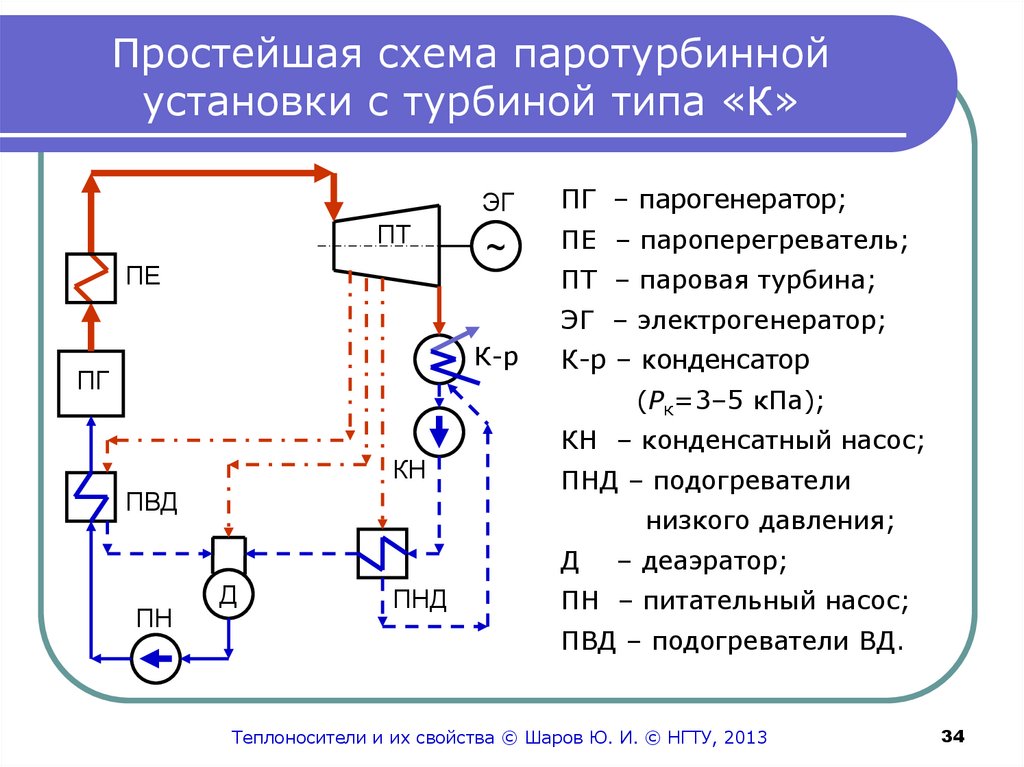
34. Простейшая схема паротурбинной установки с турбиной типа «К»
ПТПЕ
ЭГ
ПГ – парогенератор;
~
ПЕ – пароперегреватель;
ПТ – паровая турбина;
ЭГ – электрогенератор;
К-р
ПГ
К-р – конденсатор
(Pк=3–5 кПа);
КН – конденсатный насос;
КН
ПВД
ПНД – подогреватели
низкого давления;
Д
ПН
Д
ПНД
– деаэратор;
ПН – питательный насос;
ПВД – подогреватели ВД.
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
34
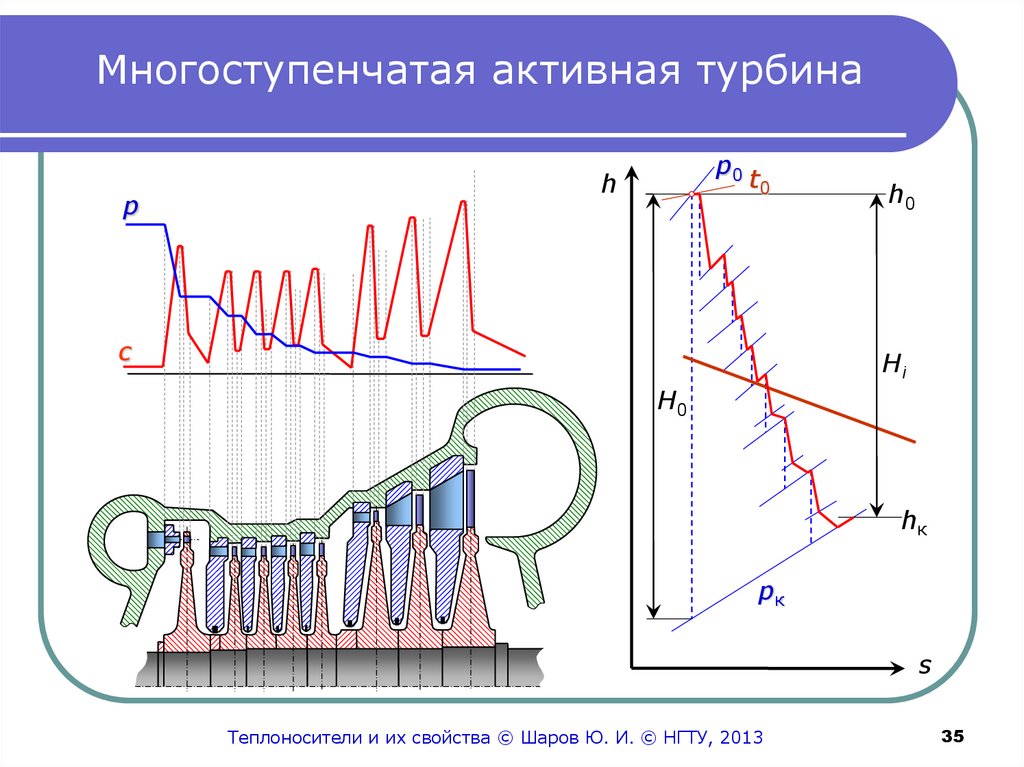
35. Многоступенчатая активная турбина
pp0
h
t0
с
h0
Hi
H0
hк
pк
s
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
35
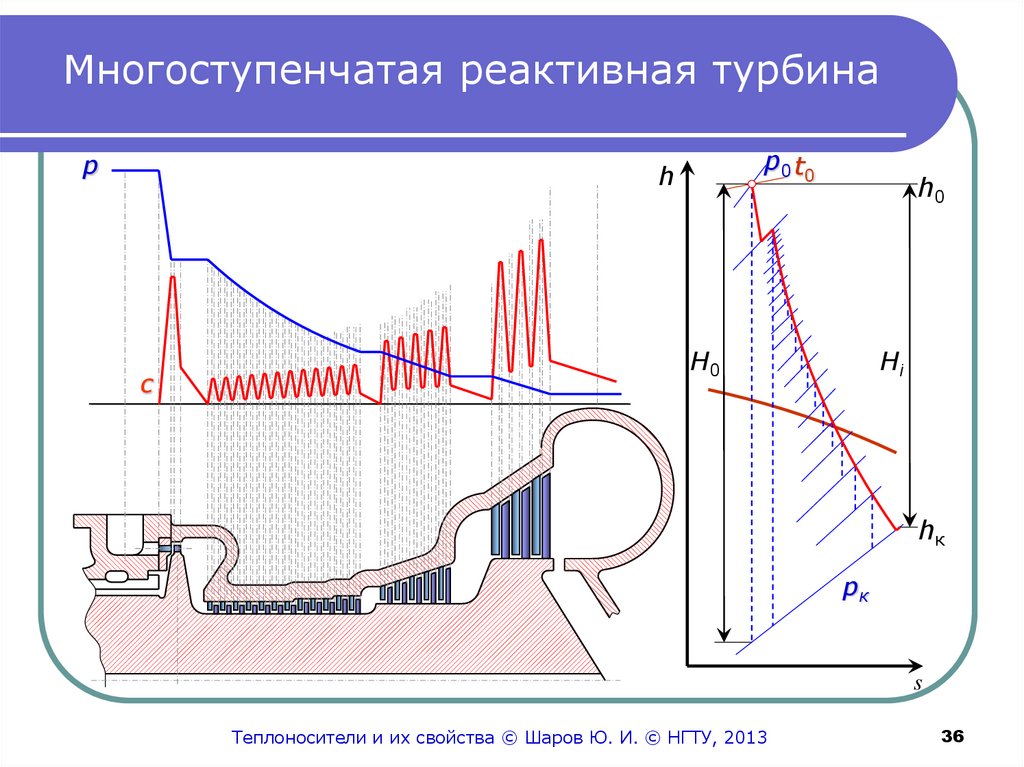
36. Многоступенчатая реактивная турбина
pp0 t0
h
с
h0
H0
Hi
hк
pк
s
Теплоносители и их свойства © Шаров Ю. И. © НГТУ, 2013
36




























 physics
physics