Similar presentations:
Многоядерные ароматические углеводороды
1. Тема: Многоядерные ароматические углеводороды
Министерство науки и высшего образования РФФГБОУ ВО
«Самарский государственный технический университет»
Химико-технологический факультет
Кафедра органической химии
Органическая химия
Направление подготовки
18.03.01 «Химическая технология»
04.03.02 «Химия, физика и механика
материалов»
Тема: Многоядерные ароматические углеводороды
Преподаватель: д.х.н., профессор Климочкин Ю.Н.
Самара
2.
Дифенил (бифенил)3м
2o
4п
2' о'
3' м'
4' п'
1 1'
5
6
6'
5'
CH3
tпл=70оС, tкип=246оС.
NO 2
3-нитро-4'-метилдифенил
23
3.
Способы получения:А)
Fe
+
o
800 C
82%
18%
терфенил
Б) Реакция Вюрца:
Br
2
+ 2Na
+ 2NaBr
33
4.
Способы получения:CH3
В) Реакция Ульмана:
CH3
2
Cu (пудра)
I
H3C
ArI > ArBr >> ArCl
Г) Реакция Гомберга-Бахмана:
+
N2 Cl
+
CH3
+ N2 + NaCl
+ NaOH
H3C
43
5.
Атропоизомерия (поворотная),зеркальные изомеры:
Поворот на 45° в бифениле.
53
6.
Реакции электрофильного замещения2HNO 3
O 2N
NO 2
Ph - заместитель первого рода
63
7.
Дифенилметанtпл=27оС, tкип=262оС
Запах
апельсиновых
корок.
Применяется как растворитель для
красителей и в парфюмерной
промышленности.
6
6'
5'
1'
4'
3'
2'
5
1
4
2
3
73
8.
Способы получения1.
o
+ ClCH2Cl +
2.
CH 2Cl
+
t
AlCl3
AlCl 3
83
9.
Способы получения3.
H
2
+
O
H2SO4
+ H2O
H
4.
CH 2OH
+
ZnCl 2
+ H2O
93
10.
Химические свойстваОкисление
O
H2CrO 4
o
Pt, 300 C
флуорен
10
3
11.
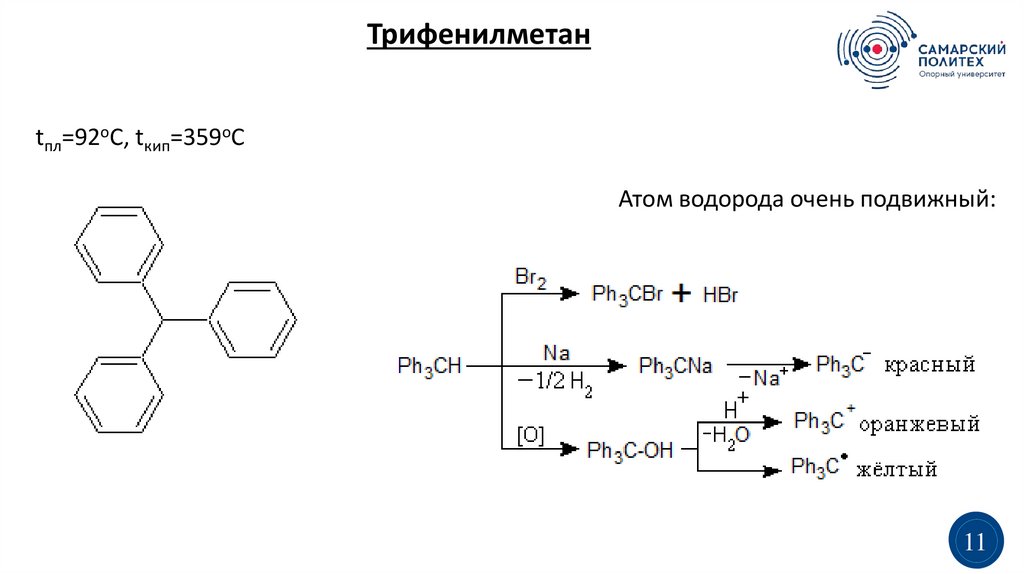
Трифенилметанtпл=92оС, tкип=359оС
Атом водорода очень подвижный:
11
3
12.
Делокализация12
3
13.
Изменение окраски фенолфталеина+
Na O
HO
-
OH
2 NaOH, OH
O
-
O
+
H
COONa
O
бесцветный
малиновый
pH = 8,2-10,0
При рН>12 снова бесцветный.
13
3
14.
Способы получения1.
2.
CHCl 3 + 3
PhCHCl 2 + 2
AlCl 3
Ph3CH + 3HCl
AlCl 3
Ph3CH
14
3
15.
Способы полученияOH
+
3.
4.
3
+ CCl 4
AlCl 3
ZnCl 2
Et 2O
Ph3CCl
AlCl 3
Ph3CH
Ph3CH
15
3
16.
Получение димедролаOH
ClCH 2CH 2N(CH 3)2
CH3
HCl
HCl
N
O
CH3
бензгидрол
CH3
HCl
N
O
CH3
HCl
димедрол
16
3
17.
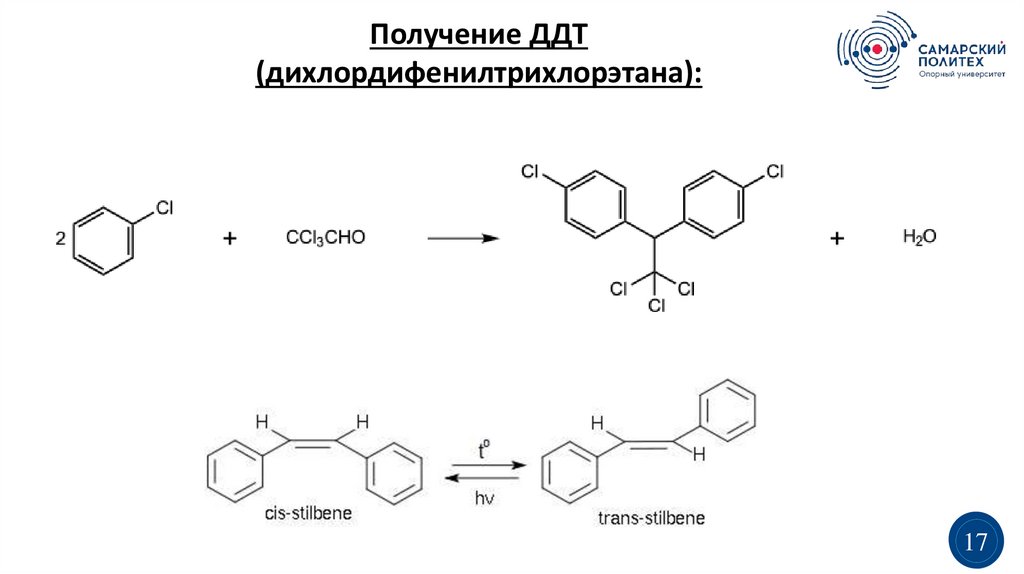
Получение ДДТ(дихлордифенилтрихлорэтана):
17
3
18.
Ароматические углеводороды с конденсированнымиядрами. Нафталин.
Два ароматических кольца, имеющих два общих углеродных атома,
называются конденсированными.
Простейший представитель ароматических соединений с двумя
конденсированными ядрами - нафталин.
Нафталин (С10Н8)
Белое кристаллическое вещество с
т. пл. 80°С, т. кип. 218°С, легко
возгоняется, обладает характерным
запахом.
18
3
19. Промышленным источником получения является каменноугольная смола и продукты пиролиза нефти (фр. 180-230С). Синтетически
Способы полученияПромышленным источником получения является каменноугольная смола и продукты
пиролиза нефти (фр. 180-230 С).
Синтетически нафталин может быть получен следующими способами:
1. При пропускании паров бензола и ацетилена над нагретым углем при 400 С:
2. Дегидрогенизацией гомологов бензола, содержащих в боковой цепи не менее четырех
атомов углерода:
CH2
CH2 Pt, 300 °C
+ 3 H2
CH2
CH3
4
20.
Способы полученияИз стирилуксусной кислоты:
CH
CH
CH2
C
O OH
Zn
Pt, 300 °C
O
-нафтол OH
Варианты диенового синтеза:
19
3
21.
Строение и свойстваРаспределение электронной плотности неравномерное, длины связей
разные.
Есопр = 61 ккал/моль
в бензоле — 72 ккал/моль
20
3
22.
ИзомерияДля монозамещенных нафталинов возможны два изомера – и .
Для дизамещенных возможно уже 10 изомеров. По систематической
номенклатуре положение заместителей обозначают цифрами. Для некоторых
дизамещенных сохранились названия и по рациональной номенклатуре.
21
3
23.
Химические свойстваНафталин - ароматическим соединением, по своим свойствам
напоминающим бензол. Устойчив к реакциям присоединения, характерным
для ненасыщенных соединений.
Для нафталина типичны реакции электрофильного замещения.
Связи 1, 2 и 3, 4 в нафталине несколько аналогичны сопряженной системе в
1,3-бутадиене. Это находит отражение в активности α - положений к
электрофильным реагентам и в реакциях присоединения.
При вступлении электрофильного реагента в α - положение возникающий σ комплекс более энергетически выгоден в сравнении с σ - комплексом,
образующимся при атаке - положения.
E
H
+
1
2
E
E
3
4
+
H
7
24.
Химические свойства1. Галогенирование (без катализатора!) и нитрование:
Нафталин вступает в реакции
замещения легче бензола.
Заместители почти всегда
вступают в α - положение.
22
3
25.
Химические свойства2. Сульфирование на направление замещения оказывает влияние
температура:
23
3
26.
3. Ацилирование по Фриделю-Крафтсу:в зависимости от растворителя приводит к α- или β-изомеру
COCH3
C2H2Cl4
+ H3C C
O AlCl
3
Cl
C6H5NO2
-ацетилнафталин
COCH3
-ацетилнафталин
10
27.
Ориентация электрофильного замещения в нафталинеКак и в случае ряда бензола, заместители в нафталиновом кольце
оказывают влияние на вступление электрофильной частицы.
1. Электронодонорный заместитель в α - положении ориентирует новый
заместитель в то же кольцо в положение 4:
R
R = CH3, OH и т.д.
SE
12
28.
2. Если такой заместитель находится в β - положении, то ориентацияпроисходит в орто - положение (α):
SE
R
R = CH3, OH и т.д.
Если в одном из колец находится электроноакцепторный заместитель, то
такое кольцо дезактивируется к электрофильному замещению и новая
электрофильная частица вступает во второе кольцо:
Y
Y
13
29.
Химические свойства4. Окисление нафталина кислородом воздуха в присутствии
V2O5 приводит к разрушению одного кольца:
24
3
30.
Химические свойства5. Восстановление: реакции присоединения протекают легче,
чем для бензола
Na, 78°C
C2H5OH
+
1,4-дигидронафталин 1,2-дигидронафталин
Na, 132°C
C5H11OH
тетралин
H2
катализатор
декалин
25
3
31.
Антраценtпл=216°С, плоский. По своим свойствам относится к ароматическим соединениям.
Для монозамещённых существует три изомера
26
3
32.
Способы получения1. Из каменноугольной смолы
2. Реакция Фриделя-Крафтса:
27
3
33.
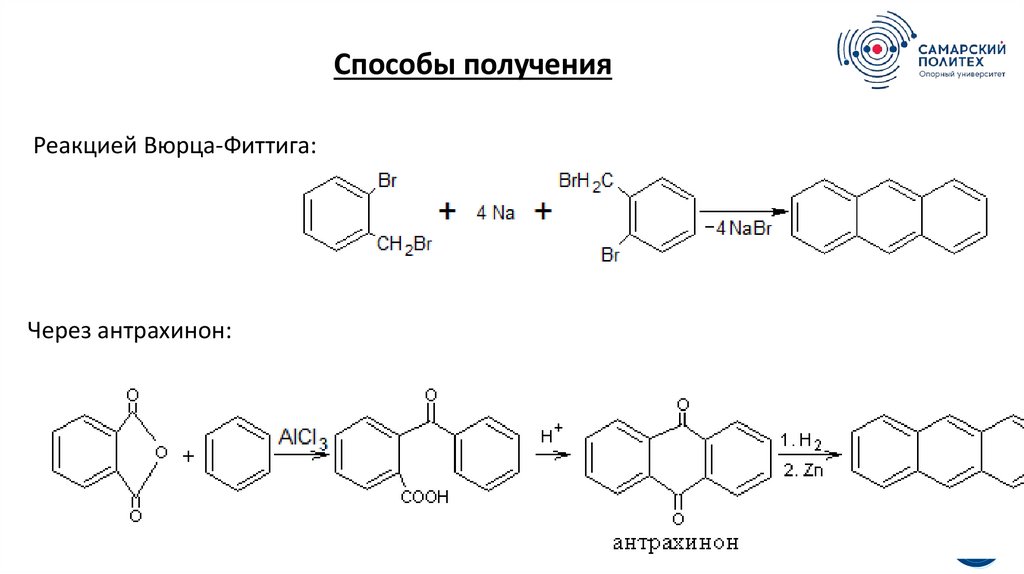
Способы полученияРеакцией Вюрца-Фиттига:
Через антрахинон:
28
3
34.
Химические свойства. Присоединение в 9 и 10положения.
Характерна еще большая непредельность, чем для нафталина. Наиболее
активными являются положения 9, 10
Галогенирование:
Гидрирование:
29
3
35.
Химические свойства. Присоединение в 9 и 10положения.
3. Окисление: антрацен еще менее устойчив к реакциям окисления и
восстановления, чем нафталин. Окисляется до 9, 10 хинонов,
4. Реакция Дильса-Альдера:
30
3
36.
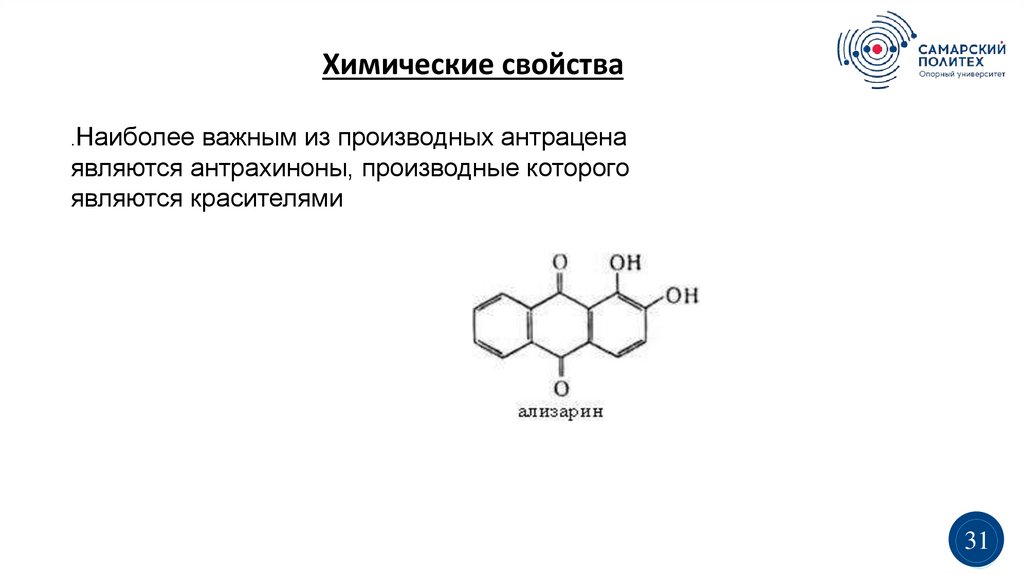
Химические свойства.Наиболее
важным из производных антрацена
являются антрахиноны, производные которого
являются красителями
31
3
37.
Фенантренtпл=100°С
32
3
38.
Химические свойства. Реакции по положению 9, 10Фенантрен, так же, как и антрацен, легко присоединяет в положение 9,10.
33
3
39.
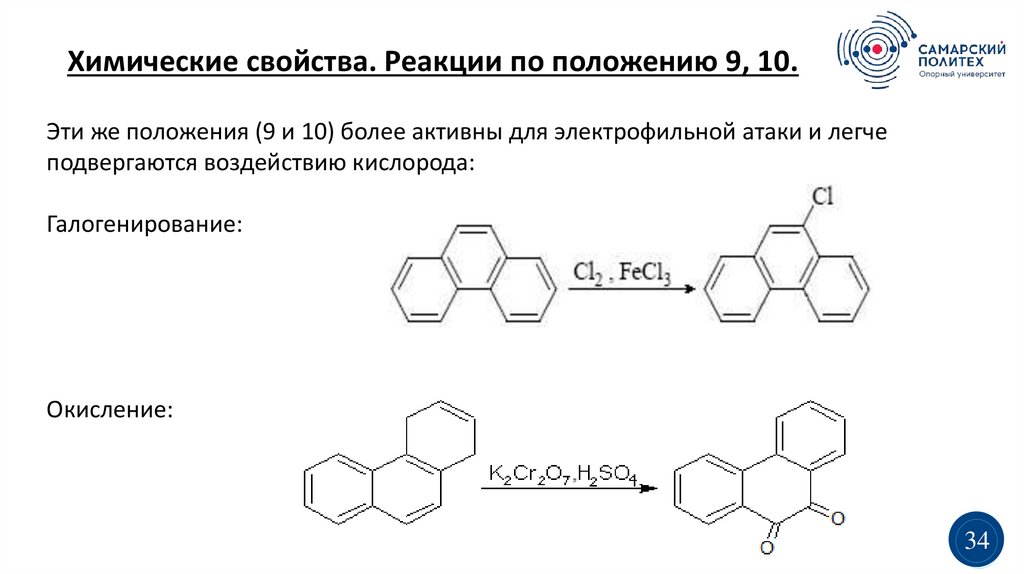
Химические свойства. Реакции по положению 9, 10.Эти же положения (9 и 10) более активны для электрофильной атаки и легче
подвергаются воздействию кислорода:
Галогенирование:
Окисление:
34
3
40.
Полиядерные ареныЛинейные:
35
3
41.
Полиядерные ареныАнгулярные:
36
3
42.
Полиядерные ареныПолностью конденсированные:
37
3





































 chemistry
chemistry