Similar presentations:
Разбор задач 34 и 35. ЕГЭ-2020
1.
ЕГЭ-2020Разбор задач 34 и 35
2.
Задача 34Железную пластину полностью растворили в 500 г раствора
азотной кислоты. При этом выделилась смесь оксида азота(II) и
оксида азота (IV) общим объемом 20,16 л. Соотношение атомов
кислорода к атомам азота в этой газовой смеси соответственно
равно 5:3. Вычислите массовую долю соли в полученном растворе.
3.
РешениеFe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2↑ + 3H2O
4Fe + 18HNO3 → 4Fe(NO3)3 + 3NO2+ 3NO + 9H2O ???
N
O
х моль х моль
NO
х моль
у моль 2у моль
NO2 у моль
ν (смеси газов) = 20,16/22,4=0,9 моль
х + у = 0,9
N(O)/N(N)=5/3
ν(O)/ν(N)= 5/3
x+2у/x+y =5/3
так как ν=N/Na =>
4.
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2OFe + 6HNO3 → Fe(NO3)3 + 3NO2↑ + 3H2O
x + y = 0,9
5(x+y) = 3(x+2y)
ν (NO) = 0,3 моль
ν (NO2) = 0,6 моль
x + y = 0,9
5x+5y = 3x+6y
x + y = 0,9
2x = y
x = 0,3
y = 0,6
4Fe + 18HNO3 → 4Fe(NO3)3 + 3NO2+ 3NO + 9H2O ???
ω(Fe(NO3)3) = m(Fe(NO3)3)/mр-ра*100% ω(Fe(NO3)3) = 121/491,4*100%=24,6 г
m(Fe(NO3)3) = ν(Fe(NO3)3)*M(Fe(NO3)3) = (0,3 + 0,2)*242 = 121 г
mр-ра = m(Fe) + mр-ра(HNO3) – m(NO) – m(NO2) = (0,3 + 0,2)*56 + 500 –
0,3*30 – 0,6*46 = 28 + 500 - 9 -27,6 = 491,4 г
5.
Задача 34Пероксид бария внесли в холодный раствор серной кислоты, при
этом оба вещества прореагировали полностью. В полученном
растворе соотношение числа атомов водорода к числу атомов
кислорода составляет 9:5. В этот раствор добавили каталитическое
количество MnO2, и его масса уменьшилась на 6,4 г. Определите
массовую долю кислоты в исходном растворе.
6.
РешениеBaO2 + H2SO4 → BaSO4↓+ H2O2 (холодный раствор!!!)
2H2O2 → 2H2O + O2↑ (катализатор MnO2)
Какие вещества находятся в растворе после взаимодействия BaO2 с
раствором H2SO4?
H2O2 и H2O
H2O2 х моль
H2 O у моль
H
2х моль
2у моль
O
2х моль
у моль
N(H)/N(O)=9/5 так как ν=N/Na =>
ν(H)/ν(O)= 9/5
2x+2у/2x+y =9/5
10x+10y = 18x + 9y
y=8x
7.
BaO2 + H2SO4 → BaSO4↓+ H2O2 (холодный раствор!!!)2H2O2 → 2H2O + O2↑ (катализатор MnO2)
Добавление катализатора приводит к разложению H2O2. И масса
раствора уменьшается за счёт того, что улетучивается кислород.
m(O2) = 6,4 г
ν(O2) = m(O2)/ M(O2) = 6,4/32 = 0,2 моль.
ν(H2O2) = 0,2*2 = 0,4 моль (по уравнению)
H2O2 0,4 моль
H2O2 х моль
y=8x
H2 O 0,4*8 =3,2 моль
H2 O у моль
H2SO4 0,4 моль (по уравнению)
ω(H2SO4) = m(H2SO4)/m(р-ра)*100% ω(H2SO4) = 39,2/96,58*100% = 40,5%
m(H2O) = ν(H2O)*M(H2O) = 3,2*18 = 57,6 г
m(H2SO4) = ν(H2SO4)*M(H2SO4) = 0,4*98 = 39,2 г
m(р-ра) = m(H2O) + m(H2SO4) = 57,6 + 39,2 = 96,8 г.
8.
Задача 34Смесь твёрдых сульфата железа (II) и сульфата железа (III), в
которой соотношение атомов серы и железа 4:3, добавили в
подкисленный 5% раствор перманганата калия массой 126,4 г. Все
вещества, участвовавшие в окислительно-восстановительной
реакции, прореагировали полностью. Рассчитайте максимальную
массу 20%-го раствора гидроксида натрия, который прореагирует с
полученным раствором.
9.
Решение10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
MnSO4 + 2NaOH → Mn(OH)2↓ + Na2SO4
m(KMnO4) = mр-ра*ω (KMnO4) = 126,4*0,05 = 6,32 г
ν (KMnO4) = m(KMnO4)/M(KMnO4) = 6,32/158 = 0,04 моль
ν(FeSO4) = 5*ν(KMnO4) = 5*0,04 = 0,2 моль
N(S)/N(Fe)=4/3 так как ν=N/Na =>
Пусть в исх. смеси Fe
S
ν(S)/ν(Fe)= 4/53
FeSO4
0,2 моль 0,2 моль 0,2 моль 0,2+3x/0,2+2x =4/3
Fe2(SO4)3 x моль 2x моль 3x моль 0,8+8x = 0,6 + 9x
x=0,2
10.
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2OFe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
MnSO4 + 2NaOH → Mn(OH)2↓ + Na2SO4
В исх. смеси
FeSO4
0,2 моль
Fe2(SO4)3 0,2 моль
После окисления KMnO4
Fe2(SO4)3 0,1 моль (по 1 уравнению)
Fe2(SO4)3 0,2 моль (из исх. смеси)
ν(MnSO4) = 0,2/5 = 0,04 моль (по 1 уравнению)
ν(NaOH) = (0,2+0,1)*6 + 0,04*2 = 1,88 моль (по 2 и 3 уравнению)
m(р-ра) = m(NaOH)*100%/ω(NaOH)
m(NaOH) = 1,88*40 = 75,2 г
m(р-ра) = 75,2*100%/20% = 376 г
11.
Задача 34Через 292,5 г 20%-ного раствора хлорида натрия пропускали
электрический ток до тех пор, пока масса раствора не уменьшилась
на 80 г. К образовавшемуся раствору добавили 13 г цинка.
Определите массовую долю воды в полученном растворе и массу
газов, выделившихся на аноде.
12.
Решение2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
m(NaCl) = m(р-ра)*ω(NaCl)
m(NaCl) = 292,5*0,2 = 58,5 г
ν(NaCl) 58,5/58,5 = 1 моль
Откуда такое большое
уменьшение массы раствора?
Электролизу подвергается вода!
ν(Cl2) = 0,5 моль (по 1 уравнению)
ν(H2) = 0,5 моль (по 1 уравнению)
m(Cl2) = 0,5*71 = 35,5 г
m(H2) =0,5*2 = 1 г
m(Cl2) + m(H2) = 36,5 г
13.
Решение2NaCl + 2H2O → 2NaOH + Cl2↑ + H2↑
ν(NaCl) 58,5/58,5 = 1 моль
2H2O → 2H2↑ + O2↑
ω(H2O) = 165,3/225,1*100%=73,43%
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑
m(H2 + O2) = 80 – 36,5 =43,5 г m(р-ра) =mр-ра(NaOH)+ m(Zn)- m(газов)- m(H2)
m (H2O) = m(р-ра) – m(NaOH) – m(Na2[Zn(OH)4])
Пусть ν(O2) – x моль,
ν(Zn) = 13/65 = 0,2 моль
тогда ν(H2) – 2x моль.
ν(NaOH) = 1 моль (по 1 уравнению)
2*2х + 32*х = 43,5 г
Zn – в недостатке
36*х = 43,5 г х =1,2 моль
ν(H2) = 0,4 моль
На аноде образуются: Cl2 и O2
m(р-ра) =292,5 + 13 - 80 - 0,2*2 =225,1 г
m(Cl2 +O2) = 0,5*71 + 1,2*32 = 73,9 г m(Na2[Zn(OH)4]) = 0,2*179=35,8 г
m(NaOH) = (1-0,4)*40 = 24 г
ω(H2O) = m(H2O)/m(р-ра)*100%
m (H2O) = 225,1 - 24 - 35,8 = 165,3 г
14.
Задача 35При сгорании 1 г органического вещества А получили 1,12 л
углекислого газа (н.у.) и 0,72 г воды. Известно, что вещество А
образуется при гидратации углеводорода Б, который вступает в
реакцию с гидроксидом диамминсеребра(I) в молярном
соотношении 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы
измерения искомых физических величин) и установите
молекулярную формулу органического вещества A;
2) составьте возможную структурную формулу вещества A, которая
однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидратации углеводорода Б с
образованием вещества А (используйте структурные формулы
органических веществ).
15.
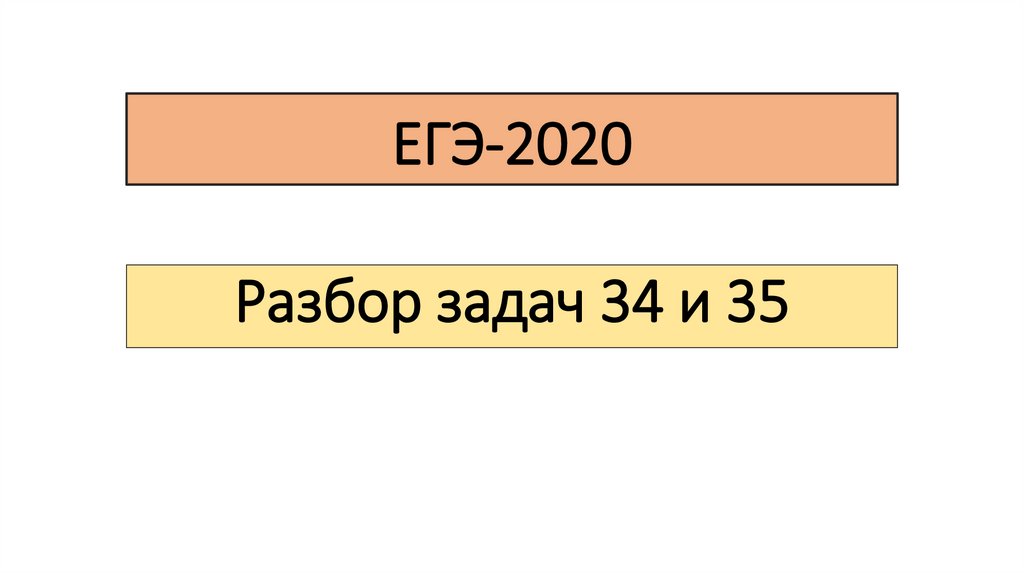
РешениеВещество A + O2 → CO2 + H2O
ν(CO2) = 1,12/22,4 = 0,05 моль; ν(С) = ν(CO2) = 0,05 моль
m(С) = 0,05*12 = 0,6 г
ν(H2O) = 0,72/18 = 0,04 моль; ν(H) = 2*ν(H2O) = 0,08 моль
m(H) = 0,08*1 = 0,08 г
m(O) = m(в-ва) – m(C) – m(H) = 1 - 0,6 - 0,08 = 0,32 г
ν(O) = 0,32/16 = 0,02 моль
ν(С) : ν(H) : ν(O) = 0,05 : 0,08 : 0,02 = 5 : 8 : 2
1) Молекулярная формула вещества А: С5H8O2
ν=N/Na
16.
РешениеГидроксид диамминсеребра - [Ag(NH3)2]OH !!!
УВ(Б) + H2O → A
УВ(Б) + [Ag(NH3)2]OH, значит УВ(Б) – алкин с концевой «≡», так как
1 моль : 2 моль
УВ(Б) – алкин с двумя концевыми «≡» связями
УВ(Б) содержит 5 атомов углерода и две концевые «≡» связи:
СH≡C-CH2-C≡CH
3) СH≡C-CH2-C≡CH + 2H2O → CH3-C-CH2-C-CH3 (ot, H2SO4, HgSO4)
II
II
O
O
по правилу Марковникова, затем кето-енольная таутомерия
2) Структурная формула вещества А:CH3-C-CH2-C-CH3
II
II
O
O
17.
Задача 35Органическое вещество содержит 62,75% углерода, 7,19% водорода,
20,91% кислорода и 9,15% азота. В составе органического вещества есть
только один атом углерода в sp3-гибридизации. При нагревании исходное
вещество реагирует с гидроксидом кальция с образованием органической
соли и газа, содержащего один атом углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения
искомых физических величин) и установите молекулярную формулу
исходного органического вещества;
2) составьте возможную структурную формулу исходного вещества,
которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного органического вещества с
гидроксидом кальция (используйте структурные формулы органических
веществ).
18.
РешениеПусть m(орг. в-ва) = 100 г, тогда
m(C) = 62,75 г; ν(С)= 62,75/12 = 5,23 моль
m(H) = 7,19 г;
ν(H) = 7,19/1 = 7,19 моль
m(O) = 20,91 г; ν(H) = 20,91/16 = 1,31 моль
m(N) = 9,15 г;
ν(N) = 9,15/14 = 0,65 моль
ν(С) : ν(H) : ν(O) : ν(N) = 5,23 : 7,19 : 1,31 : 0,65 = 8 : 11 : 2 : 1
1) Молекулярная формула вещества: С8H11O2N
???
19.
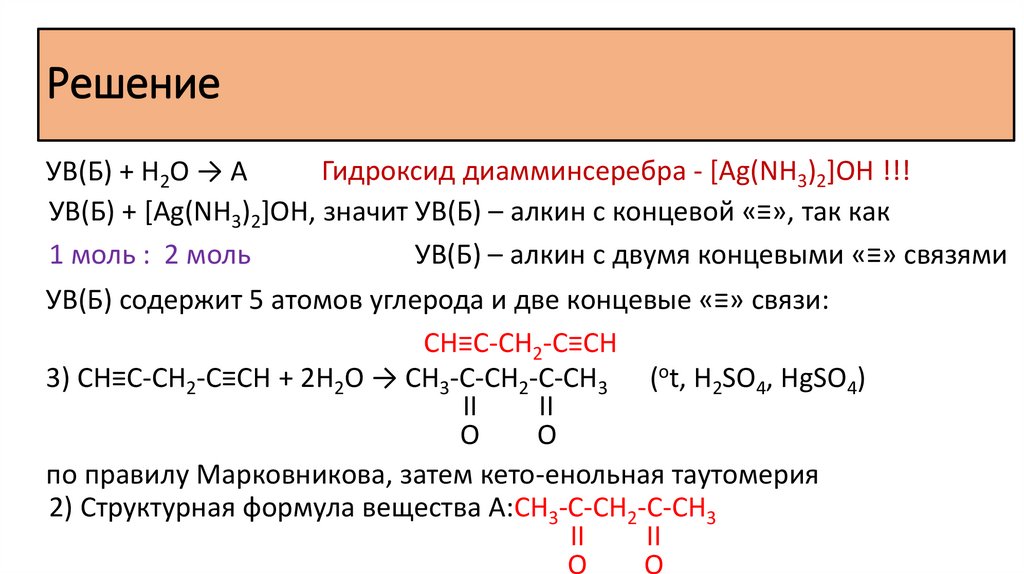
Решение2) Структурная формула исходного вещества:
Алкиламмониевая соль карбоновой кислоты:
бензоат метиламмония
3) Уравнение исходного вещества с гидроксидом кальция:
20.
Задание 35Вещество А содержит 9,30% углерода, 5,43% водорода, 49,62% кислорода,
10,85% азота и 24,80% серы по массе. Известно, что вещество А образуется
при восстановлении вещества Б цинком в присутствии серной кислоты.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения
искомых физических величин) и установите молекулярную формулу
органического вещества A;
2) составьте возможную структурную формулу вещества A, которая
однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции, протекающей при восстановлении
вещества Б цинком в присутствии серной кислоты (используйте структурные
формулы органических веществ).
21.
РешениеПусть m(в-ва А) = 100 г, тогда
m(C) = 9,3 г;
ν(С)= 9,3/12 = 0,775 моль
m(H) = 5,43 г;
ν(H) = 5,43/1 = 5,430 моль
m(O) = 49,62 г; ν(H) = 49,62/16 = 3,101 моль
m(N) = 10,85 г; ν(N) = 10,85/14 = 0,775 моль
m(S) = 24,80 г; ν(S) = 24,80/32 = 0,775 моль
ν(С) : ν(H) : ν(O) : ν(N) : ν (S) = 0,775 : 5,430 : 3,101 : 0,775 : 0,775 =
1:7:4:1:1
1) Молекулярная формула вещества А: СH7O4NS
???
22.
Решение1) Молекулярная формула вещества А: СH7O4NS
Б + Zn + H2SO4 → А
2) Структурная формула вещества А: [CH3NH3]HSO4
гидросульфат метиламмония
3) Уравнение вещества Б с цинком в присутствии серной кислоты:
CH3 – NO2 + 3Zn + 4H2SO4 → [CH3 – NH3]HSO4 + 3ZnSO4 + 2H2O
23.
Задача 35При сгорании органического вещества А массой 2,64 г получено 1,792 л
углекислого газа (н.у.), 1,44 г воды и 448 мл азота (н.у.). Известно, что вещество
А подвергается гидролизу. Если провести гидролиз в присутствии соляной
кислоты, то в качестве единственного продукта образуется соль, содержащая
хлорид-ион.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения
искомых физических величин) и установите молекулярную формулу исходного
органического вещества;
2) составьте возможную структурную формулу исходного вещества, которая
однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции гидролиза вещества А в присутствии соляной
кислоты (используйте структурные формулы органических веществ).
24.
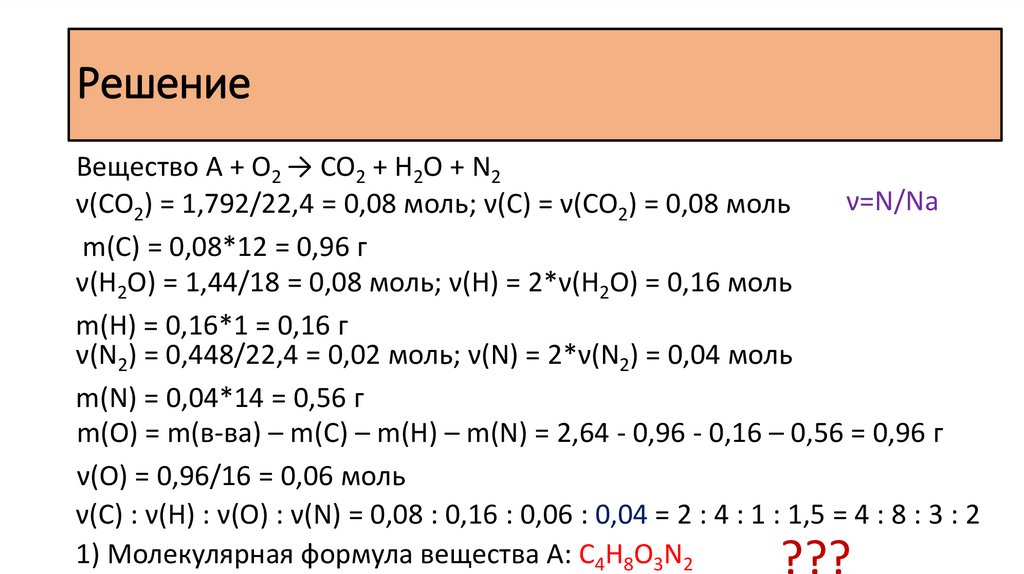
РешениеВещество A + O2 → CO2 + H2O + N2
ν=N/Na
ν(CO2) = 1,792/22,4 = 0,08 моль; ν(С) = ν(CO2) = 0,08 моль
m(С) = 0,08*12 = 0,96 г
ν(H2O) = 1,44/18 = 0,08 моль; ν(H) = 2*ν(H2O) = 0,16 моль
m(H) = 0,16*1 = 0,16 г
ν(N2) = 0,448/22,4 = 0,02 моль; ν(N) = 2*ν(N2) = 0,04 моль
m(N) = 0,04*14 = 0,56 г
m(O) = m(в-ва) – m(C) – m(H) – m(N) = 2,64 - 0,96 - 0,16 – 0,56 = 0,96 г
ν(O) = 0,96/16 = 0,06 моль
ν(С) : ν(H) : ν(O) : ν(N) = 0,08 : 0,16 : 0,06 : 0,04 = 2 : 4 : 1 : 1,5 = 4 : 8 : 3 : 2
1) Молекулярная формула вещества А: С4H8O3N2
???
25.
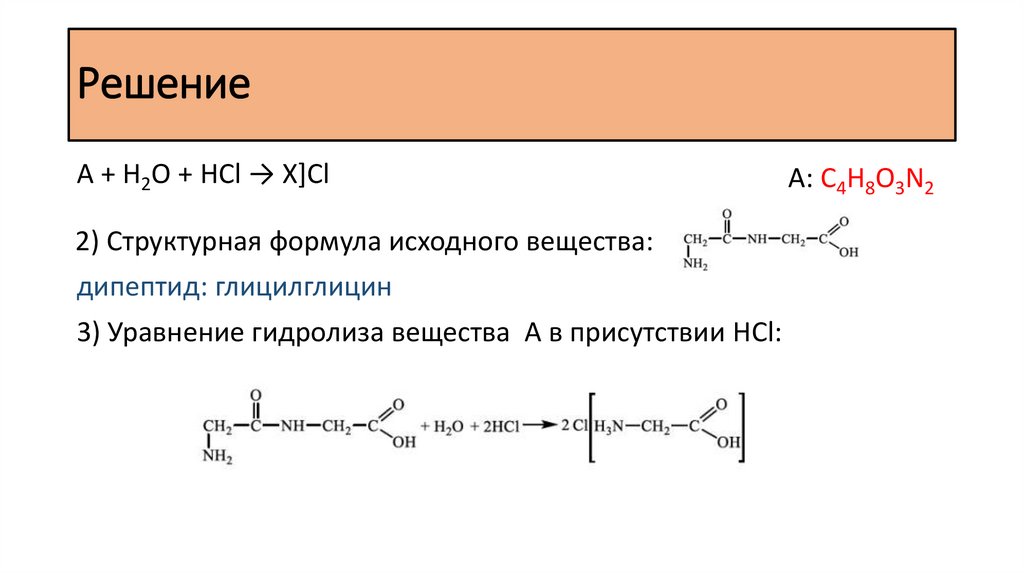
РешениеA + H2O + HCl → X]Cl
2) Структурная формула исходного вещества:
дипептид: глицилглицин
3) Уравнение гидролиза вещества A в присутствии НСl:
А: С4H8O3N2




















 chemistry
chemistry








