Similar presentations:
Классификация химических реакций по числу и составу исходных и полученных веществ
1.
Ильина И.В., руководитель ЦДОШ, учитель химииМБОУ «Средняя общеобразовательная школа №27
имени А.А. Дейнеки» г. Курска
E-mail мой: ilina.irina71@mail.ru
2. М.В. Ломоносов – учёный- энциклопедист. Обобщение и систематизация знаний
Химическое превращение,химическая реакция
ест ь главный предмет химии».
Н.Н.Семёнов
М.В. Ломоносов – учёныйэнциклопедист. Обобщение и
систематизация знаний
3. Какие явления относятся к (Ф) физическим, а какие к (Х) химическим.
1)2)
3)
4)
5)
6)
7)
8)
9)
10)
кипение воды,
образование на деревьях инея,
скисание молока,
ржавление гвоздя,
таяние льда,
горение бенгальских огней,
гниение растений,
приготовление сахарной пудры из сахара,
горение свечи,
растворение соли.
4. ПОВТОРИМ!
Что такое химическая реакция?Перечислите признаки протекания
химической реакции.
Какие условия необходимы для
возникновения химической реакции?
Приведи примеры химических реакций из
повседневной жизни.
5. Расставить коэффициенты
1.2.
3.
4.
5.
6.
7.
8.
P2O5 + H2O =HPO3
Fe(OH)3 = Fe2O3 + H2O
KClO3 = KCl + O2
Al + S = Al2S3
Zn + HCl = ZnCl2 + H2
Cu(НСО3)2 = CuO + CO2 + H2O
HgO = Hg + O2
CaCO3 + HNO3 =Ca(NO3)2 + H2CO3
6. ПРОВЕРИМ!
1.2.
3.
4.
5.
6.
7.
8.
P2O5 + H2O =2HPO3
2Fe(OH)3 = Fe2O3 + 3H2O
2KClO3 = 2KCl + 3O2
2Al + 3S = Al2S3
Zn + 2HCl = ZnCl2 + H2
Cu(НСО3)2 = CuO + 2CO2 + H2O
2HgO = 2Hg + O2
CaCO3 + 2HNO3 =Ca(NO3)2 + H2CO3
7. Классификация химических реакций по числу и составу исходных и полученных веществ
Классификация химическихреакций по числу и составу
исходных и полученных веществ
1. РЕАКЦИИ СОЕДИНЕНИЯ
2. РЕАКЦИИ РАЗЛОЖЕНИЯ
3. РЕАКЦИИ ЗАМЕЩЕНИЯ
4. РЕАКЦИИ ОБМЕНА
8. ЗАКРЕПИМ!
1.2.
3.
4.
5.
6.
7.
8.
P2O5 + H2O =2HPO3
2Fe(OH)3 = Fe2O3 + 3H2O
2KClO3 = 2KCl + 3O2
2Al + 3S = Al2S3
Zn + 2HCl = ZnCl2 + H2
Cu(НСО3)2 = CuO + 2CO2+H2O
2HgO = 2Hg + O2
CaCO3+2HNO3=Ca(NO3)2+H2CO3
соединение
разложение
разложение
соединение
замещение
разложение
разложение
обмена
9. Дописать уравнение, указать тип реакций, расставить коэффициенты.
Уравнение реакцииТип химической реакции
а) AgI —> ? + I2
а) 2AgI —> 2Ag + I2
– разложение
б) MgO + H2SO4 —> MgSO4 + ?
б) MgO + H2SO4 —> MgSO4 + H2O
- обмена
в) Al + HCl —> AlCl3 + ?
в) 2Al + 6HCl —> 2AlCl3 + 3H2
- замещение
г) Na + Cl2 —> ?
г) 2Na + Cl2 —> 2NaCl
- соединение
10. ОБОБЩИМ!
ХИМИЧЕСКИЕПРИЗНАКИ
1. цвет
2. газ
3. осадок
4. запах
5. тепло
6. свет
РЕАКЦИИ
УСЛОВИЯ
1.нагревание
2.соприкосновение
3. катализатор
ТИПЫ
по числу и составу исходных
веществ и продуктов
реакции
1. соединения
2. разложения
3. замещения
4. обмена
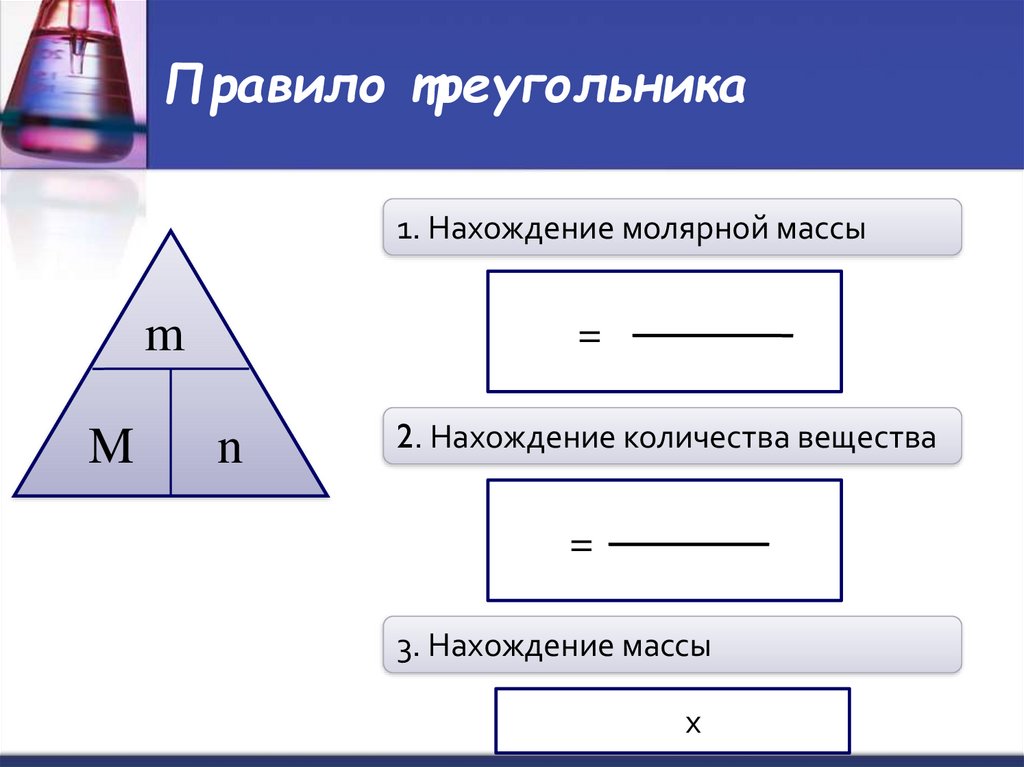
11. Правило треугольника
1. Нахождение молярной массыm
M
=
n
2. Нахождение количества вещества
=
3. Нахождение массы
х
12.
Определит е массу сульфида алюминияAl2S3), количест вом вещест ва 2,5 моль.
Дано:
n(Al2S3) =2,5 моль
m(Al2S3) – ?
Решение:
m=n×M
M(Al2S3) = 27×2 + 32×3= 150 г/моль
m(Al2S3) = n(Al2S3) × M(Al2S3) =
= 2,5 моль × 150 = 375 г
Ответ: m(Al2S3) = 375 г
13.
Рассчит айт е массу соли (ZnCl2), кот ораяобразует ся при взаимодейст вии 13 г
цинка с соляной кислот ой (НCl).
Дано:
m(Zn)=13 г
m(ZnCl2) – ?
M(Zn) = 65 г/моль
Решение:
0,2 моль
x моль
Zn + 2HCl = ZnCl2 + H2↑
1 моль
1 моль
m(Zn)
1) n(Zn) =
M(Zn)
13 г
n(Zn)=
= 0,2 моль
65 г/моль
M(ZnCl2) =65 +35,5·2 =
136 г/моль
2) x = n(ZnCl2) = n(Zn) = 0,2 моль
3) m(ZnCl2) = n(ZnCl2)·M(ZnCl2) =
0,2 моль·136 г/моль = 27,2 г
Ответ: m(ZnCl2) = 27,2 г
14.
В 1745 г. Высочайшимуказом Елизаветы
Петровны Ломоносов был
назначен профессором
химии, и стал
действительным членом
Российской Академии наук.
Михаил Васильевич
Ломоносов считал химию
одной из главных областей
своего научного творчества.
15. Ломоносов не раз говорил, что химия – его «главная профессия»
В 1 7 4 8 г . он создал приАк адем ии наук первую в
России хим ическ ую
лаборат орию .
Лаборатория
Ломоносова стала
первым в истории
России
исследовательским
учреждением,
прообразом будущих
научноисследовательских
институтов
16. М.В. Ломоносов – учёный энциклопедист
От к рыт ияЛом оносова
обог ат или м ног ие от расли знания.
Он развивал ат ом ном олек улярные
предст авления
о
ст роении
вещ ест ва, в период г осподст ва
т еории т еплорода ут верж дал, чт о
т еплот а обусловлена движ ением
к орпуск ул
Закон сохранения массы
веществ:
Масса веществ, вступивших в
реакцию равна массе веществ,
получившихся в результате её.
17. Домашнее задание
1. Повторить параграфы 1- 11, 202. Упражнения 1, 2 и тест (из презентации)
3. Подготовиться к контрольной работе
Пишите в электронный журнал или на мою почту.
E-mail: ilina.irina71@mail.ru
18. Упражнение 1. Дописать уравнения реакций, указать тип реакций, расставить коэффициенты.
Домашнее заданиеУпражнение 1. Дописать уравнения реакций,
указать тип реакций, расставить коэффициенты.
а) Al + O2 = ?
б) Mg + Cl2 = ?
в) HCl + NaOH = NaCl + ?
г) MgCO3 = MgO +?
д) Zn + HCl = ZnCl2 + ?
е) CuO + Mg = MgO + ?
19. Упражнение 2. Указать тип химических реакций, расставить коэффициенты.
Домашнее заданиеУпражнение 2. Указать тип
расставить коэффициенты.
химических
Уравнение реакции
а) Al + O2 —> Al2O3
б) MnO2 + H2 —> Mn + H2O
в) H2O2 —> H2 + O2
г) HNO3 + Fe(OH)3 —> Fe(NO3)3+ H2O
реакций,
Тип химической
реакции
20. ТЕСТ
1. Соотнесите:Тип реакции
1. замещения;
2. обмена;
3. соединения;
4. разложения.
Схема реакции
а) 2 gO 2 g+O2 ;
б) 4AI + 3O2 2AI2O3 ;
в) 2KBr + CI2 2KCI + Br2 ;
г) Сu(OH)2 + 2HCI 2H2O+ CuCI2 .
2. В уравнении реакции, схема которой
Fe2O3+ H2 Fe + H2O
Коэффициент перед формулой железа равен:
а) 3,
б) 6,
в) 2,
г) 1.
21. ТЕСТ
3. Реакции, в результате которых из одного сложноговещества образуется несколько более простого состава
относятся к:
а) реакциям соединения;
б) реакциям разложения;
в) реакциям замещения;
г) реакциям обмена.
4. Веществом «А» в схеме уравнения реакции является:
Mg + HCI MgCI2 + А
а) H2
б) CI2
в)Mg
г) O2
22.
ТЕСТ5. Реакция CaCO3 = CaO + CO2 относится к реакциям
1) разложения
2) соединения
3) обмена
4) замещения
6. Реакция разложения описана уравнением
1) Cu(OH)2 = CuO + H2O
2) BaO + H2O = Ba(OH)2
3) Na2SO4 + BaCl2 = ZnCl2 + BaSO4
4) FeO + H2 = Fe + H2O





















 chemistry
chemistry








