Similar presentations:
Реакции окисления-восстановления в химическом анализе. (Лекция 7.1)
1.
АНАЛИТИЧЕСКАЯ ХИМИЯЛЕКЦИЯ 7, часть 1
Реакции окисления-восстановления в химическом анализе
Лектор Семенова Ирина Николаевна
2.
3.
n2Ox1 + n1Red 2 = n2Red 1 + n1Ox2Ox1 + n1e = Red1
Red 2 - n2e = Ox2
Ox1/ Red 1-окислительно-восстановительная пара;
Ox2/ Red 2 - окислительно-восстановительная пара;
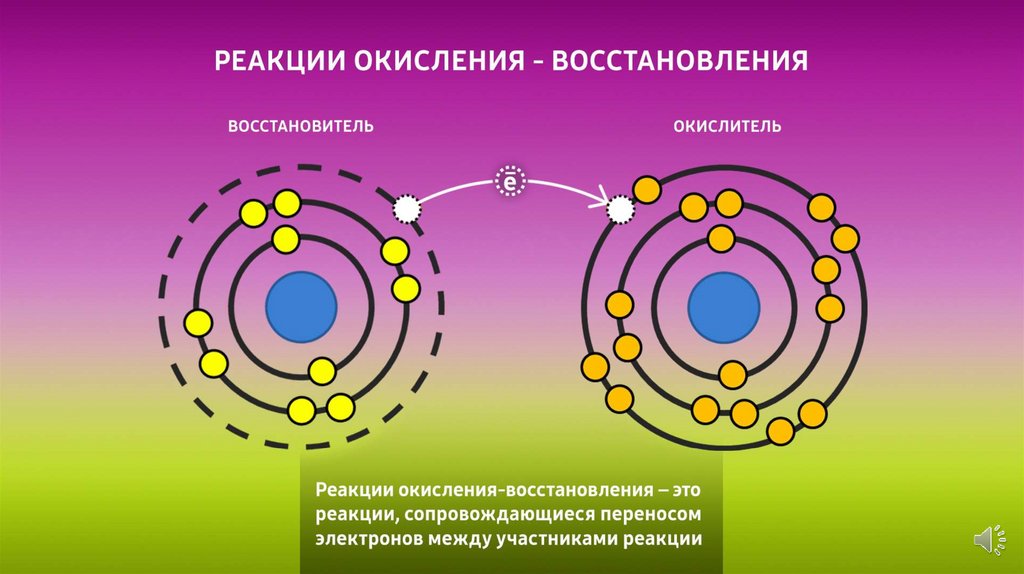
Реакция, показывающая изменения, происходящие с
каждым участником реакции, называется
полуреакцией.
4.
Возможность протекания окислительно-восстановительной реакцииопределяется химической активностью пары, которая количественно
характеризуется величиной стандартного окислительновосстановительного потенциала Е0Оx/Red
Стандартный окислительно-восстановительный потенциал – это
потенциал окислительно-восстановительной пары, измеренный
относительно стандартного водородного электрода при t0= 250C и
ɑOx = ɑRed = 1 моль/л.
Чем больше значение стандартного окислительно-восстановительного
потенциала, тем сильнее выражены окислительные свойства пары.
5.
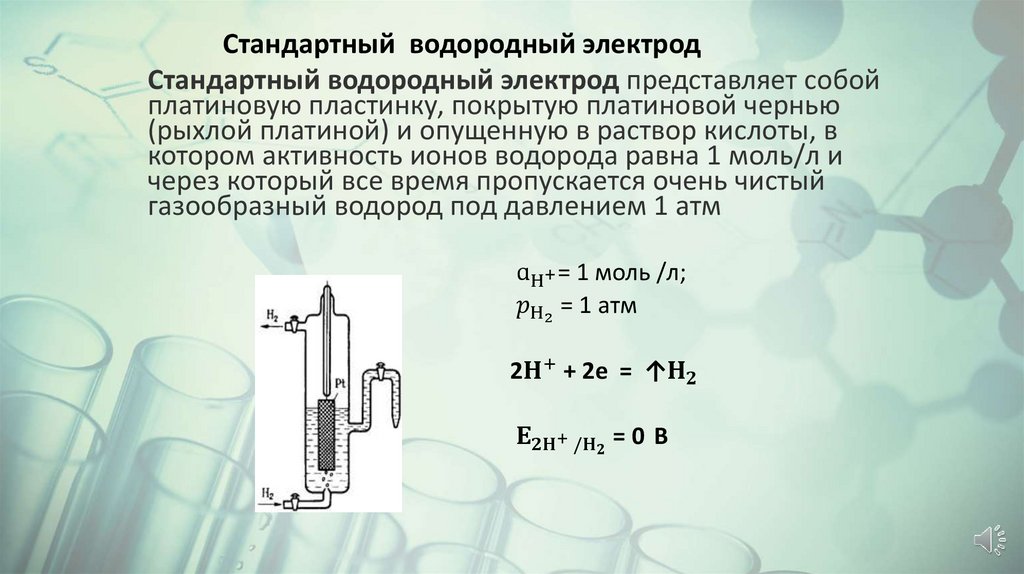
Стандартный водородный электродСтандартный водородный электрод представляет собой
платиновую пластинку, покрытую платиновой чернью
(рыхлой платиной) и опущенную в раствор кислоты, в
котором активность ионов водорода равна 1 моль/л и
через который все время пропускается очень чистый
газообразный водород под давлением 1 атм
ɑH+ = 1 моль /л;










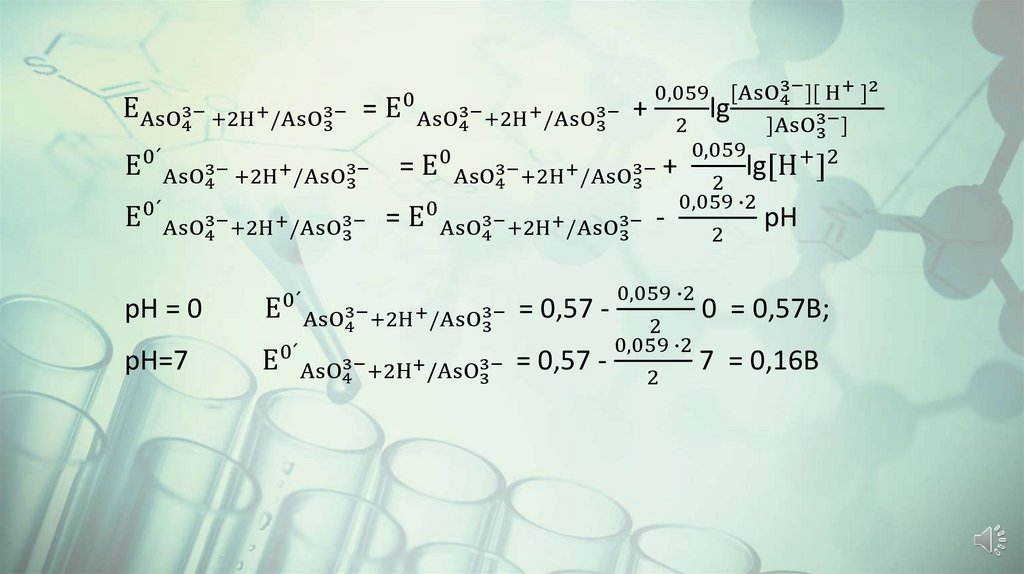


 chemistry
chemistry








