Similar presentations:
Классификация электрохимических методов анализа
1.
Тема лекции:2.
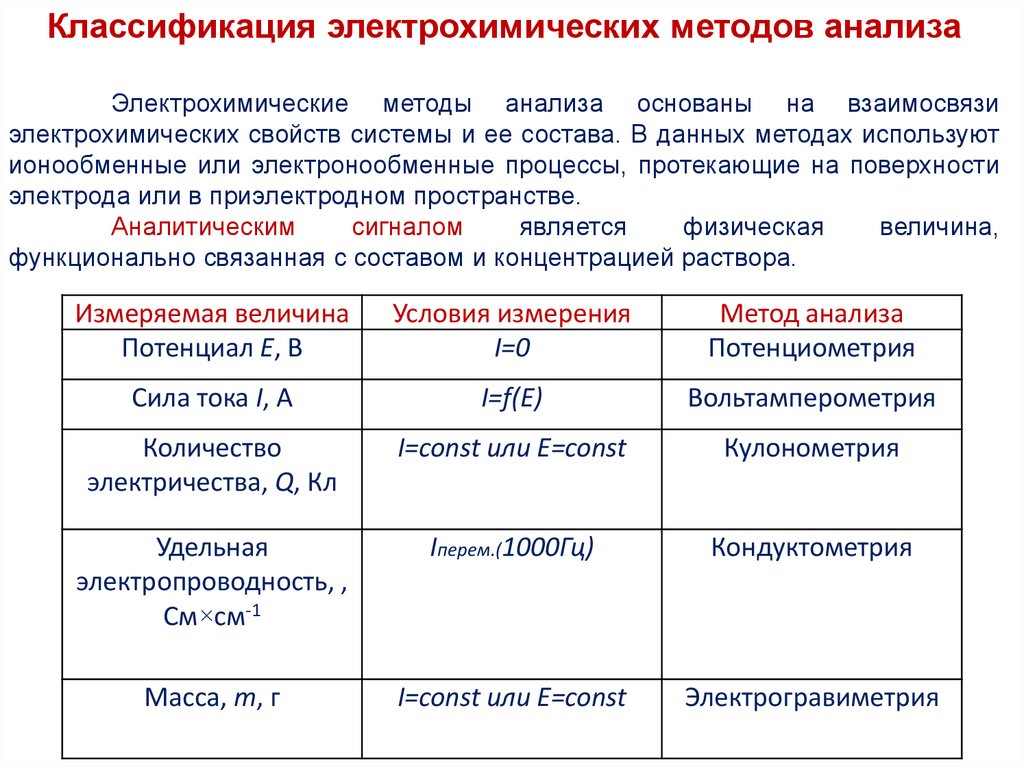
Классификация электрохимических методов анализаЭлектрохимические методы анализа основаны на взаимосвязи
электрохимических свойств системы и ее состава. В данных методах используют
ионообменные или электронообменные процессы, протекающие на поверхности
электрода или в приэлектродном пространстве.
Аналитическим
сигналом
является
физическая
величина,
функционально связанная с составом и концентрацией раствора.
Измеряемая величина
Потенциал Е, В
Условия измерения
I=0
Метод анализа
Потенциометрия
Сила тока I, А
I=f(E)
Вольтамперометрия
Количество
электричества, Q, Кл
I=const или E=const
Кулонометрия
Удельная
электропроводность, ,
См×см-1
Iперем.(1000Гц)
Кондуктометрия
Масса, m, г
I=const или E=const
Электрогравиметрия
3.
ОСНОВНЫЕ ПОНЯТИЯ ЭЛЕКТРОХИМИИГальванический элемент
Окислительно-восстановительные реакции, инициирующие
возникновение электрического тока, или наблюдаемые при
прохождении электрического тока через раствор являются
предметом изучения электрохимии.
При погружении металлического электрода в раствор,
содержащий ионы этого металла, между твердой и жидкой фазами
устанавливается равновесие:
Двойной электрический слой
Ме0
Ме n+ + n е
Величина электродного
Величина равновесного
потенциала, возникшая на
потенциала электрода
границе металл-раствор,
зависит от природы
металла, температуры, а
называется равновесным
также от состава и
потенциалом электрода
концентрации исследуемого
раствора
4.
Математическим выражением данной зависимости являетсяуравнение Нернста
RT
aOx
Ox Red
ln
nF aRed
0
или при 25˚С:
0.059 aOx
Ox Red
lg
,
n
aRed
0
где φ – равновесный электродный потенциал, В; φ0 – стандартный
окислительно-восстановительный потенциал, В; R – универсальная
газовая постоянная, равная 8.314 Дж/моль К; Т – абсолютная
температура, К; n – число электронов, участвующих в реакции; F – число
Фарадея, составляющее 96500 Кл/моль; aOx
и aRed – активности
окисленной и восстановленной формы ионов соответственно, моль/л.
Активность- это реально действующая концентрация ионов в растворах
электролитов. a
c, где - коэффициент активности, с – молярная
концентрация, моль/л.
5.
Два электрода, погруженные в соответствующие растворы, образуютгальванический элемент, напряжение которого равно алгебраической разности
потенциалов этих электродов. Напряжение гальванического элемента
называется электродвижущей силой (э.д.с.) элемента:
Е К А,
где а – потенциал анода; к –потенциал катода.
Катод – это электрод, на котором
происходит восстановление.
Анод – электрод, на котором происходит
окисление.
Катод
Анод
6.
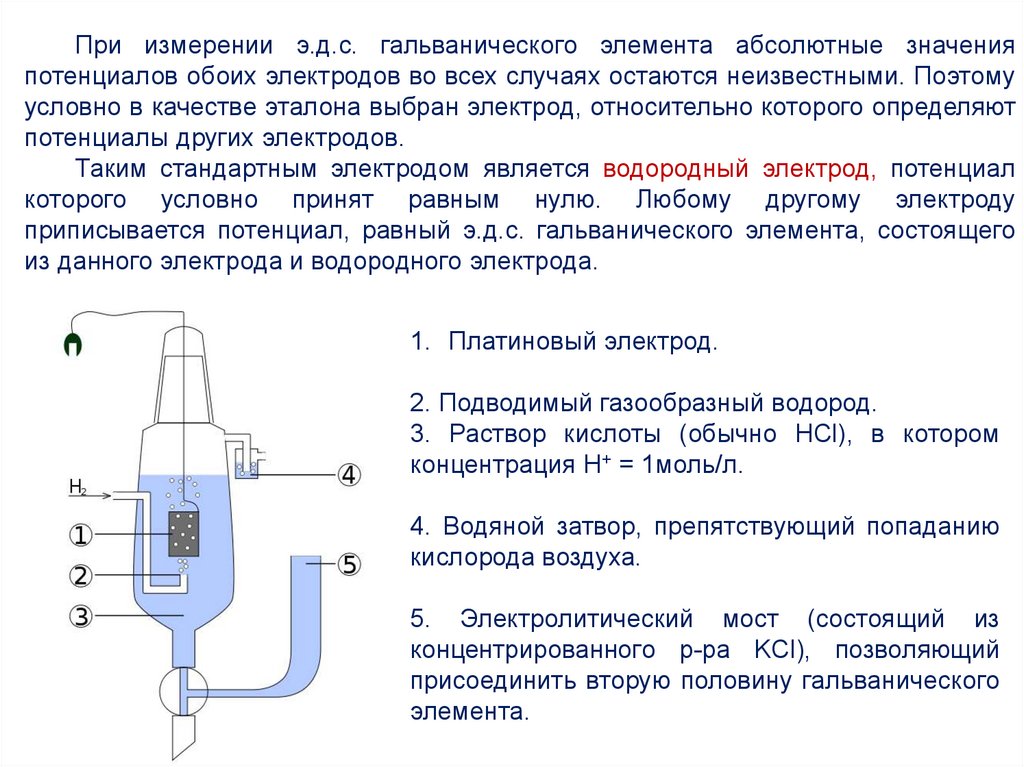
При измерении э.д.с. гальванического элемента абсолютные значенияпотенциалов обоих электродов во всех случаях остаются неизвестными. Поэтому
условно в качестве эталона выбран электрод, относительно которого определяют
потенциалы других электродов.
Таким стандартным электродом является водородный электрод, потенциал
которого условно принят равным нулю. Любому другому электроду
приписывается потенциал, равный э.д.с. гальванического элемента, состоящего
из данного электрода и водородного электрода.
1. Платиновый электрод.
2. Подводимый газообразный водород.
3. Раствор кислоты (обычно HCl), в котором
концентрация H+ = 1моль/л.
4. Водяной затвор, препятствующий попаданию
кислорода воздуха.
5. Электролитический мост (состоящий из
концентрированного р-ра KCl), позволяющий
присоединить вторую половину гальванического
элемента.
7.
ЭлектродРеакция
Е0 при 25ºС, В
Потенциал металлического электрода,
Li+/ Li
Li+ + e- = Li
-3,045
Rb+ + e- = Rb
-2,925
погруженного в раствор соли данного металла Rb+/ Rb
K+/ K
K+ + e- = K
-2,924
с концентрацией 1 моль/л, измеренный
Cs+/ Cs
Cs+ + e- = Cs
-2,923
относительно стандартного водородного
2+
2+
Ca /Ca
Ca + 2e = Ca
-2,866
электрода, называется стандартным
+
+
Na / Na
Na + e = Na
-2,714
электродным потенциалом и обозначается
Mg2+/ Mg Mg2+ + 2e- = Mg
-2,363
0
0
буквой φ или Е . Величины стандартных
Al3+/Al
Al3+ + 3e- = Al
-1,663
электродных потенциалов в водных растворах при Mn2+/Mn Mn2+ + 2e- = Mn
-1,179
2+
2+
25˚С, расположенные в порядке возрастания
Cr /Cr
Cr + 2e = Cr
-0,913
2+
2+
Zn /Zn
Zn + 2e = Zn
-0,763
составляют ряд стандартных
Cr3+/Cr
Cr3+ + 3e- = Cr
-0,744
электродных потенциалов.
Fe2+/Fe
Fe2+ + 2e- = Fe
-0,440
Co2+/Co
Co2+ + 2e- = Co
-0,277
2+
2+
Ni /Ni
Ni + 2e = Ni
-0,250
2+
2+
Sn /Sn
Sn + 2e = Sn
-0,136
Pb2+/Pb
Pb2+ + 2e- = Pb
-0,126
Таким образом, в электрохимии под
Fe3+/Fe
Fe3+ + 3e- = Fe
-0,037
2H+/H2
2H+ + 2e- = H2
0
величиной электродного потенциала φ или
2+
2+
Cu /Cu
Cu + 2e = Cu
0,337
Е, подразумевают э.д.с. гальванической
+
+
Ag /Ag
Ag + e = Ag
0,799
пары электродов, потенциал одного из
Hg2+/Hg Hg2+ + 2e- = Hg
0,850
которых известен.
Pt2+/Pt
Pt2+ + 2e- = Pt
1,188
Au+/Au
Au+ + e- = Au
1,692
8.
Каждаяокислительно-восстановительная
система
также
характеризуется определенным значением равновесного потенциала,
который возникает на благородном металле, погруженном в раствор,
содержащий окисленную и восстановленную форму вещества, например,
Fe3+и Fe2+ или Sn4+ и Sn2+.
Прямое
измерение
величины
равновесного
потенциала
неосуществимо.
В потенциометрии используют гальванический элемент, состоящий
из двух электродов, погруженных либо в один и тот же раствор (элемент
без переноса), либо в два различных раствора, контактирующих друг с
другом (цепь с переносом).
1. Электрод, потенциал которого зависит от концентрации
(активности)
определенных
ионов
в
растворе
называется
индикаторным.
2. Электрод, потенциал которого не зависит от концентрации
(активности) определенных ионов в растворе называется электродом
сравнения.
Потенциометрический метод анализа основан на измерении
электродвижущих сил обратимых гальванических элементов.
9.
Классификация потенциометрических методованализа
1. Прямая потенциометрия (ионометрия).
2. Потенциометрическое титрование (косвенная
потенциометрия).
В прямой потенциометрии происходит непосредственное измерение э.д.с.
гальванического элемента, условно принятой равной величине
равновесного потенциала, и нахождение с помощью уравнения Нернста
активности (концентрации) ионов в растворе.
При проведении потенциометрического титрования осуществляется
измерение потенциала в процессе химической реакции между
определяемым веществом и титрантом. Конечную точку титрования
находят по скачку потенциала, отвечающему моменту завершения
реакции. В косвенных методах используют кислотно-основные,
окислительно-восстановительные реакции, процессы осаждения и
комплексообразования.
10.
Основные приемы ионометрического анализаМетод градуировочного графика.
Сущность метода заключается в измерении э.д.с. электродной пары (Е,
мВ) для стандартных растворов определяемых ионов и построении
градуировочного графика, представляющего собой зависимость Е от
активности (ai, моль/л) или концентрации (сi, моль/л) i-го компонента,
выраженной в логарифмической форме: pai или pci, где pai= -lgai, pci= -lgci.
Градуировочная
зависимость
потенциала индикаторного электрода
(Е, мВ) от активности определяемого
компонента A (аA, моль/л) в растворе.
11.
Метод добавокВ методе добавок сначала измеряют потенциал электрода в
анализируемом растворе Е1, а затем добавляют к нему точно
определенный объем стандартного раствора и снова измеряют потенциал
электрода Е2. Концентрацию определяемого иона с рассчитывают по
формуле:
C
C
E
1
10 S
где С – прирост концентрации определяемого иона за счет введения
стандартного раствора, Е = Е1 - Е2 – разность потенциалов электрода в
анализируемом растворе до и после введения добавки, S – тангенс угла
наклона нернстовской области градуировочной кривой (крутизна
электродной функции).
Данный метод предполагает использование известного значения крутизны
электродной функции S для определяемого иона.
12.
Потенциометрическое титрованиеПотенциометрическое титрование основано на измерении потенциала
индикаторного электрода в процессе проведения титриметрического анализа.
Достоинства:
1) инструментальный метод исключает субъективные ошибки, связанные с
визуальным установлением т. э.;
2) при
одинаковой ошибке измерения предел определяемых концентраций
существенно ниже, т. е. метод более чувствителен;
3) титрование можно проводить в мутных и окрашенных средах;
4)
возможно
последовательное
определение
нескольких
компонентов,
находящихся в одном растворе;
5) процесс титрования может быть автоматизирован.
13.
Определение точки эквивалентностипри потенциометрическом титровании чаще всего осуществляют
графическими методами
Кривые потенциометрического
титрования:
1 –интегральная форма;
2- дифференциальная кривая по первой
производной;
3- дифференциальная кривая по второй
производной;
4- кривая Грана
Если титруемая система обратима, то кривые титрования
симметричны. В этом случае для нахождения т. э. как точки
перегиба на интегральной кривой
Более точным методом определения т. э. является
графическое изображение данных потенциометрического
титрования в виде дифференциальных кривых первого и
второго порядков.
В методе Грана т.э. определяют , опуская перпендикуляр на
ось абсцисс из точки пересечения двух прямых.
14.
Виды электродов и приемы работы с нимиИндикаторные электроды
В потенциометрии применяют металлические и мембранные электроды.
Данные электроды реагируют на изменение концентрации определяемого иона и
заменяют собой индикаторы, используемые в обычном титровании, поэтому такие
электроды и называют индикаторными.
Классификация
1.
Электронообменные
электроды,
на
межфазных
границах
которых
протекают реакции с участием электронов. К электронообменным в основном
относятся активные металлические электроды I рода (серебряный, медный,
кадмиевый), а также инертные электроды (платиновый, золотой).
2. Ионообменные электроды, на межфазных границах которых протекают
реакции обмена ионами. Такие электроды называют также мембранными
ионоселективными (ИСЭ).
или
15.
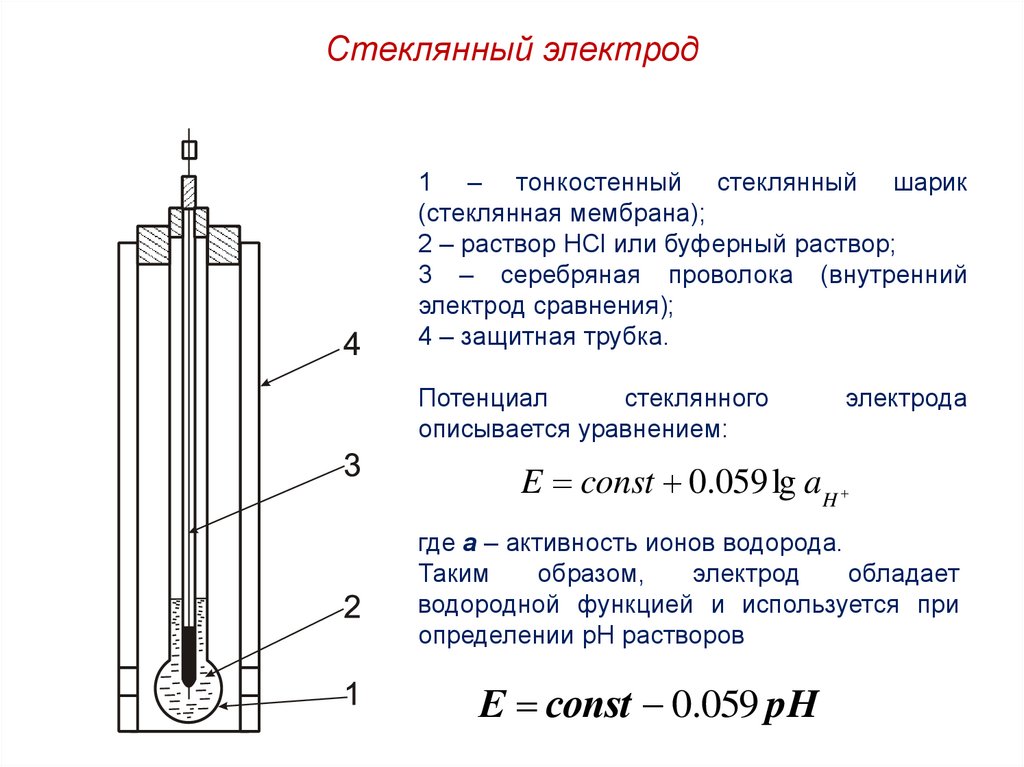
Стеклянный электрод1 – тонкостенный стеклянный шарик
(стеклянная мембрана);
2 – раствор HCl или буферный раствор;
3 – серебряная проволока (внутренний
электрод сравнения);
4 – защитная трубка.
Потенциал
стеклянного
описывается уравнением:
электрода
E const 0.059 lg aH
где а – активность ионов водорода.
Таким
образом,
электрод
обладает
водородной функцией и используется при
определении рН растворов
Е сonst 0.059 pH
16.
Электроды сравненияЭто электроды, потенциал которых известен, постоянен и не
зависит от состава изучаемого раствора.
Наиболее
распространен
хлоридсеребряный
электрод
сравнения. Его изготавливают путем электролитического нанесения
хлорида серебра на серебряную проволоку, которую погружают в раствор
хлорида калия (Ag, AgCl/KCl). У поверхности электрода устанавливается
равновесие:
AgClТВ.+e-
Ag+Cl-
Зависимость равновесного потенциала хлоридсеребряного электрода от
активности хлорид-ионов описывается уравнением Нернста:
E=E0Ag/AgCl,Cl- -0.059 lg aCl-
17.
Некоторые моделииндикаторных электродов
и электродов сравнения
18.
Приборы и техника измеренийВ потенциометрическом анализе основными измерительными приборами
являются потенциометры различных типов.
Они предназначены для измерения э.д.с. электродной системы. Так как э.д.с.
зависит от активности соответствующих ионов в растворе, многие потенциометры
позволяют непосредственно измерять также величину рX –отрицательный
десятичный логарифм активности иона Х.
Потенциометр в комплекте с соответствующим ИСЭ носит название иономер.
Если потенциометр и электродная система предназначена для измерения
активности только ионов водорода, прибор называется рН-метр.
19.
Электронный рН-метр20.
самый маленький и дешевый рН-метрСНЕСКЕR1 - модель со сменным
компактным рН-электродом
рН-метр МР 220
АТП-02 – полностью
автоматизированный
высокоточный
потенциометрический
титратор
рН-метр АНИОН-4102


















 chemistry
chemistry








