Similar presentations:
Биоэнергетика. Современное представление о биологическом окислении
1. Военно- Медицинская Академия
Биоэнергетика.Современное представление о биологическом окислении.
Тема:
2.
Детоксикация ксенобиотиковСинтез
Важных
Метаболитов
Устранение Шлаковых
(Вредных вещ-в из клетки –
- продуктов метаболизма)
Функции
биологического
окисления
Регуляция
Обмена
веществ
Энергетическое обеспечение
Химический
Синтез
Осмотическая
Поддержание
Работа
Электрические
toC тела
процессы
Механическая
работа
3.
XVIII век -открытие
1.Ломоносов М.В. - Ме
2Ме + О2
2МеО
(окисл)
2.Лавуазье (1775г.)
S + О2
СО2 + Н2О
(Субстраты продукты питания)
(горение)
О2
4.
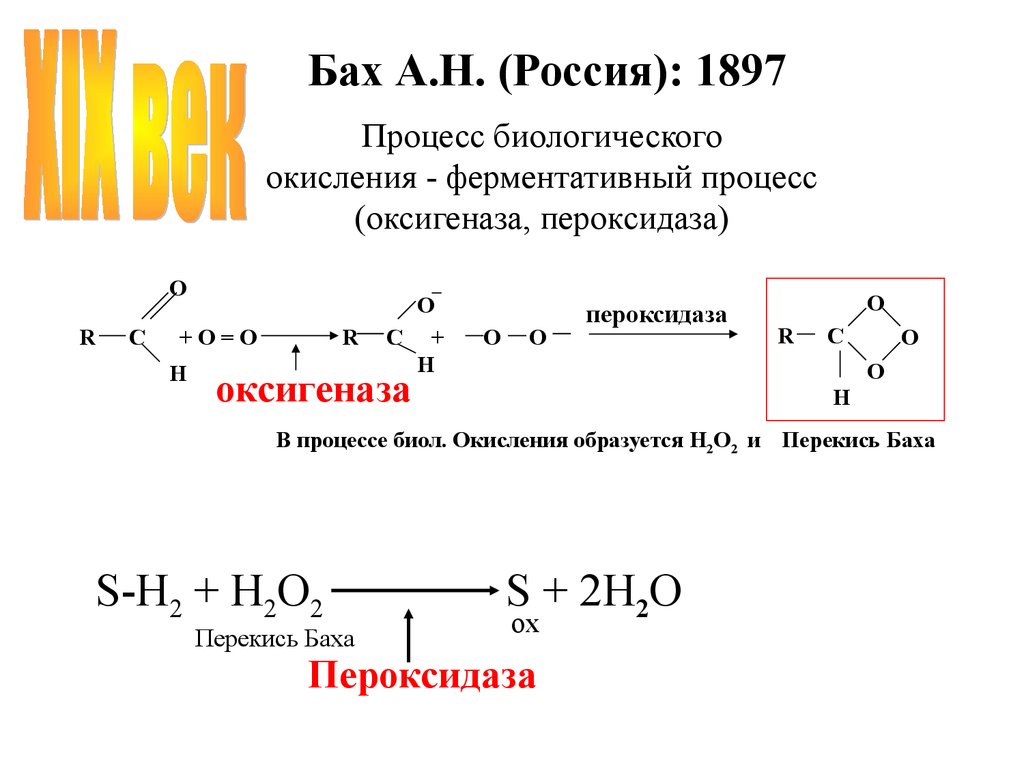
Бах А.Н. (Россия): 1897Процесс биологического
окисления - ферментативный процесс
(оксигеназа, пероксидаза)
O
R
C
+O=O
H
R
O
C +
H
O
O
пероксидаза
O
R
C
O
O
оксигеназа
H
В процессе биол. Окисления образуется H2O2 и Перекись Баха
S-H2 + H2O2
Перекись Баха
S + 2H2O
ох
Пероксидаза
5.
Палладин В.Н. (1912г.){
Многстадийные
процессы
А. SH2 + A
анаэробная фаза акцептор
протонов Н+
Б.
AH2 + /2O2
аэробная фаза
1
Е-цитохромоксидаза (Fe ) + /2O2
+2
1
S + AH2 (восст.)
оксидаза
A
Окисл.
+
H2O
2Н+
Е - цитохромоксидаза (Fe+3) + H2O
(
)
Кейлин -1925 г. - цитохромы (гем - Е)
О. Варбург - 1928г. - цитохромоксидазу
6.
Открытие оксигеназ (введение О2 в молекулу)А. Андре, Хоу (1932)
Б. Хайанши (1955)
1CH=CH
}
ОКСИГЕНАЗЫ
C17H31COOH Линолевая к-та
А
О2
CH3(CH2)4-CH - CH……..R1
ОН
Б
ОН
О
С - ОН
ОН
+ О2
ОН
С - ОН
пирокатехин
О
Муконовая к-та
7.
I Оксидазный: в митохондрияхH
S…………………………………..+ 1/2 O2
H
Многоступенчатый
путь - коферменты
CO2 +H2O + АТФ
80 - 90% по потреблению О2
II Пероксидазный : в макрофагах, фагоцитах, лейкоцитах,
гистиоцитах - флавопротеиды (ФМН, ФАД)
H
S + ФМН
H
SOX + ФМН-Н2
ФМН-Н2 +О2
ФМН + Н2О2
2Н2О2
МПО
2Н2О + О2
*МПО - миэлопероксидаза
8.
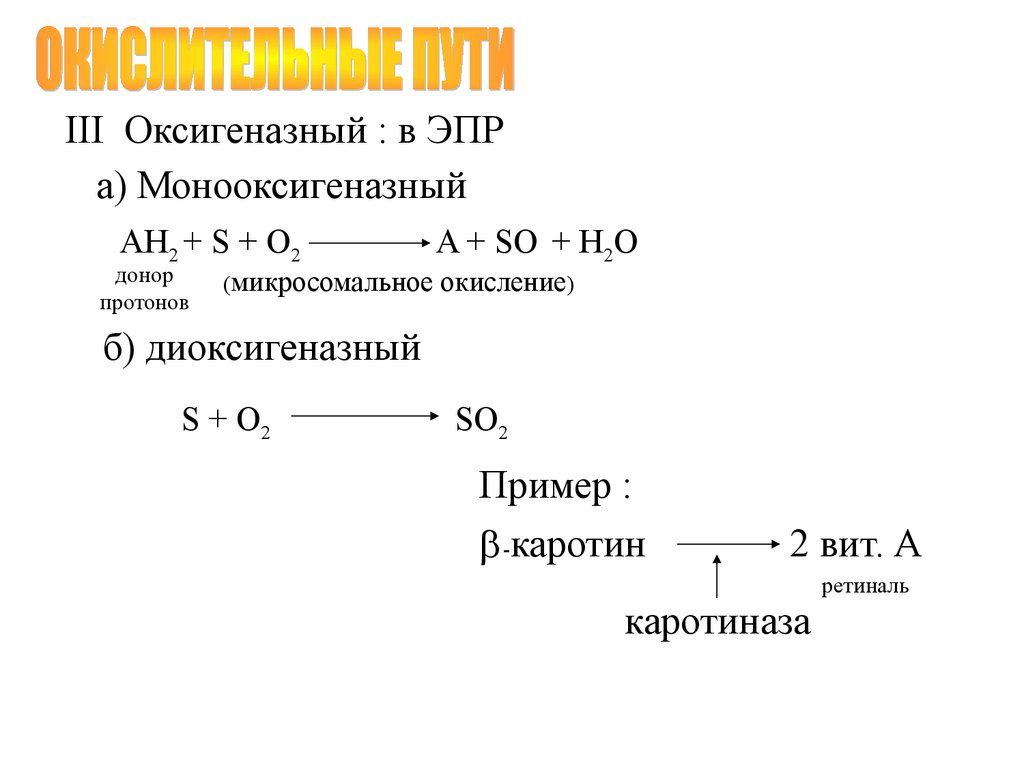
III Оксигеназный : в ЭПРа) Монооксигеназный
АН2 + S + O2
донор
протонов
(микросомальное
A + SO + H2O
окисление)
б) диоксигеназный
S + O2
SO2
Пример :
-каротин
2 вит. А
ретиналь
каротиназа
9.
IV Бесферментный : за счет аномальных форм кислорода:О2-; ОН+; НО.2; Н2О2 ( свободные радикалы*)
О2 + е
О2- (супероксид)
.
О2 + Н
2О2- + 2Н
Н2О2
НО2 (пероксидный
*СОД радикал)
- супероксиддисмутаза
.
О2 + Н2О2
ОН+ + ОН-
ПОЛ мембран
R
R
CH НО2
CH2
CH
CHOOH
R1
R1
Окисление
белков
мембран
(перекись жирной кислоты)
Изменение
функций
клеток
10.
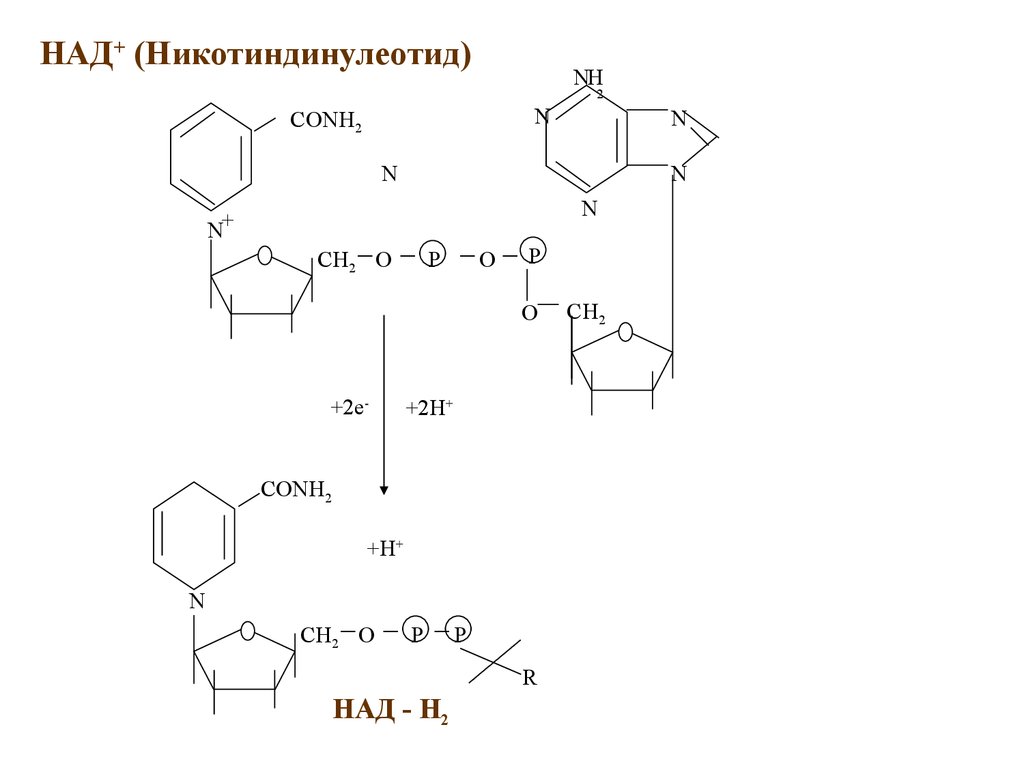
НАД+ (Никотиндинулеотид)NH
2
N
CONH2
N
N
N
N
N+
CH2 O
P
O
P
O
+2e-
+2H+
CONH2
+H+
N
CH2 O
P
P
R
НАД - H2
CH2
11.
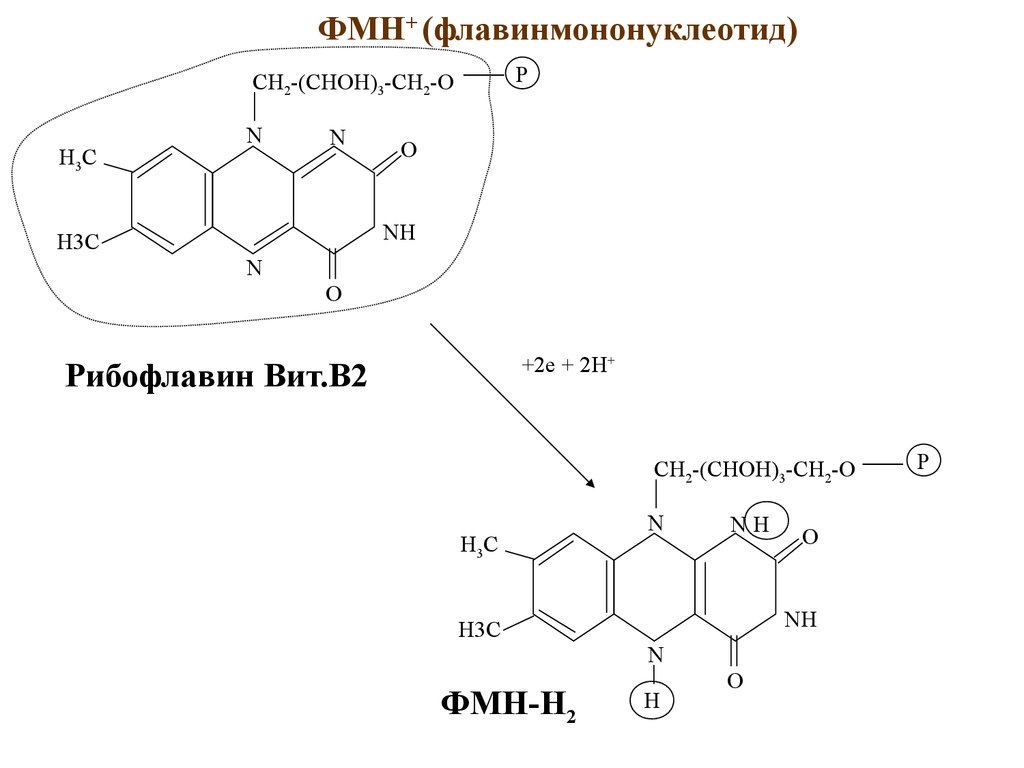
ФМН+ (флавинмононуклеотид)P
CH2-(CHOH)3-CH2-O
H3C
N
N
O
NH
H3C
N
O
+2e + 2H+
Рибофлавин Вит.B2
CH2-(CHOH)3-CH2-O
H3C
N
NH
NH
H3C
N
ФМН-Н2
O
H
O
P
12.
Убихинон - КоQO
CH3
CH3
O
CH3
O
R
O
R-C
10
(Q10)
+2H+
2e-
OH
CH3
O
CH3
O
R
CH3
Убигидрохинон - КоQ - H2
OH
13.
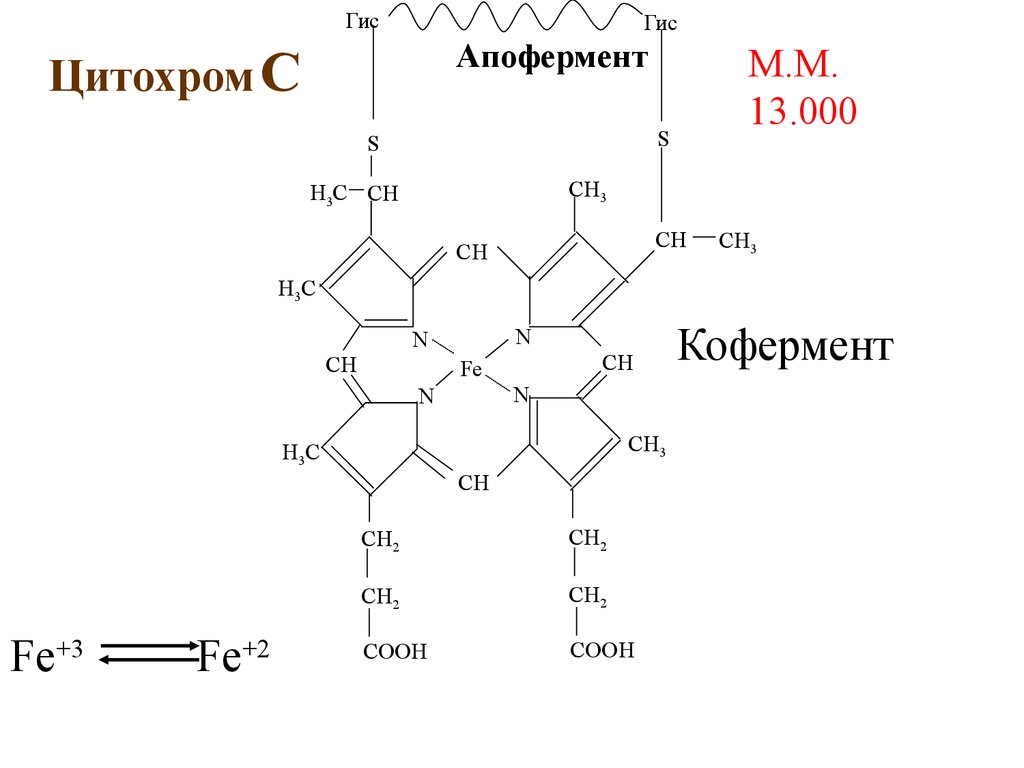
ГисГис
Апофермент
Цитохром С
М.М.
13.000
S
S
CH3
H3C CH
CH
CH
CH3
H3C
N
N
CH
CH
Fe
N
N
CH3
H3C
CH
Fe+3
Fe+2
СН2
СН2
СН2
СН2
СООН
СООН
Кофермент
14.
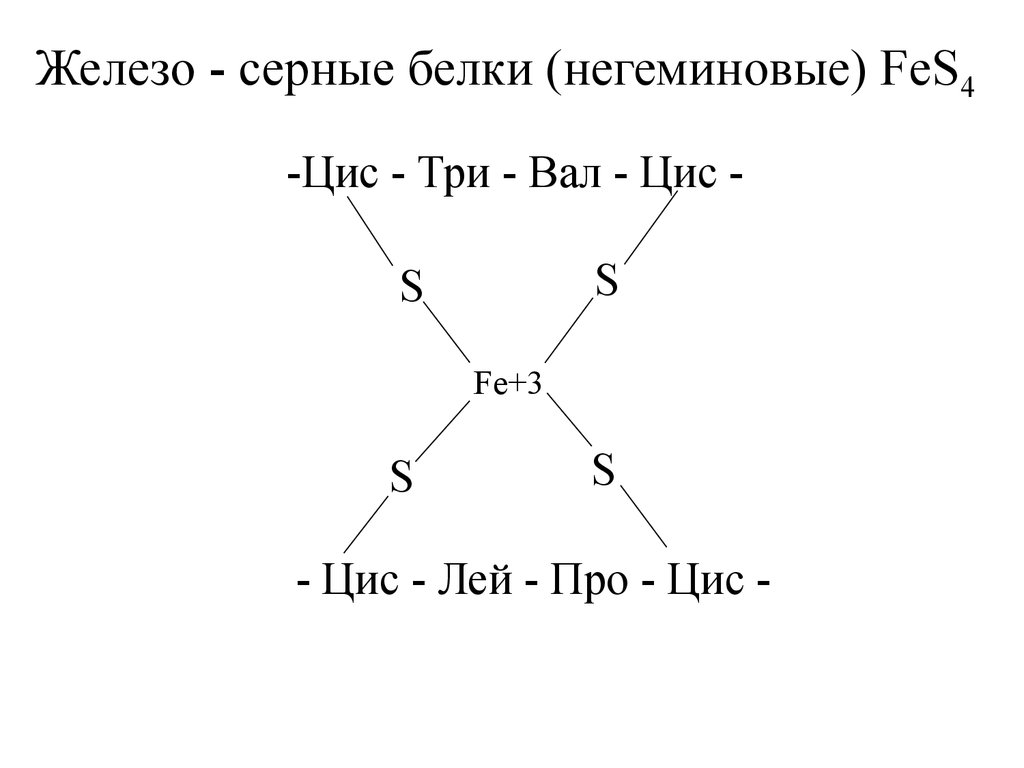
Железо - серные белки (негеминовые) FeS4-Цис - Три - Вал - Цис S
S
Fe+3
S
S
- Цис - Лей - Про - Цис -
15.
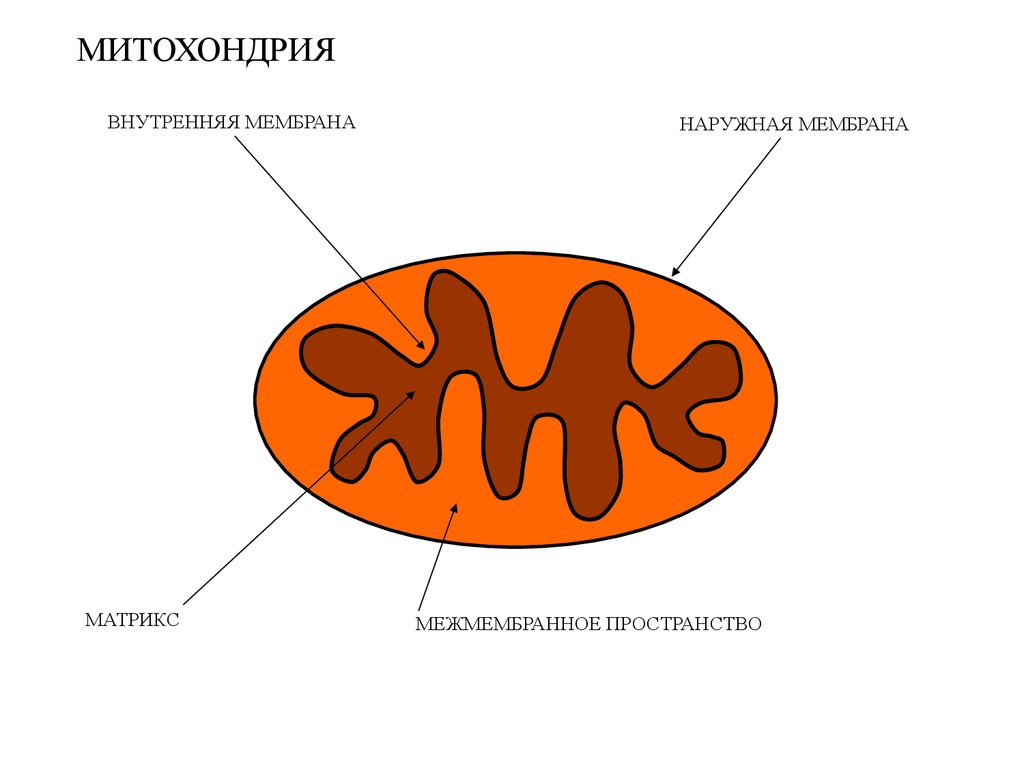
МИТОХОНДРИЯВНУТРЕННЯЯ МЕМБРАНА
МАТРИКС
НАРУЖНАЯ МЕМБРАНА
МЕЖМЕМБРАННОЕ ПРОСТРАНСТВО
16.
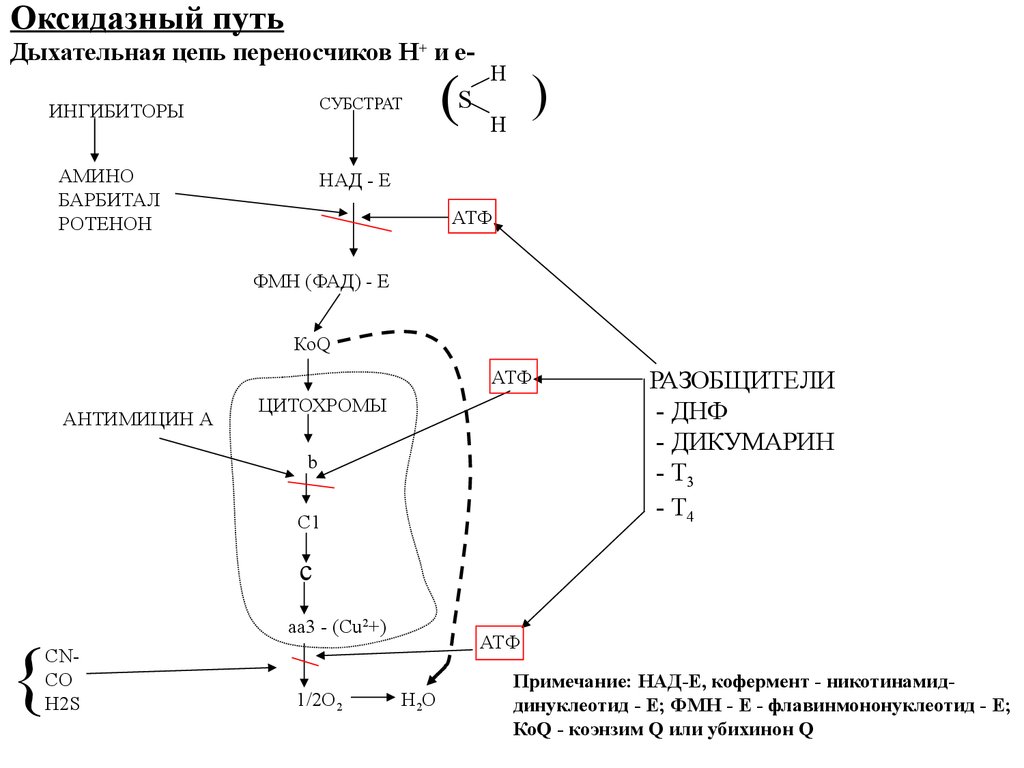
Оксидазный путьДыхательная цепь переносчиков Н+ и еСУБСТРАТ
ИНГИБИТОРЫ
АМИНО
БАРБИТАЛ
РОТЕНОН
(S
H
)
H
НАД - Е
АТФ
ФМН (ФАД) - Е
КоQ
АТФ
АНТИМИЦИН А
ЦИТОХРОМЫ
b
C1
РАЗОБЩИТЕЛИ
- ДНФ
- ДИКУМАРИН
- Т3
- Т4
c
{
CNCO
H2S
aa3 - (Cu2+)
1/2O2
АТФ
H2O
Примечание: НАД-Е, кофермент - никотинамиддинуклеотид - Е; ФМН - Е - флавинмононуклеотид - Е;
КоQ - коэнзим Q или убихинон Q
17.
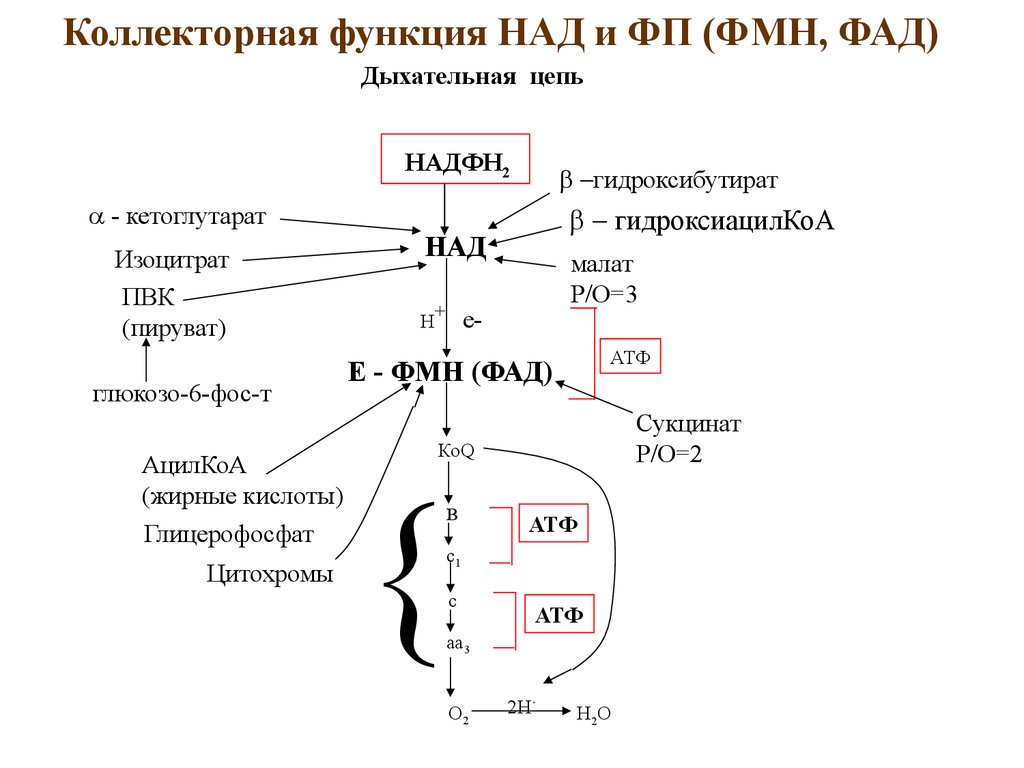
Коллекторная функция НАД и ФП (ФМН, ФАД)Дыхательная цепь
НАДФН2
гидроксибутират
- кетоглутарат
Изоцитрат
ПВК
(пируват)
глюкозо-6-фос-т
АцилКоА
(жирные кислоты)
Глицерофосфат
Цитохромы
гидроксиацилКоА
НАД
Н
+
малат
Р/О=3
е-
АТФ
Е - ФМН (ФАД)
Сукцинат
Р/О=2
КоQ
{
в
АТФ
с1
с
АТФ
аа3
О2
2Н
.
Н 2О
18.
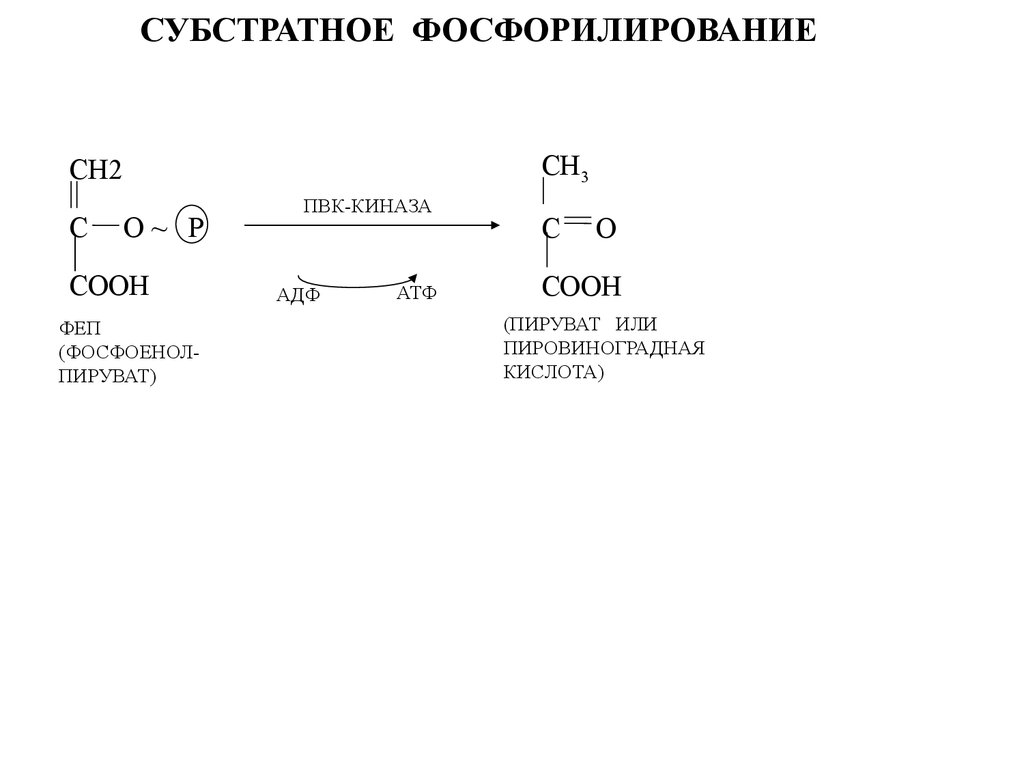
СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕСН3
СН2
С
O~ Р
СООН
ФЕП
(ФОСФОЕНОЛПИРУВАТ)
ПВК-КИНАЗА
АДФ
АТФ
С
O
СООН
(ПИРУВАТ ИЛИ
ПИРОВИНОГРАДНАЯ
КИСЛОТА)
19.
W + АДФ + ФнеоргЭнергия
АТФ + Н2О
1936 г. проф. Энгельгардт В.Н.
Р/О = 3
1940 - 41 г. проф. Белицер
(Киев) АТФ
АДФ + 7,6 ккал + Фн
20.
Теория Митчела. Окислительное фосфорилированиеТеория Метчела (1964 г.)
1978 - Нобелевская премия
Внутреняя мембрана
МАТРИКС
e- - -
Избыток
[OH-][H+]
{
Н 2О
АДФ
+
Н3РО4
-
+
+
+
+
+
+
2H+
2H+
Биологическое окисление -за ряжает мембрану
Окислитеоьное фосфорилирование-раз ряжает
2H+
+
АТФ - синтаза
АТФ
H+
OH-
Избыток
[H+]+[OH-]
Н2О
21.
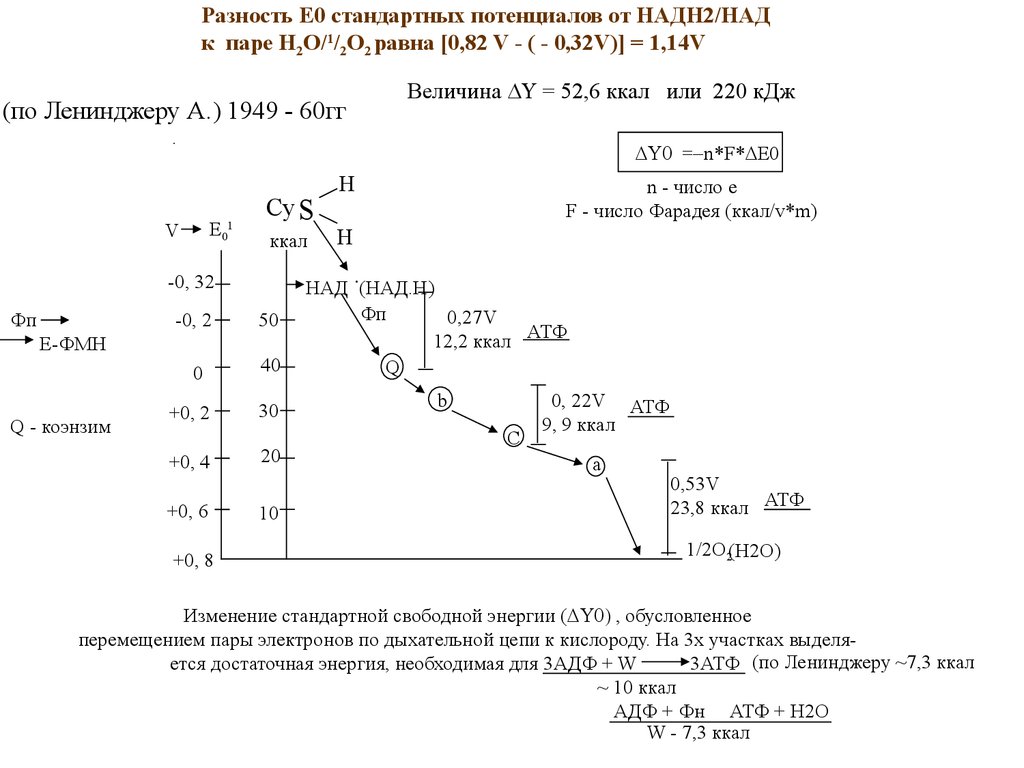
Разность Е0 стандартных потенциалов от НАДН2/НАДк паре Н2О/1/2О2 равна [0,82 V - ( - 0,32V)] = 1,14V
Величина = 52,6 ккал или 220 кДж
(по Ленинджеру А.) 1949 - 60гг
.
= n*F* E0
Е01
V
Су S
ккал
-0, 2
50
0
40
Е-ФМН
Q - коэнзим
+0, 2
30
+0, 4
20
+0, 6
10
+0, 8
n - число е
F - число Фарадея (ккал/v*m)
H
.
-0, 32
Фп
H
НАД (НАД.Н)
Фп
0,27V
12,2 ккал АТФ
Q
b
C
0, 22V АТФ
9, 9 ккал
a
0,53V
23,8 ккал АТФ
1/2O2(H2O)
Изменение стандартной свободной энергии ( , обусловленное
перемещением пары электронов по дыхательной цепи к кислороду. На 3х участках выделяется достаточная энергия, необходимая для 3АДФ + W
3АТФ (по Ленинджеру ~7,3 ккал
~ 10 ккал
АДФ + Фн АТФ + Н2О
W - 7,3 ккал
22.
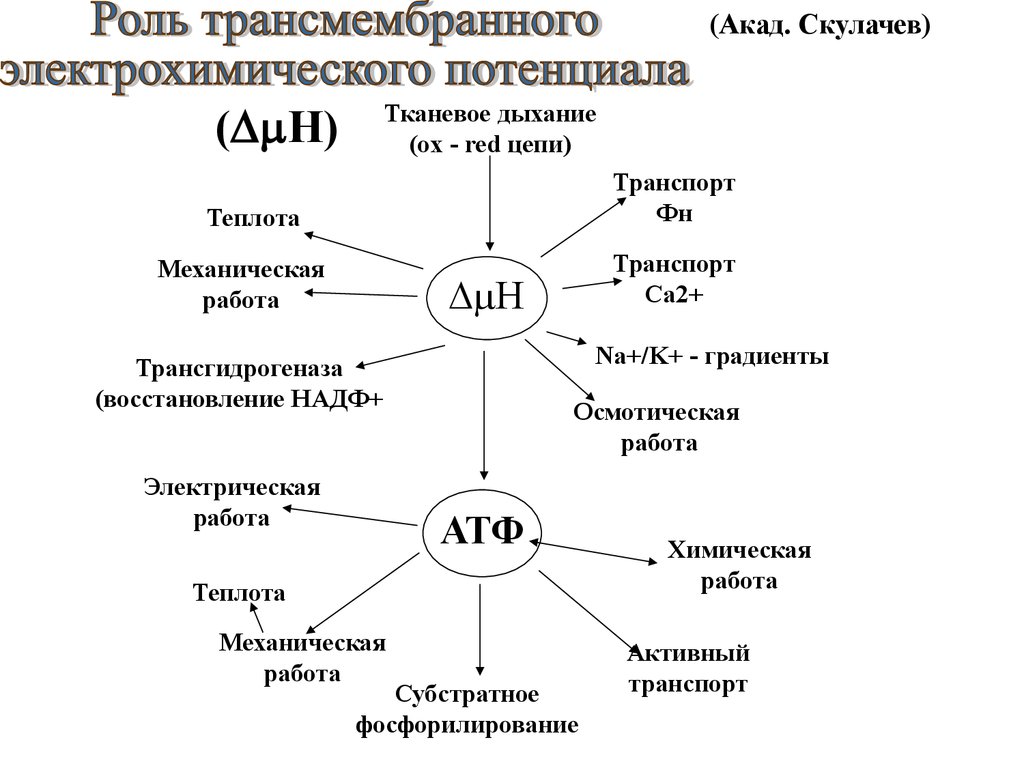
(Акад. Скулачев)Тканевое дыхание
(ox - red цепи)
( H)
Транспорт
Фн
Теплота
Механическая
работа
Транспорт
Са2+
H
Na+/K+ - градиенты
Трансгидрогеназа
(восстановление НАДФ+
Электрическая
работа
Осмотическая
работа
АТФ
Теплота
Механическая
работа
Субстратное
фосфорилирование
Химическая
работа
Активный
транспорт
23.
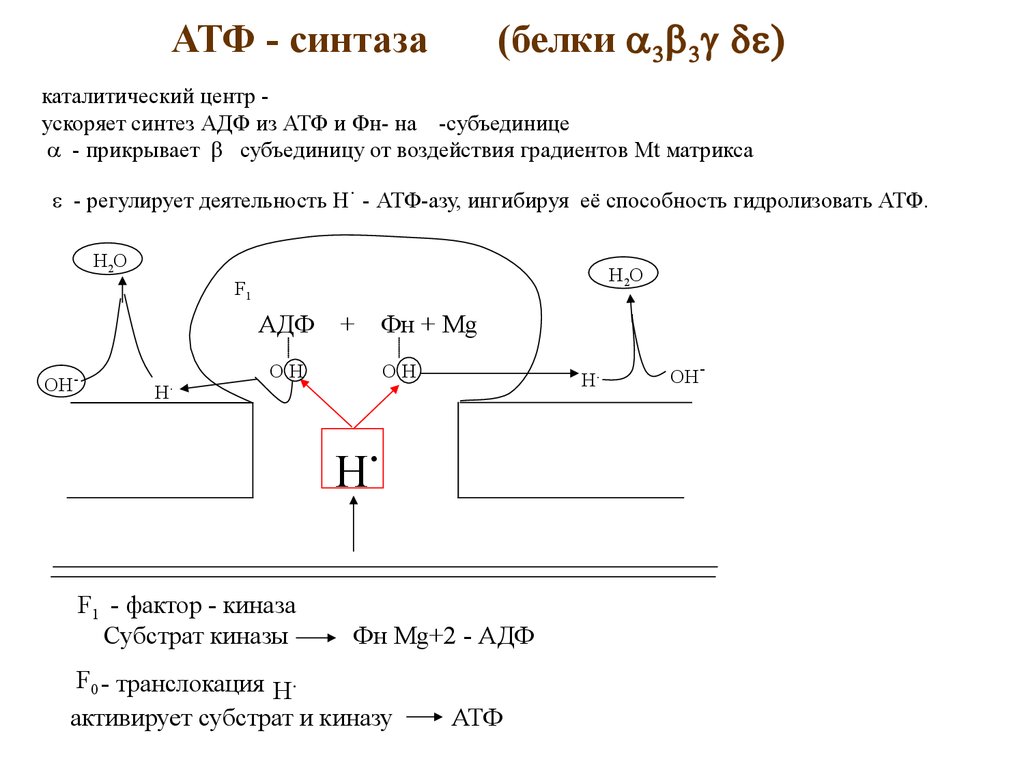
(белкиАТФ - синтаза
каталитический центр ускоряет синтез АДФ из АТФ и Фн- на -субъединице
- прикрывает субъединицу от воздействия градиентов Mt матрикса
.
- регулирует деятельность Н - АТФ-азу, ингибируя её способность гидролизовать АТФ.
H 2O
H2O
F1
АДФ
OH-
H
.
+
Фн + Mg
OH
OH
H
F1 - фактор - киназа
Субстрат киназы
H.
.
Фн Mg+2 - АДФ
F0 - транслокация H.
активирует субстрат и киназу
АТФ
OH-
24.
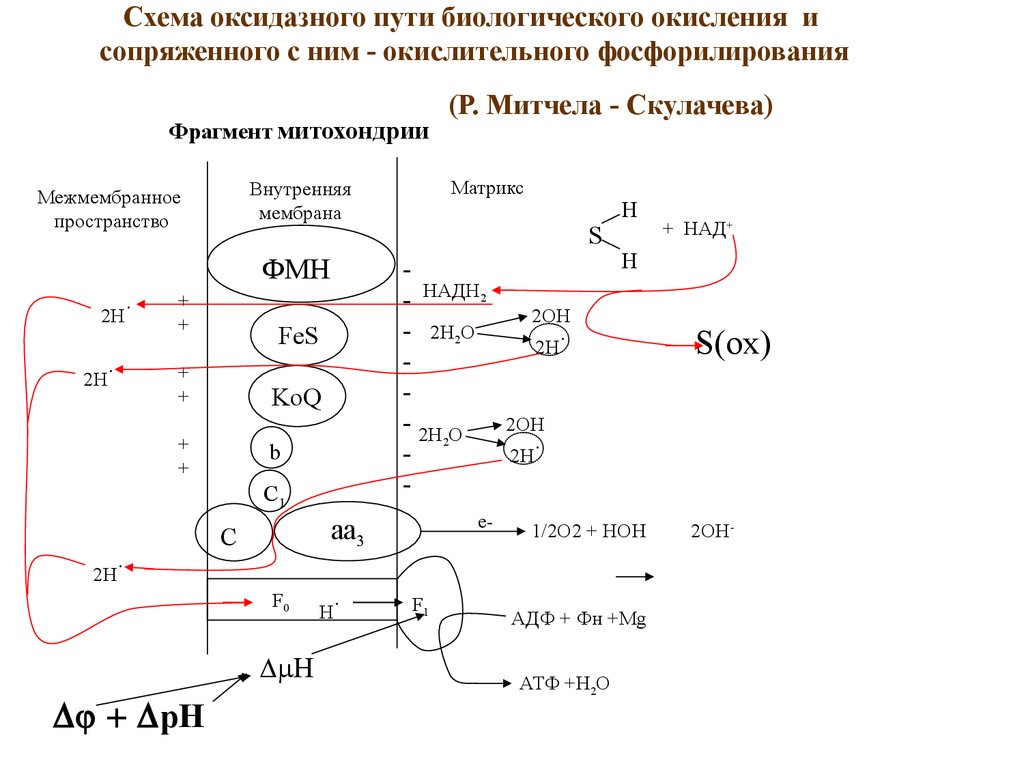
Схема оксидазного пути биологического окисления исопряженного с ним - окислительного фосфорилирования
Фрагмент митохондрии
ФМН
2Н
2Н
.
.
+
+
+
+
KoQ
b
C1
.
е-
aa3
C
F0
H
pH
S
- НАДН2
- 2Н2О
- 2Н О
2
-
FeS
+
+
2Н
Матрикс
Внутренняя
мембрана
Межмембранное
пространство
(Р. Митчела - Скулачева)
Н
.
F1
H
H
2ОН
2Н
+ НАД+
.
S(ox)
2ОН
2Н
.
1/2О2 + НОН
АДФ + Фн +Mg
АТФ +Н2О
2ОН-
25.
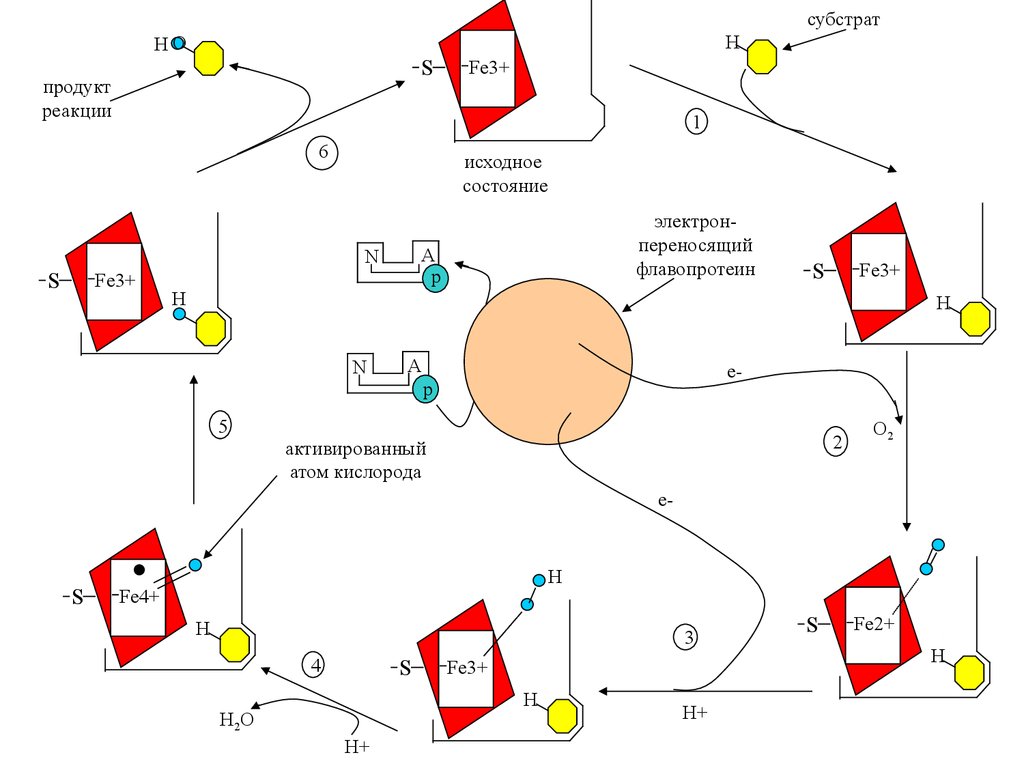
субстратH
HO
S
продукт
реакции
1
6
исходное
состояние
Fe3+
электронпереносящий
флавопротеин
A
p
N
S
Fe3+
S
Fe3+
H
H
N
5
A
e-
p
2
активированный
атом кислорода
O2
e-
S
H
Fe4+
H
3
4
S
Fe3+
H
H 2O
H+
H+
S
Fe2+
H










 biology
biology chemistry
chemistry








