Similar presentations:
Метаболизм. Биоэнергетика
1.
МЕТАБОЛИЗМ.БИОЭНЕРГЕТИКА
Svetlana Protopop
doctor în științe medicale,
conferențiar universitar
2.
Метаболизм (обмен веществ)совокупность превращений веществ,
начиная с их поступления в организм до
образования конечных продуктов (СО2, Н2О
и NH3).
• Внешний метаболизм (внеклеточный) –
включает превращения веществ на путях их
поступления и выделения из клетки.
• Промежуточный метаболизм
(внутриклеточный).
3.
Функции метаболизма• Обеспечение организма доступной энергией в
виде макроэргических соединений.
• Расщепление макромолекул на «строительные
блоки» для синтеза необходимых организму
веществ.
• Синтез необходимых веществ (белков,
углеводов, липидов, нуклеиновых кислот).
• Синтез и расщепление специализированных
биологически активных веществ (гормонов,
биогенных аминов).
4.
Метаболические пути• Метаболизм состоит из химических
реакций и метаболических путей.
• Метаболический путь –
последовательность химических реакций, в
ходе которых субстрат превращается в
конечный продукт.
• Каждая реакция метаболического пути
катализируется отдельным ферментом.
5.
Метаболические пути• Центральные – общие для синтеза и
расщепления основных классов веществ
(белков, углеводов, липидов).
• Специфические – характерные для синтеза
и расщепления индивидуального вещества
(гормон, биогенный амин, медиатор,
кофермент).
6.
Метаболические пути• Линейные.
Примеры: гликолиз, глюконеогенез.
• Циклические.
Примеры: цикл Кребса, синтез мочевины.
• Разветвленные.
Примеры: синтез триглицеридов и
фосфолипидов, синтез холестерола и
кетоновых тел.
7.
Фазы метаболизма• Катаболизм – расщепление сложных
веществ до простых конечных продуктов
(СО2, Н2О и NH3). Катаболические
процессы сопровождаются выделением
энергии (экзергонические процессы).
• Анаболизм – синтез сложных веществ из
простых веществ. В анаболических
процессах используется энергия
(эндергонические процессы).
8.
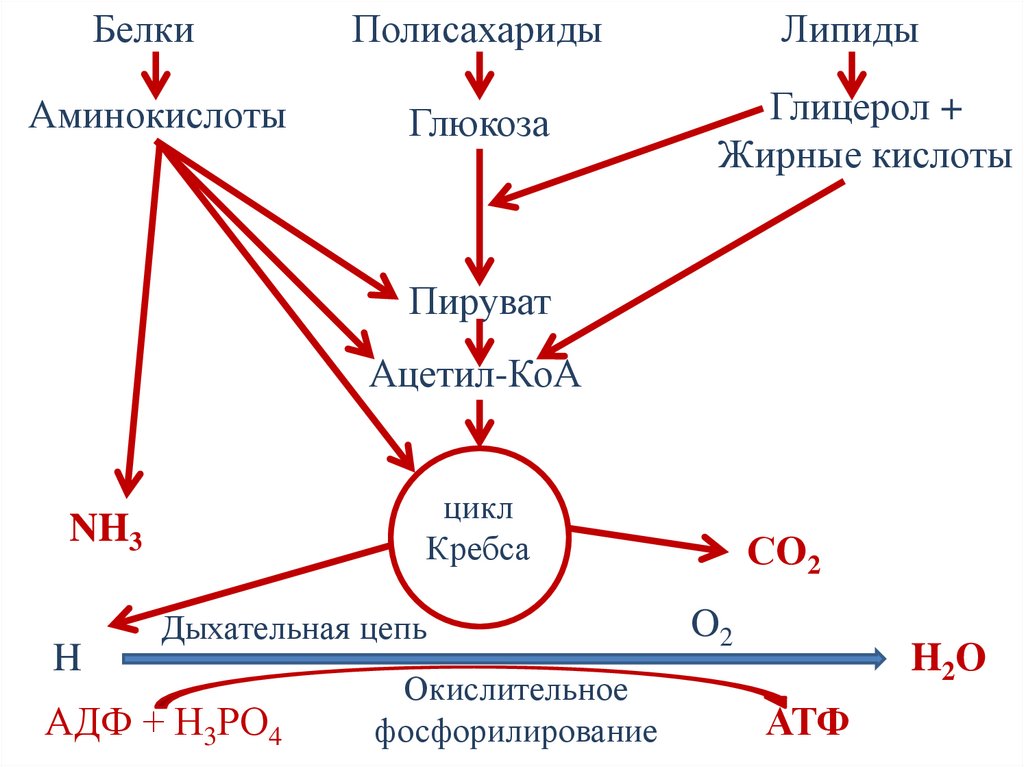
Этапы катаболизма• I этап – расщепление полимеров до мономеров,
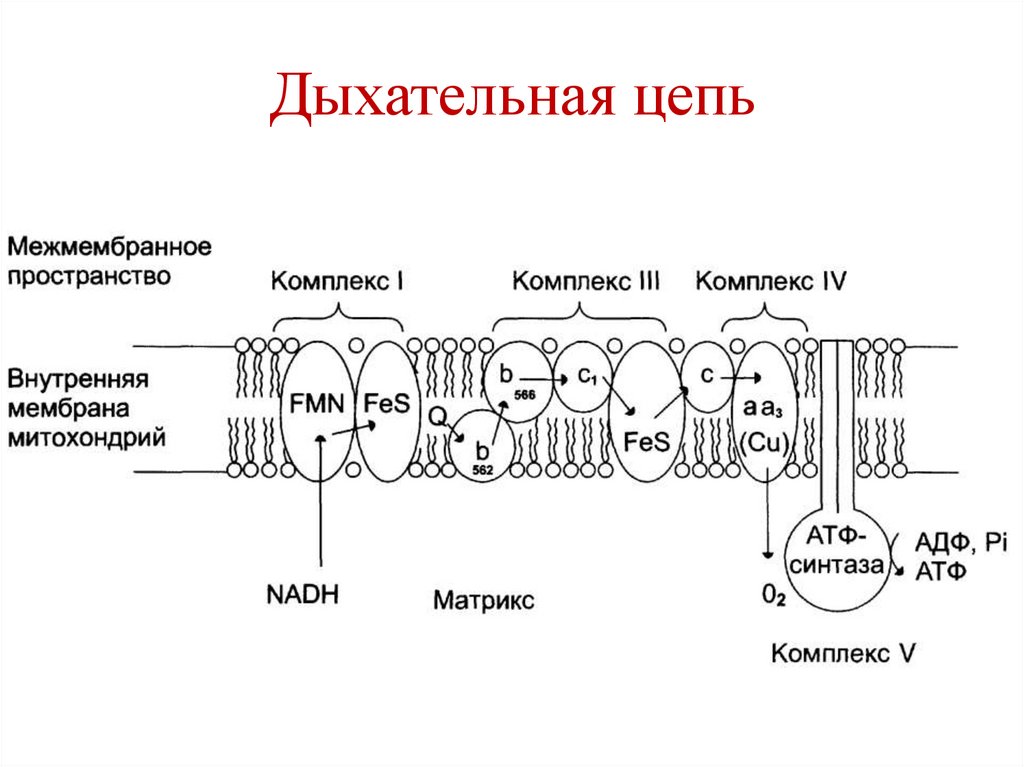
протекает в ЖКТ, не сопровождается
образованием полезной энергии.
• II этап – расщепление мономеров до общего
метаболита – ацетил-СоА. Образуется ≈20%
энергии.
• III этап – расщепление ацетил-СоА до конечных
продуктов (СО2 и Н2О). Включает цикл Кребса,
дыхательную цепь и окислительное
фосфорилирование. Образуется ≈ 80% энергии.
9.
БелкиПолисахариды
Липиды
Аминокислоты
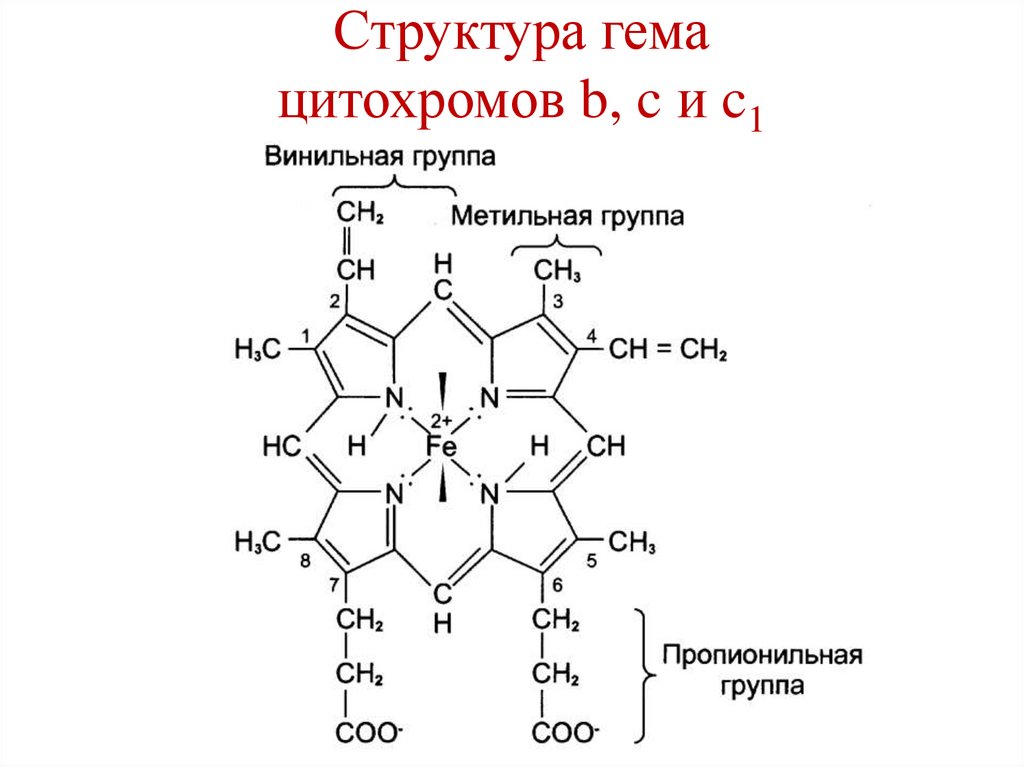
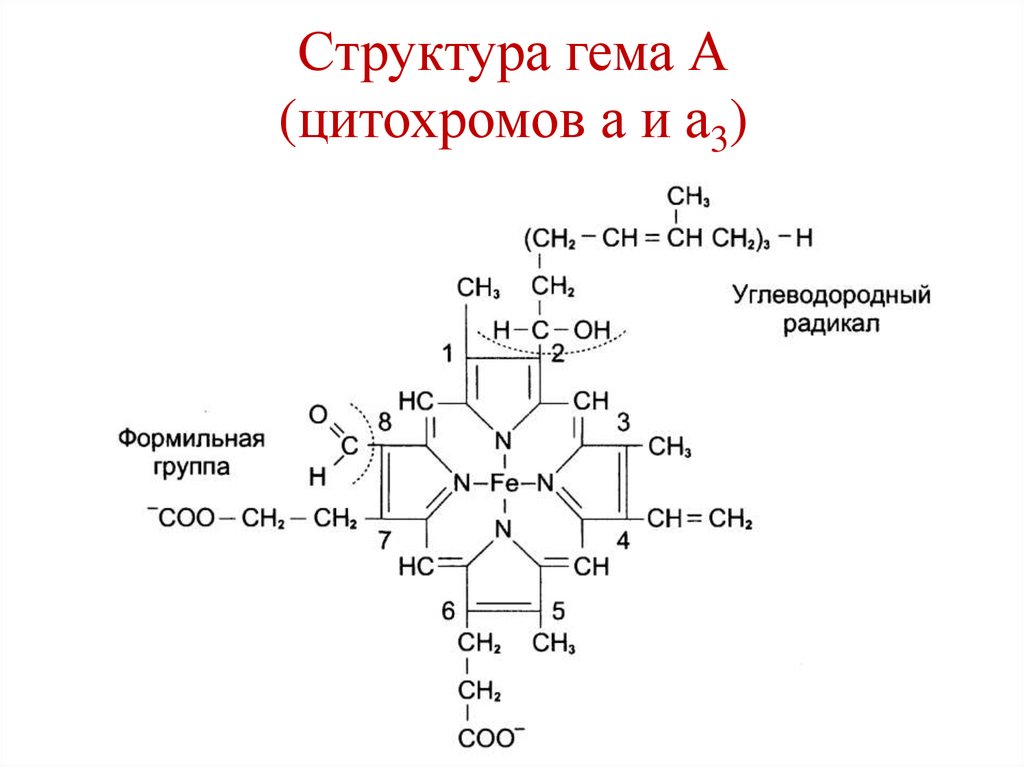
Глюкоза
Глицерол +
Жирные кислоты
Пируват
Ацетил-КоА
цикл
Кребса
NH3
H
Дыхательная цепь
АДФ + Н3РО4
Окислительное
фосфорилирование
СO2
O2
H2O
АТФ
10.
Анаболизмпротекает в обратном направлении катаболизму
с определенными особенностями:
Локализация
Энергия
Регуляция
Катаболизм
Анаболизм
Митохондрии,
Обычно
лизосомы
цитоплазма
Выделение
Использование
Активаторы катаболизма обычно
являются ингибиторами
анаболизма и наоборот.
11.
Законы термодинамики• I закон – закон сохранения энергии;
общая энергия системы и окружающей среды
– величина постоянная.
• II закон – все процессы в системе стремятся к
необратимому переходу полезной энергии в
хаотическую форму.
12.
Термодинамические системы• Биологические системы являются открытыми
термодинамическими системами –
обмениваются с внешней средой и материей, и
энергией.
13.
Свободная энергия• Каждая термодинамическая система обладает
определенной внутренней энергией (∆Е),
которая состоит из свободной и связанной
энергии.
• Свободная энергия (∆G) – та часть энергии
системы, которая может быть использована
для совершения работы при постоянной
температуре и давлении.
14.
Свободная энергияСвязанная энергия (Т∆S) – та часть энергии
системы, которая не может быть использована
для совершения работы:
• Т – абсолютная температура;
• ∆S – энтропия.
∆Е = ∆G + Т∆S
Стандартная свободная энергия – ∆G0´
Стандартные условия:
t = 25ºС; рН = 7; концентрация – 1 моль/л.
15.
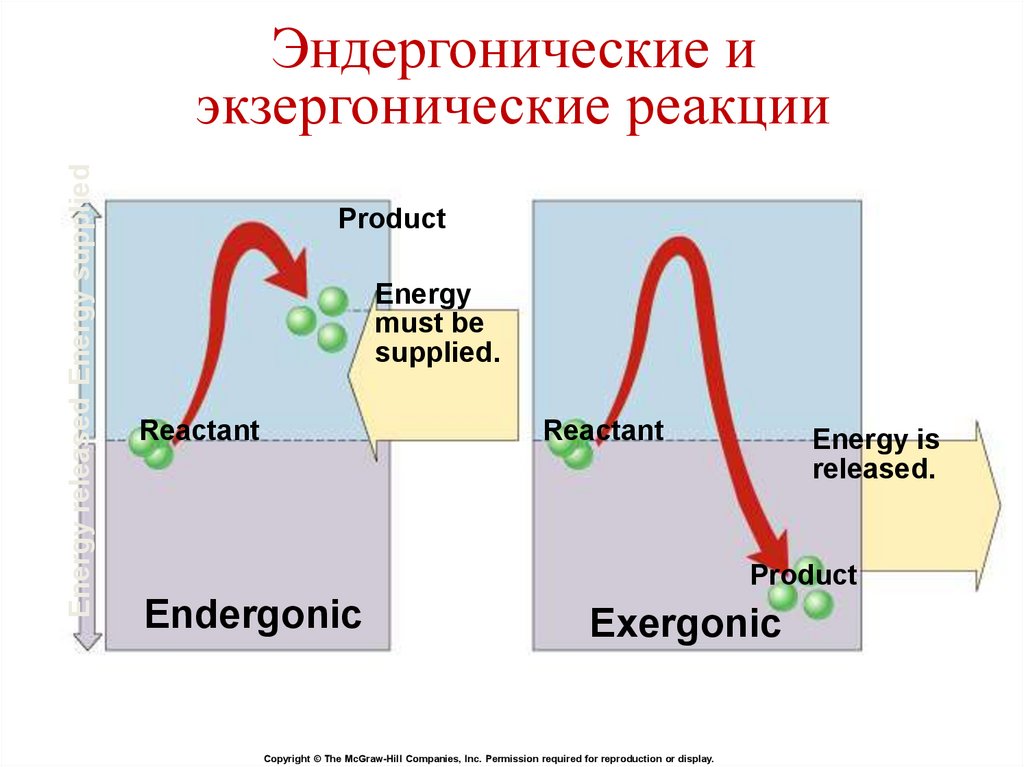
Свободная энергияЗначение ∆G определяет направление
химической реакции.
1. ∆G ˂ 0. Реакция протекает самопроизвольно
и сопровождается уменьшением свободной
энергии – экзергонические реакции.
2. ∆G ˃ 0. Реакция нуждается в поступлении
свободной энергии извне – эндергонические
реакции.
3. ∆G = 0. Реакция находится в состоянии
равновесия.
16.
Energy released Energy suppliedЭндергонические и
экзергонические реакции
Product
Energy
must be
supplied.
Reactant
Reactant
Energy is
released.
Product
Endergonic
Exergonic
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
17.
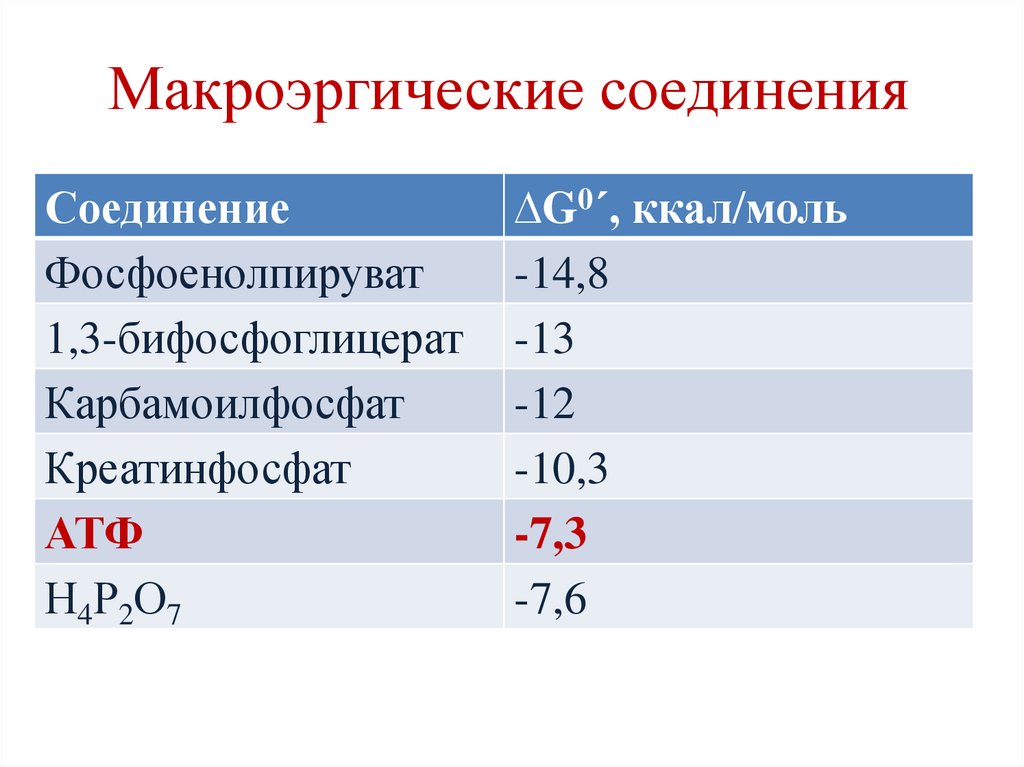
Макроэргические соединенияхимические соединения, содержащие
химические связи, при расщеплении которых
выделяется ≥ 5 ккал/моль энергии.
Связи называются макроэргическими и
обозначаются ~.
Макроэргические вещества выполняют
функцию энергетических посредников
(переносчики энергии от катаболических к
анаболическим процессам).
18.
Макроэргические соединенияСоединение
Фосфоенолпируват
1,3-бифосфоглицерат
Карбамоилфосфат
Креатинфосфат
АТФ
Н4Р2О7
∆G0´, ккал/моль
-14,8
-13
-12
-10,3
-7,3
-7,6
19.
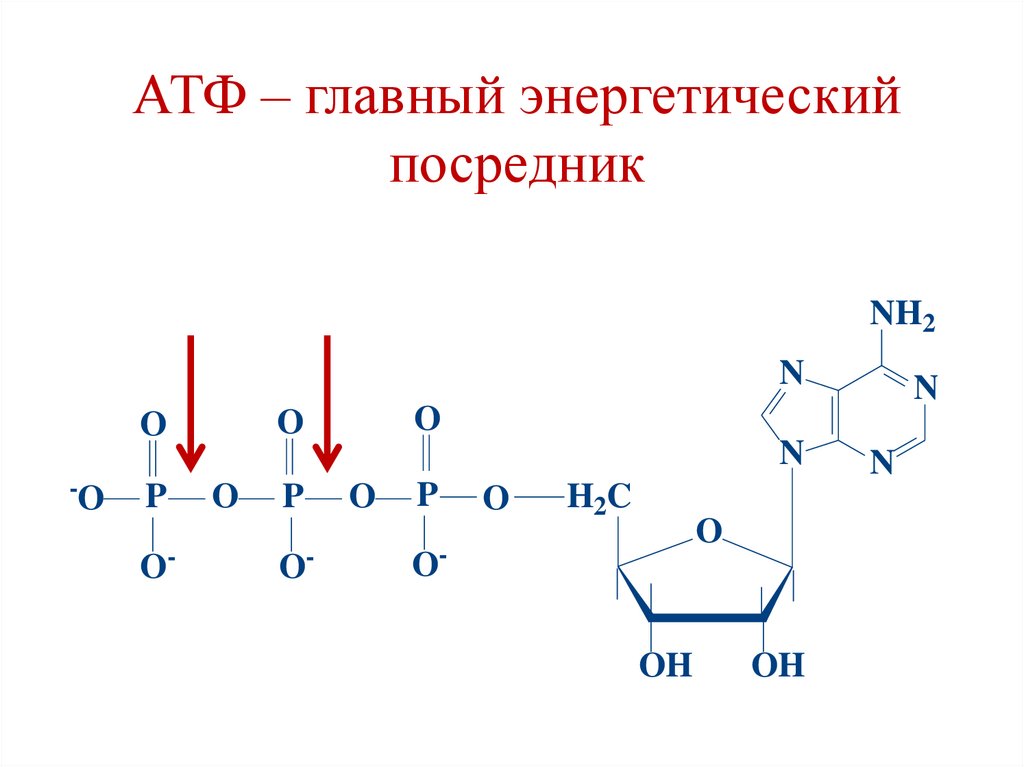
АТФ – главный энергетическийпосредник
NH2
N
-O
P
O-
O
O
O
O
P
O-
N
N
O
P
O
H2C
O
OOH
OH
N
20.
Варианты гидролиза АТФ1. АТФ + Н2О → АДФ + Н3РО4;
-7,3 ккал/моль
2.
а) АТФ + Н2О → АМФ + Н4Р2О7;
-7,3 ккал/моль
b) Н4Р2О7 + Н2О → 2 Н3РО4;
-7,6 ккал/моль
-14,9 ккал/моль
21.
Механизмы синтеза АТФ1. Окислительное фосфорилирование – синтез
АТФ, сопряженный с переносом электронов
по дыхательной цепи.
АДФ + Н3РО4 → АТФ
2. Субстратное фосфорилирование – синтез
АТФ за счет энергии гидролиза
супрамакроэргических соединений.
22.
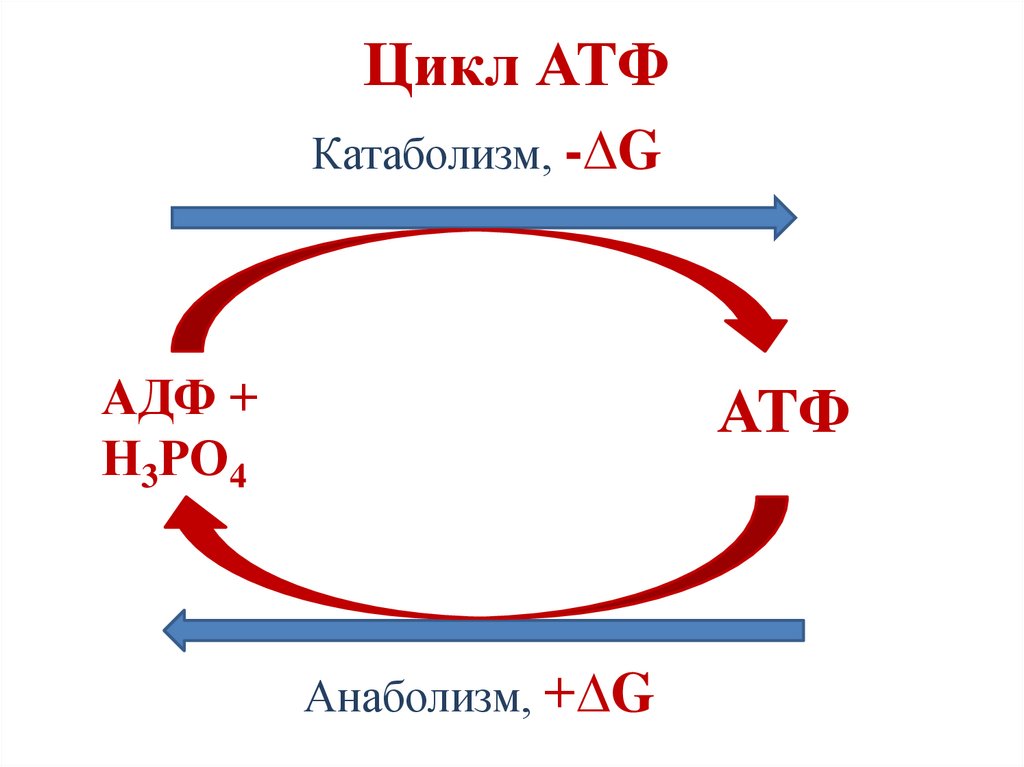
Реакции субстратного фосфорилирования23.
Цикл АТФКатаболизм, -∆G
АДФ +
Н3РО4
АТФ
Анаболизм, +∆G
24.
Энергетическое состояние клеткихарактеризует «заполнение» клетки
макроэргическими связями (энергией).
Показатели энергетического состояния:
Энергетический заряд:
[ATP]+1/2[ADP]
[ATP]+[ADP]+[AMP]
N – 0,8-0,95
25.
Регуляция внутриклеточногометаболизма
Аллостерическая регуляция
Ковалентная регуляция
Индукция и репрессия
Регуляция энергетическим состоянием
клетки.
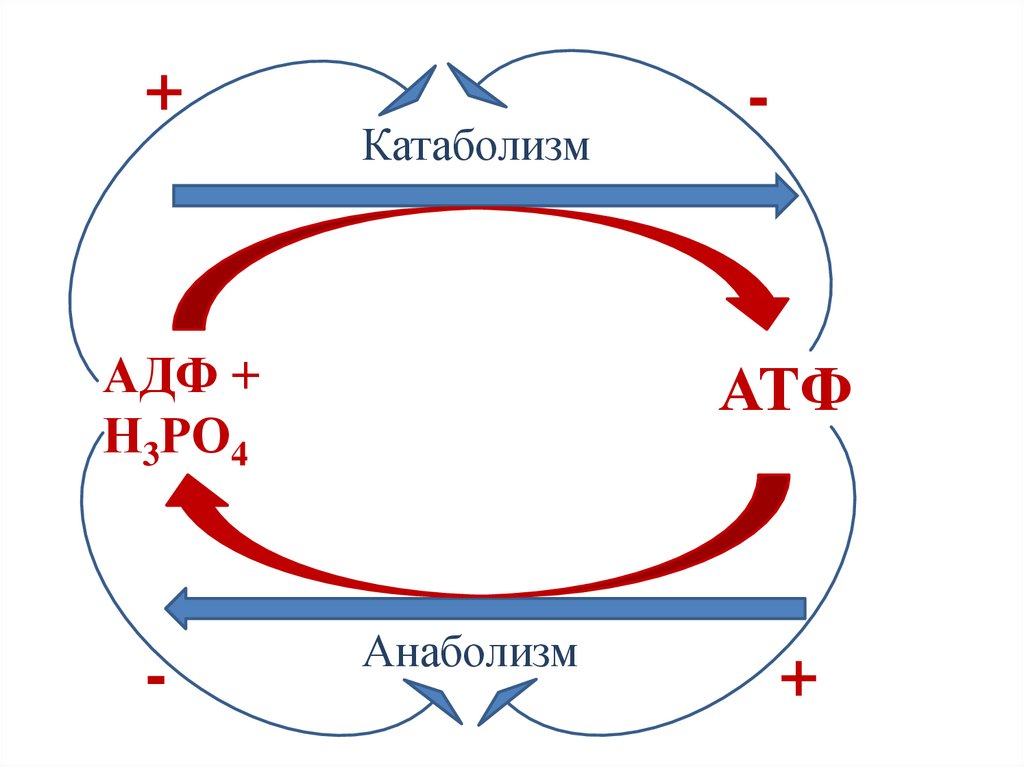
26.
+Катаболизм
АДФ +
Н3РО4
-
-
АТФ
Анаболизм
+
27.
Регуляция энергетическим состоянием клеткиКатаболические процессы ингибируются АТФ
(является продуктом катаболических путей),
но активируются АМФ, АДФ (являются
субстратами катаболических путей).
Анаболические процессы активируются АТФ
(является субстратом анаболических путей), но
ингибируются АМФ, АДФ (являются
продуктами анаболических путей).
28.
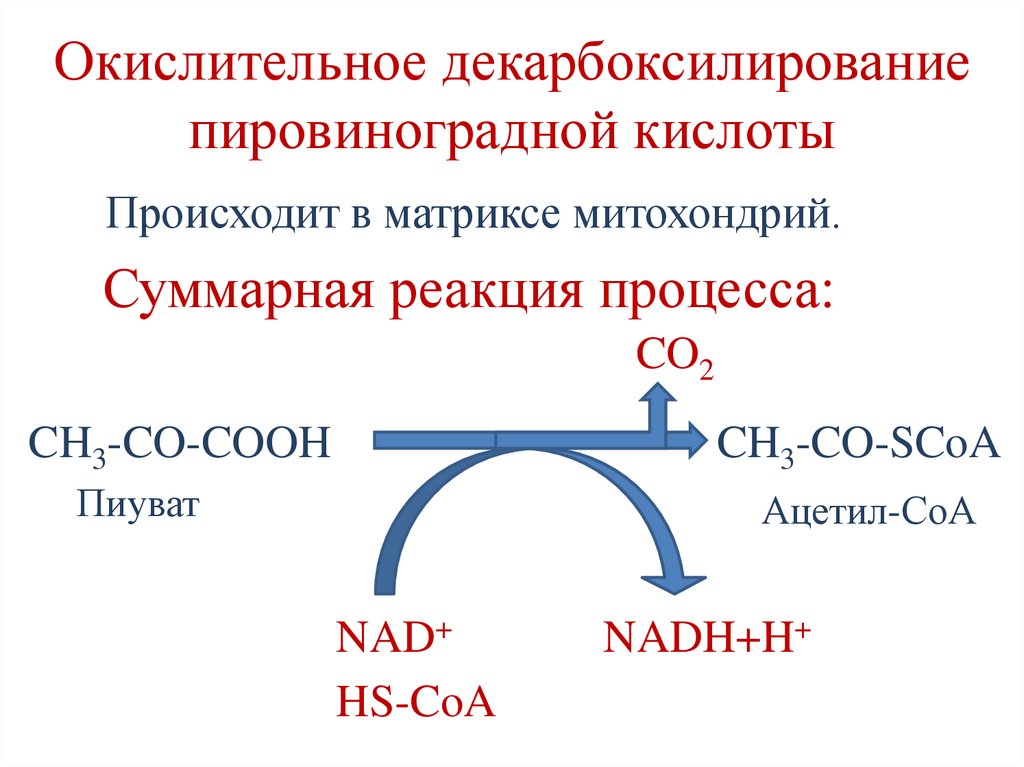
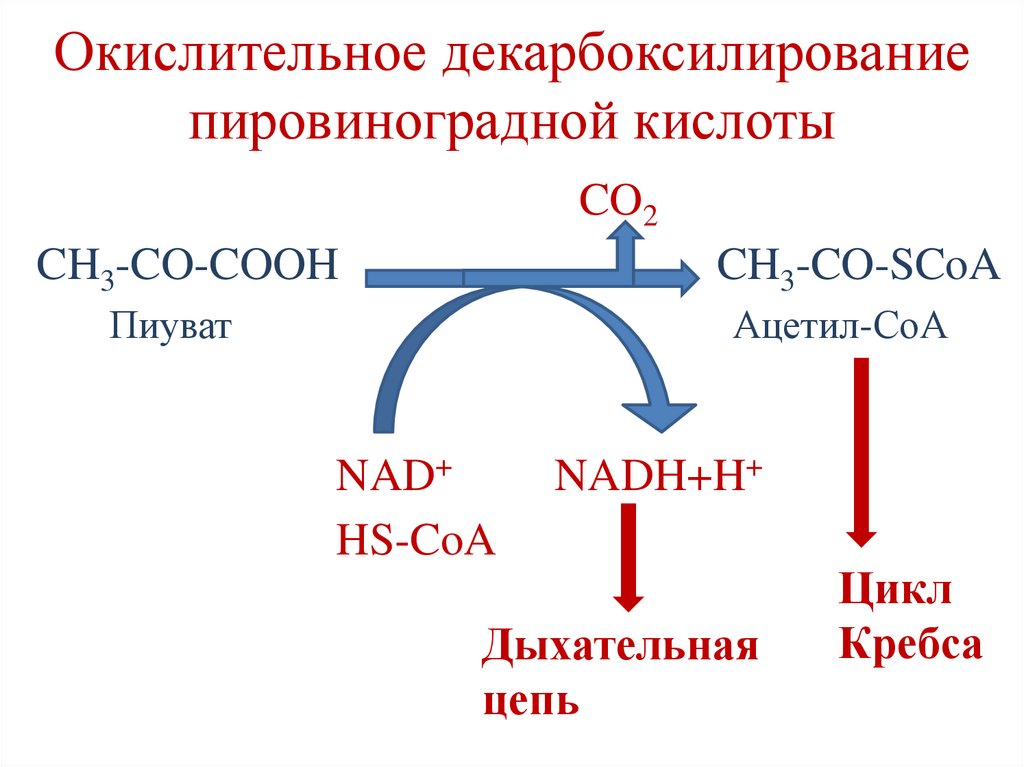
Окислительное декарбоксилированиепировиноградной кислоты
Происходит в матриксе митохондрий.
Суммарная реакция процесса:
CO2
CH3-CO-COOH
CH3-CO-SCoA
Пиуват
Ацетил-СоА
NAD+
HS-CoA
NADH+H+
29.
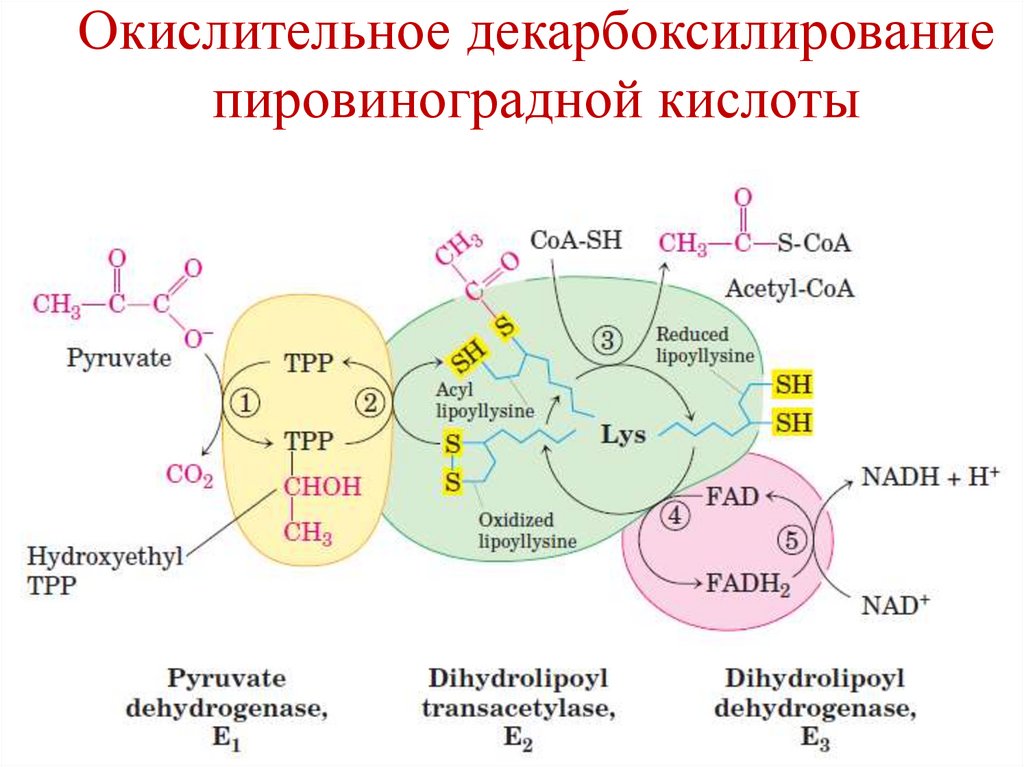
Окислительное декарбоксилированиепировиноградной кислоты
Происходит с участием
пируватдегидрогеназного комплекса (ПДК),
состоящего из 3-х ферментов и 5 коферментов.
1. Е1 – пируват дегидрогеназа
2. Е2 – дигидролипоил ацетил трансфераза
3. Е3 – дигидролипоил дегидрогеназа
В состав комплекса входят и 2 регуляторных
фермента – киназа и фосфопротеинфосфатаза,
участвующие в ковалентной модификации Е1.
30.
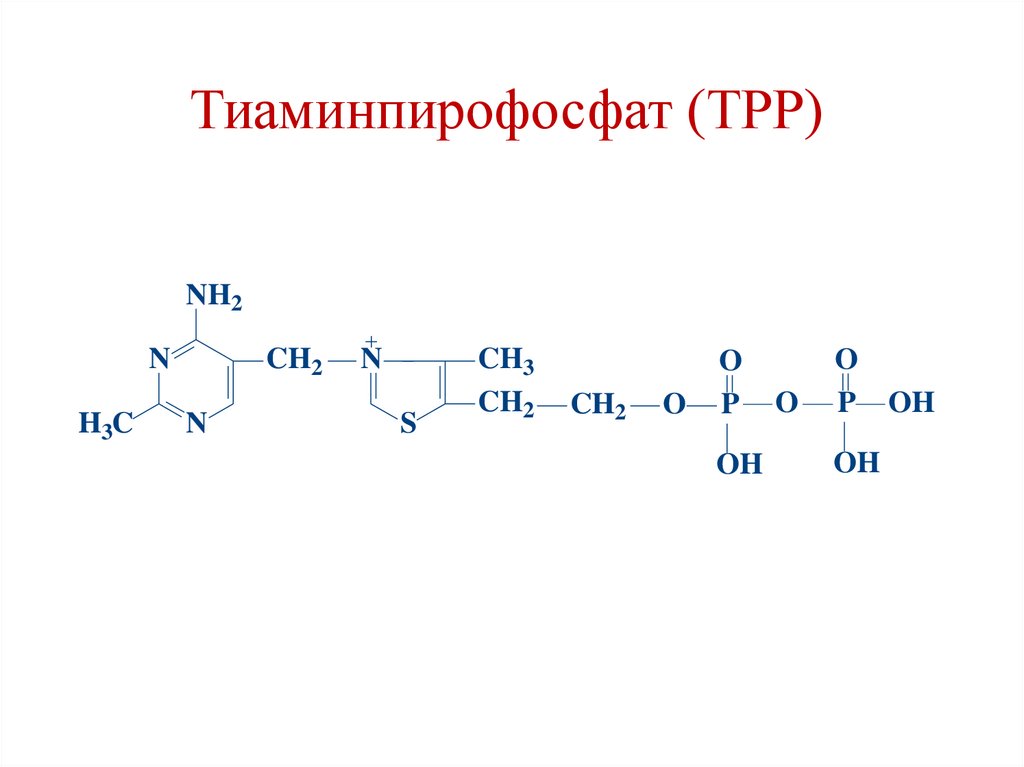
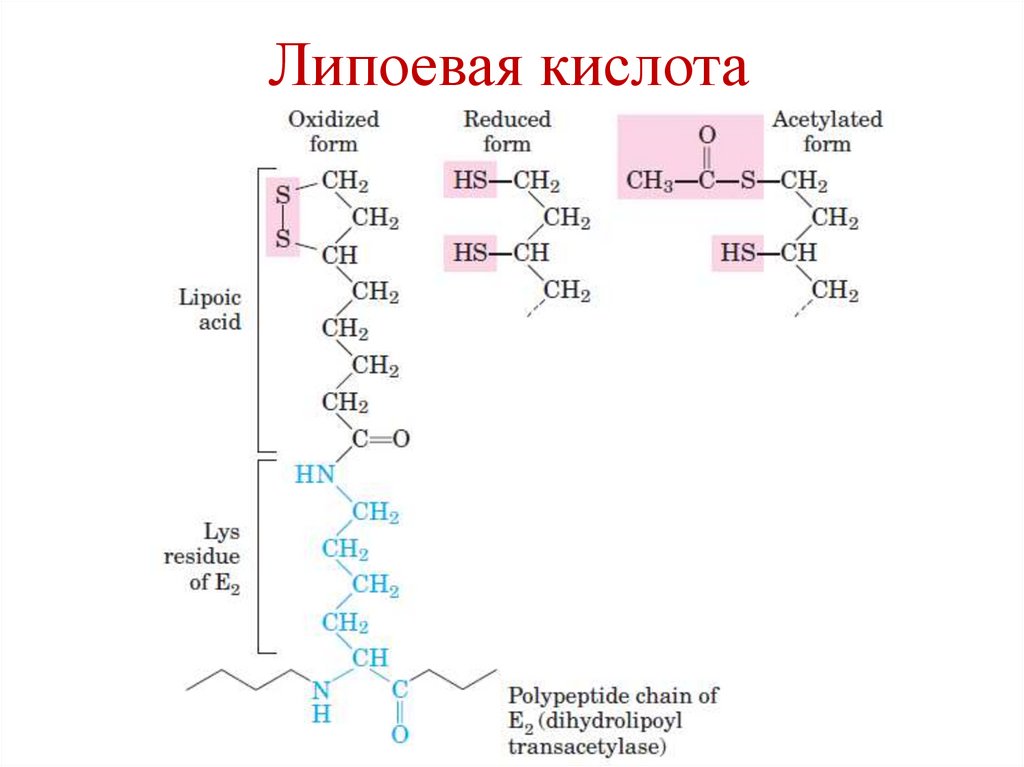
Коферменты ПДК:1. Е1 – ТРР (тиамин, витамин В1)
2. Е2 – липоевая кислота (AL)
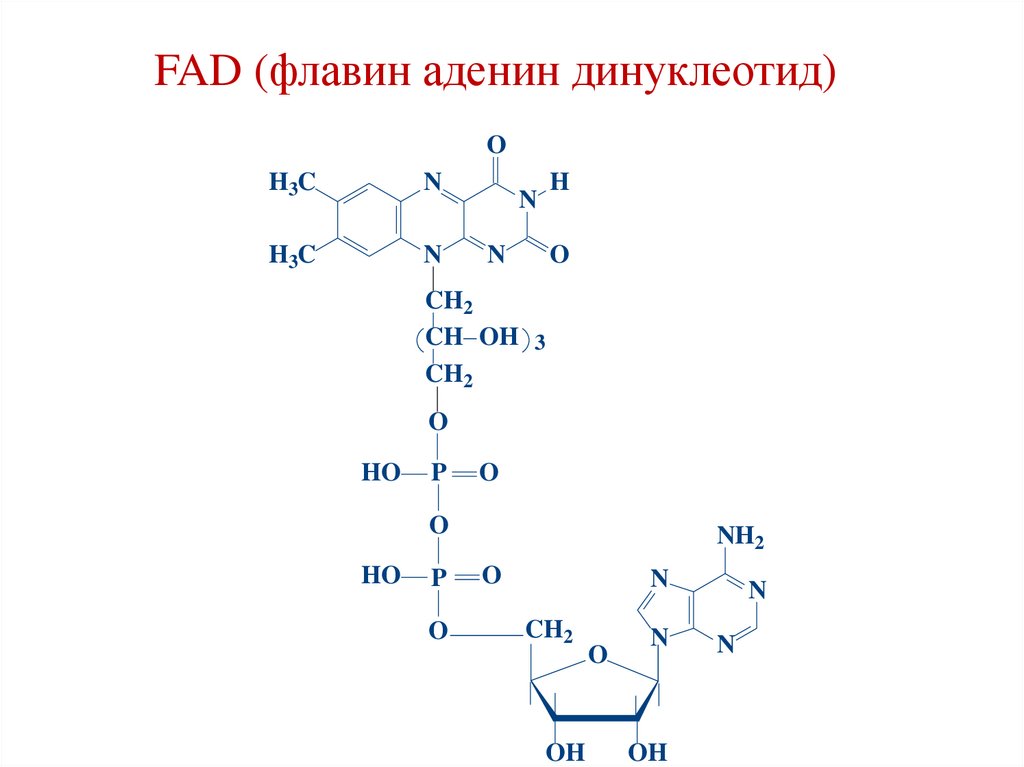
3. Е3 – FAD (рибофлавин, витамин В2)
4. NAD+ (никотинамид, витамин РР)
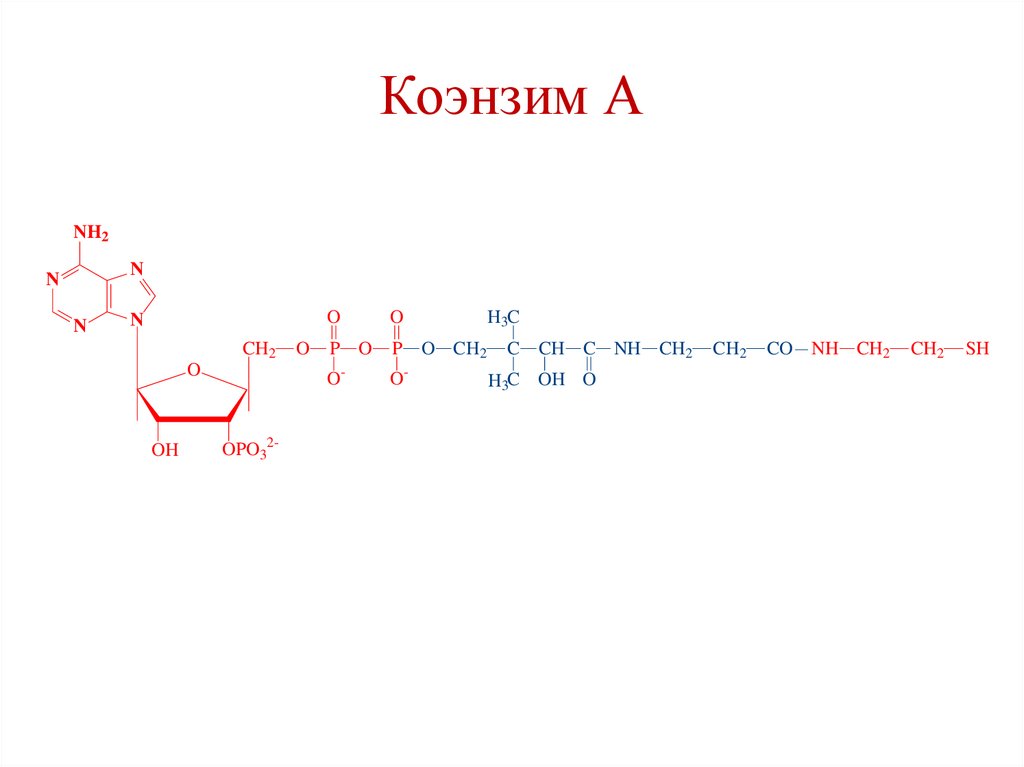
5. HS-CoA (пантотеновая кислота)
31.
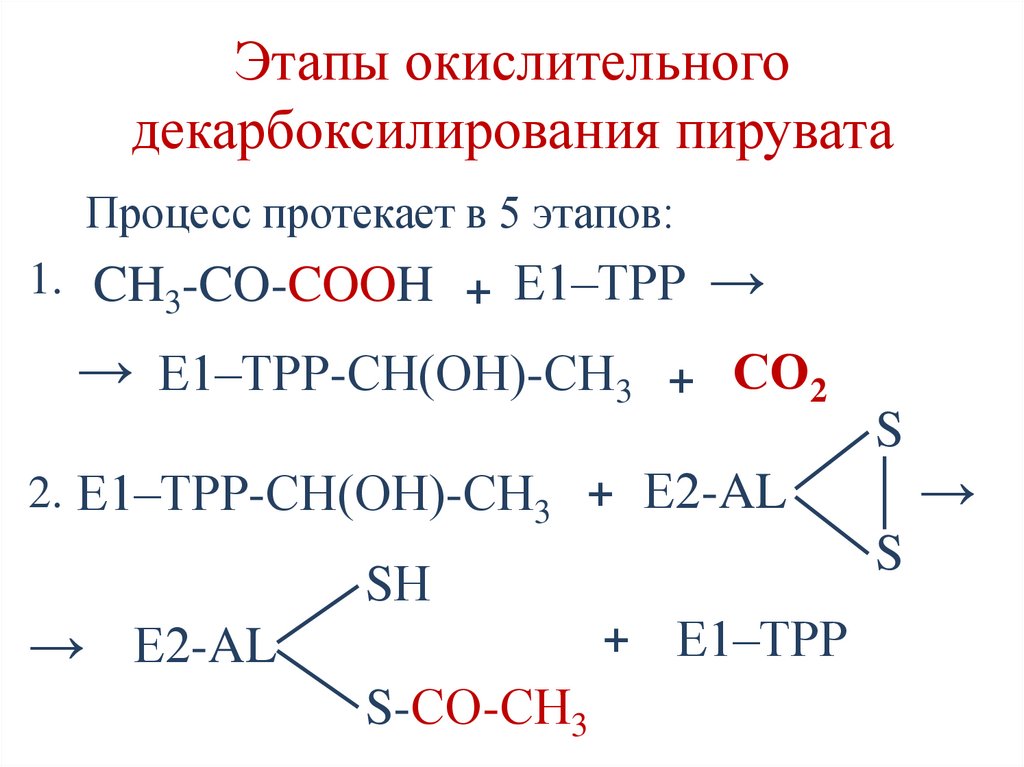
Этапы окислительногодекарбоксилирования пирувата
Процесс протекает в 5 этапов:
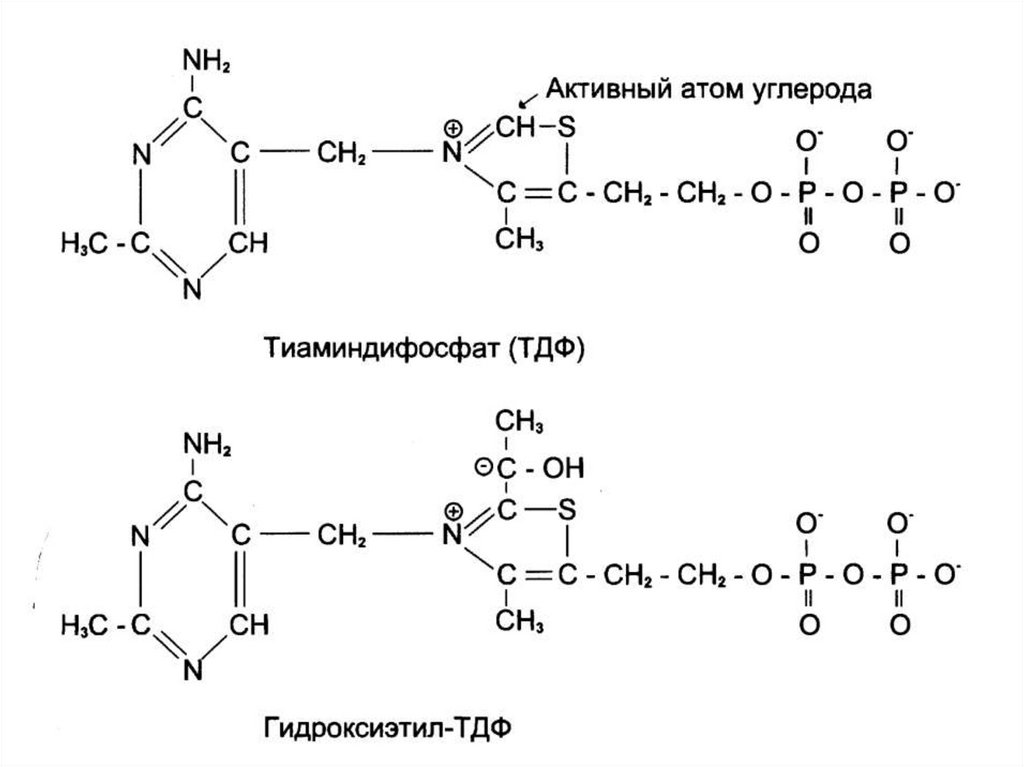
1. CH3-CO-COOH + Е1–ТРР →
→ Е1–ТРР-СН(ОН)-СН3 + СО2
S
→
2. Е1–ТРР-СН(ОН)-СН3 + Е2-AL
S
SН
→ Е2-AL
+
S-СО-СН3
Е1–ТРР
32.
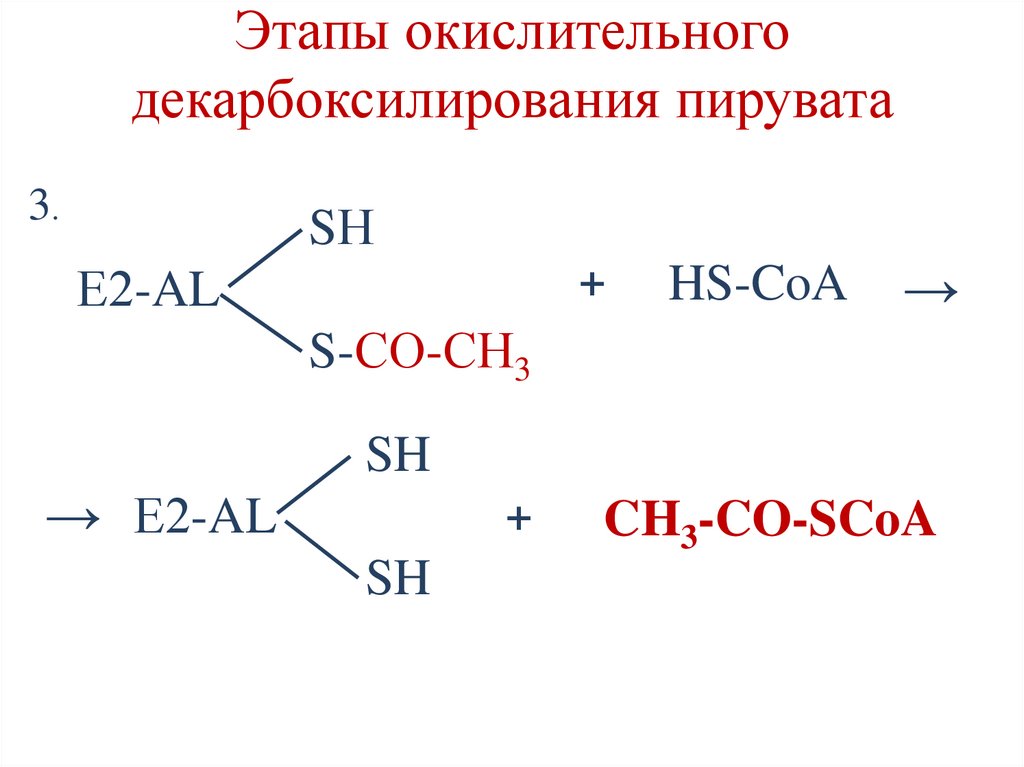
Этапы окислительногодекарбоксилирования пирувата
3.
SН
Е2-AL
+
HS-CoA
→
S-СО-СН3
SH
→ Е2-AL
+
SH
CH3-CO-SCoA
33.
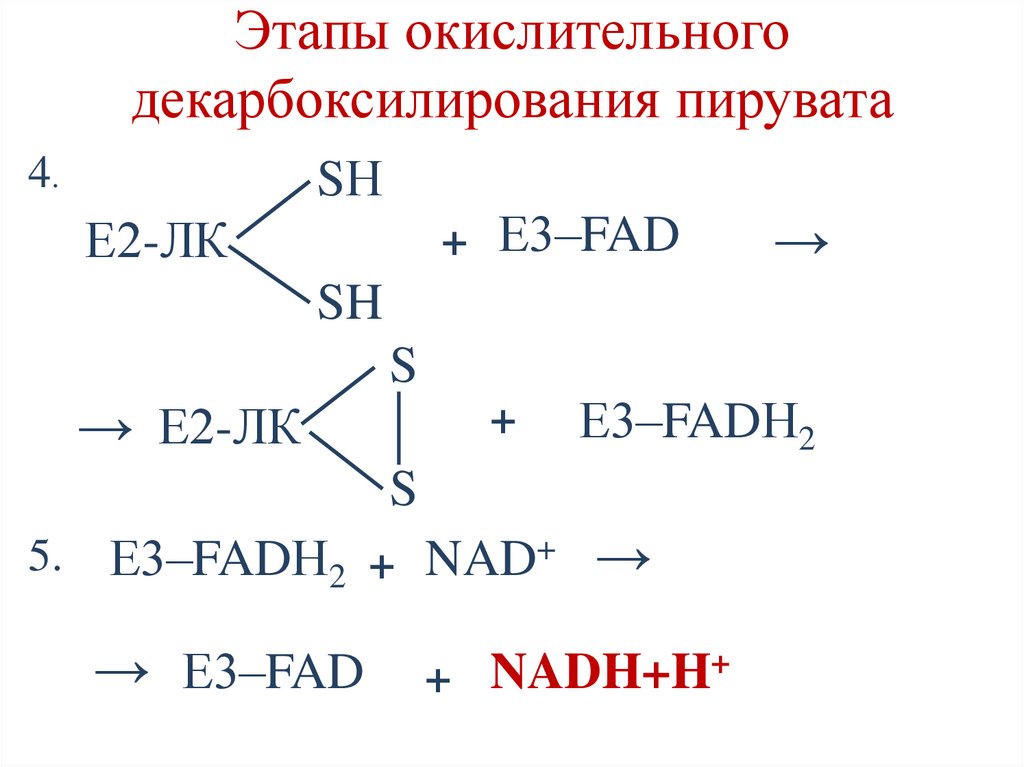
Этапы окислительногодекарбоксилирования пирувата
4.
SН
+ Е3–FAD
Е2-ЛК
→
SH
S
→ Е2-ЛК
+
Е3–FADН2
S
5.
Е3–FADН2 + NAD+ →
→ Е3–FAD
+ NADH+H+
34.
Окислительное декарбоксилированиепировиноградной кислоты
35.
Окислительное декарбоксилированиепировиноградной кислоты
CO2
CH3-CO-COOH
CH3-CO-SCoA
Пиуват
Ацетил-СоА
NAD+
HS-CoA
NADH+H+
Дыхательная
цепь
Цикл
Кребса
36.
Тиаминпирофосфат (ТРР)NH2
N
H3C
CH2
N
N
S
CH3
CH2
CH2
O
O
P
OH
O
O
P OH
OH
37.
38.
Коэнзим АNH2
N
N
N
N
CH2
O
OH
OPO32-
O
O
O
P O
P O CH2
O-
O-
H3C
C CH C NH CH2
H3C OH O
CH2
CO NH CH2
CH2
SH
39.
FAD (флавин аденин динуклеотид)O
H3C
N
H3C
N
N
N
H
O
CH2
CH OH 3
CH2
O
HO
P
O
O
HO
P
O
NH2
O
N
CH2
OH
O
N
OH
N
N
40.
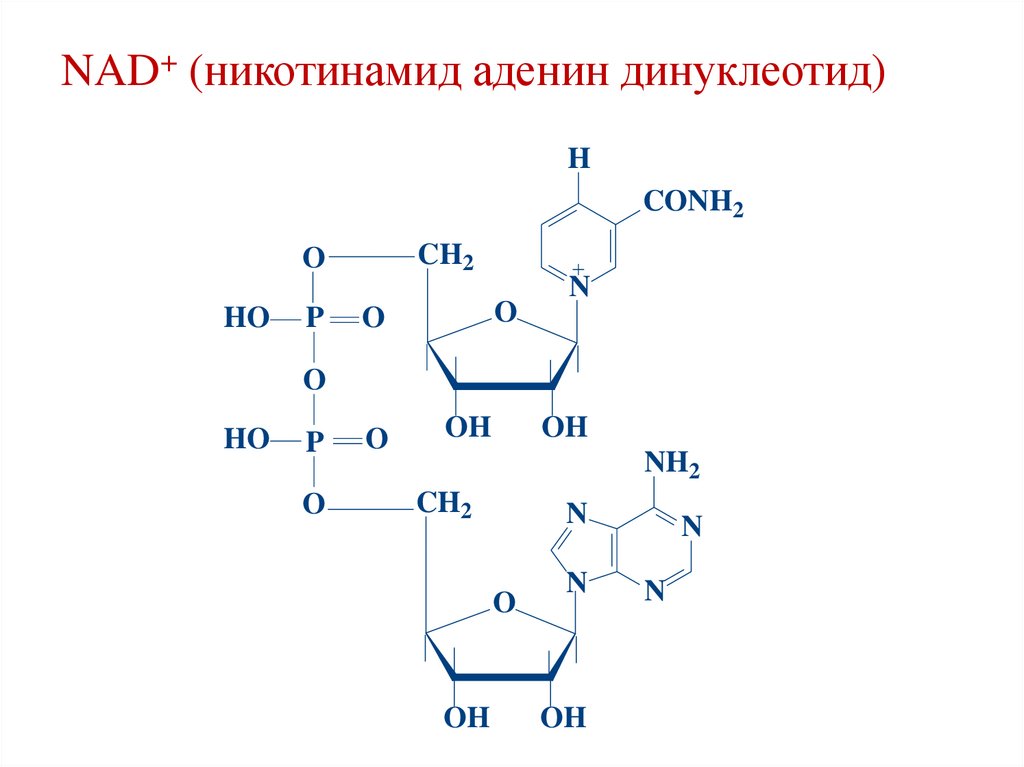
NAD+ (никотинамид аденин динуклеотид)H
CONH2
CH2
O
HO
P
O
O
N
O
HO
P
O
O
OH
OH
NH2
CH2
N
O
OH
N
OH
N
N
41.
Липоевая кислота42.
Регуляция пируватдегидрогеназногокомплекса
1. Ковалентная регуляция Е1 (фермент
активируется при дефосфорилировании и
ингибиуется при фосфорилиовании).
2. Аллостерическая регуляция Е2 и Е3
(конечные продукты – ацетил-СоА и НАДН
ингибируют соответственно Е2 и Е3).
3. Регуляция энергетическим состоянием
клетки (АТФ – ингибитор, АМФ –
активатор).
43.
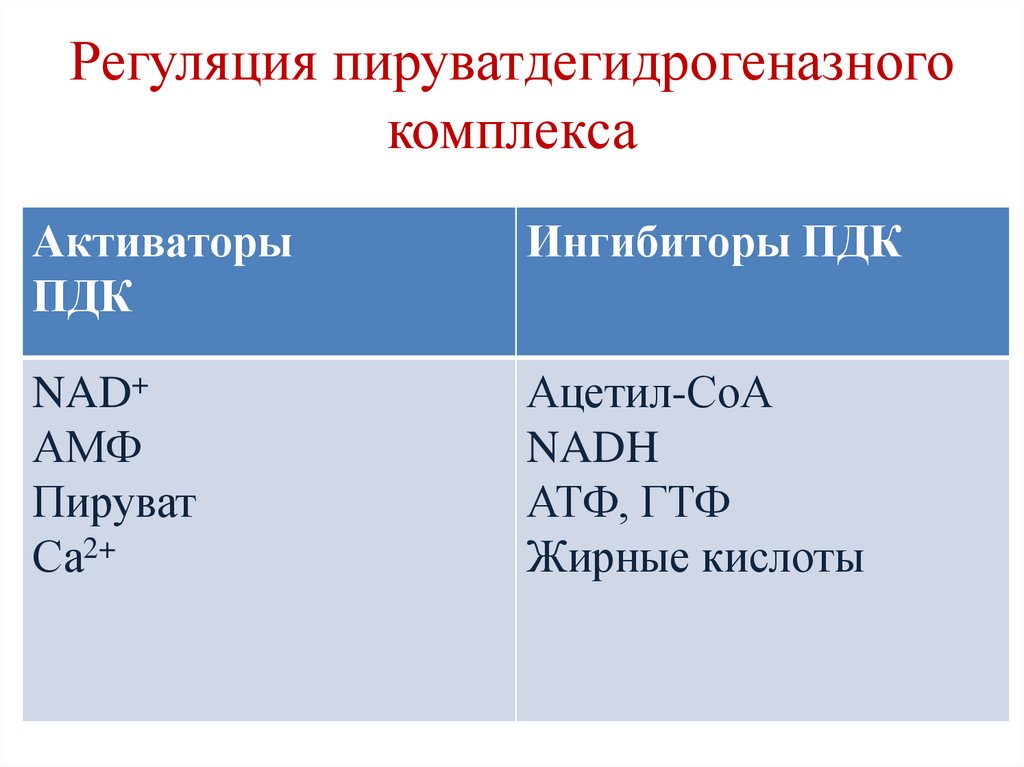
Регуляция пируватдегидрогеназногокомплекса
Активаторы
ПДК
Ингибиторы ПДК
NAD+
АМФ
Пируват
Са2+
Ацетил-СоА
NADH
АТФ, ГТФ
Жирные кислоты
44.
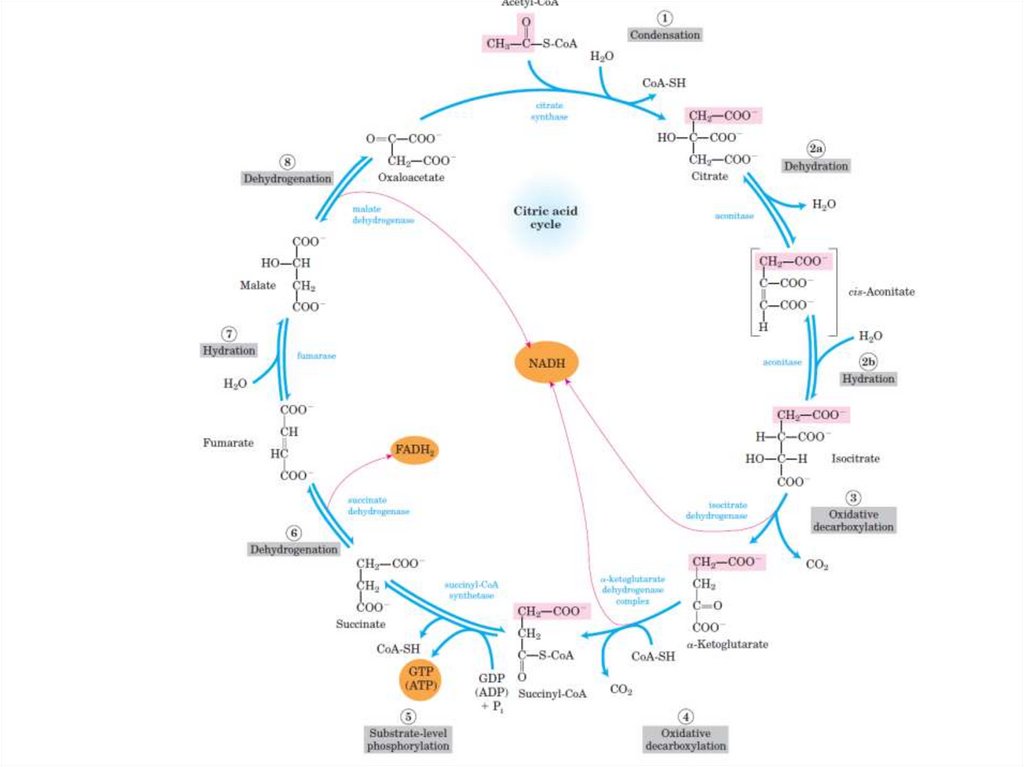
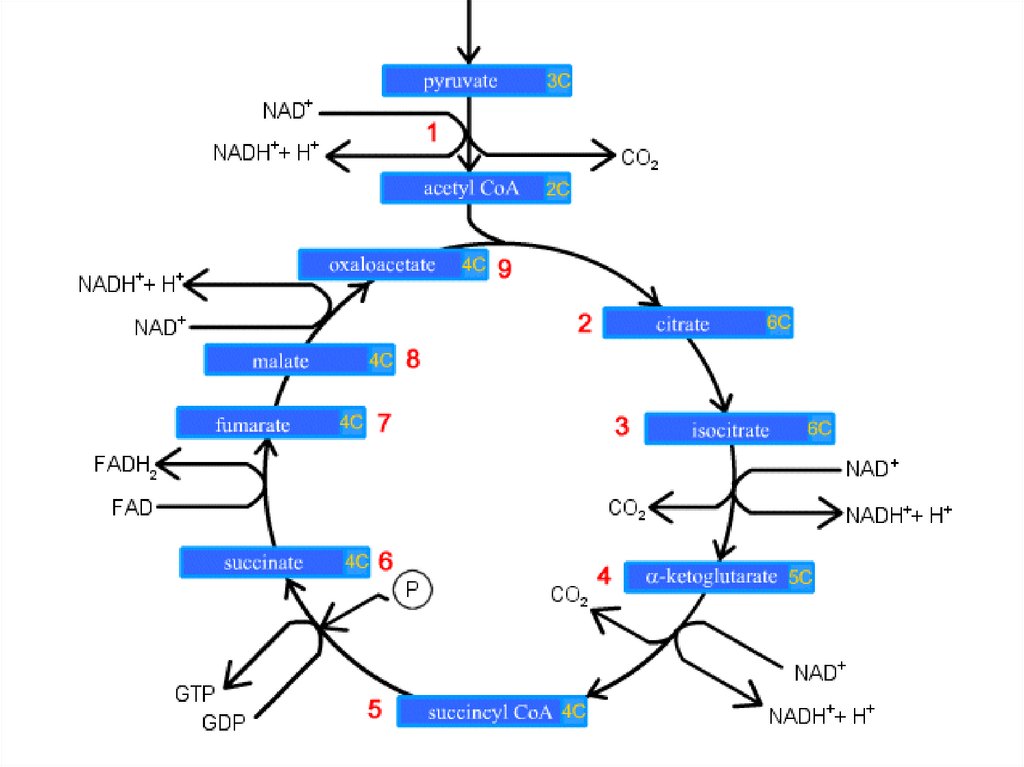
Цикл Кребса (цикл трикарбоновыхкислот – ЦТК, цикл лимонной
кислоты, цитратный цикл)
последовательность реакций, в ходе
которых происходит полное окисление
ацетильного остатка ацетил-СоА до 2
молекул СО2.
Происходит в матриксе митохондрий.
45.
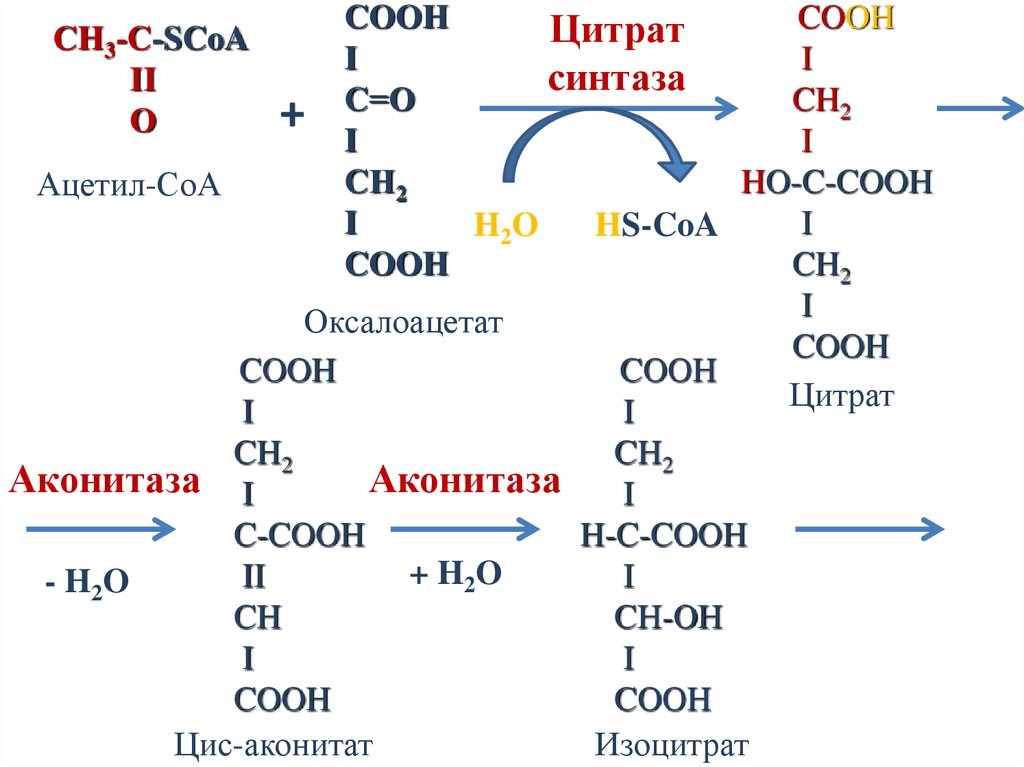
COOHCOOH
Цитрат
I
I
синтаза
C=О
CH2
+ I
I
CН2
HO-C-COOH
Ацетил-СоА
I
I
H2O
HS-CoA
COOH
CH2
I
Оксалоацетат
COOH
COOH
COOH
Цитрат
I
I
CH3-C-SCoA
II
O
CH2
CH2
Аконитаза I
Аконитаза
I
C-COOH
H-C-COOH
+ H2O
II
I
- H2O
CH
CН-ОН
I
I
COOH
COOH
Цис-аконитат
Изоцитрат
46.
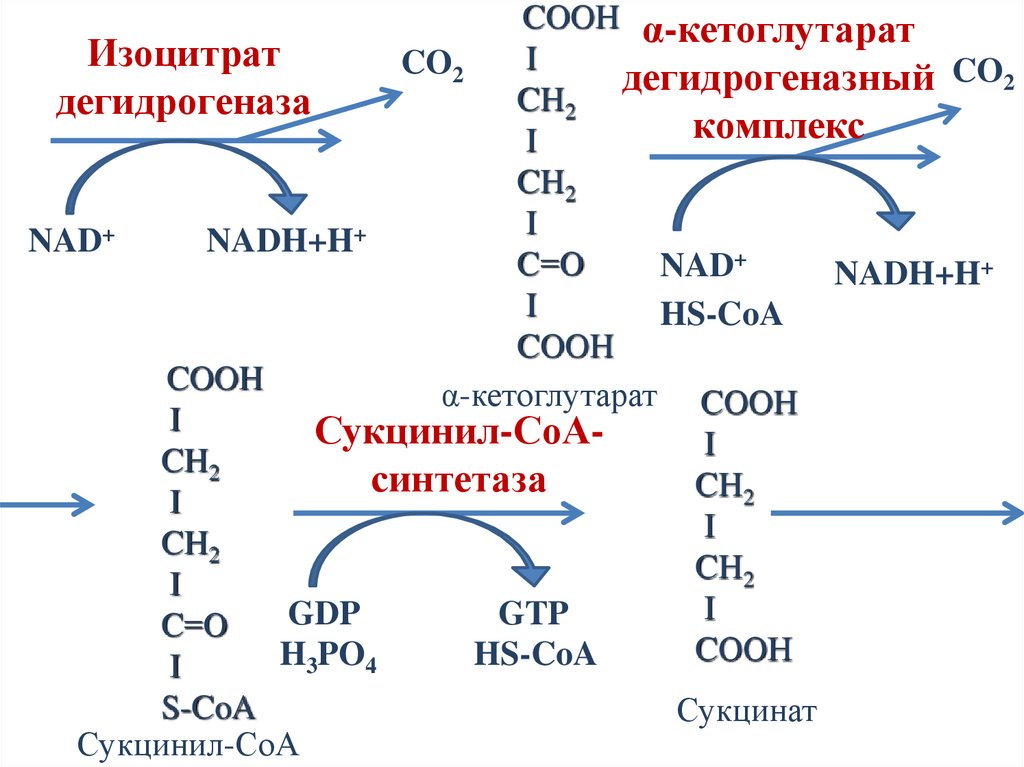
COOH α-кетоглутаратИзоцитрат
I
CO2
дегидрогеназный CO2
CH2
дегидрогеназа
комплекс
I
CH2
I
NAD+
NADH+H+
C=О
NAD+
NADH+H+
I
HS-CoA
COOH
COOH
α-кетоглутарат COOH
I
Сукцинил-СоАI
CH2
синтетаза
CH2
I
I
CH2
CH2
I
I
GDP
GTP
C=О
CООН
H3PO4
HS-CoA
I
S-CoA
Сукцинил-СоА
Сукцинат
47.
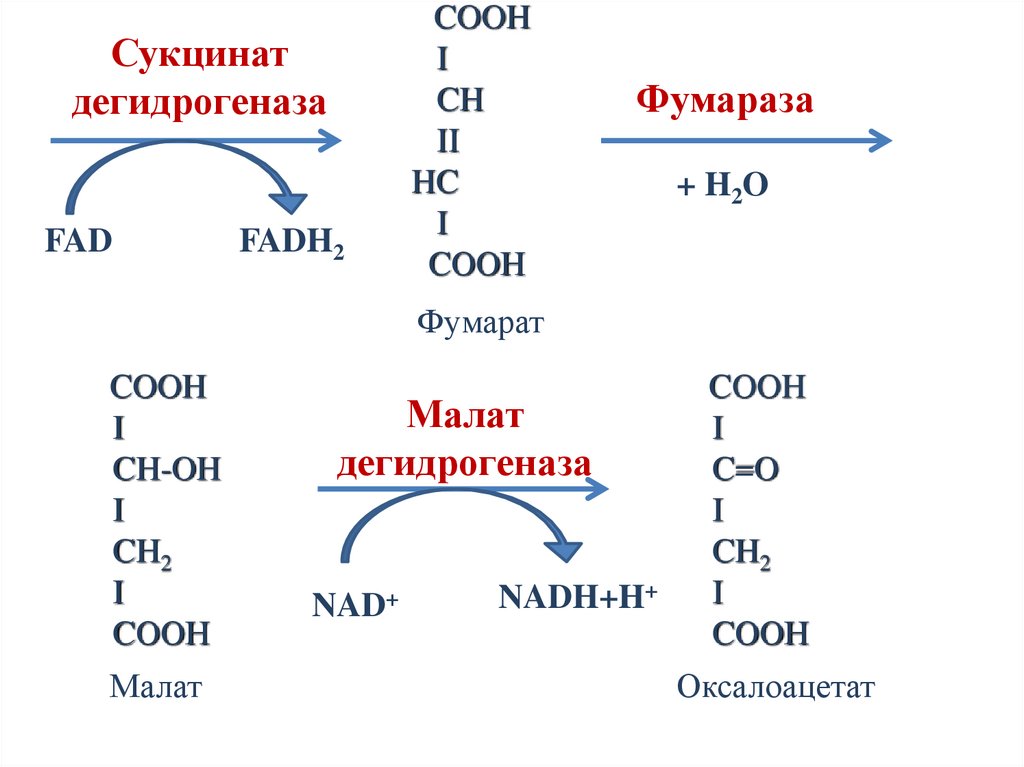
Сукцинатдегидрогеназа
FAD
FADH2
COOH
I
CH
II
HC
I
CООН
Фумараза
+ H2O
Фумарат
COOH
I
CH-OH
I
CH2
I
CООН
Малат
Малат
дегидрогеназа
NAD+
NADH+H+
COOH
I
C=O
I
CH2
I
CООН
Оксалоацетат
48.
Суммарная реакция цикла КребсаCH3-CO-SCoA + 2H2O + 3NAD+ + 1FAD +
GDP + H3PO4 →
2CO2 + HS-CoA + 3NADH+3H+ + 1FADH2 +
GTP
49.
50.
51.
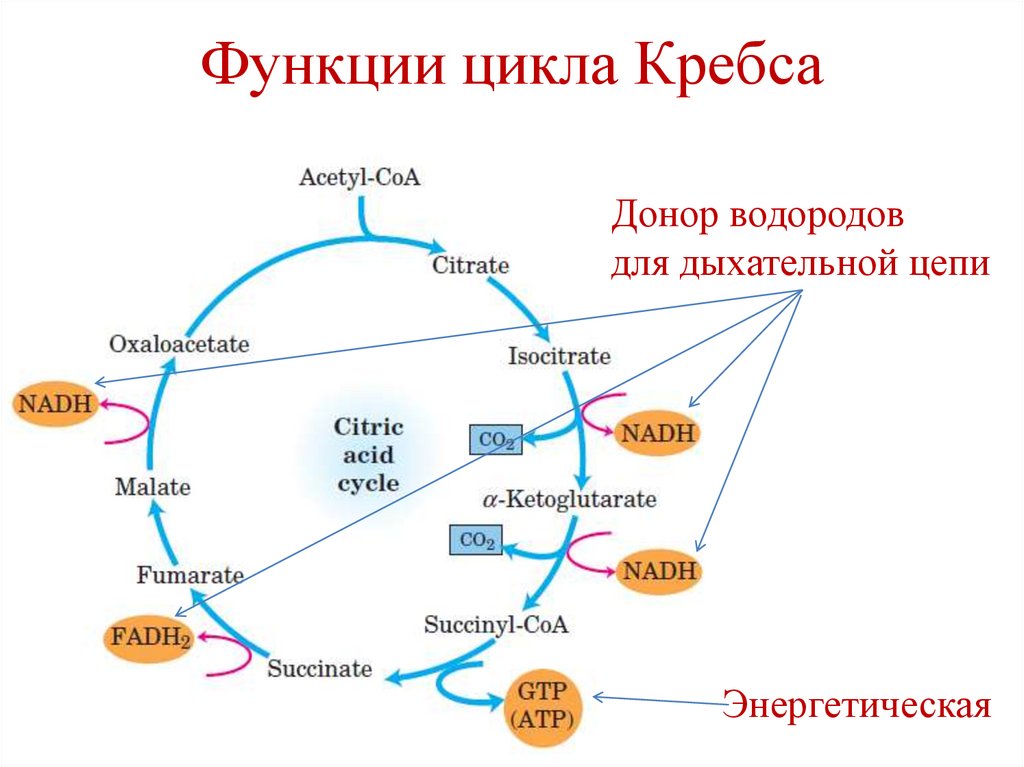
Функции цикла Кребса1. Интегративная – объединяет пути
метаболизма основных классов веществ.
2. Энергетическая – синтез одной молекулы
ГТФ в реакции субстратного
фосфорилирования.
3. Донор водородов для дыхательной цепи
(в составе NADH и FADH2).
52.
Функции цикла КребсаДонор водородов
для дыхательной цепи
Энергетическая
53.
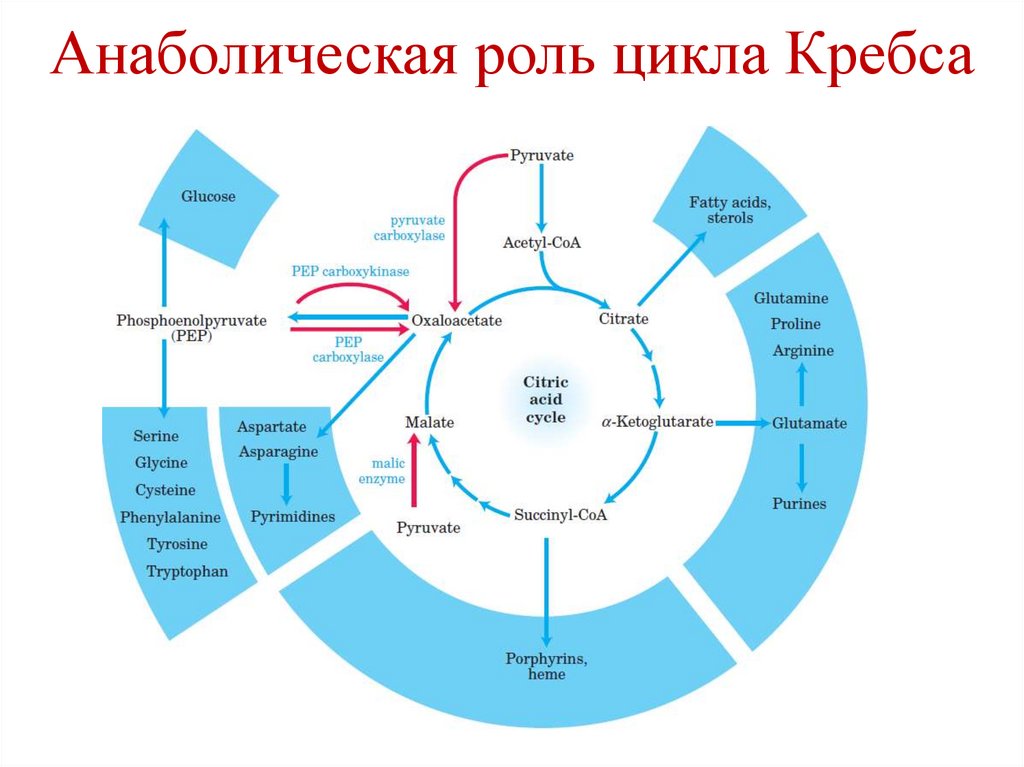
Функции цикла Кребса4. Амфиболическая:
a) Катаболическая – расщепление ацетил-СоА
до 2 молекул СО2
b) Анаболическая – промежуточные продукты
цикла Кребса могут использоваться для
синтеза определенных веществ.
Примеры:
оксалоацетат → Asp, Asn;
α-кетоглутарат → Glu, Gln.
54.
Анаболическая роль цикла Кребса55.
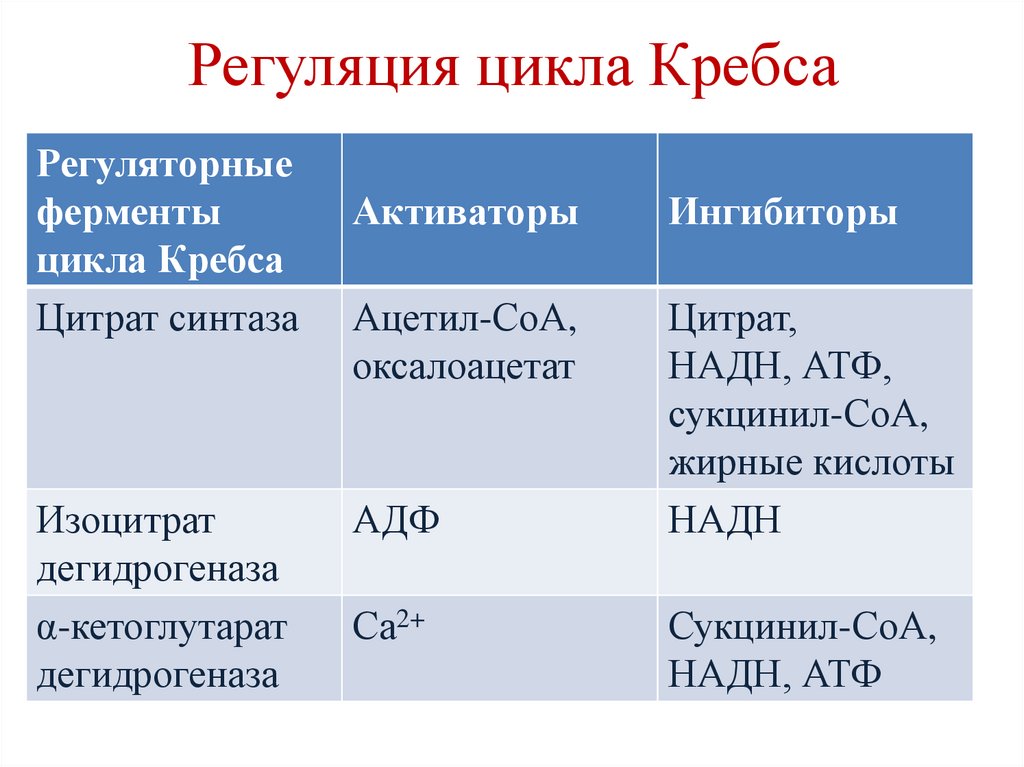
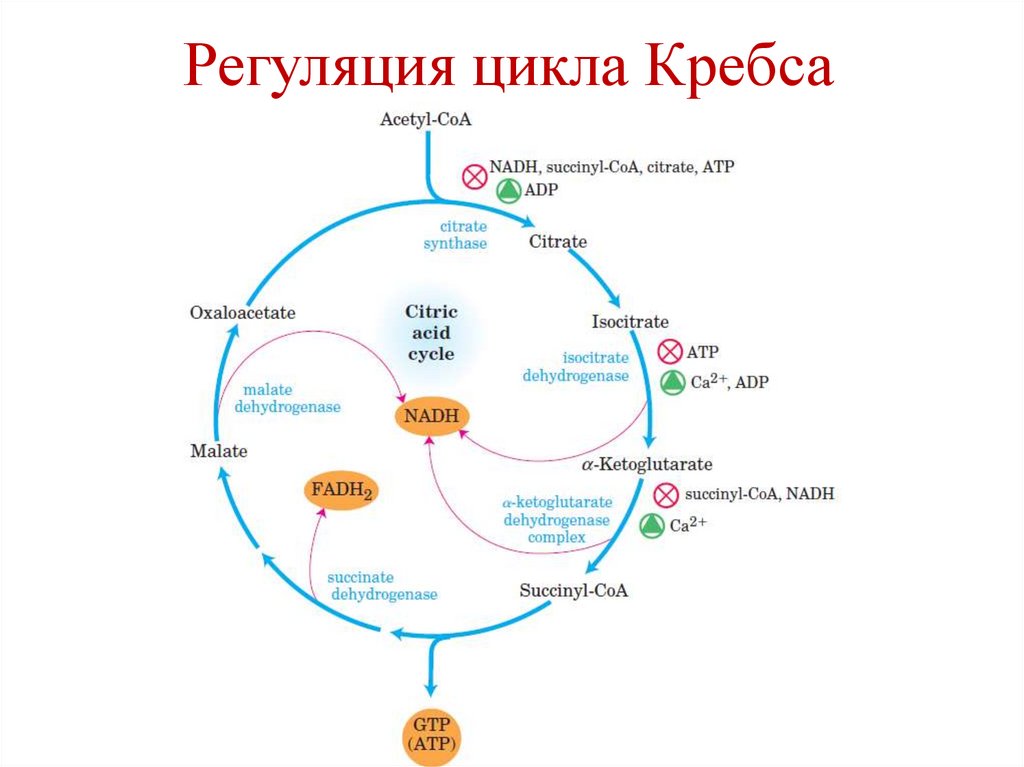
Регуляция цикла КребсаРегуляторные
ферменты
цикла Кребса
Цитрат синтаза
Изоцитрат
дегидрогеназа
α-кетоглутарат
дегидрогеназа
Активаторы
Ингибиторы
Ацетил-СоА,
оксалоацетат
Цитрат,
НАДН, АТФ,
сукцинил-СоА,
жирные кислоты
НАДН
АДФ
Са2+
Сукцинил-СоА,
НАДН, АТФ
56.
Регуляция цикла Кребса57.
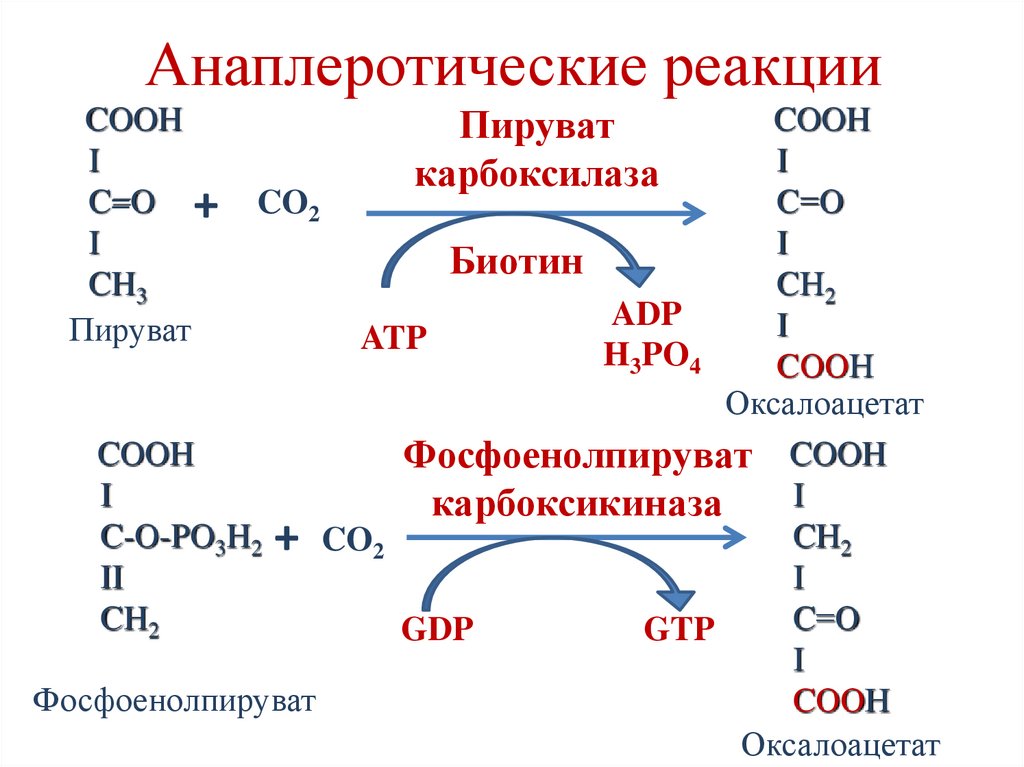
Анаплеротические реакции- реакции, пополняющие промежуточные
продукты цикла Кребса.
• Необходимость анаплеротических реакций
вытекает из анаболической функции цикла
Кребса.
58.
Анаплеротические реакцииПируват
карбоксилаза
COOH
I
C=O +
I
CH3
Пируват
COOH
I
C=О
CO2
I
Биотин
CН2
ADP
I
ATP
H3PO4
CООН
Оксалоацетат
COOH
Фосфоенолпируват COOH
I
I
карбоксикиназа
C-O-PO3H2
CН2
CO2
II
I
CH2
C=О
GDP
GTP
I
Фосфоенолпируват
CООН
Оксалоацетат
+
59.
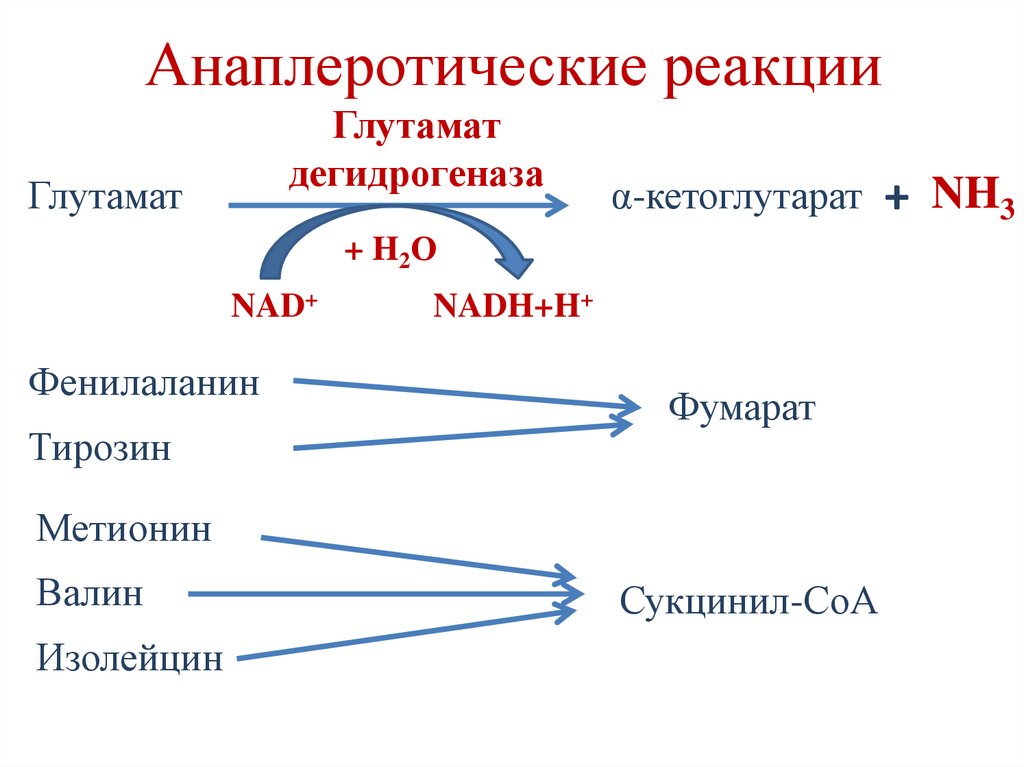
Анаплеротические реакцииГлутамат
дегидрогеназа
Глутамат
α-кетоглутарат + NH3
+ H2О
NAD+
Фенилаланин
Тирозин
NADH+H+
Фумарат
Метионин
Валин
Изолейцин
Сукцинил-СоА
60.
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ.ДЫХАТЕЛЬНАЯ ЦЕПЬ.
ОКИСЛИТЕЛЬНОЕ
ФОСФОРИЛИРОВАНИЕ
61.
Биологическое окисление(тканевое дыхание)
– совокупность реакций окисления,
протекающих в живых организмах.
• Функция – обеспечение организма
доступной химической энергией в виде
АТФ.
62.
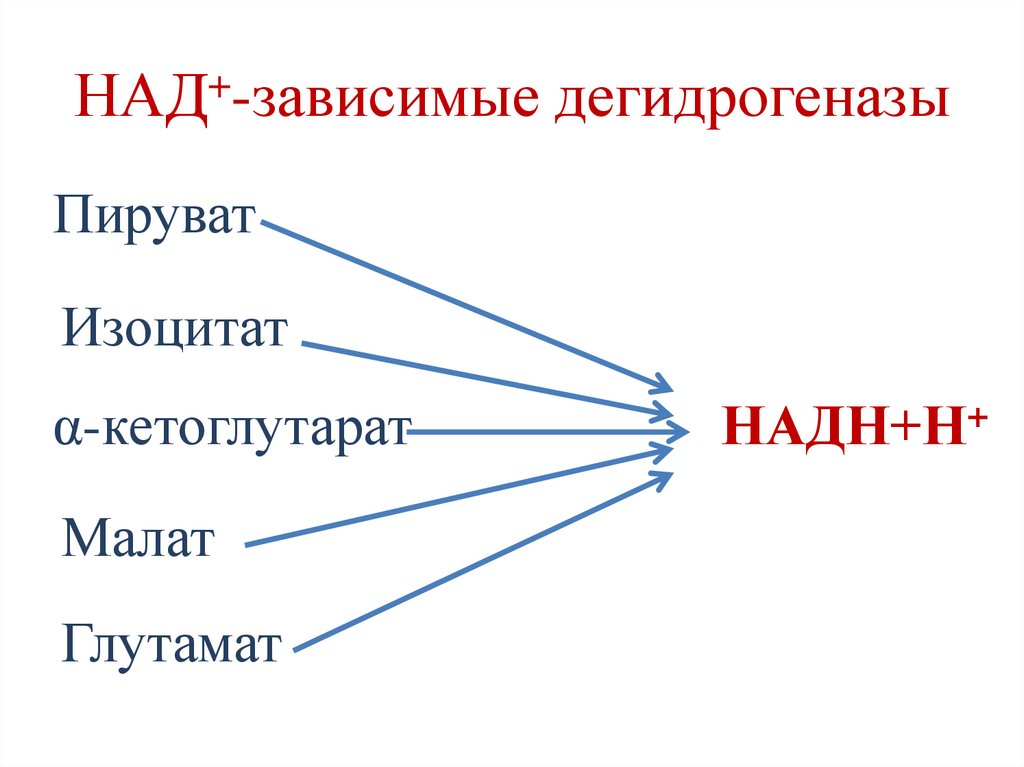
Биологическое окисление (БО)• БО начинается с реакций дегидрирования
субстратов.
• Реакции дегидрирования катализируются
ферментами дегидрогеназами, которые в
качестве коферментов содержат НАД+ и
ФАД.
63.
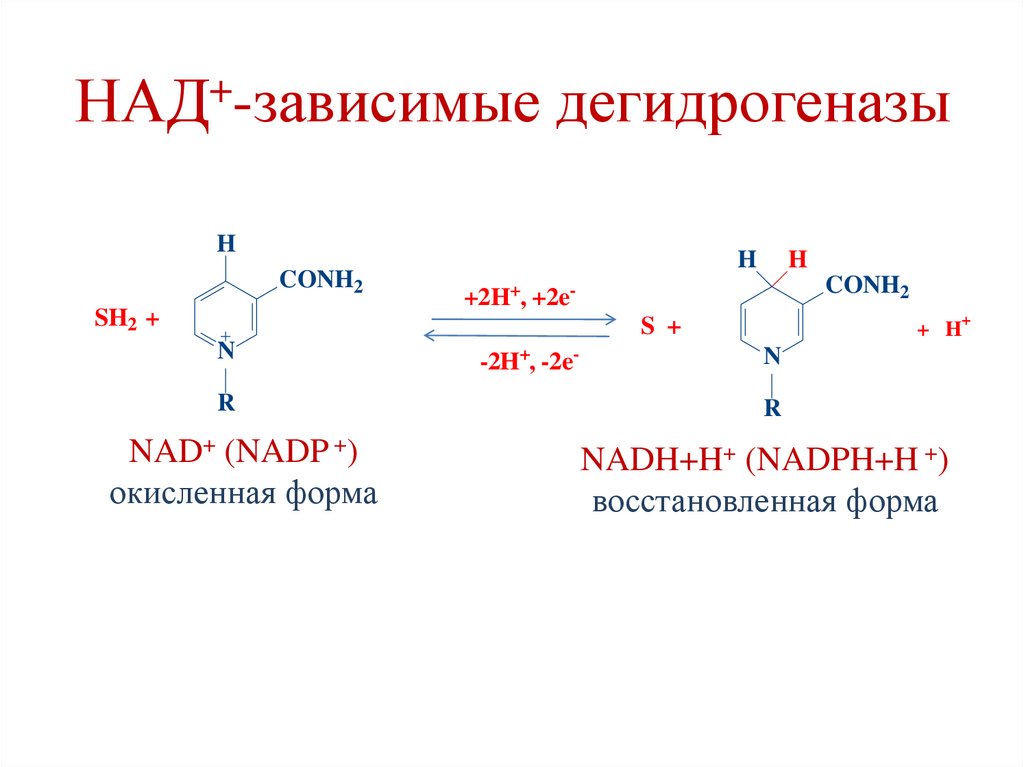
НАД+-зависимые дегидрогеназыПируват
Изоцитат
α-кетоглутарат
Малат
Глутамат
НАДН+Н+
64.
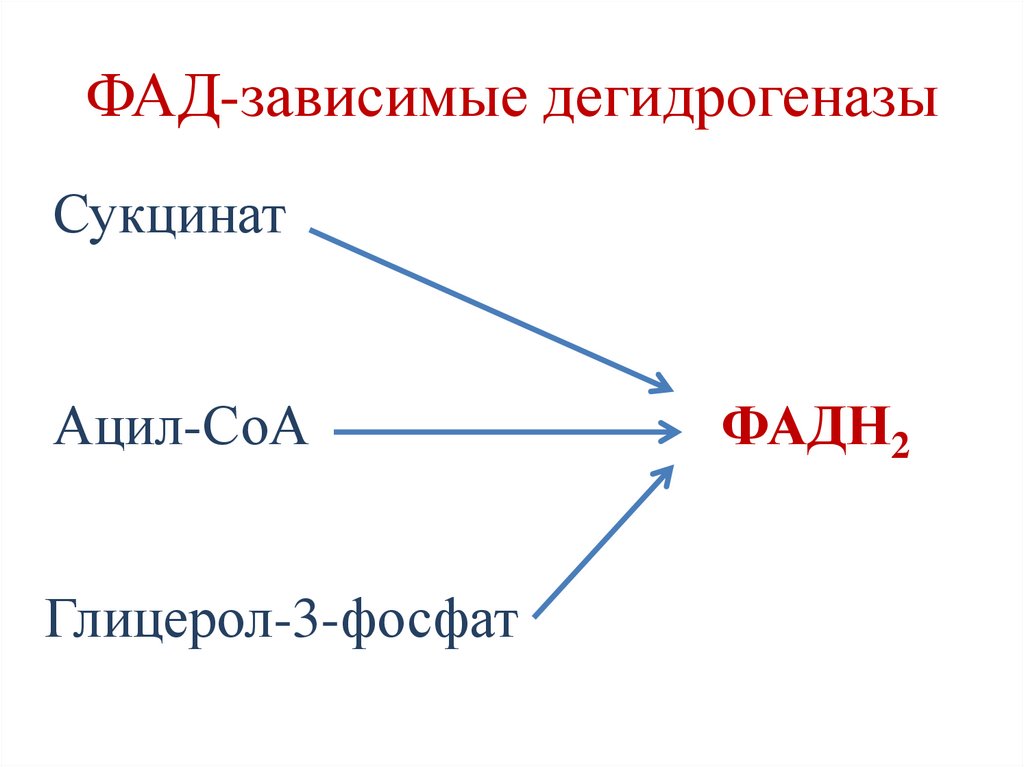
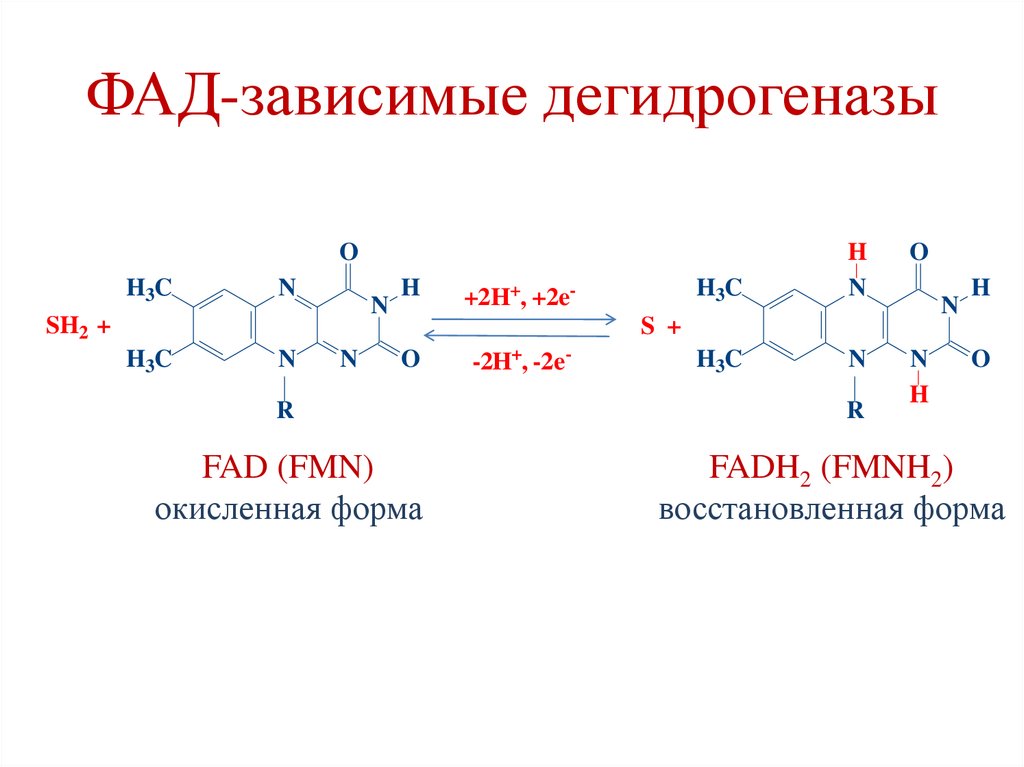
ФАД-зависимые дегидрогеназыСукцинат
Ацил-СоА
Глицерол-3-фосфат
ФАДН2
65.
• НАДН и ФАДН2, полученные в реакцияхдегидрирования субстратов, переносят
электроны и протоны в дыхательную цепь.
66.
Дыхательная цепь (ДЦ)• Комплекс ферментов и окислительновосстановительных систем, участвующих в
переносе электронов и протонов с
восстановленных коферментов (НАДН и
ФАДН2) на кислород с образованием воды.
• Локализация процесса – внутренняя
митохондриальная мембрана.
67.
Функции дыхательной цепи• Энергетическая – перенос электронов по
дыхательной цепи сопровождается
выделением свободной энергии, которая
используется для синтеза АТФ.
• Реокисление коферментов НАДН и ФАДН2.
68.
Окислительно-восстановительныесистемы (редокс-системы)
• ОВ система состоит из донора и акцептора
электронов.
• Каждая ОВ система обладает ОВ
потенциалом (∆Еº´), который измеряется в
вольтах (V) и характеризует сродство ОВ
системы к электронам (т.е. способность
отдавать или принимать электроны).
69.
Окислительно-восстановительныйпотенциал
• Чем электроотрицательнее величина ОВ
потенциала, тем выше способность ОВ пары
отдавать электроны.
• Чем электроположительнее величина ОВ
потенциала, тем выше способность ОВ пары
принимать электроны.
• В дыхательной цепи ОВ системы
расположены в порядке возрастания ОВ
потенциала.
70.
Окислительно-восстановительныесистемы дыхательной цепи
NAD+/NADH
―
FMN/FMNH2
―
CoQ/CoQH2
―
цит.b (Fe3+)/цит.b(Fe2+ ) ―
цит.c1(Fe3+)/цит.c1(Fe2+ ) ―
цит.c(Fe3+)/цит.c(Fe2+ )
―
цит.а(Fe3+)/цит.а(Fe2+ )
―
цит.а3(Fe3+)/цит.а3(Fe2+ ) ―
½O2/H2O
―
-0,32V
-0,05V
+0,04V
+0,12V
+0,22V
+0,25V
+0,29V
+0,55V
+0,82V
71.
НАД+-зависимые дегидрогеназыH
CONH2
SH2 +
H
H
CONH2
+2H+, +2e-
+ H+
S +
N
-2H+, -2e-
N
R
R
NAD+ (NADP +)
окисленная форма
NADH+H+ (NADPH+H +)
восстановленная форма
72.
ФАД-зависимые дегидрогеназыO
H3C
N
N
SH2 +
H3C
N
N
H
+2H+, +2e-
O
H3C
H
N
H3C
N
N
H
N
S +
O
R
FAD (FMN)
окисленная форма
-2H+, -2e-
R
H
O
FADH2 (FMNH2)
восстановленная форма
73.
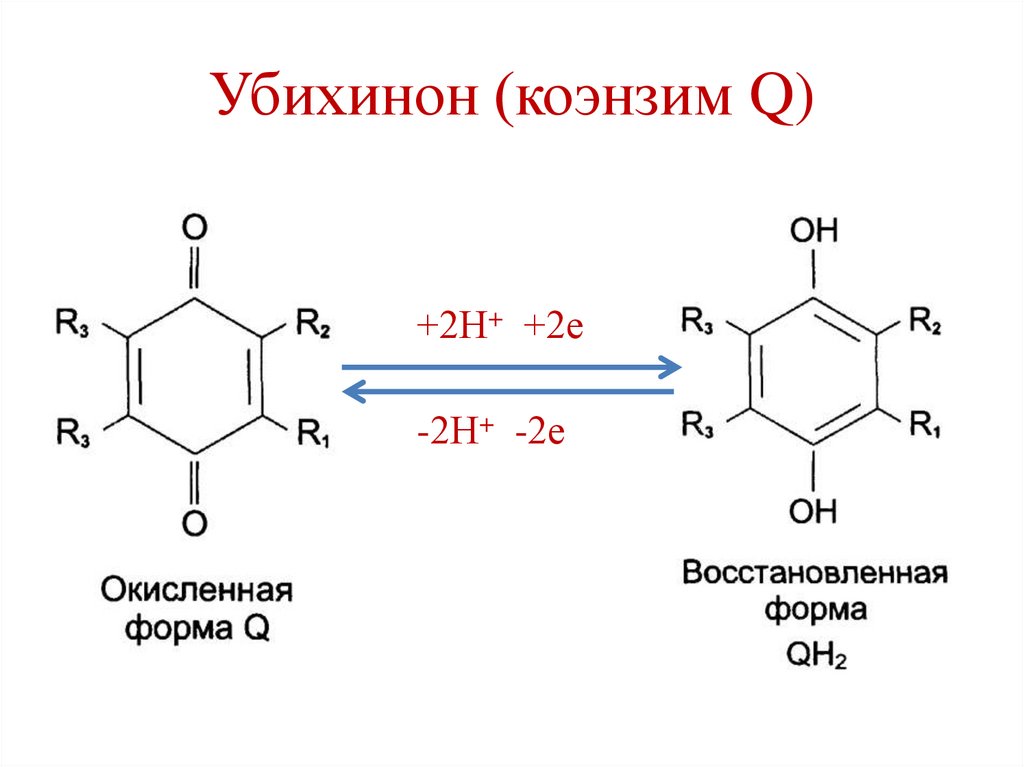
Убихинон (коэнзим Q)74.
Убихинон (коэнзим Q)+2Н+ +2е
-2Н+ -2е
75.
Железо-серные белки• Белки, содержащие атомы железа
(негемовое железо), связанные с серой
остатков цистеина и/или неорганической
серой.
• 3 типа железо-серных центров:
1. FeS
2. Fe2S2
3. Fe4S4
76.
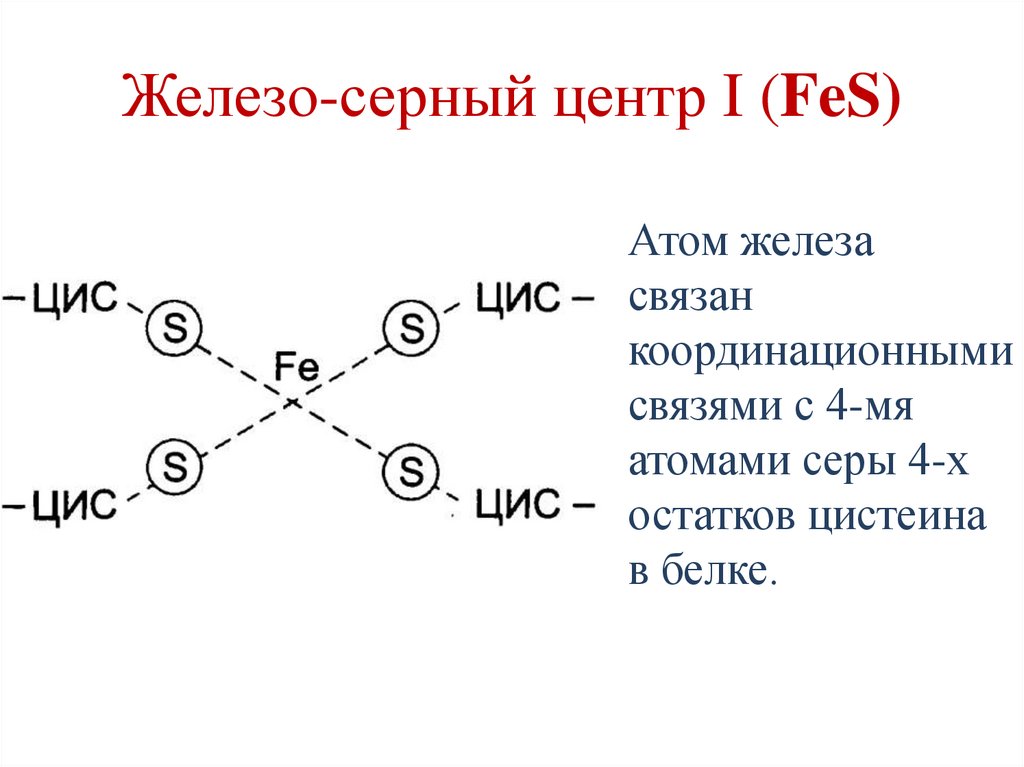
Железо-серный центр I (FeS)Атом железа
связан
координационными
связями с 4-мя
атомами серы 4-х
остатков цистеина
в белке.
77.
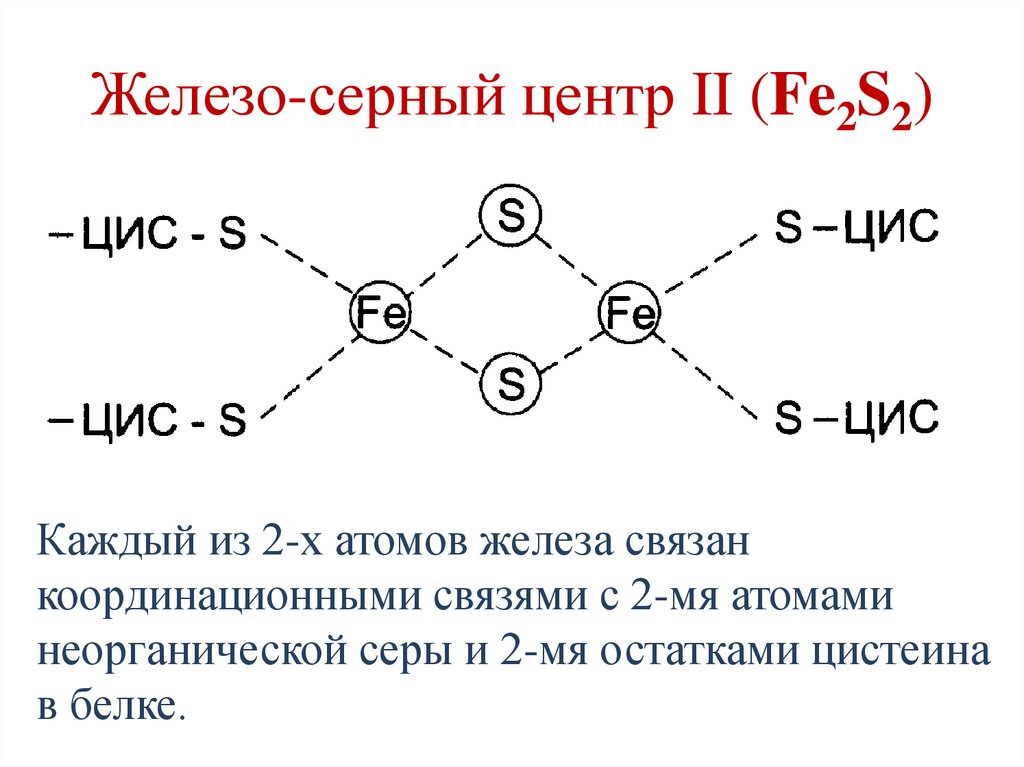
Железо-серный центр II (Fe2S2)Каждый из 2-х атомов железа связан
координационными связями с 2-мя атомами
неорганической серы и 2-мя остатками цистеина
в белке.
78.
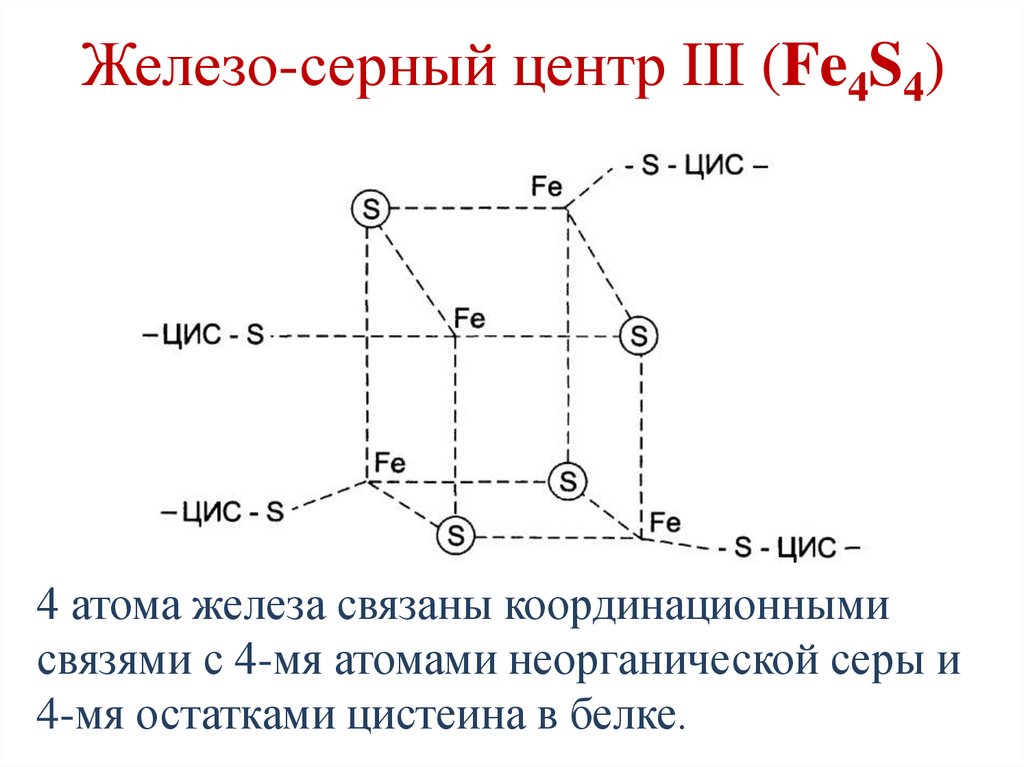
Железо-серный центр III (Fe4S4)4 атома железа связаны координационными
связями с 4-мя атомами неорганической серы и
4-мя остатками цистеина в белке.
79.
Цитохромы – гемопротеины• в дыхательной цепи участвуют цитохромы
b, c, c1, а и а3.
• Цитохромы различаются:
1. Структурой боковых цепей гема.
2. Структурой полипептидных цепей.
3. Способом связи полипептидных цепей с
гемом.
4. Значением ОВ потенциала.
80.
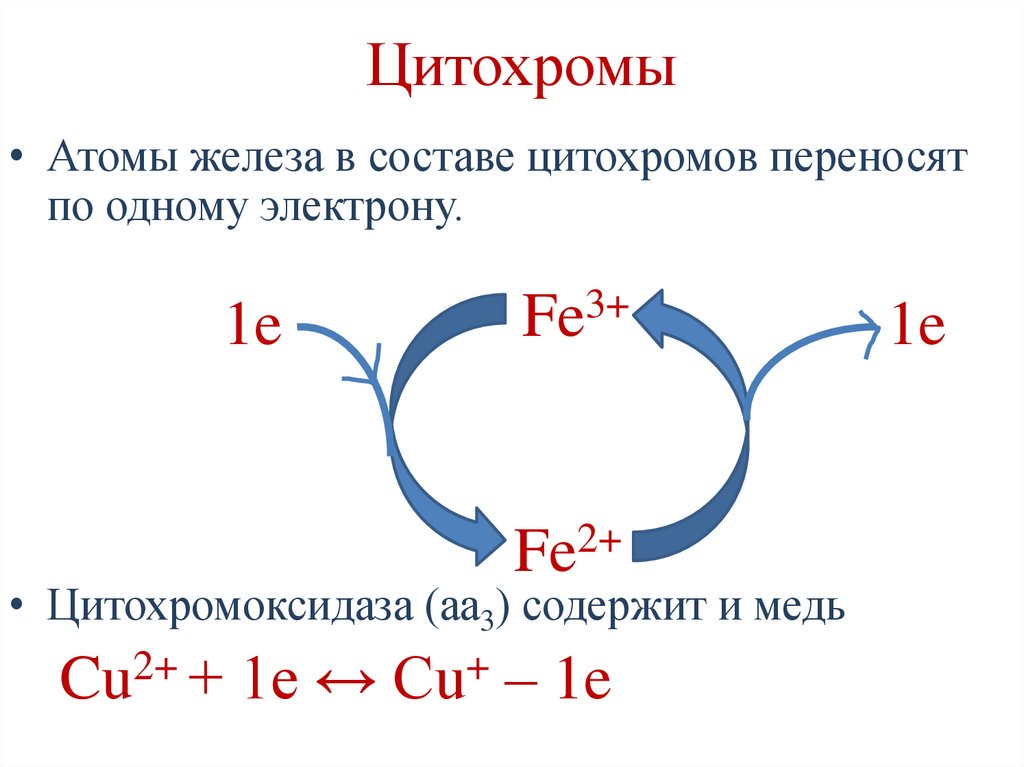
Цитохромы• Атомы железа в составе цитохромов переносят
по одному электрону.
1e
3+
Fe
2+
Fe
• Цитохромоксидаза (аа3) содержит и медь
Cu2+ + 1e ↔ Cu+ – 1e
1e
81.
Структура гемацитохромов b, c и c1
82.
Структура гема А(цитохромов а и а3)
83.
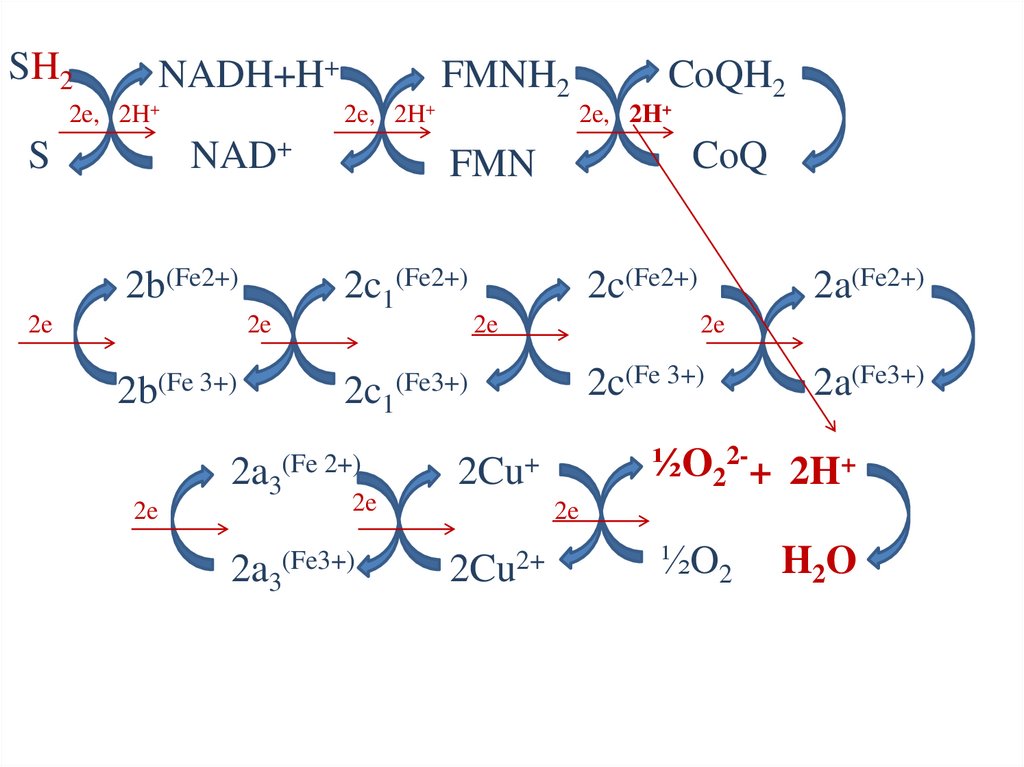
Дыхательная цепь84.
SH2NADH+H+
2e, 2H+
2e, 2H+
NAD+
S
2b(Fe2+)
2e
FMNH2
2b(Fe 3+)
2e
2e, 2H+
CoQ
FMN
2c1(Fe2+)
2e
CoQH2
2c(Fe2+)
2e
2e
2c(Fe 3+)
2c1(Fe3+)
2a3(Fe 2+)
2e
2Cu+
2a3(Fe3+)
2Cu2+
2a(Fe2+)
2a(Fe3+)
½O22-+ 2H+
2e
½O2
H2O
85.
NADH+H+2H+
2e
H2O
½O2
½O22-
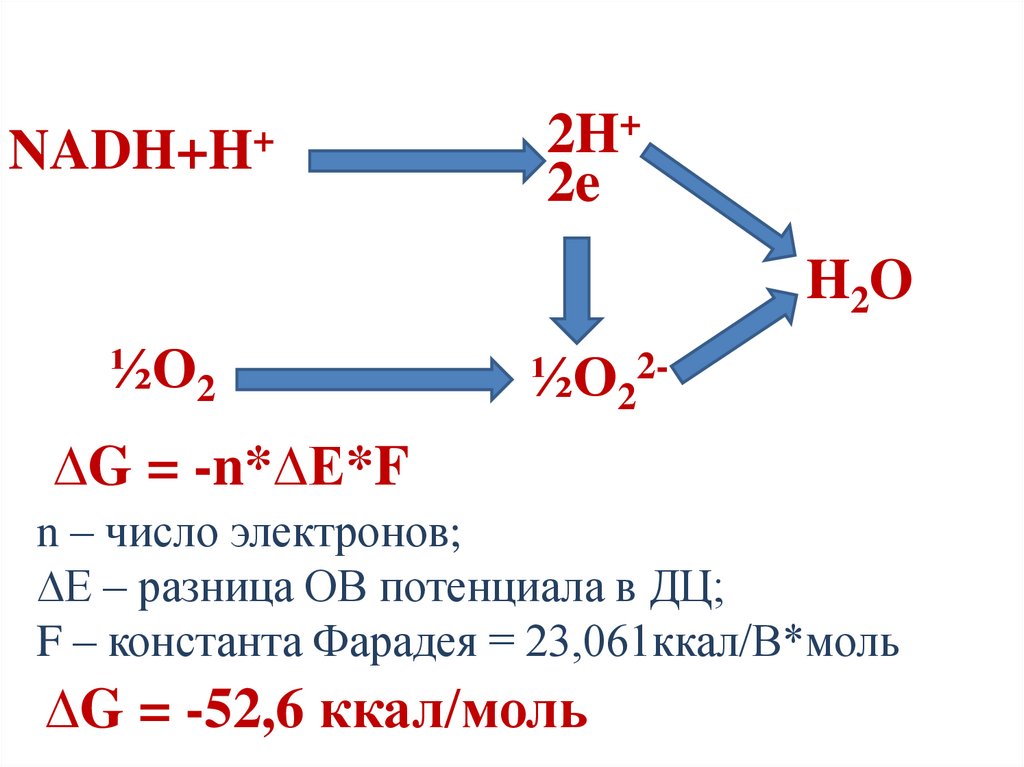
∆G = -n*∆E*F
n – число электронов;
∆E – разница ОВ потенциала в ДЦ;
F – константа Фарадея = 23,061ккал/В*моль
∆G = -52,6 ккал/моль
86.
Окислительно-восстановительныесистемы дыхательной цепи
NAD+/NADH
―
FMN/FMNH2
―
CoQ/CoQH2
―
цит.b (Fe3+)/цит.b(Fe2+ ) ―
цит.c1(Fe3+)/цит.c1(Fe2+ ) ―
цит.c(Fe3+)/цит.c(Fe2+ )
―
цит.а(Fe3+)/цит.а(Fe2+ )
―
цит.а3(Fe3+)/цит.а3(Fe2+ ) ―
½O2/H2O
―
-0,32V
-0,05V
+0,04V
+0,12V
+0,22V
+0,25V
+0,29V
+0,55V
+0,82V
87.
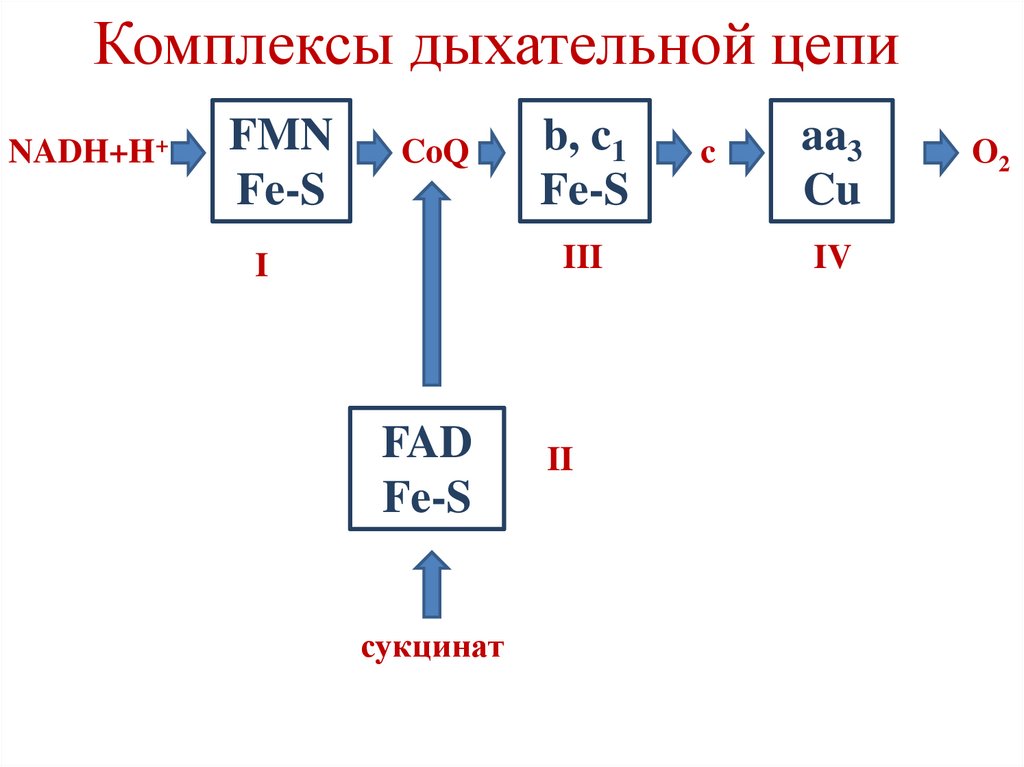
Комплексы дыхательной цепиNADH+H+
FMN
Fe-S
CoQ
b, c1
Fe-S
III
I
FAD
Fe-S
сукцинат
II
c
aa3
Cu
IV
O2
88.
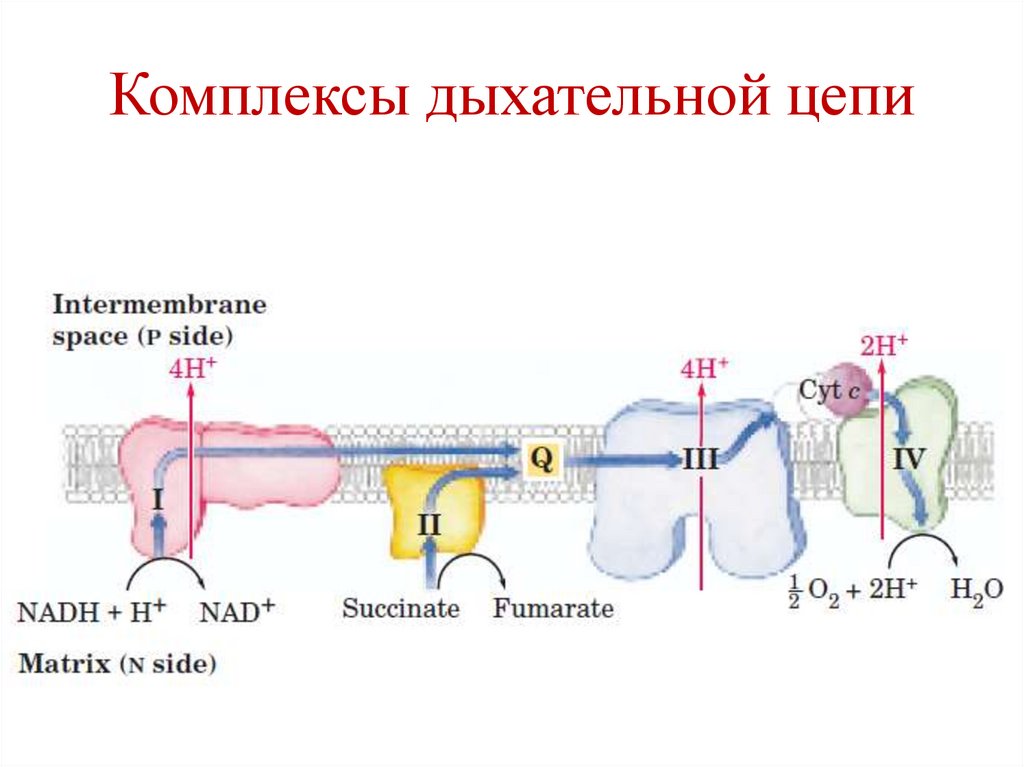
Комплексы дыхательной цепиI – NADH-CoQ-редуктаза
II – сукцинат-CoQ-редуктаза
III – CoQH2-цитохром с-редуктаза
IV – цитохромоксидаза
89.
Комплексы дыхательной цепи90.
Окислительноефосфорилирование
синтез АТФ из АДФ и фосфата,
сопряженный с дыхательной цепью
(за счет энергии переноса электронов по
дыхательной цепи).
• Перенос электронов по дыхательной цепи
происходит постепенно и сопровождается
уменьшением свободной энергии.
91.
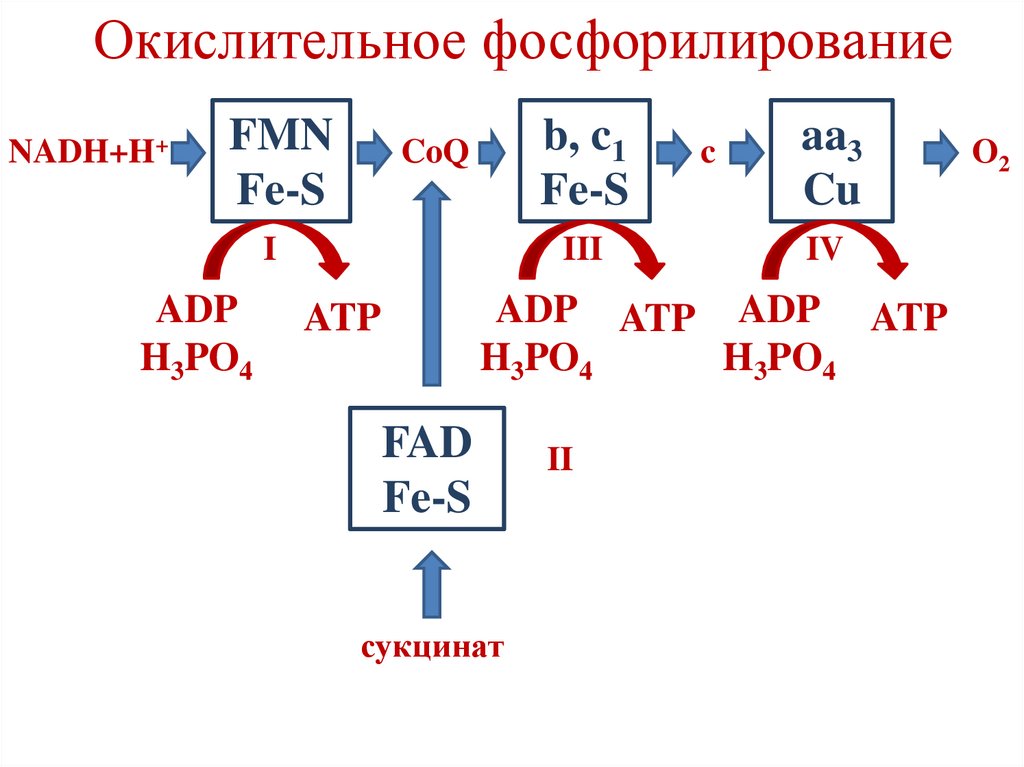
Окислительноефосфорилирование
• В ДЦ существуют 3 участка, где снижение
свободной энергии достаточно для синтеза АТФ
из АДФ и фосфата (˃ 7,3 ккал/моль).
• Участки, где происходит синтез АТФ,
называются точками фосфорилирования.
• Они соответствуют I, III и IV комплексам
дыхательной цепи.
92.
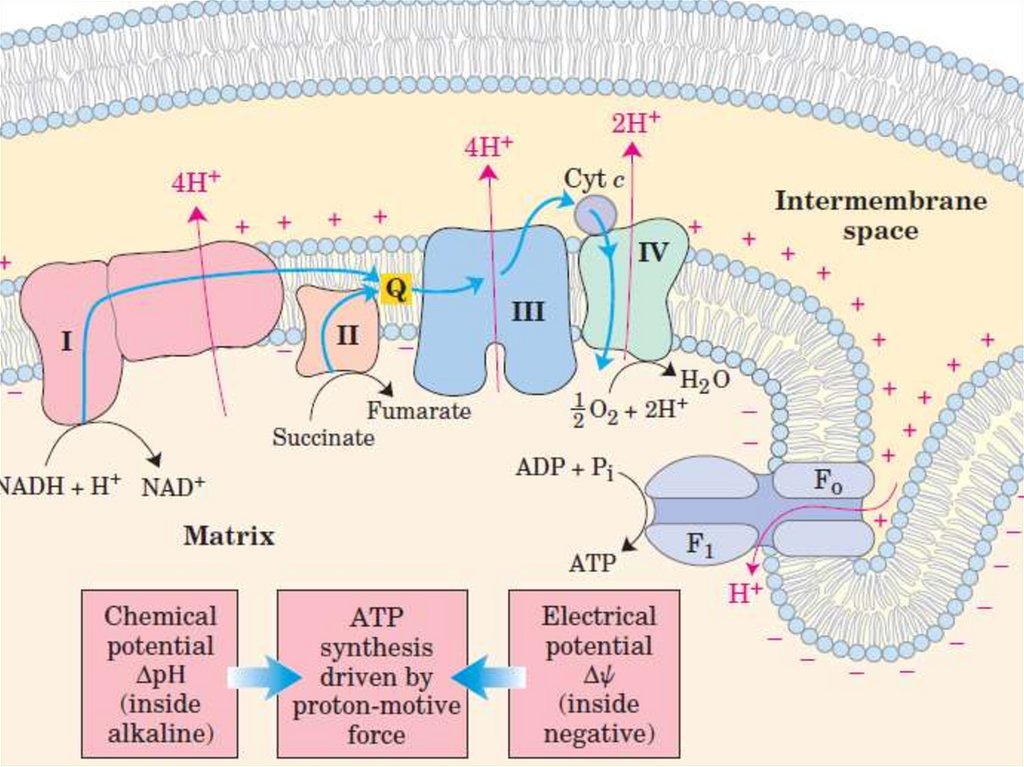
Окислительное фосфорилированиеNADH+H+
FMN
Fe-S
b, c1
Fe-S
CoQ
I
ADP
H3PO4
III
c
aa3
Cu
IV
ADP ATP ADP ATP
H3PO4
H3PO4
ATP
FAD
Fe-S
сукцинат
II
O2
93.
+НАДН+Н = 3АТФ
ФАДН2 = 2 АТФ
94.
Энергетический балансцикла Кребса
Суммарная реакция цикла Кребса
CH3-CO-SCoA + 2H2O + 3NAD+ + 1FAD +
GDP + H3PO4 → 2CO2 + HS-CoA +
3NADH+3H+ + 1FADH2 + GTP
3НАДН = 3*3АТФ = 9АТФ
1ФАДН2 = 2АТФ
1ГТФ = 1АТФ
12 АТФ
95.
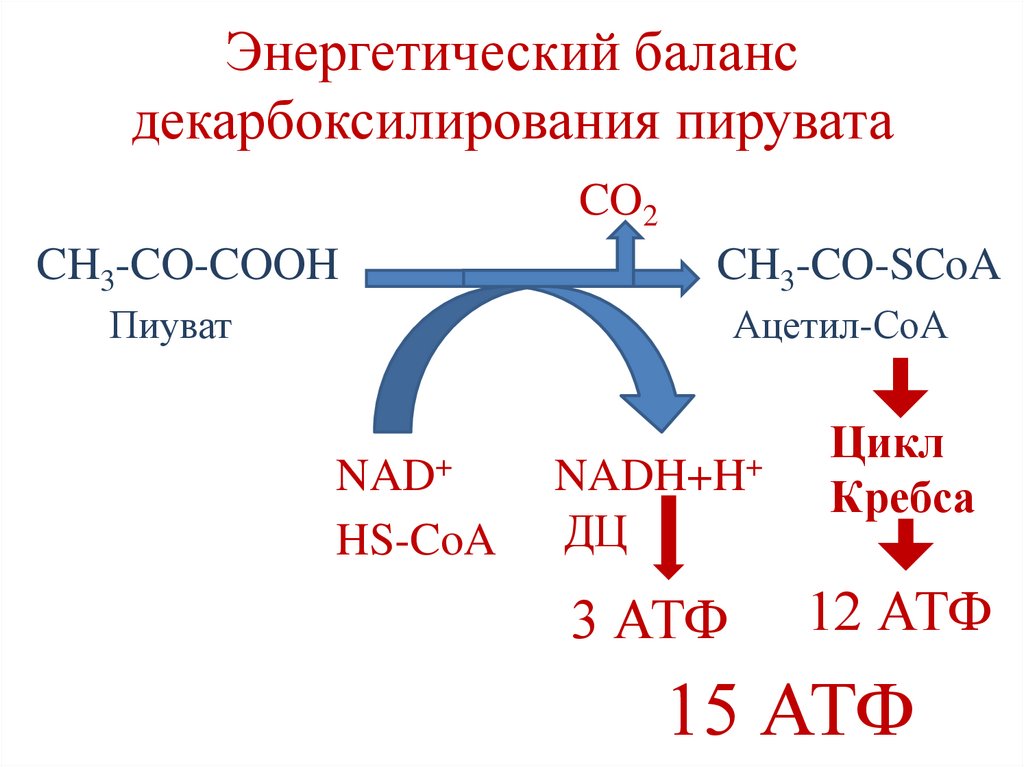
Энергетический балансдекарбоксилирования пирувата
CO2
CH3-CO-COOH
CH3-CO-SCoA
Пиуват
Ацетил-СоА
NAD+
NADH+H+
HS-CoA
ДЦ
3 АТФ
Цикл
Кребса
12 АТФ
15 АТФ
96.
Механизм сопряжения окисленияи фосфорилирования
Хемиосмотическая теория Митчелла
объясняет каким образом энергия переноса
электронов по дыхательной цепи
используется для синтеза АТФ.
97.
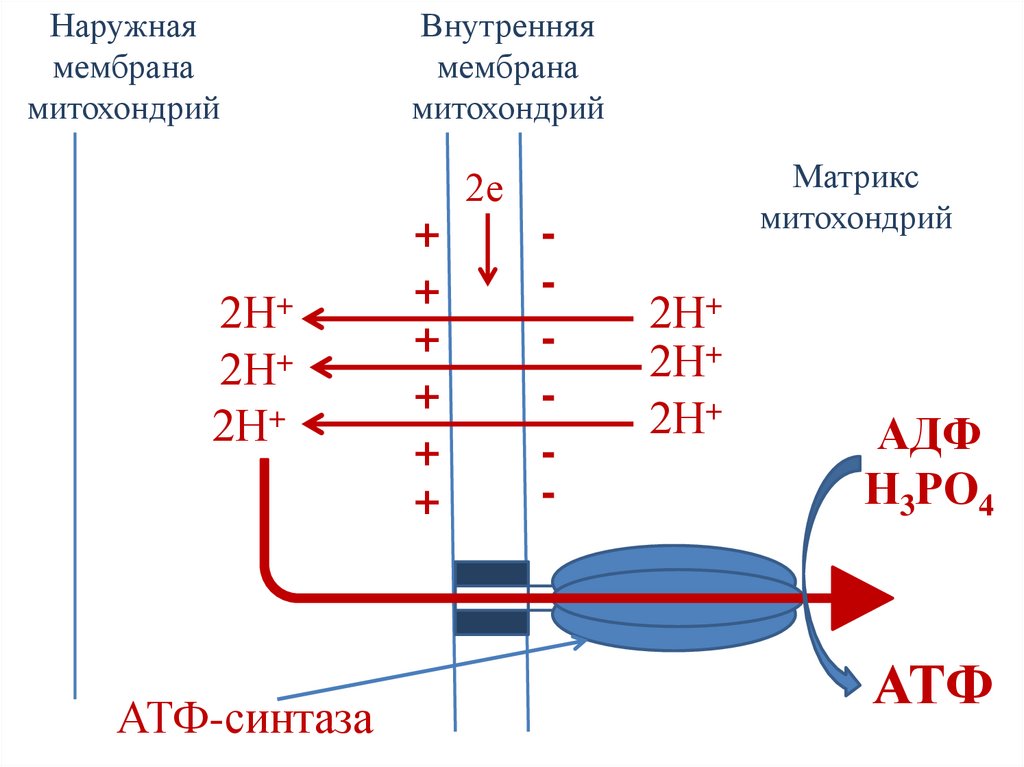
Хемиосмотическая теорияМитчелла
• Перенос электронов по дыхательной цепи
сопровождается выкачиванием протонов из
матрикса митохондрий в межмембранное
пространство.
• Протоны не могут вернуться обратно в
матрикс митохондрий, поскольку
внутренняя мембрана митохондрий
непроницаема для протонов.
98.
Хемиосмотическая теорияМитчелла
• Создается протонный градиент –
концентрация протонов в межмембранном
пространстве больше чем в матриксе.
• Протоны заряжены положительно, поэтому
появляется разность потенциалов по обе
стороны внутренней мембраны:
положительный – на наружной и
отрицательный – на внутренней стороне
внутренней мембраны митохондрий.
99.
Хемиосмотическая теорияМитчелла
• В совокупности электрический и
концентрационный градиенты составляют
электрохимический потенциал - ∆µН+
• Протоны могут возвращаться в матрикс
митохондрий только через ионный канал
фермента АТФ-синтаза.
100.
Хемиосмотическая теорияМитчелла
• Перенос протонов через АТФ-синтазу по
градиенту концентрации сопровождается
выделением свободной энергии, которая
используется для синтеза АТФ.
• Протонный градиент является движущей
силой синтеза АТФ.
101.
Наружнаямембрана
митохондрий
Внутренняя
мембрана
митохондрий
Матрикс
митохондрий
2е
2Н+
2Н+
2Н+
АТФ-синтаза
+
+
+
+
+
+
-
2Н+
2Н+
2Н+
АДФ
Н3РО4
АТФ
102.
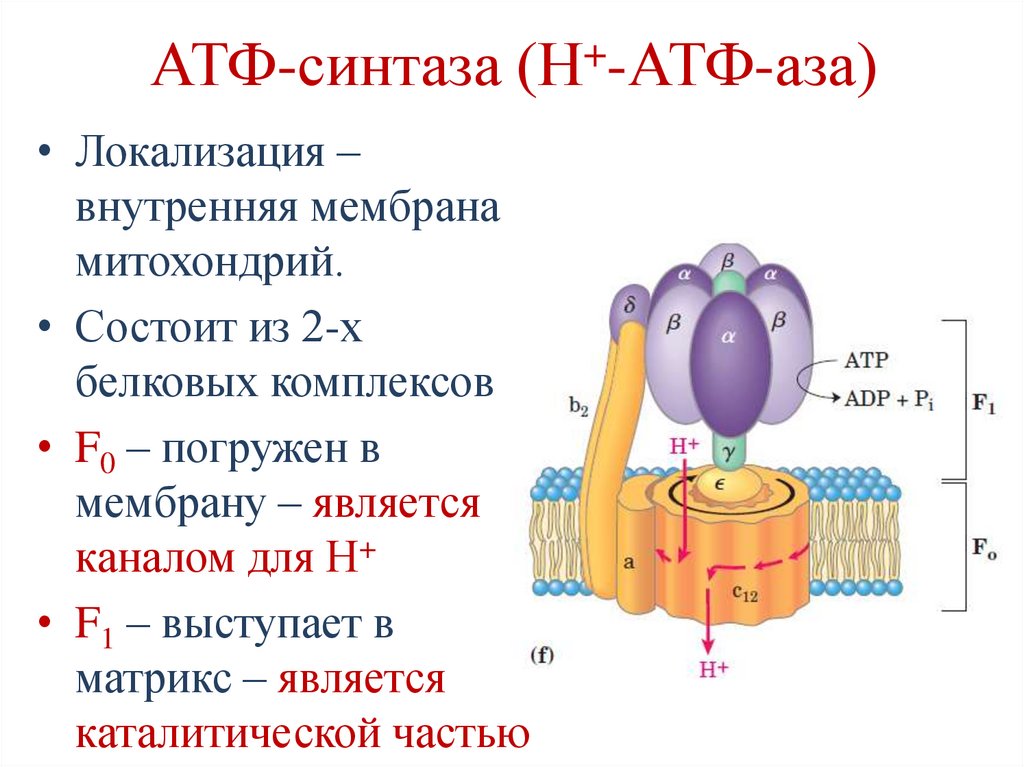
+АТФ-синтаза (Н -АТФ-аза)
• Локализация –
внутренняя мембрана
митохондрий.
• Состоит из 2-х
белковых комплексов:
• F0 – погружен в
мембрану – является
каналом для Н+
• F1 – выступает в
матрикс – является
каталитической частью
103.
104.
Коэффициент окислительногофосфорилирования (Р/О - отношение
количества фосфорной кислоты (Р),
используемой на фосфорилирование АДФ, к
атому кислорода (О), используемого в
дыхательной цепи.
Для НАДН – Р/О = 3
Для ФАДН2 – Р/О = 2
Дыхательный контроль – зависимость
скорости дыхательной цепи от концентрации
АДФ.
105.
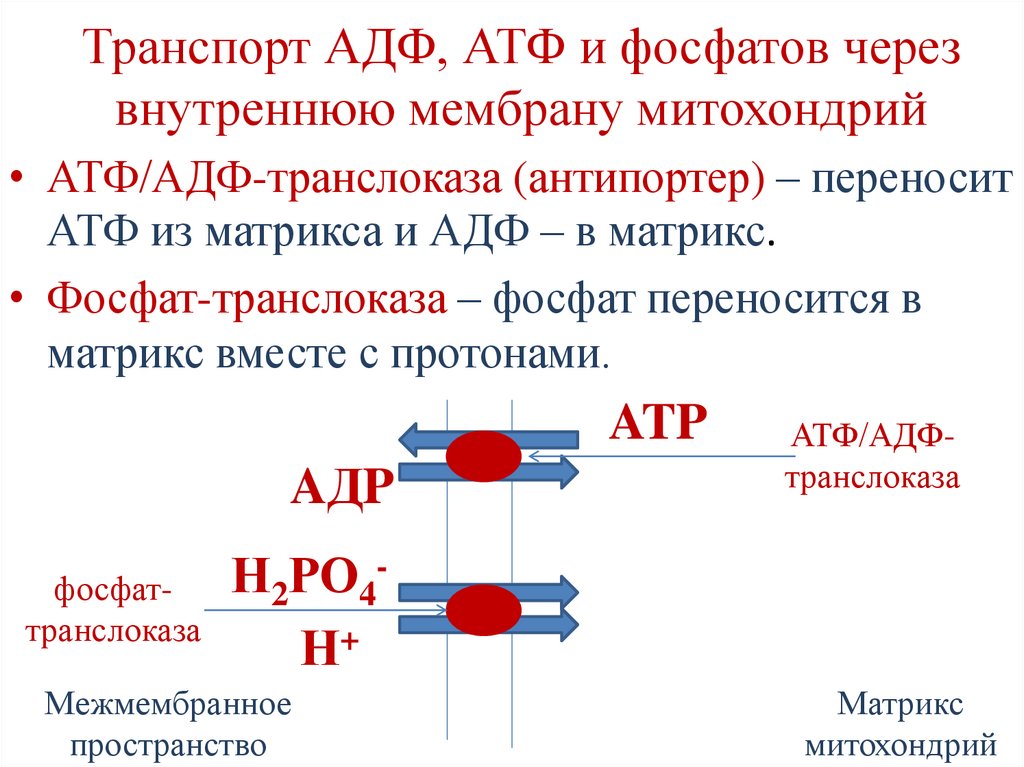
Транспорт АДФ, АТФ и фосфатов черезвнутреннюю мембрану митохондрий
• АТФ/АДФ-транслоказа (антипортер) – переносит
АТФ из матрикса и АДФ – в матрикс.
• Фосфат-транслоказа – фосфат переносится в
матрикс вместе с протонами.
ATP
AДP
АТФ/АДФтранслоказа
Н
РО
фосфат2
4
транслоказа
Н+
Межмембранное
пространство
Матрикс
митохондрий
106.
Терморегуляторная функциядыхательной цепи
• 40-45% энергии переноса электронов по
дыхательной цепи используется для синтеза
АТФ.
• 25% - на транспорт веществ через мембрану.
• 30-35% - на теплообразование (термогенез).
107.
Разобщение дыхания ифосфорилирования
• происходит под действием веществ, которые
переносят протоны (протонофоры) или другие
ионы (ионофоры) из межмембранного
пространства в матрикс митохондрий, минуя
канал АТФ-синтазы.
• Исчезает протонный градиент и уменьшается
синтез АТФ.
• Энергия переноса электронов выделяется в
виде теплоты, коэффициент Р/О уменьшается.
108.
Разобщающие агенты• 2,4-динитрофенол
• Дикумарол
• Билирубин
• Тироксин
• Свободные жирные кислоты
109.
Разобщающие агенты• Разобщающие агенты являются
липофильными веществами, связывают в
межмембранном пространстве протоны и
переносят их в матрикс.
• Разобщающие агенты увеличивают термогенез
!!!
110.
111.
Физиологическая рольразобщения
• Поддержание температуры тела у
новорожденных, у зимнеспящих животных,
при адаптации к холоду.
• Бурая жировая ткань специализированна на
термогенезе:
• Содержит много митохондрий;
• Содержит много ферментов ДЦ;
• Содержит белок термогенин (разобщающий
белок, UCP – uncoupling protein).
112.
Термогенин• По структуре близок к АТФ/АДФантипортеру, но не переносит нуклеотиды, а
переносит анионы жирных кислот.
Патологическое разобщение:
• Йодтиронины индуцируют синтез
термогенина – при гиперфункции
щитовидной железы увеличивается
температура тела.
113.
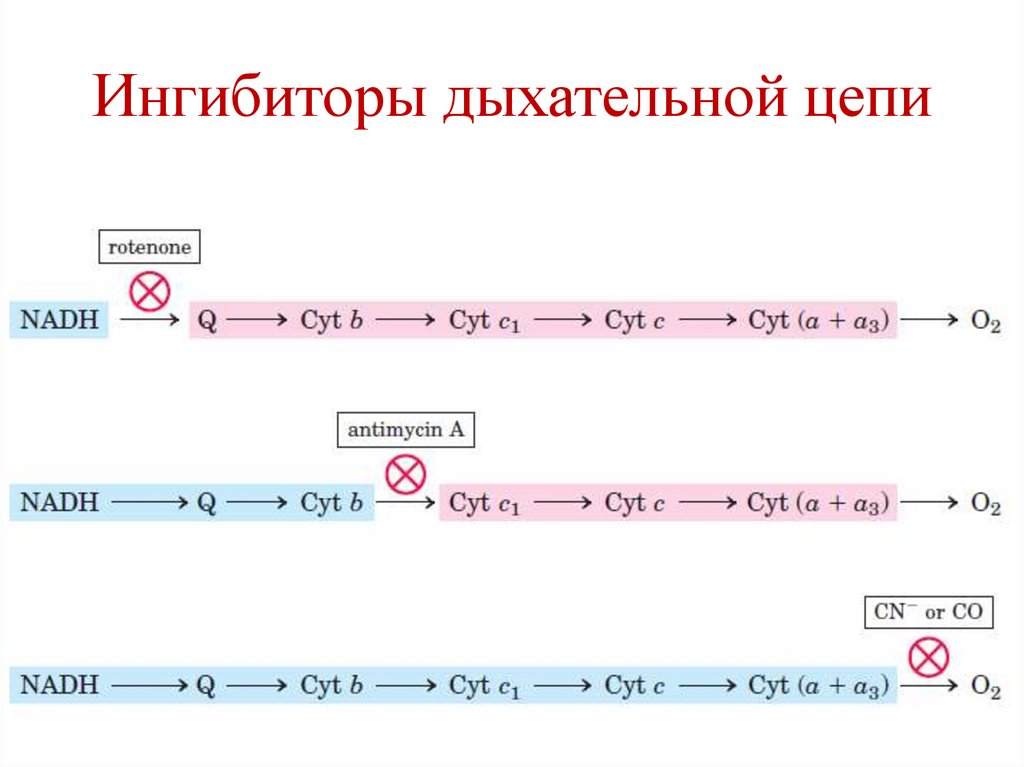
Ингибиторы дыхательной цепи• I комплекс – ротенон
• III комплекс – антимицин
• IV комплекс – цианиды, СО
Ингибиторы АТФ-синтазы
• Олигомицин
114.
Ингибиторы дыхательной цепи115.
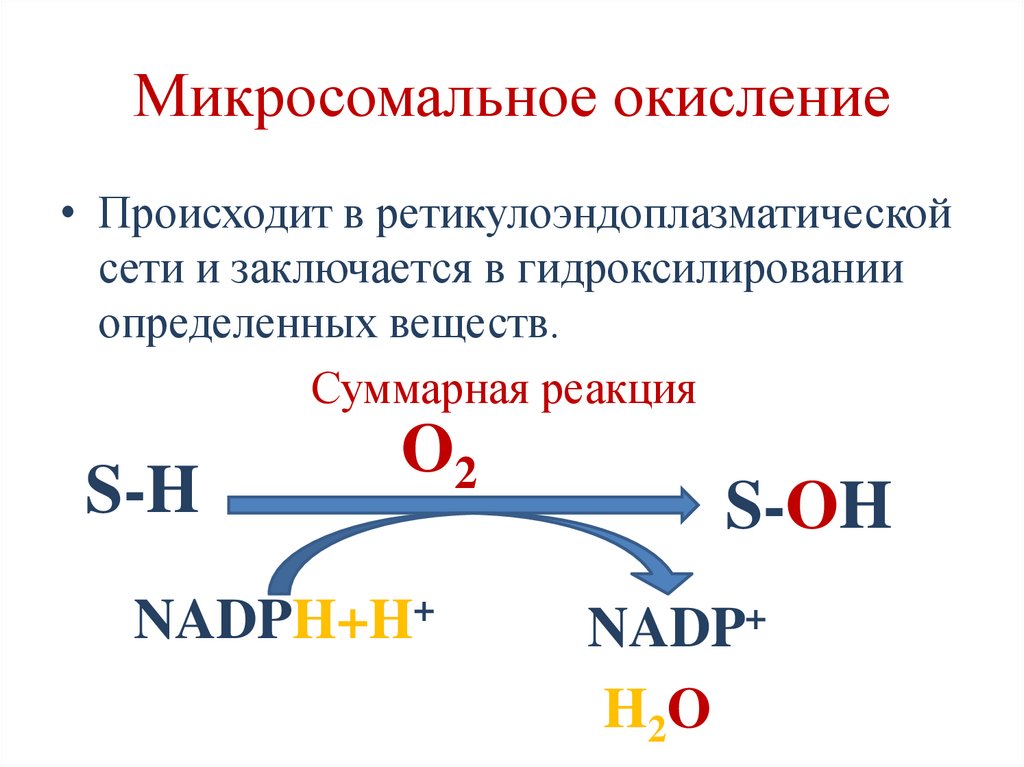
Микросомальное окисление• Происходит в ретикулоэндоплазматической
сети и заключается в гидроксилировании
определенных веществ.
Суммарная реакция
S-H
O2
NADPH+H+
S-OH
NADP+
H2O
116.
Микросомальное окисление117.
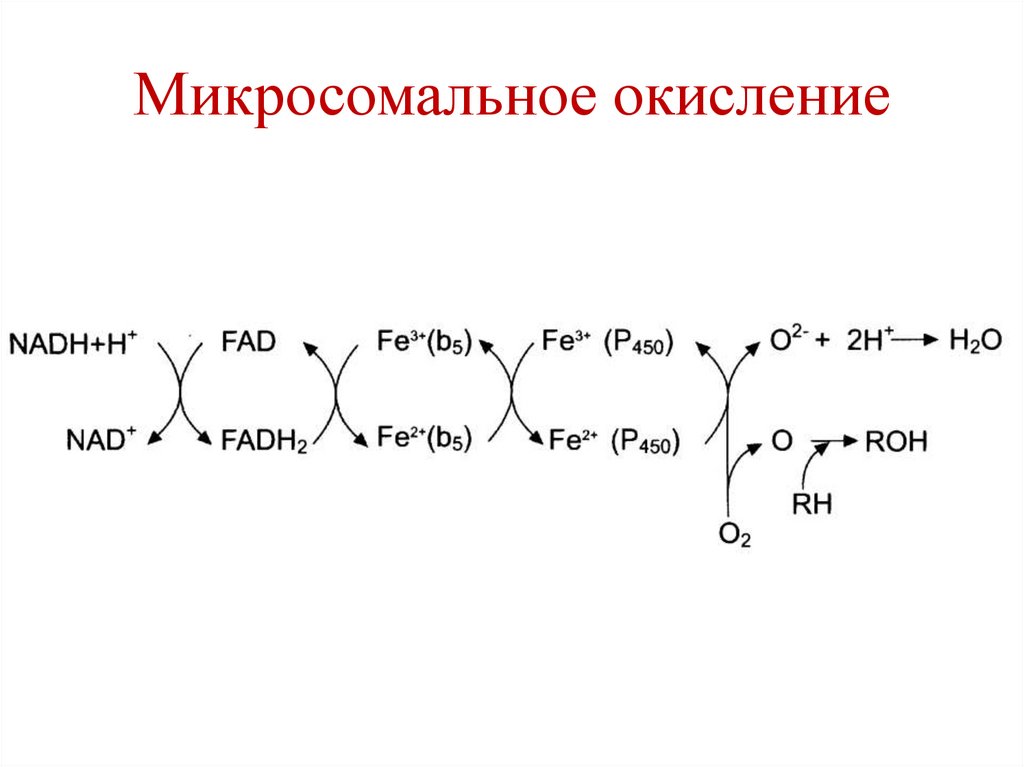
Микросомальное окисление• Ферменты – гидроксилазы (монооксигеназы).
В процессе участвует цитохром Р450 и ФАДзависимый флавопротеин.
Биологическая роль:
1. Обезвреживание экзогенных токсичных
веществ и инактивация эндогенных активных
веществ.
2. Синтетическая роль (синтез стероидных
гормонов, катехоламинов и др. веществ).
118.
Активные формы кислорода• Образуются при неполном восстановлении
кислорода.
Супероксидный анион
О2 + е- → О2Перекись водорода
О2- + О2- + 2Н+ → Н2О2 + О2
Гидроксильный радикал
О2- + Н2О2 → О2 + НО- + НО∙
119.
Активные формы кислорода• В нормальных количествах обладают
физиологическими эффектами (фагоцитоз
микроорганизмов, чужеродных частиц).
• В высоких концентрациях повреждают
нуклеиновые кислоты, белки, ферменты,
мембранные липиды.
120.
Антиоксидантные системы1. Ферменты:
Супероксиддисмутаза (СОД)
О2- + О2- + 2Н+ → Н2О2 + О2
Каталаза
2Н2О2 → 2Н2О + О2
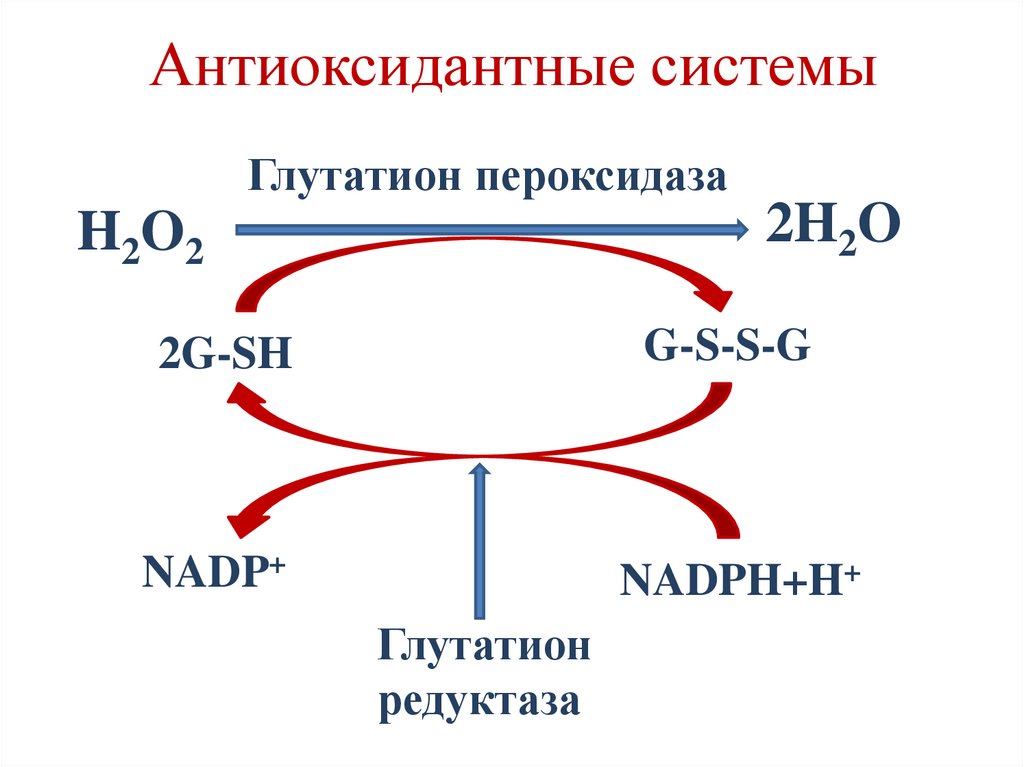
Глутатион пероксидаза
Глутатион редуктаза
2. Витамины Е, С.
121.
Антиоксидантные системыГлутатион пероксидаза
2H2O
H2O2
2G-SH
G-S-S-G
NADP+
NADPH+H+
Глутатион
редуктаза












































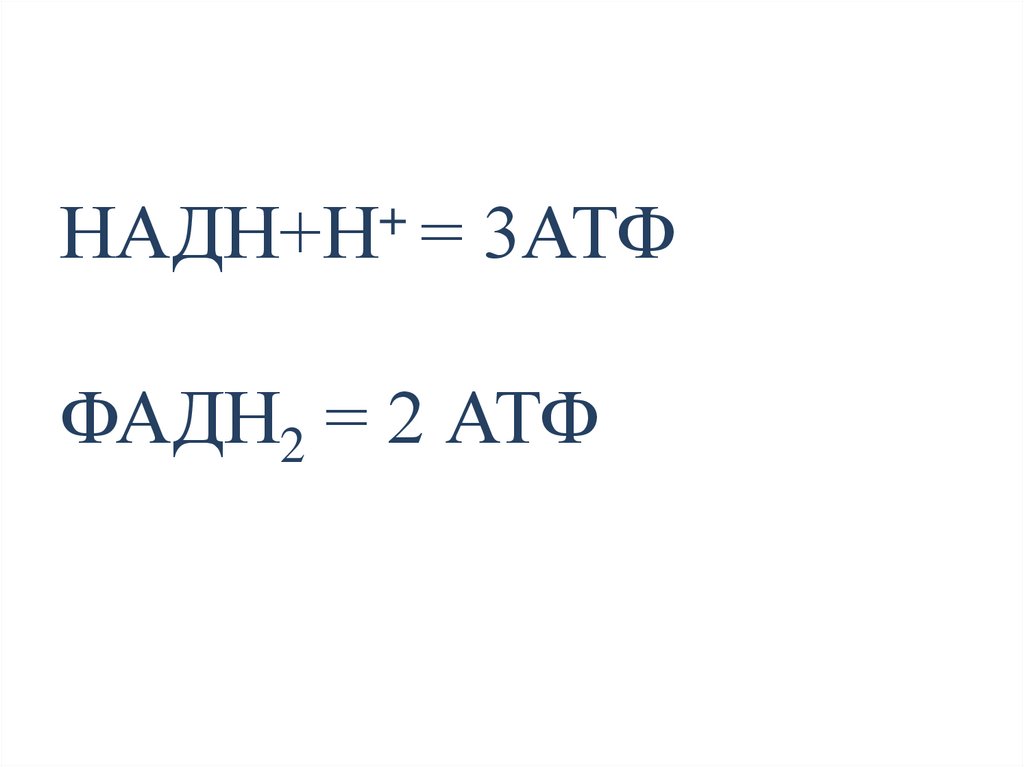


















 biology
biology








