Similar presentations:
Биоэнергетика. Биологическое окисление. Биологические виды энергии
1. БИОЭНЕРГЕТИКА
Л.И.Нефёдовд.м.н., профессор, D.h.c.,
профессор кафедры биохимии,
УО “ГрГУ им. Янки Купалы”
www.nil.grsu.by
1
2.
∆Go первой реакции:+14 кДж/моль указывает на невозможность ее
самопроизвольного
протекания
(эндергоническая), второй
-31 кДж/моль (экзергоническая): ∑∆Go -17.
Для
обеспечения
протекания
в
благоприятном с позиции термодинамики
направлении
реакций
в
клетке
необходимы
молекулы,
реакции
гидролиза которых характеризуется
(-)G – это макроэрги типа АТФ.
2
3.
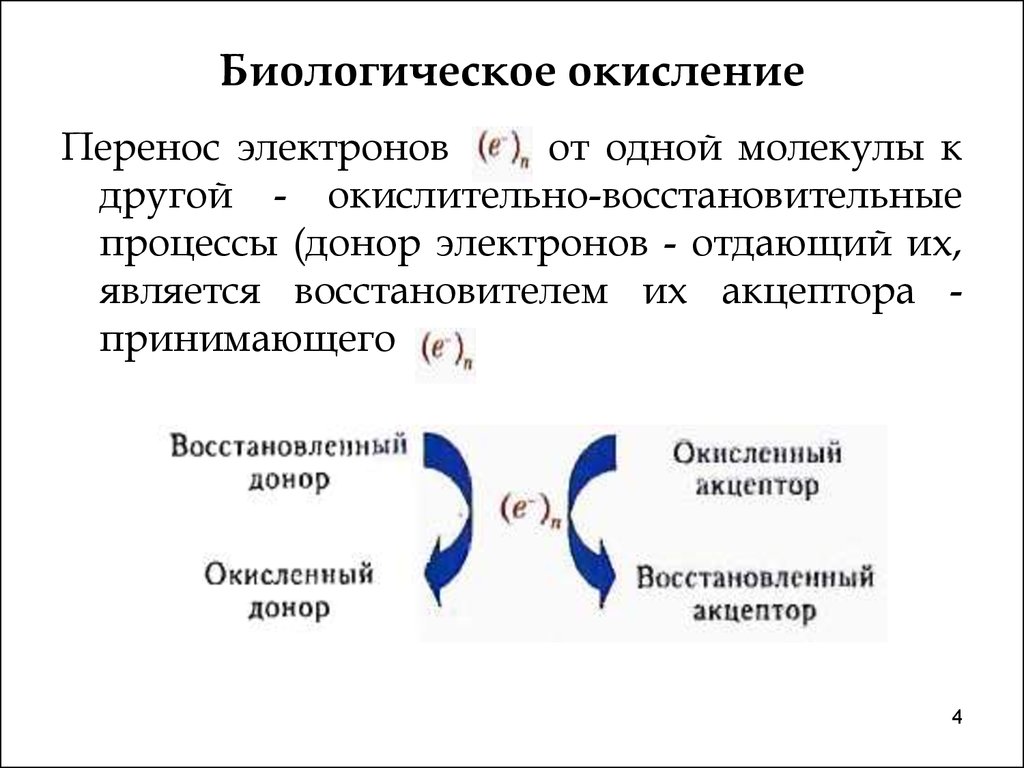
34. Биологическое окисление
Перенос электроновот одной молекулы к
другой - окислительно-восстановительные
процессы (донор электронов - отдающий их,
является восстановителем их акцептора принимающего
4
5. Способы передачи
• - прямой перенос:• - в составе состоящих из протона и электрона
атомов водорода:
• в составе состоящего из двух электронов и
одного протона гидрид - иона (:H-);
• от окисляемого вещества на кислород,
связывающийся ковалентно с окисляемым
веществом.
Чаще всего переносятся два электрона рассматриваются
как
«единица»
биологического окисления.
5
6.
Вкачестве
эквивалента
для
оплаты
энергетических затрат в:
1. - мембране - используется ΔμН+ или
ΔμNa+,
2. - цитоплазме – АТФ, креатинфосфат и
другие макроэрги.
Источник АТФ – фосфорилирование:
1. субстратное (гликолиз, реакция сукцинил-КоА
—> сукцинат в ЦТК);
2. окислительное (генерация ΔμН+ и ΔμNa+,
используемых
для
окислительного
фосфорилирования
при
транспорте
электронов
в
дыхательной
цепи
энергосопрягающих мембран митохондрий).
6
7. БИОЛОГИЧЕСКИЕ ВИДЫ ЭНЕРГИИ
Энергияразности
потенциалов
на
сопрягающих мембранах может:
1. - обратимо превращаться в энергию АТФ
в
Н+-АТФ-синтазной
реакции
в
мембранах, генерирующих протонный
потенциал ΔμН+;
2. - Na+-АТФ-синтазой (Na+-АТФазой) в
“натриевых”
мембранах,
поддерживающих потенциал ΔμNa+.
Энергия субстратов дыхания утилизируется
ферментами дыхательной редокс-цепи.
Генерируемый потенциал используется для
совершения
полезной
работы
образования АТФ.
7
8. Катализирующие окислительно-восстановительные реакции биологического окисления ОКСИДОРЕДУКТАЗЫ
- двухкомпонентные ферменты, коферментамикоторых м.б. моно- и динуклеотиды (производные
витаминов
РР
(В5)
и
В2),
производные
протопорфиринов, хиноны, ионы металлов промежуточные акцепторы электронов.
Оксидоредуктаза с восстановленным коферментом
не участвует в катализе до тех пор, пока
электроны её кофермента не будут переданы на
конечный акцептор.
Отношение
восстановленный
кофермент/окисленный
кофермент
–
важнейший регуляторный фактор окислительновосстановительных реакций.
8
9.
По типу конечного акцептора всеокислительно-восстановительные
реакции разделяют на аэробные
(конечный акцептор О2) и анаэробные
(конечный
акцептор
другие
соединения),
а по способу передачи электронов,
которым пользуются оксидоредуктазы,
различают
дегидрогеназы,
оксидазы,
оксигеназы и гидропероксидазы.
9
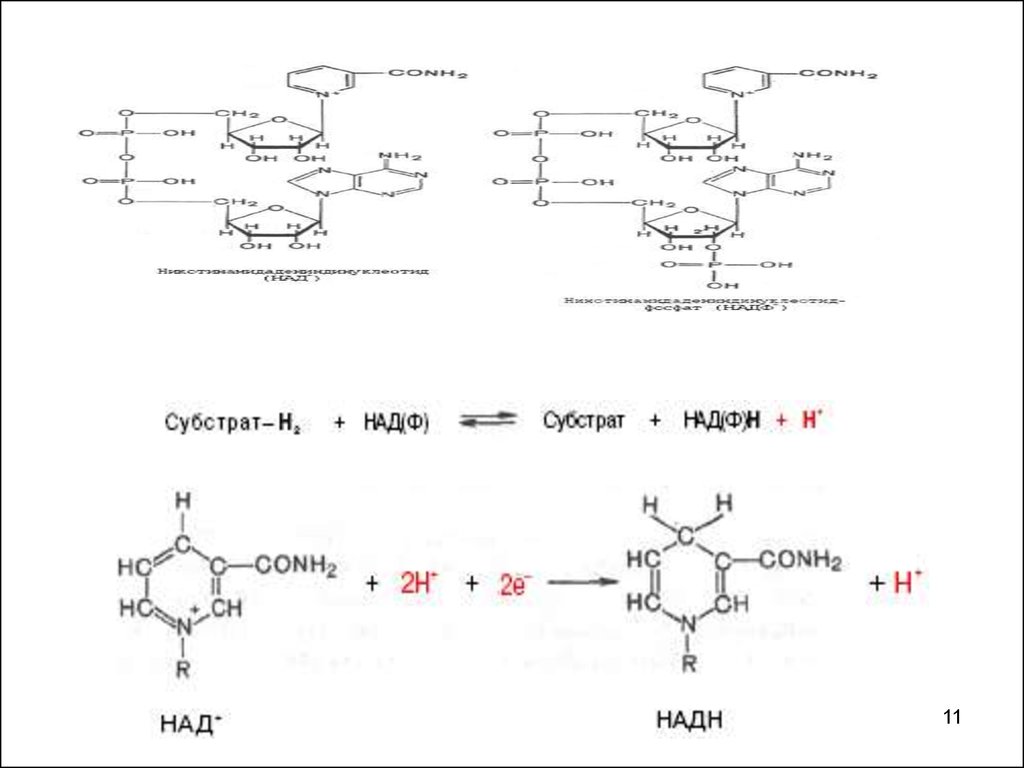
10.
Самаямногочисленная
группа
оксидоредуктаз
никотинамид
(пиридин)-зависимые
и
флавинзависимые дегидрогеназы.
• Коферменты никотинамидзависимых
дегидрогеназ - динуклеотиды.
• Различают два типа коферментов
данных
дегидрогеназ:
никотинамидадениндинуклеотид
(НАД+)
и
никотинамидадениндинуклеотидфосф
ат (НАДФ+).
10
11.
1112.
НАД+ и НАДФ - дегидрогеназы катализируютперенос гидрид-иона (акцептором в реакции
выступает пиридиновое кольцо никотинамида).
• Различия в структуре НАД+ и НАДФ+ не
отражаются на механизме их участия в
реакциях переноса электронов, но придают
им разные функции в клетке:
- НАДН∙Н+ поставляет электроны в реакции,
обеспечивающие образование макроэргов, а
- НАДФН∙Н+ - для анаболических процессов
(восстановительные синтезы) и реакций
обезвреживания ксенобиотиков и активных
форм О2.
12
13.
• Активная часть молекулы ФАД и ФМН изоаллоксазиновое кольцо рибофлавина.• В отличие от НАД+ и НАДФ - дегидрогеназ,
которые
переносят
одновременно
два
электрона, коферменты флавинзависимых
дегидрогеназ обладают важным качеством могут переносить и по одному, и по два
электрона 13
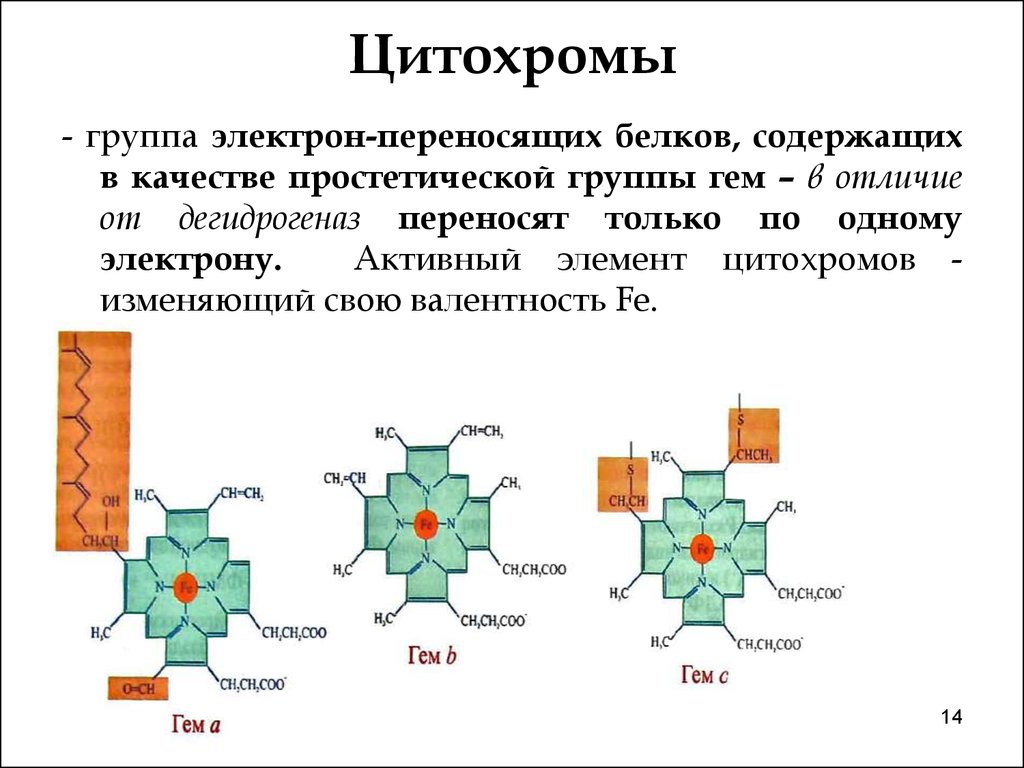
14. Цитохромы
- группа электрон-переносящих белков, содержащихв качестве простетической группы гем – в отличие
от дегидрогеназ переносят только по одному
электрону.
Активный элемент цитохромов изменяющий свою валентность Fe.
14
15. Железосерные комплексы
-Железосерные комплексы
группа
белков,
участников
окислительновосстановительных реакций.
Fe в этих комплексах – негемовое (негемовые
железопротеины) и формирует FeS-центры, в
которых атом Fe связывается координационными
связями с S цистеиновых остатков молекулы белка играют важную роль в соединении в цепочках
переноса
электронов
двуэлектронных
переносчиков с одноэлектронными.
15
16.
Все перечисленные выше белки иферменты используют 3 из 4-х
механизмов переноса электронов:
1. перенос электронов (цитохромы и FeSбелки),
2. перенос электронов в составе:
2.1. гидрид-ионов (НАД-зависимые
дегидрогеназы)
2.2. атомов водорода (ФАД-зависимые
дегидрогеназы).
16
17.
ТранспортирующаяH+-АТФ-синтаза
использует для синтеза АТФ энергию
градиента потенциала.
У
эукариот
окислительное
фосфорилирование происходит только в
аэробных условиях.
Второй способ синтеза АТФ осуществляется
в анаэробных условиях и основан на
переносе фосфатных остатков на АДФ
через метаболит с высоким потенциалом
переноса фосфатных групп - образование
АТФ из креатинфосфата.
17
18. Катаболизм белков, жиров и углеводов на трёх стадиях клеточного дыхания
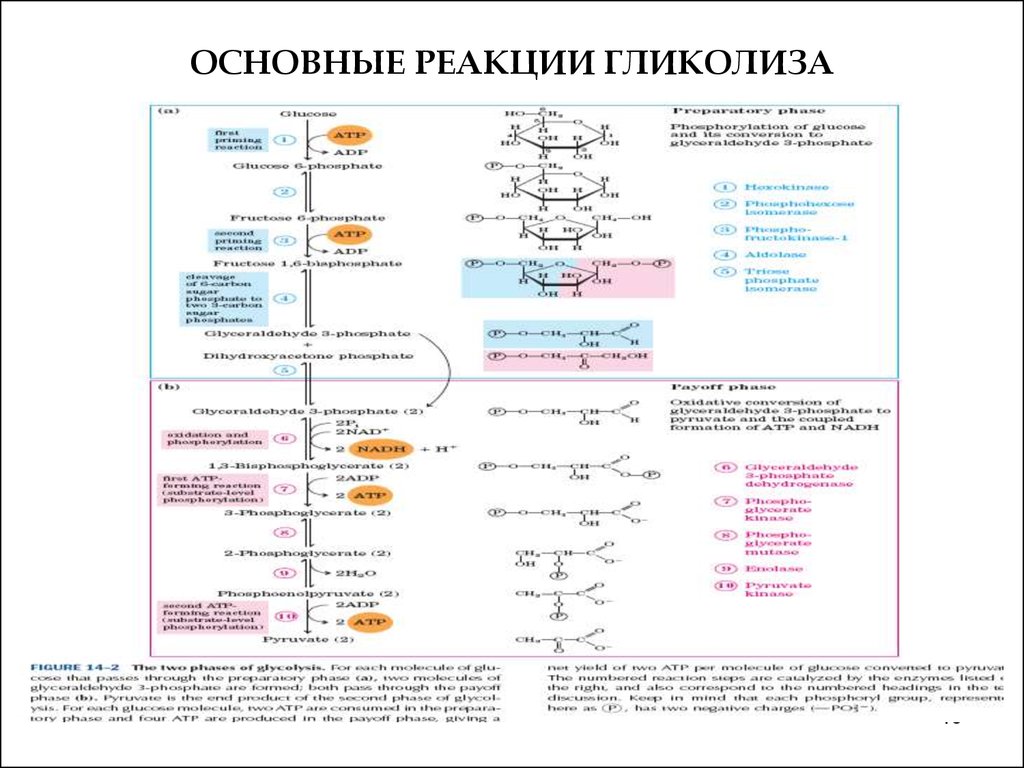
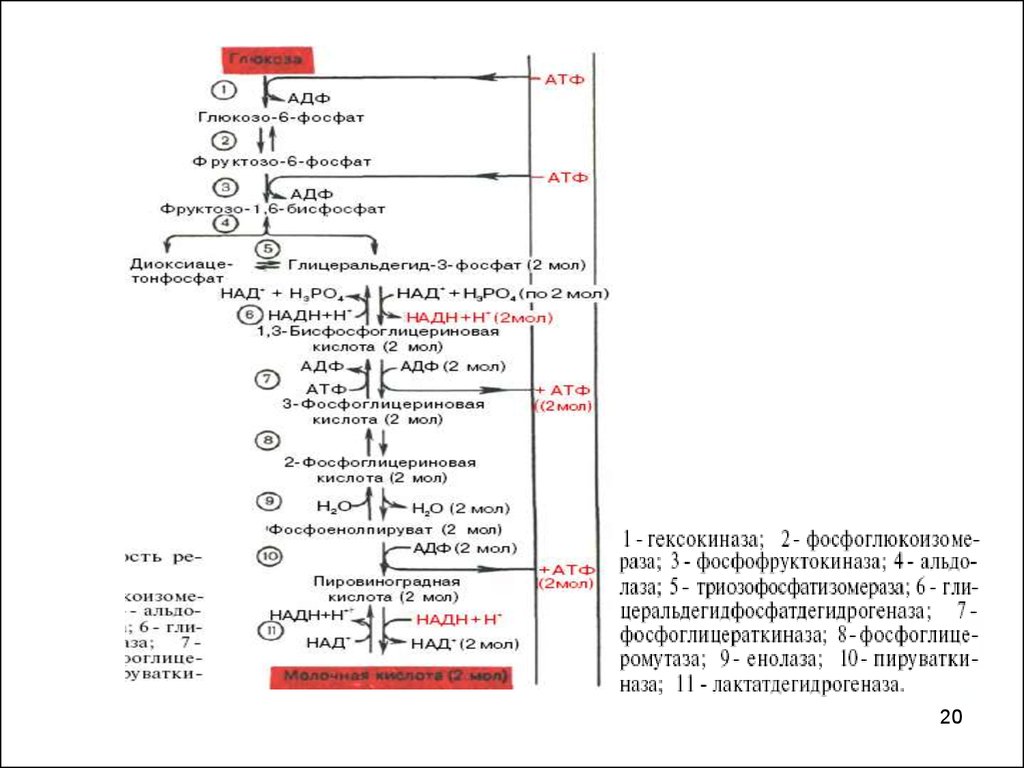
1819. ОСНОВНЫЕ РЕАКЦИИ ГЛИКОЛИЗА
1920.
2021. ГЛИКОЛИЗ
Т.о. при расщеплении 1М глюкозы образуется 2Мпирувата, при окислении которых до 2М ацетилКоА и последующих 2 оборотов ЦТК - 30 молекул
АТФ - окисление 1 М пирувата до СО2 и Н2О =15 М
АТФ.
К
этому
количеству
добавляется
2М
АТФ,
образующиеся при анаэробном гликолизе, и 6М
АТФ, синтезирующихся при окислении 2М
цитоплазматического НАДН, образующихся при
окислении
2М
глицеральдегид-3-фосфата
в
дегидрогеназной реакции гликолиза, при расщеплении в тканях 1 молекулы глюкозы по
уравнению
С6Н12О6 + 6О2 —> 6СО2 + 6Н2О
синтезируется 38 молекул АТФ
21
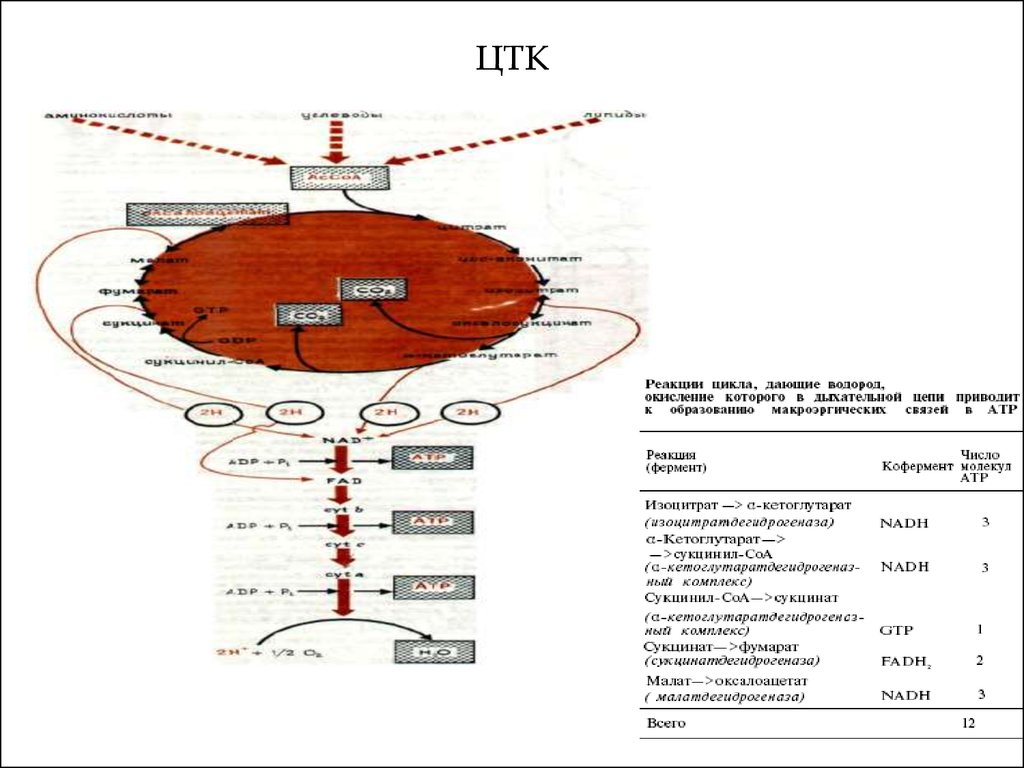
22. ЦТК
2223. ЦТК
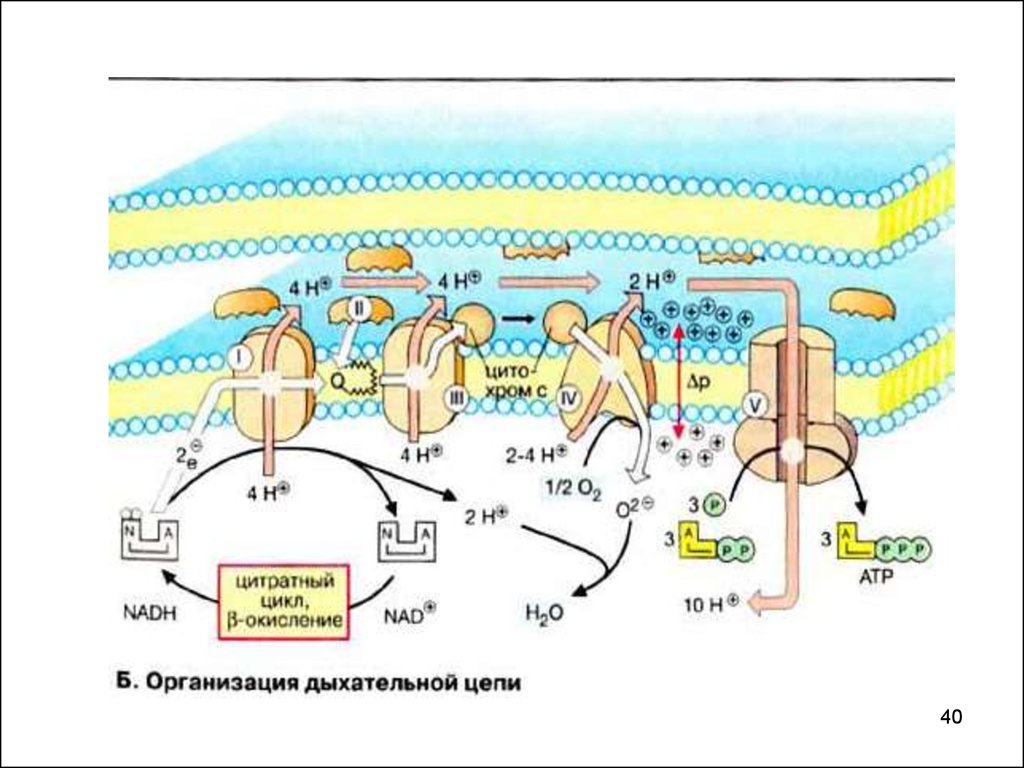
2324. I комплекс цепи тканевого дыхания – НАДН ∙ Н+: KoQ- оксидоредуктаза
- более 30 белковых субъединиц с общей М.м. 850кДа
формируют
пронизывающую
мембрану
структуру, напоминающую букву «L». Основная
функция комплекса – перенос электронов от
НАДН∙Н+ на KoQ. В переносе участвуют ФМН и
FeS-комплексы (флавопротеин I).
При работе комплекса используется свойство ФМН
переносить по одному электрону. Основной путь
переноса электронов:
Одновременно с переносом электронов комплекс
транспортирует
протоны
из
матрикса
в
межмембранное пространство (ММП). На каждые
2 электрона переносятся 4 протона.
24
25.
2526. II комплекс цепи тканевого дыхания – сукцинат : убихиноноксидоредуктаза (сукцинатедгидрогеназа)
- состоит из 4-х субъединиц с общей молекулярноймассой 97 кДа. В состав комплекса входят
железосерные белки с тремя типами FeS-центров
(флавопротеин II):
Первичным акцептором водорода является ФАД,
ковалентно связанный с комплексом. Путь, по
которому проходят электроны в комплексе:
26
27.
Комплекс II называют флавопротеином II(ФП2) т.к. на этом участке дыхательной цепи
в общий фонд KoQ передают свои электроны
другие флавопротеины: ФП3 - ацил-КоАдегидрогеназа (окисляющая активную жирную
кислоту)
и
ФП4
–
глицерофосфатдегидрогеназа.
В
состав
перечисленных
ФП
входят
ковалентно связанный ФАД и FeS - белки.
ФП1 - это комплекс I, также передающий
электроны KoQ, который становится, т.о.,
своеобразным
коллектором
всех
электронов, поступающих в митохондрию
из разных субстратов, и передает их
комплексу III.
27
28.
2829.
2 компонента внутренней мембраны не связаны скомплексами структурно, но обеспечивают
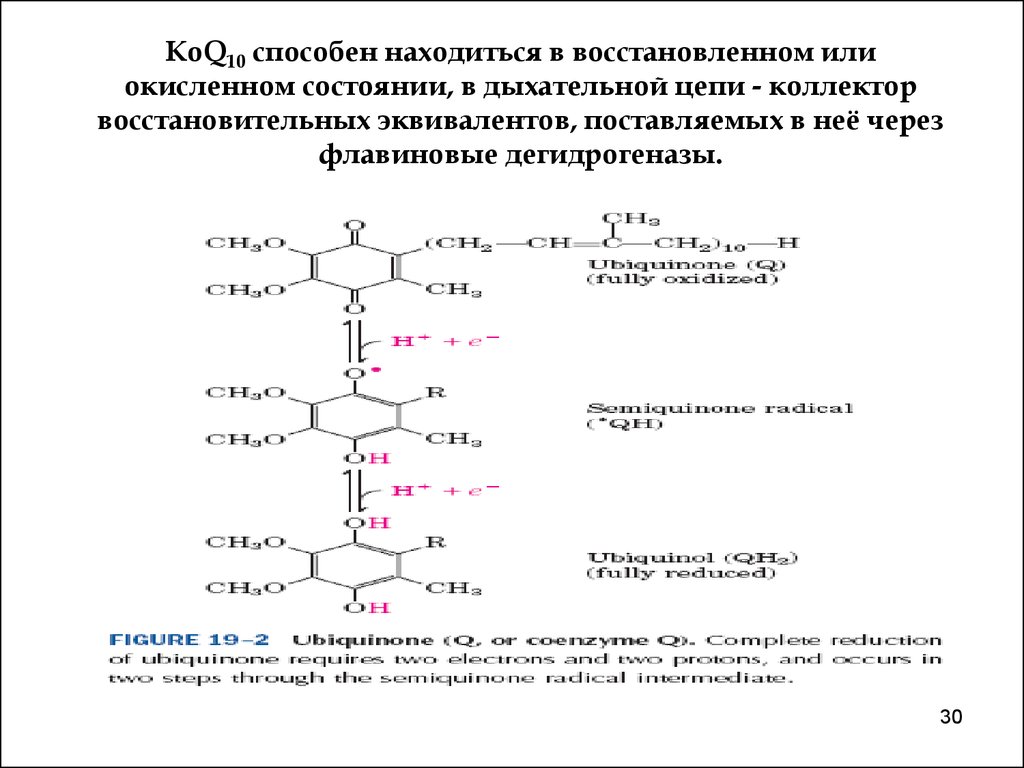
функциональную связь между ними. Это коэнзим (КоQ10 или убихинон) и цитохром с.
Убихинон - хинон с длинной полиизопреновой цепью,
состоящей из 10 изопреновых единиц (Q10!),
обеспечивающей его растворимость в липидах.
Свободное перемещение по мембране и самая
высокая молярная концентрация среди других
переносчиков делают КоQ10 функционально
значимым в механизмах транспорта электронов в
митохондриях.
Подобно ФАД и ФМН, КоQ10 может принимать 1
(семихинон) и 2 (убихинол) электрона, что позволяет
ему обеспечивать связь между переносчиками двух
и одного электронов.
29
30. КоQ10 способен находиться в восстановленном или окисленном состоянии, в дыхательной цепи - коллектор восстановительных эквивалентов, поста
КоQ10 способен находиться в восстановленном илиокисленном состоянии, в дыхательной цепи - коллектор
восстановительных эквивалентов, поставляемых в неё через
флавиновые дегидрогеназы.
30
31.
Цитохром с по величине редокс-потенциаларасполагается между III и IV комплексами
внутренней мембраны и обеспечивает связь
между ними. Это единственный из
водорастворимых участников переноса
электронов.
Т.о., по величине редокс - потенциала удается
«выстроить» комплексы митохондрий в цепь
переноса электронов от НАДН∙Н+ до О2, с
которым взаимодействует IV комплекс.
Эта цепь ферментов получила название цепи
ферментов митохондриального (тканевого)
дыхания
31
32. III комплекс цепи тканевого дыхания – убихинол: цитохром с оксидоредуктаза (цитохром с- редуктаза)
- в его состав входят два цитохрома b (bL и bH),цитохром с1, и FeS-белок. Суммарная реакция
процессов,
протекающих
при
участии
комплекса III:
- комплекс забирает электроны у KoQH2 и
передает их цитохрому с. Т.к. цитохромы
неспособны связывать протоны, 4 протона
переносятся комплексом в межмембранное
пространство.
32
33. ЦИТОХРОМЫ
- выстроенные в дыхательную цепь в порядкевозрастания
окислительно-восстановительного
потенциала гемопротеины, в которых простетическая
геминовая группа близка по структуре (цитохром b)
гему Нb.
Ионы Fe+2(+3) в геме обратимо изменяют валентность
получая или отдавая электроны.
Цитохромы b, с1, с, а и а3 играют наиболее важную роль
процессах тканевого дыхания.
а3
- терминальный участок дыхательной цепи –
цитохромоксидаза,
окисляющая
цитохром
с
и
образование
Н2О
путём
двухэлектронного
восстановления одного атома кислорода - каждая
молекула O2 одновременно взаимодействует с двумя
электрон-транспортными цепями и при транспорте
каждой пары электронов в матриксе митохондрий
накапливается до 6 протонов.
33
34. IV комплекс дыхательной цепи - цитохром с-оксидаза
Получив электрон, цитохром с путем простойдиффузии переносит его на IV комплекс,
названный оксидазой из-за способности
непосредственно взаимодействовать с О2.
У млекопитающих - это крупный (~200 кДа)
трансмембранный белок из 6 – 13 субъединиц,
некоторые
из
них
кодируются
митохондриальной ДНК. В его состав входят
два хромопротеина - цитохром а и
цитохром а3, два атома меди - СuA и СuB,
связанные с белковыми частями цитохромов
таким
образом,
что
пространственно
сближены с Fe порфиринов, с которыми они
способны обмениваться электронами.
34
35.
Цитохром с-оксидаза катализирует одноэлектронноеокисление четырех восстановленных молекул
цитохрома с, одновременно осуществляя полное
(четырехэлектронное) восстановление молекулы О2.
Протоны для образования молекул Н2О поступают из
матрикса. Цитохром с, переносящий по 1 электрону,
вначале передает его СuA, а затем электрон переходит на
цитохром а. Кислород взаимодействует с Fe цитохрома
а3 после восстановления последнего. Комплекс IV
переносит также в межмембранное пространство 2
протона на каждые 2 переносимых электрона.
35
36.
Т.о., в результате последовательного переносаэлектронов всеми комплексами дыхательной цепи
митохондрий
на
каждые
2
перенесенных
электрона образуется 1 молекула Н2О, а
высвобождаемая в реакциях переноса электронов
энергия используется для переноса протонов в
межмембранное пространство.
36
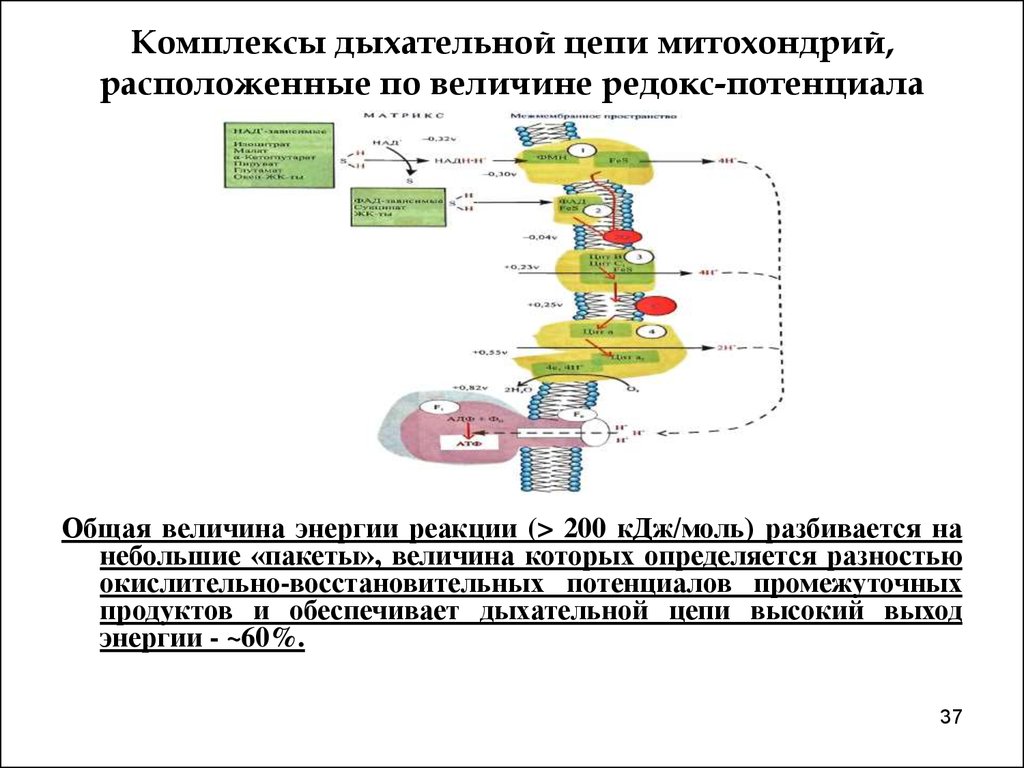
37. Комплексы дыхательной цепи митохондрий, расположенные по величине редокс-потенциала
Общая величина энергии реакции (> 200 кДж/моль) разбивается нанебольшие «пакеты», величина которых определяется разностью
окислительно-восстановительных потенциалов промежуточных
продуктов и обеспечивает дыхательной цепи высокий выход
энергии - ~60%.
37
38. Образование молекулы Н2О сопровождается переносом 10 или 6 протонов в ММП
Место включения Н+ в дыхательную цепь зависитот
количества протонов, переносимых в
межмембранное пространство.
Примечательна
судьба
водородов
НАД+зависимых дегидрогеназ, катализирующих
окислительные реакции вне митохондрий.
Так,
большинство
НАД+-зависимых
дегидрогеназ, поставляющих водород I
комплексу дыхательной цели, находятся в
матриксе митохондрий - они катализируют
реакции окисления в ЦТК (3 дегидрогеназы),
окислительное
декарбоксилирование
ПК,
окислительное
дезаминирование
Глу,
окисление гидроксиацил-КоА и др.
38
39.
Комплексы дыхательной цепи содержатразличные простетические группы связанные с белками окислительновосстановительных коферменты:
1. флавин (ФМН или ФАД), в комплексах I
и II;
2. железо-серные центры (в I, II и III) содержат 2-6 ионов Fe, образующих
комплексы с неорганическим сульфидом и
SH-группами остатков Цис);
3. группы гема (в II, III и IV).
39
40.
4041.
4142.
1.2.
3.
4.
5.
Электроны поступают в дыхательную цепь
различными путями:
при окислении НАДН+Н+ комплекс I переносит их
через ФМН и Fe/S-центры на КоQ;
при окислении сукцината, ацил-КоА и др.
субстратов они переносятся на КоQ комплексом II
или митохондриальной сукцинатдегидрогеназой через
связанный с ней ФАДН2 или флавопротеин окисленный Ко Q восстанавливается, и переносит их в комплекс III, поставляющий их
через 2 гема b1 Fe/S-центр и гем с1 на
гемсодержащий белок цитохром с,переносящий их к комплексу IV - цитохром соксидазе, содержащей 2 Cu2+- cодержащих центра
(A и B) и гемы а и а3, от которых электроны,поступают к О2 – при его восстановлении
образуется основной анион О2-, связывающий 2
протона и переходящий в Н2О.
42
43.
Окисление НАДН комплексом I происходит навнутренней стороне мембраны и в матриксе,
где и реализуется ЦТК и β-окисление
жирных
кислот
наиболее
важные
источники НАДН.
Перенос протонов комплексами I, III
и IV реализуется векторно - из
матрикса
в
межмембранное
пространство.
Только АТФ-синтаза митохондрий
реализует обратное движение
протонов в матрикс.
43
44. ХЕМИОСМОТИЧЕСКАЯ КОНЦЕПЦИЯ
- превращения энергии в живых клетках выдвинута П.Митчеллом в 1960г. Нобелевская премия, 1978) для
объяснения молекулярного механизма сопряжения
транспорта электронов с образованием АТФ в
дыхательной цепи и развита Дж. Уокером
(Нобелевская премия, 1997), описавшим молекулярные
механизмы
действия
основополагающего
фермента биоэнергетики - протонной АТФсинтазы.
Движение электронов по дыхательной цепи
источник энергии для транслокации протонов
через
митохондриальную
мембрану,
а
возникающая в результате этого разность
электрохимических потенциалов (ΔμH+) приводит
в
действие
АТФ-синтазу,
катализирующую
образование АТФ из АДФ и Рi:
АДФ + Рi = АТФ
44
45. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- механизм регуляции образования и потребления АТФ,основанный на сопряжении процессов её ресинтеза с
общими коферментами и другими факторами.
В отсутствие АДФ АТФ-синтаза не в состоянии
использовать протонный градиент на внутренней
митохондриальной
мембране,
что
ингибирует
электронный перенос в дыхательной цепи и НАДН не
может быть вновь окислен в НАД+.
Возникающее высокое соотношение НАДН/НАД+
ингибирует ЦТК и замедляет потребление субстратов,
и, наоборот, активация потребления АТФ стимулирует
усвоение пищи и дыхательную цепь.
Если создание протонного градиента подавлено,
процессы окисления субстратов и переноса электронов
протекают быстрее обычного, а вместо ресинтеза АТФ
выделяется тепло.
45
46. РАЗОБЩАЮЩИЕ АГЕНТЫ
- функциональноразделяют
окисление
и
фосфорилирование, без участия АТФ-синтазы,
содействуя переносу протонов из межмембранного
пространства в матрикс.
Разобщение возникает в результате повреждения
внутренней
мембраны,
действия
2,4динитрофенола - переносчика протонов через
мембрану
или
природного
соединения
термогенина, разобщающего протонный канал в
митохондриях бурых жировых клеток (источник
теплообразования бурый жир обнаружен у новорожденных и
животных, впадающих в зимнюю спячку, а при охлаждении
организма норадреналин активирует гормонзависимую липазу.
Благодаря интенсивному липолизу образуется большое
количество свободных жирных кислот, которые распадаются в
при β-окислении и в дыхательной цепи. Т.к. жирные кислоты
при этом открывают протонный канал термогенина, их
распад не зависит от наличия АДФ, т. е. протекает с
максимальной скоростью и генерирует энергию в форме тепла)
46
47.
4748. Организация и функционирование дыхательной цепи
Компоненты дыхательной цепи митохондрий впорядке
убывания
окислительновосстановительного потенциала
48
49.
4950. ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Известно, что при недостатке АДФ скоростьаэробного дыхания тормозится (дыхательный
контроль). Таким способом регулируется скорость
окислительного фосфорилирования.
Д. Е. Аткинсон (1968) предложил характеризовать
энергетическое состояние клетки количественно,
вычисляя «заполнение» системы АТФ-АДФ-АМФ
высокоэнергетическими фосфатными связями.
Если все содержащиеся в клетке аденозинфосфаты
находятся в форме АТФ, то система энергетически
заполнена до предела, т. е. ее энергетический заряд
равен 1,0.
Если аденозинфосфаты находятся в форме АМФ, то
система не содержит высокоэнергетических связей,
она энергетически «пуста», ее заряд равен 0.
Энергетический заряд системы ‘АТФ-АДФ-АМФ
вычисляется по уравнению:
50
51.
От величины энергетического заряда зависят скоростиреакций ЦТК и скорости других реакций, связанных
с образованием или потреблением энергии.
Например, у дрожжей уменьшение отношения АТФ/АМФ
вызывает активацию ЦТК за счет активирования
цитрат-синтазы и изоцитратдегидрогеназы. В тканях
животных важную регуляторную роль выполняет
отношение АТФ/АДФ.
51
52.
Система для исследования дыхания митохондрий in vitro изменения количества О2 в водном растворе - состоитиз ячейки с платиновым электродом, связанным с
полярографом: в добавленную взвесь митохондрий вносят
субстраты или регуляторы системы переноса электронов,
количественно оценивая скорость дыхания и возможность
синтеза АТФ.
По Д.Чансу существует 5 состояний митохондрий, при
которых скорость их дыхания ограничивается
определенными факторами состояния дыхательного
контроля:
52
53.
В покоящейся клетке митохондрии находятся в состоянии4, при котором скорость дыхания определяется
количеством АДФ.
Во время работы митохондрии могут пребывать в
состояниях 3 (исчерпываются возможности дыхательной
цепи) или 5 (недостаток О2). Cкорость потребления О2
митохондриями контролируется концентрацией АДФ.
Т.о. окисление и фосфорилирование – сопряженные
процессы.
53
54.
Реакциидыхательной
цепи
сопряжены
с
реакциями
аэробного
фосфорилирования,
которое in vitro может быть
разобщено введением 2,4-ДНФ и
сходных веществ, in vivo подобную
роль
выполняют
тириодные
гормоны.
54
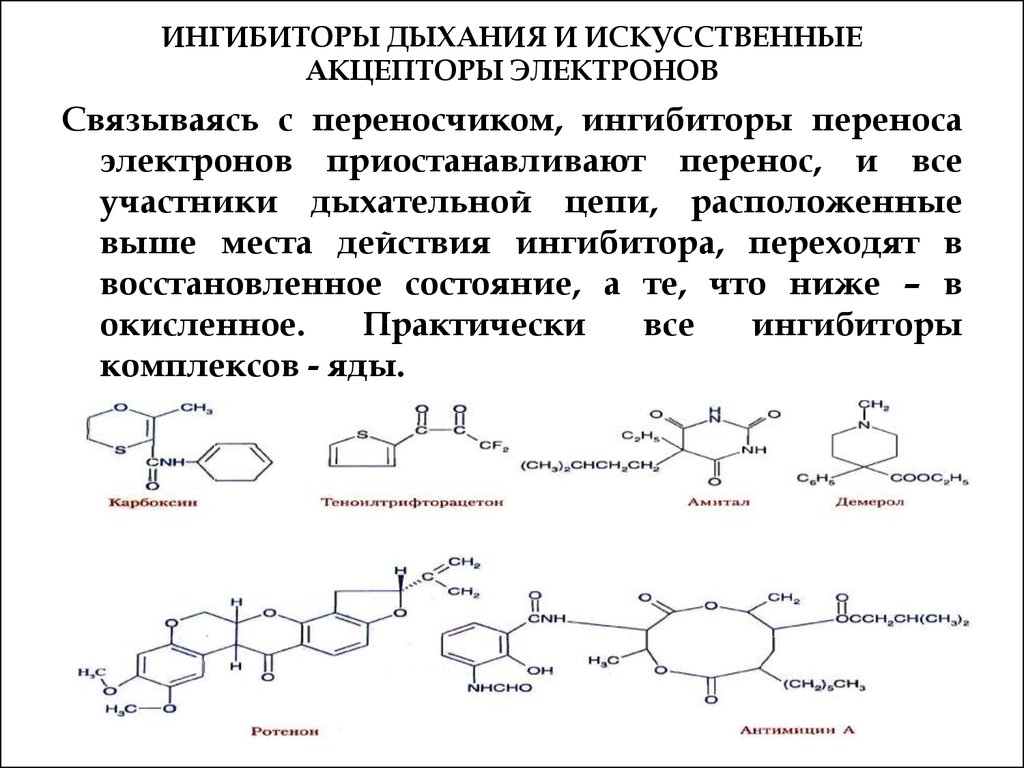
55. ИНГИБИТОРЫ ДЫХАНИЯ И ИСКУССТВЕННЫЕ АКЦЕПТОРЫ ЭЛЕКТРОНОВ
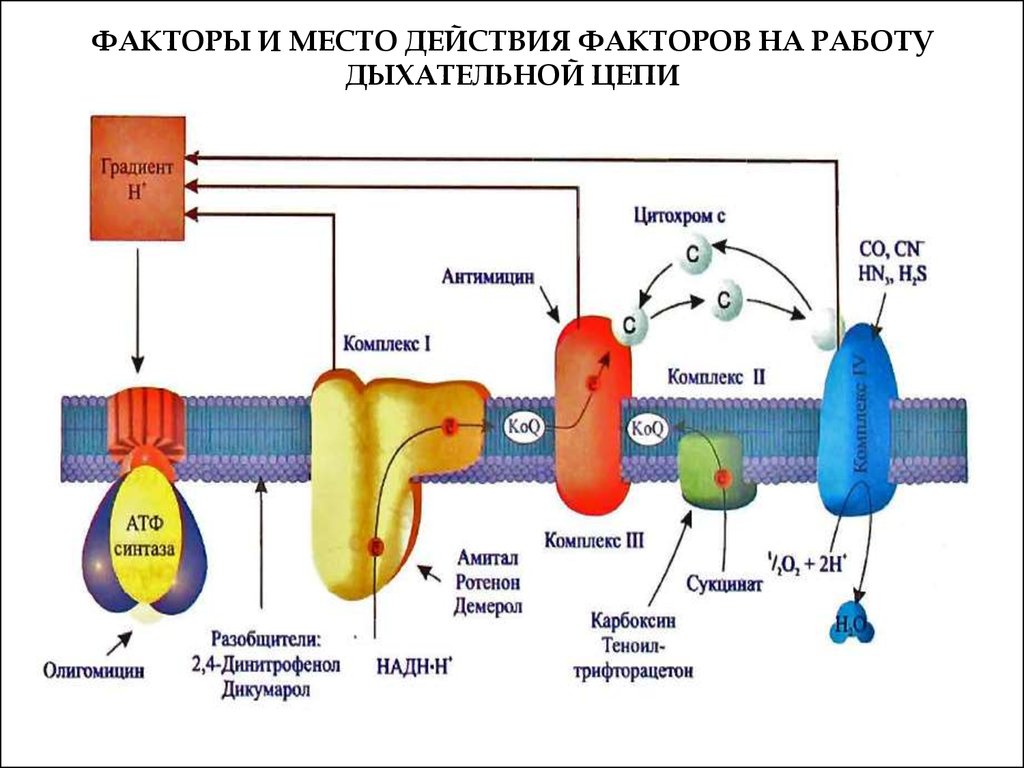
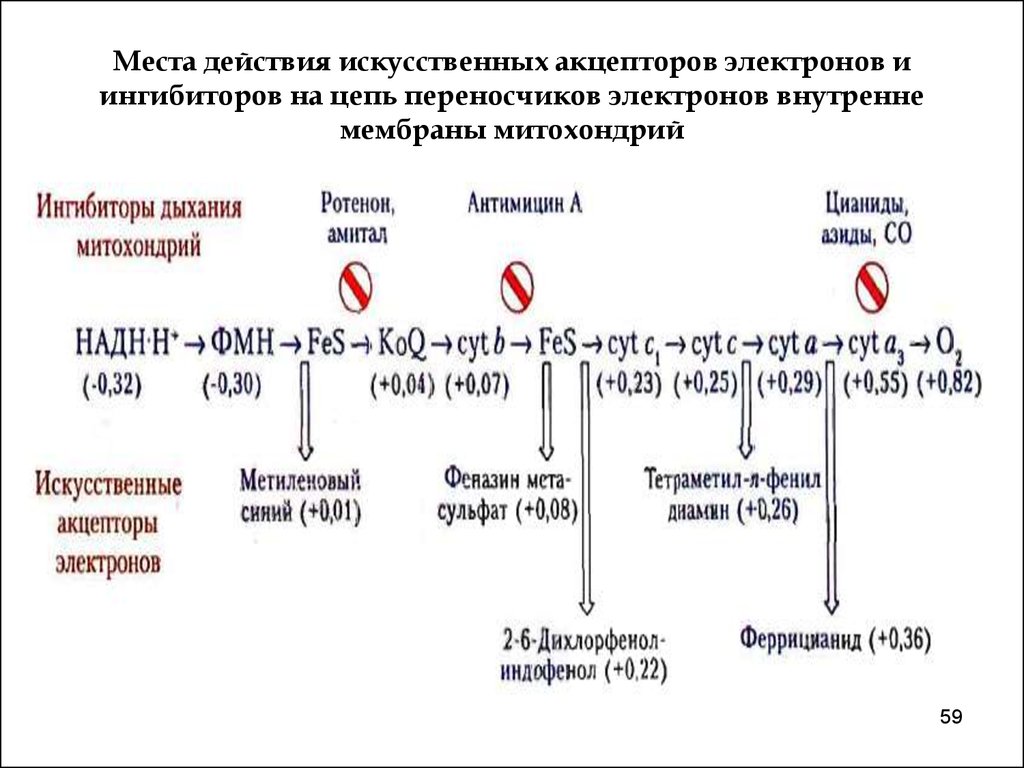
Связываясь с переносчиком, ингибиторы переносаэлектронов приостанавливают перенос, и все
участники дыхательной цепи, расположенные
выше места действия ингибитора, переходят в
восстановленное состояние, а те, что ниже – в
окисленное.
Практически
все
ингибиторы
комплексов - яды.
55
56.
Ротенон - растительный яд, применяемый индейцамипри ловле рыбы и используемый как инсектицида;
Амитал - производное барбитуровой кислоты,
антибиотик антимицин А, цианиды.
(ротенон н амитал тормозят перенос водорода от
ФМН к убихинону; антимицин А - транспорт
электронов от цитохрома b к цитохрому с1 (III
комплекс); CN-, CO, H2S, HN3 - ингибиторы
цитохромоксидазы,
а
карбоксин
и
теноилтрифторацетон
ингибиторы
II
комплекса).
Ингибитор синтеза АТФ - антибиотик олигомицин:
он не влияет на окисление, но тормозит
фосфорилирование
и
в
его
присутствии
добавление АДФ не оказывает стимулирующего
влияния на дыхание.
56
57.
При добавлении разобщителей окислительногофосфорилирования
между
последним
и
окислением нарушается сопряжение, снимается
дыхательный контроль со стороны АДФ и
окисление резко усиливается.
Разобщители имеют гидрофобный характер, хорошо
растворимы в липидах и способны связывать
протоны.
Используя искусственные акцепторы электронов,
удается запустить перенос электронов выше
действия ингибитора, а т.к. большинство таких
акцепторов
окрашенные
соединения,
по
изменению их цвета количественно оценивают
скорость работы комплексов дыхательной цепи.
57
58. ФАКТОРЫ И МЕСТО ДЕЙСТВИЯ ФАКТОРОВ НА РАБОТУ ДЫХАТЕЛЬНОЙ ЦЕПИ
5859. Места действия искусственных акцепторов электронов и ингибиторов на цепь переносчиков электронов внутренне мембраны митохондрий
5960.
- V комплекс внутренней мембраныобеспечивает возвращение протонов в
матрикс и энергия ∆рН используется для
синтеза АТФ.
Нарушение
целостности
мембраны,
затрудняющее создание градиента рН,
препятствует и синтезу АТФ, а V комплекс,
не
поддерживаемый
∆рН,
начинает
выполнять функцию протонного насоса,
перекачивающего
протоны
в
ММП,
используя энергию гидролиза АТФ и
стремясь создать ∆рН, который снижается
из-за нарушения целостности мембраны.
60
61.
6162.
Каждая из трех β-субъединиц может находиться в одном из трехконформационных состояний, различающихся сродством к
АТФ, АДФ и Фн:
1.
L - происходит связывание АДФ и Фн с активным центром;
2.
Т - образуется АТФ;
3.
О - ослабление связи с АТФ и ее высвобождение.
Основная движущая сила смены конформации каталитических
субъединиц - перемещение по α-субъединице фрагмента Fo
протонов из ММП в матрикс.
62
63.
Учеловека и других млекопитающих
существует специальная бурая жировая
ткань,
цвет которой определяется
цитохромами митохондрий адипоцитов.
Особенность дыхания таких митохондрий, в
структуре внутренней мембраны которых
находится белок термогенин, выполняющий
функцию протонного канала и снижающий
генерируемый митохондриями градиент
электрохимического
потенциала,
несопряженное
дыхание
и
вся
продуцируемая ими энергия выделяется в
виде теплоты.
63
64.
Этот процесс регулируется жирными кислотами, а бурая жироваяткань - незаменимый источник теплоты у зимнеспящих
животных и у новорожденных детей с недостаточно
совершенной теплопродукцией.
Любое нарушение целостности мембраны также приводит к
разобщению окислительного фосфорилирования. Окисление
без фосфорилирования протекает также под воздействием
разобщителей, некоторых ионофоров - веществ, специфически
связывающих и облегчающих транспорт катионов через
мембраны. Довольно значительная часть энергии градиента
электрохимического
потенциала
расходуется
на
энергозависимый ионный транспорт в митохондриях.
64
65. РЕГУЛЯТОРНОЕ ТЕПЛООБРАЗОВАНИЕ И СВОБОДНОЕ ОКИСЛЕНИЕ
В организме среднего взрослого человека в суткигенерируется и высвобождается 8000 кДж энергии.
За это время не изменяются существенно ни масса тела,
ни его структура и состав. Поэтому вся эта энергия,
за исключением количества, которое потребовалось
для выполнения физической работы, выделяется в
виде тепла и необратимо рассеивается в
окружающей среде, обеспечивая организм теплом,
необходимым для поддержания температуры тела
37°С.
При помещении теплокровных животных усиливается
теплообразование в мышцах, которое включает в
себя несколько механизмов:
Сократительный
термогенез
актомиозин
гидролизует АТФ, скелетные мышцы сокращаются начинается мышечная дрожь: скелетные мышцы
наряду с сократительной функцией служат
«отопительной системой».
65
66. ЭНЕРГЕТИКА МЫШЦ И ДРУГИХ СОКРАТИТЕЛЬНЫХ СТРУКТУР
В1939г. В.Энгельгардт и М.Любимова
обнаружили, что сократительный белок
мышц – миозин - обладает АТФ-азной
активностью: при гидролизе АТФ за счет
освобождающейся энергии происходит его
сокращение (изменение конформации) —
мышца
совершает
работу.
Т.о.,
сократительный
белок
мышц
сам
извлекает себе энергию для работы из
молекул АТФ. Позднее было показано,
что повышенная АТФ-азная активность
обнаруживается и в ряде других случаев,
когда в живом организме осуществляется
движение (при движении листьев стыдливой
мимозы).
66
67.
Хотя непосредственным источником энергииработающей
мышцы
служит
АТФ,
ее
содержание в мышце невелико.
Запасными макроэргическими соединениями в
мышцах
млекопитающих
является
креатинфосфат, а у беспозвоночных аргининфосфат. За счет высокоэнергетических
связей этих соединений из АДФ в мышцах
может образовываться АТФ.
Кроме процесса сокращения мышц актин как
главный
компонент
микрофиламентов
участвует в стабилизации и изменении
формы клеток, в митозе, движении клеток (в
частности, амебоидном), токах цитоплазмы,
движении
органелл,
фагоцитозе,
секреторной, активности, распределении
белков в мембране и др.
67
68.
Актин содержитсяпрактически во всех
эукариотических клетках, но особенно
много его (20—30% от общего белка) в
активно
передвигающихся
клетках
(амебы, макрофаги, тромбоциты), у
которых он преобладает среди белков
клеточного экстракта.
У большинства немышечных клеток, как
и
в
мышечных
волокнах,
преобразователем
энергии,
обладающим АТФ-азной активностью,
является миозин, близкий по структуре к
мышечному.
68
69.
Содержание АТФ в мышцах относительнопостоянно ~5 мМ на 1 кг сырого веса (~
0,25%).
Мышцы
не
накапливают
значимых
количеств АТФ, но её концентрация не
может быть ниже 2 мМ на 1 кг сырого веса
ткани, т.к. при этом в саркоплазматическом
ретикулуме перестанет действовать «Са2+насос» и мышца будет сокращаться вплоть
до полного исчерпания всех запасов АТФ и
развития ритора (состояния стойкого
непреходящего сокращения).
69
70.
В скелетных мышцах человека 3 вида анаробныхпроцессов, в ходе которых возможен ресинтез
АТФ:
1. креатинфосфокиназная реакция (фосфогенный,
алактатный анаэробный процесс) - ресинтез
АТФ за счет трансфосфорилирования между
креатинфосфатом и АДФ;
2. миокиназная реакция - ресинтез АТФ за счет
дефосфорилирования части АДФ;
3. гликолиз (лактацидный анаэробный процесс) ресинтез
АТФ
при
ферментативном
анаэробном
расщеплении
углеводов,
заканчивающегося образованием
молочной
кислоты.
70
71. ИСТОЧНИКИ ЭНЕРГИИ МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
1. Ресинтез АТФ путём трансфосфорилирования АДФ скреатинфосфатом, катализируемый креатинкиназой:
Это чрезвычайно быстрый и максимально эффективный
путь ресинтеза АТФ (за счет каждой молекулы
креатинфосфата образуется 1 молекула АТФ).
71
72. 2. Ресинтез АТФ в миокиназной (аденилаткиназной) реакции
-реализуется в мышцах при значительном увеличении
концентрации АДФ (мышечном утомлении) в саркоплазме, когда
скорость ресинтеза АТФ не уравновешивает скорость его
расщепления - “аварийный механизм” ресинтеза АТФ, - часть
образующейся АМФ необратимо дезаминируется и выводиться
из энергетического обмена, что не выгодно, поскольку ведет к
уменьшению общих запасов АТФ в мышцах. Одновременно
некоторое увеличение концентрации АМФ в саркоплазме при
миокиназной
реакции
активирует
ферменты
гликолиза
(фосфофруктокиназу) и способствует повышению скорости
анаэробного ресинтеза АТФ - миокиназная реакция выполняет
роль метаболического усилителя передачи сигнала от АТФ-азы
миофибрилл на АТФ-синтезирующие системы клетки. Как и
креатинфосфокиназная, она легко обратима и используется для
устранения избытка АТФ:
72
73.
7374.
Мышцы - главные энергетические субстраты дляних – глюкоза, жирные кислоты и кетоновые
тела.
В отличие от мозга, в мышцах запасается
значимое количество гликогена (эквивалент – 5
000 kJ -1200 ккал) - аккумулируется ~75% всего
гликогена человека, а его количество после
потребления пищи может достигать в
мышцах 1% от их массы.
Гликоген легко превращается в Гл-6-Ф. В мышцах,
как и в мозге, нет Гл-6-Ф-азы, и поэтому они не
могут экспортировать глюкозу, а накапливают
её преимущественно для срочного получения
энергии.
74
75.
В активно действующей скелетной мышцескорость гликолиза значимо превышает
скорость
ЦТК.
Большая
часть
образующегося
при
этом
пирувата
восстанавливается
до
лактата,
транспортируемого и превращаемой в
печени в глюкозу.
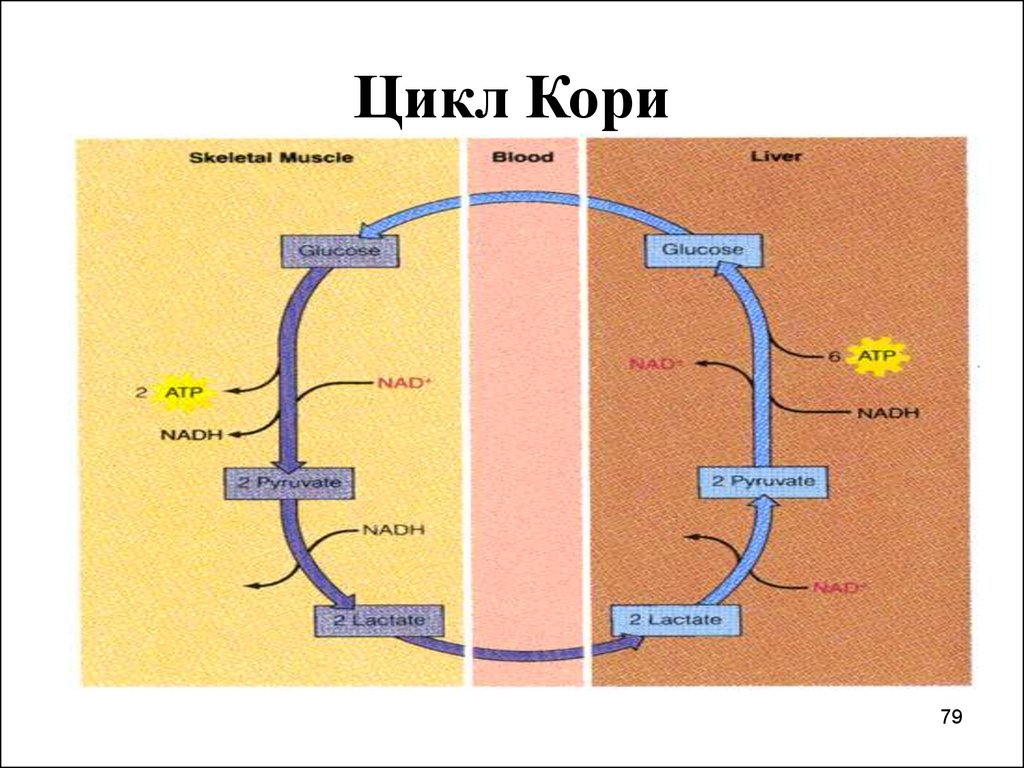
И т.о., по циклу Кори, метаболическая
нагрузка мышц переносится в печень,
пируват трансаминируется до
глюконеогенного Ала, превращаемого в
печени в глюкозу.
75
76.
Впокое в мышцах ситуация
другая: главными энергетическими
субстратами становятся жирные
кислоты.
Для
миокарда
основными
энергетическими
субстратами
могут стать кетоновые тела –
сердце
чаще
использует
ацетоацетат, чем глюкозу.
76
77.
Между интенсивно протекающими в мышечной ипеченочной тканях гликолизом и глюконеогенезом
существует взаимосвязь:
при высокой активности мышц
и
активации гликолиза образующийся
в них избыток лактата диффундирует
в кровь и в печень, где значимая его
часть
превращается
в
глюкозу
(глюконеогенез) - пируват используется
как энергетический субстрат для
деятельности мышечной ткани.
77
78. МЕТАБОЛИЧЕСКАЯ РЕГУЛЯЦИЯ МЫШЕЧНОГО СОКРАЩЕНИЯ
I. Цикл КориВ клетках, не содержащих митохондрий (в
эритроцитах)
или
в
тканях
при
недостаточном снабжении О2 (в работающих
мышцах) АТФ ресинтезируется за счет
процесса превращений глюкозы в лактат анаэробного гликолиза.
Лактат переносится кровью в печень, где в
процессе глюконеогенеза с затратой АТФ
вновь конвертируется в глюкозу (цикл Кори).
78
79. Цикл Кори
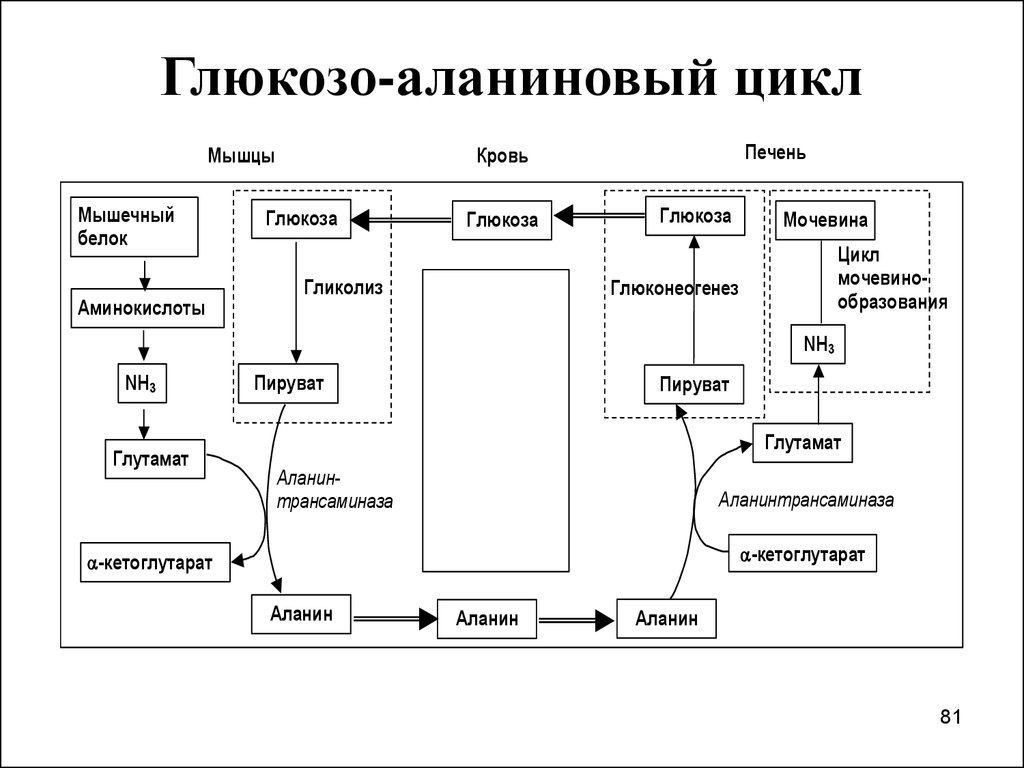
7980. II.ГЛЮКОЗО-АЛАНИНОВЫЙ ЦИКЛ
Обратная связь, подобная циклу Кори,существует в цикле аланина, в
котором также участвует пируват цикл начинается с протеолиза белков.
Образующиеся
аминокислоты
в
результате
трансаминирования
превращаются
в
α-кетокислоты,
которые в основном включаются в
ЦТК.
80
81. Глюкозо-аланиновый цикл
Мышечныйбелок
Аминокислоты
Печень
Кровь
Мышцы
Глюкоза
Глюкоза
Гликолиз
Глюкоза
Мочевина
Цикл
мочевинообразования
Глюконеогенез
NH3
NH3
Глутамат
Пируват
Пируват
Глутамат
Аланинтрансаминаза
Аланинтрансаминаза
-кетоглутарат
-кетоглутарат
Аланин
Аланин
Аланин
81
82.
8283. БИОЭНЕРГЕТИКА МЫШЕЧНОЙ ДЕЯТЕЛЬНОСТИ
Энергия для сокращения и расслабления мышцобеспечивается поступлением АТФ:
Небольшой резерв энергии, которого хватает не более, чем на
10-12 с, сосредоточен в виде креатинфосфата.
Анаэробное гликолитическое расщепление гликогена
(гликолиз) достигает своего максимума через 40-50 с после
начала мышечной работы.
Через 60-70 с включаются аэробные процессы образования
(фосфорилирования) АТФ в митохондриях, расположенных
вблизи саркомеров.
Лимитирующим фактором этого процесса является
количество поставляемого О2.
83
84.
Аэробныйпуть
ресинтеза
АТФ
приобретает значение при длительной
и менее
интенсивной работе
миокарда.
Содержание АТФ и креатинфосфата в
сердечной мышце ниже, чем в
скелетной мускулатуре, а расход АТФ
велик.
Поэтому ресинтез АТФ в миокарде
происходит намного интенсивнее,
чем в скелетной мускулатуре.
84
85.
Длямиокарда
основным
путем
образования
богатых
энергией
фосфорных соединений является путь
окислительного
фосфорилирования,
связанный с поглощением О2.
Регенерация
АТФ
в
процессе
анаэробного расщепления углеводов
(гликолиз)
в
сердце
человека
практического значения не имеет и
поэтому миокард очень чувствителен
к недостатку О2.
85
86.
Характернойособенностью
обмена
веществ в миокарде по сравнению со
скелетной мышцей является также
то, что большее значение имеет
аэробное
окисление
веществ
неуглеводной природы.
Только 30–35% поглощаемого сердцем
О2, расходуется на окисление углеводов
и продуктов их превращения.
86
87.
Главным же субстратом дыхания всердечной мышце являются жирные
кислоты.
Окисление неуглеводных веществ
обеспечивает
около
65–70%
потребности миокарда в энергии, а
из свободных жирных кислот в
сердечной мышце особенно легко
подвергается окислению олеиновая
кислота.
87









































































 biology
biology








