Similar presentations:
Углеводороды. Химический диктант
1. Урок химии «Обобщение знаний по теме: «Углеводороды»»
Преподаватель ГБПОУ ВО ВАТимени В.П.Чкалова
Кузнецова Екатерина
Владимировна
2. Цель урока:
• повторить, обобщить и систематизироватьзнания учащихся об углеводородах на
основе характеристики состава, строения и
свойств основных классов.
3. Химический диктант:
1.2.
3.
4.
5.
6.
7.
8.
Как называются по систематической номенклатуре
ациклические углеводороды, в молекулах которых атомы
углерода связаны только простыми связями .
Как называются по систематической номенклатуре
ациклические углеводороды, в молекулах которых есть две
двойных связи.
Как называются по систематической номенклатуре
карбоциклические углеводороды, в молекулах которых
присутствует бензольное ядро:
Напишите общую формулу алканов.
Напишите общую формулу алкенов.
Напишите общую формулу аренов.
Вещества, имеющие одинаковый состав но разное строение
называются …..
Вещества, имеющие одинаковое строение, отличающиеся
друг от друга на группу атомов - СН2- называются ….
4. Химический диктант:
Изомерами разных гомологических рядов являютсяалкены и …
10. Изомерами разных гомологических рядов являются
алкадиены и …
11. Назовите по систематической номенклатуре вещество
следующего строения:
CH3- CH=C(CH3)- CH3
9.
12. Назовите по систематической номенклатуре вещество
следующего строения:
CH3- C≡C- CH (CH3)- CH (CH3)- CH3
13. Вид гибридизации в молекуле этина.
14. Сколько π-связей в молекуле этена?
15. Сколько σ -связей в молекуле этина?
16. Какую форму имеет молекула метана?
5. Химический диктант:
17. Валентный угол в молекуле метана.18. Длина связи С=С в молекуле алкена?
19. Существует ли чередование двойных и одинарных
связей в молекуле бензола?
20. Наиболее характерными для предельных
углеводородов являются реакции …
21. Наиболее характерными для непредельных
углеводородов являются реакции…
22. Наиболее характерными для аренов являются
реакции …
23. Как называется реакция присоединения водорода
…..
24. Как называется реакция отрыва водорода …..
25. Как называется реакция присоединения воды …..
6. Проверьте себя
1.2.
3.
4.
5.
6.
Алканы
Алкадиены.
Арены
CnH2n+2
CnH2n
CnH2n-6
7.
8.
9.
10.
11.
12.
Изомерами
Гомологами
Циклоалканы
Алкины
2-метилбутен-2
4,5-диметилгексин-2
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
Sp-гибридизация
1
3
Тетраэдр.
109028/
0,134нм
Нет
Замещения
Присоединения
Замещения
Гидрирование
Дегидрирование
гидратация
7.
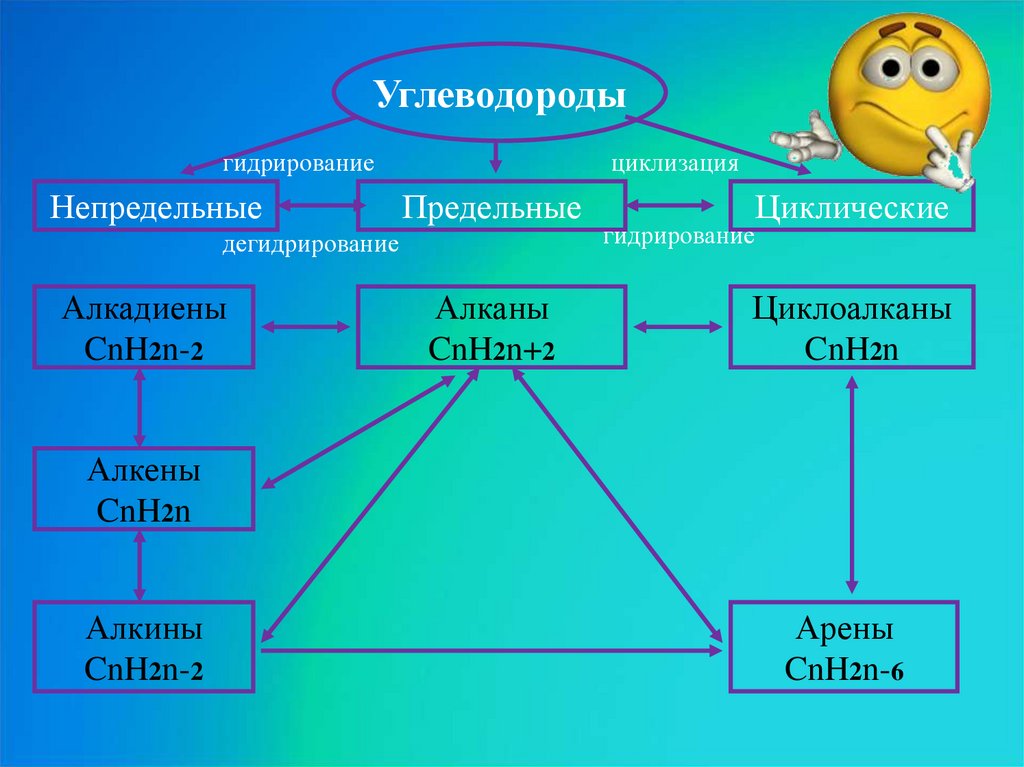
Углеводородыгидрирование
Непредельные
циклизация
Предельные
дегидрирование
Алкадиены
CnH2n-2
Алканы
CnH2n+2
Циклические
гидрирование
Циклоалканы
CnH2n
Алкены
CnH2n
Алкины
CnH2n-2
Арены
CnH2n-6
8. Задание 1: напишите уравнения реакций по цепочке превращений. Определите тип каждой реакции.
Задание 1: напишите уравнения реакций поцепочке превращений. Определите тип
каждой реакции.
• Циклопропан → 1-бромпропан →гексан →бензол →циклогексан
1 уровень – (3 балла)
СН4 →НС≡СН → С6Н6 →С6Н5NO2
2 уровень – (4 балла)
2- метилбутан → 2-бром, 2-метилбутан → 2-метилбутен-2→
→ 2-метилбутанол-2
3 уровень – (5 баллов)
CH3 - CH = CH2 +HCl→ A KOH(спирт)→ B +H2O, → C
Назовите вещества А , В и С
9.
• 1 уровень – (3 балла)1
3 Н NO
СН4 →НС≡СН
→2 С6Н6 →С
6 5
2
• 2 уровень – (4 балла)
1
• 2- метилбутан →
2-бром, 2-метилбутан →2
t
1• 2СН4 →НС≡СН +3H2 реакция
2-метилбутен-2→
разложения
3
→ 2-метилбутанол-2
Сакт,
t
•2 3НС≡СН
→С6Н6 –реакция
hγ
тримеризации
1 CH3-CH(CH3)-CH2-CH3 + Br2 → CH3C(Br)(CH3)-CH2-CH3+ HBr- замещение
3• С6Н6 + HO-NO2→
конц.H2SO4→С Н NO +H O реакция
CH3-C(Br)(CH3)-CH2-CH3 +KOH→ CH3-C
6 5
2
2
2
(CH3)=CH-CH3 +KBr+H2O –
замещения нитрогруппой
дегидрагалогенирование
3 CH3-C (CH3)=CH-CH3 +H2O конц.H3PO4→
CH3-C (CH3)(OH)-CH2-CH3 гидратация
1
3 уровень – (5 баллов)
2
3
CH3 - CH = CH2 +HCl→ A KOH(спирт)→ B +H2O, → C
1 CH3 - CH = CH2 +HCl→ CH3 – CH(Cl) – CH3 2-хлорпропан – A, присоединение
2 CH3-C(Сl) - CH3 +KOH→ CH3-CH=CH2 +KBr+H2O пропен – B,
дегидрагалогенирование
3 CH3-CH=CH2+H2O конц.H3PO4→ CH3-CH(OH)-CH3 пропанол -2 - С, гидратация
10. Задание 2 Решение качественных задач.
В двух емкостях находятся этани этин. Определите вещества с
помощью качественных
реакций, подтвердив
уравнениями реакций.
(Ответ: Пропустить оба
вещества через бромную воду.
Где находился пропин бромная вода обесцветится.)
• В одном цилиндре находятся
метан и пропен. Как разделить
данную смесь? Напишите
соответствующие реакции.
• (Ответ. Через газовую смесь
пропускают бромную воду:
Чистый метан остается в виде
газа. Образовавшийся 1,2дибромпропан обрабатывают
цинком: Чистый пропен
выделяется в виде газа)
11. Задание 3. Решение расчетных задач.
Выберите задание 1 из 3 по уровню сложности.• 1 уровень: Установите
молекулярную формулу
углеводорода, если известно, что
в его составе 80% углерода, 20%
водорода, а относительная
плотность паров по воздуху
1,034. – 3 балла
• (C2H6-этан)
• 2 уровень: При сжигании 4,4 г
неизвестного углеводорода
выделилось 6,72 л углекислого
газа и 7,2 г воды. Выведите
формулу этого углеводорода,
если его относительная
плотность по водороду равна 22.
– 4 балла
• (С3H8 – пропан)
•3 уровень: При взаимодействии одного и того
же количества алкена с различными
галогеноводородами образуется
соответственно 7,85 г хлоропроизводного или
12,3г бромпроизводного. Определите
молекулярную формулу алкена? – 5 баллов
• (С3H6 – пропен)
12. Задание 4. Самостоятельная работа
1. Общая формула аренов:1. CnH2n+2
2. CnH2n
3. CnH2n-2
4. CnH2n-6
2. Изомером вещества, формула которого CH3-CH=CH-CH3, является:
1. 2-Метилбутен-1
2. Бутен-1
3. Бутан
4. Бутин-1
3. Вещество, для которого не характерна реакция гидрирования:
1. Метан
2. Пропин
3. Пропен
4. Бензол
13. Задание 4. Самостоятельная работа
4. Вещество, для которого характерна реакция замещения:1.
2.
3.
4.
пентан
пентен-1
пентин-1
пентадиен-1,3
5. Формулы веществ, вступающих в реакцию друг с другом:
1.
2.
3.
4.
C2H6
C3H8
C6H6
C2H4
и HCl
и H2
и H2O
и H2
6. Формула вещества Х в цепочке превращений CH4 t→ XH2,Ni→C2H4
1.
2.
3.
4.
CO2
C2H6
C2H2
C3H8
14. Задание 4. Самостоятельная работа
7.Следующим гомологом вещества бутин-1 является:1.
2.
3.
4.
Бутин-2
Пентин-1
Пентин-2
Пропен
8. Молекулярная формула углеводорода, содержащего 85,7% углерода и
14,3% водорода с относительной плотностью по водороду 14, является:
1.
2.
3.
4.
C2H4
CH4
C2H2
C2H6
15. Проверьте себя!
• Посчитайте баллы за тестирование.• Ответы
1-4
2-1
3-1
4-1
5-4
6-3
7-2
8-1
16. Подведение итогов
• Посчитайте общее количество баллов заурок:
• 42-43 балла – оценка «5»
• 38-41 балл – оценка «4»
• 32 -38 баллов – оценка «3»
• Меньше 32 баллов – вам надо еще раз
повторить материал!
• Д/З Подготовка к контрольной работе: Повторить состав, строение,
свойства, получение углеводородов по классам.
17. Информационные ресурсы
Картинкиhttps://yandex.ru/images/search?p=4&text=%D1%81%D0%BC%D0%B0%D0%B9%D0%BB%D1%8B&redircnt=1430760147.1&img_url=htt
p%3A%2F%2Fspravka.ua%2Fcompany%2Fphoto%2F4e471dca288bc.JPG&pos=137&rpt=simage&_=1430756649880&uinfo=sw-1366-sh768-ww-1349-wh-653-pd-1-wp-16x9_1366x768
https://yandex.ru/images/search?img_url=http%3A%2F%2Fwww.chemistry.ssu.samara.ru%2Fchem2%2Fpic%2Fu712.gif&uinfo=sw-1366-sh768-ww-1349-wh-653-pd-1-wp16x9_1366x768&_=1430750044801&p=2&text=%D1%83%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%
D0%BE%D0%B4%D1%8B&redircnt=1430753641.1&noreask=1&pos=69&rpt=simage&lr=193
https://yandex.ru/images/search?img_url=http%3A%2F%2F5fan.ru%2Ffiles%2F11%2F5fan_ru_57745_80cdacdf5660ff1e1e6e6f388cf416fa.ht
ml_files%2F7.png&uinfo=sw-1366-sh-768-ww-1349-wh-653-pd-1-wp16x9_1366x768&_=1430750044801&p=2&text=%D1%83%D0%B3%D0%BB%D0%B5%D0%B2%D0%BE%D0%B4%D0%BE%D1%80%
D0%BE%D0%B4%D1%8B&redircnt=1430753641.1&noreask=1&pos=72&rpt=simage&lr=193&pin=1
https://yandex.ru/images/search?text=%D1%81%D0%BC%D0%B0%D0%B9%D0%BB%D1%8B&redircnt=1430760147.1
https://yandex.ru/images/search?p=6&text=%D1%81%D0%BC%D0%B0%D0%B9%D0%BB%D1%8B&redircnt=1430760147.1&img_url=htt
p%3A%2F%2Fimg3.proshkolu.ru%2Fcontent%2Fmedia%2Fpic%2Fstd%2F2000000%2F1933000%2F19323423ee3a0e2e2d31cbd.png&pos=189&rpt=simage&_=1430756676454&uinfo=sw-1366-sh-768-ww-1349-wh-653-pd-1-wp-16x9_1366x768
Литература
Габриелян О.С. Химия. 10 класс. Базовый уровень: учеб. для общеобразоват. учреждений. – М., 2013.
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г.
Лысова – М., 2006.
Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах и упражнениях. – М., 2003.
















 chemistry
chemistry








