Similar presentations:
Алюминий. Из истории открытия
1.
2.
3.
1. Из истории открытия2. Электронное строение
3. Свойства атома
4. Строение простого вещества
5. Физические свойства
6. Химические свойства
7. Нахождение в природе
8. Получение
9. Применение
4.
1. Из истории открытияВпервые Al был получен датским физиком
Эрстедом в 1825 г. Название элемента
происходит от лат.«алюмен», так в древности
называли квасцы, которые использовали для
крашения тканей (KAl(SO4)2.12H2O).
Позже в 1827 г. немецкий химик Фридрих
Велер получил алюминий
следующим способом:
t
AlCl3+3K
3KCl + Al
Далее
5.
1. Из истории открытияГлавная
В период открытия алюминия этот
металл был дороже золота. Англичане
хотели почтить богатым подарком
великого русского химика Д.И
Менделеева, подарили ему
химические весы, в которых одна
чашка была изготовлена из золота,
другая - из алюминия. Чашка из
алюминия стоила дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных, но
и промышленников и даже
императора Франции.
6.
2. Электронное строениеАl
27
+13
0
P+ = 13
e- = 13
n0 = 14
2e
8e
3e
3s2
2s2
Порядок заполнения
3p1
2p6
Далее
1s2
Краткая электронная запись
7.
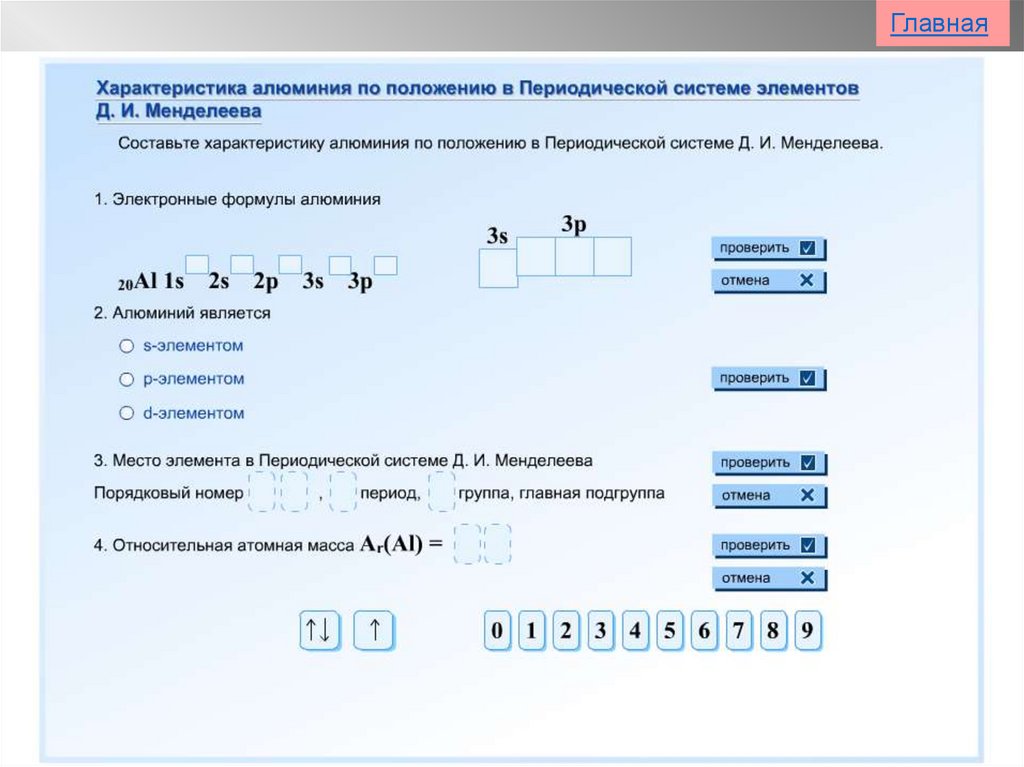
Вставьте пропущенные слова1. Алюминий - элемент III группы, главной подгруппы.
2. Заряд ядра атома алюминия равен +13.
3. В ядре атома алюминия 13 протонов.
4. В ядре атома алюминия 14 нейтронов.
5. В атоме алюминия 13 электронов.
6. Атом алюминия имеет 3 энергетических уровня.
7. Электронная оболочка имеет строение 2е, 8е, 3е.
8. На внешнем уровне в атоме 3 электронов.
9. Степень окисления атома в соединениях равна +3 .
10.Простое вещество алюминий является металлом.
11.Оксид и гидроксид алюминия имеют амфотерный характер
Далее
8.
Главная9.
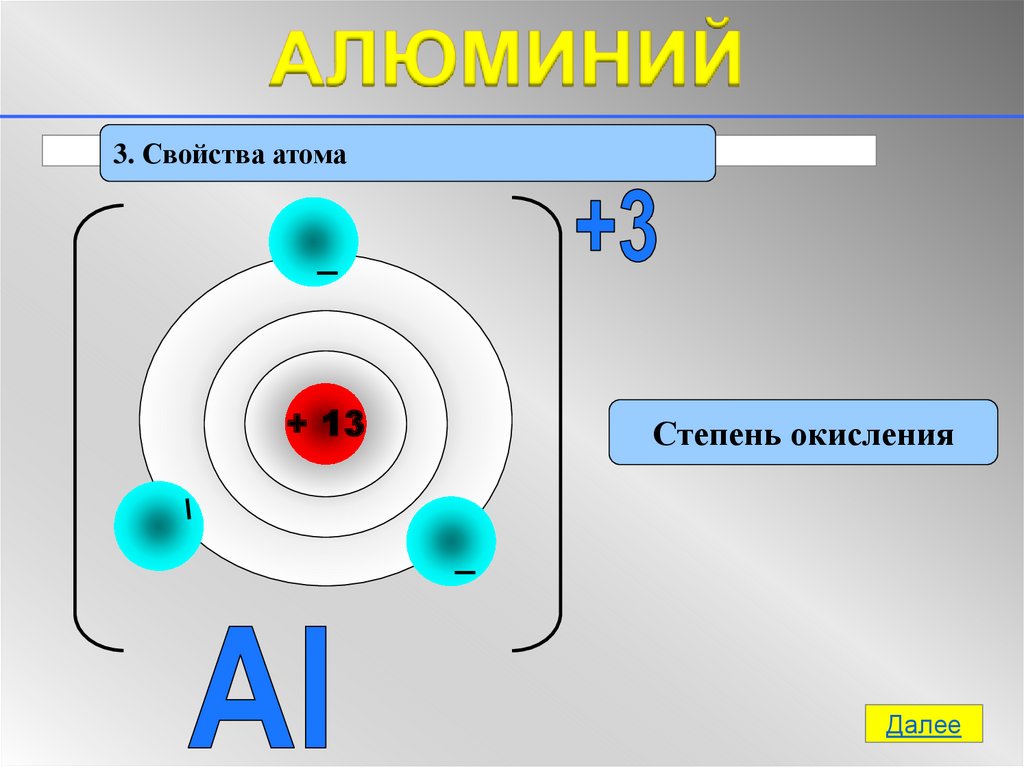
3. Свойства атома+ 13
Степень окисления
Далее
10.
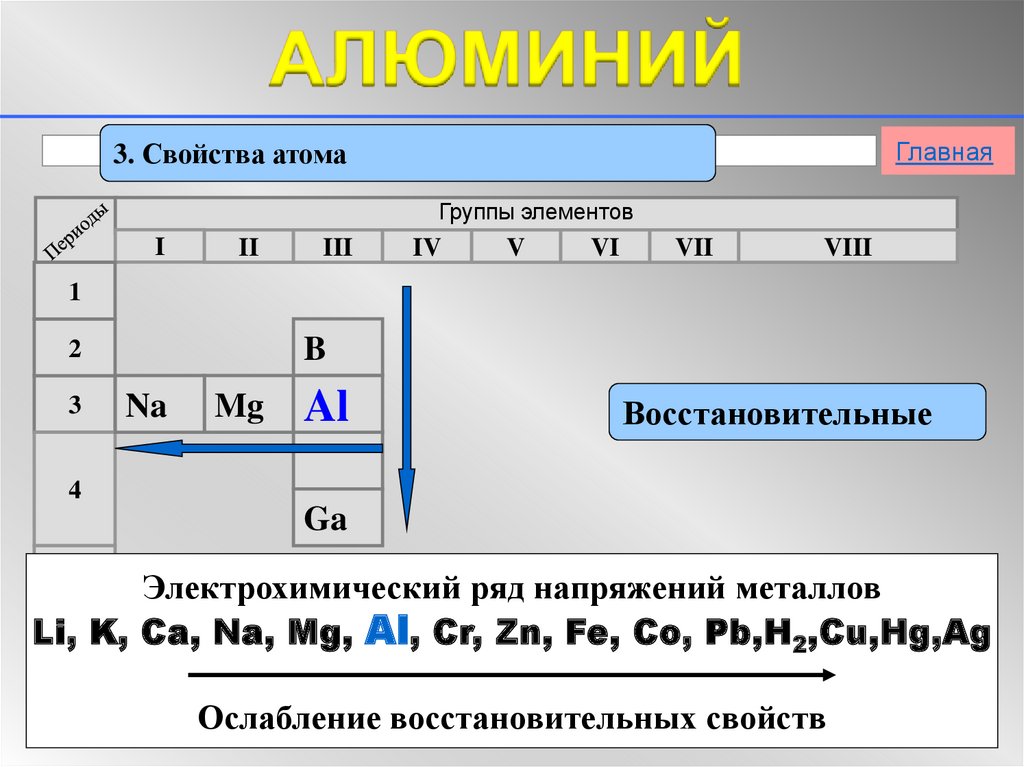
Главная3. Свойства атома
Группы элементов
I
II
III
IV
V
VI
VII
VIII
1
B
2
3
Na
Mg
Al
Восстановительные
4
Ga
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
5
Ослабление восстановительных свойств
11.
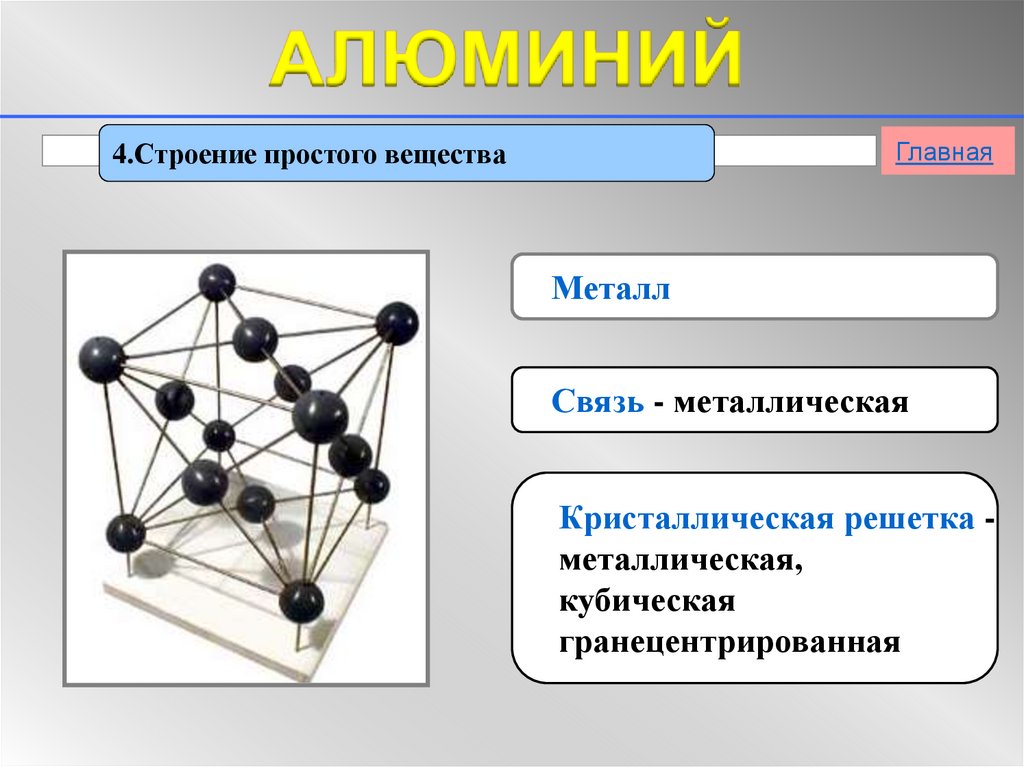
Главная4.Строение простого вещества
Металл
Связь - металлическая
Кристаллическая решетка металлическая,
кубическая
гранецентрированная
12.
5. Физические свойстваЦвет – серебристо-белый
t пл. = 660°C.
t кип. ≈ 2450°C.
Электропроводный, теплопроводный
Легкий, плотность ρ = 2,6989 г/см3
Мягкий, пластичный.
Главная
13.
Главная6. Химические свойства
C н е м е т а л л а м и (c кислородом, с серой)
C неметаллами (c галогенами, с углеродом)
C водой
C кислотами
Cо щ е л о ч а м и
C
оксидами
металлов
2Аl
3Cl
= 2Al
2AlCl
оксидную
пленку)
4Аl
3O
=
O
2
3 6]↑+ 3H2↑
2Al(Снять
+ 6HCl
=
2AlCl
2Al + 6NaOH
++
6H
O
=
2Na
[Al(OH)
2
2
2
3 3 + H2
t 2O3 + 2Fe
2Al + Fe2O3 = Al
2Al
++2NaOH
+
2H
O
=2NaAlO
+3H
↑
2Al
+3H
6H
O
=
2Al(OH)
+
H
↑
2
2
2
2Al
+
3S
=
Al
S
2
3
2
2Al
SO
=
Al
(SO
)
+
H
↑
4Al 3C
C
2
4
2
2
4 43 3
2
14.
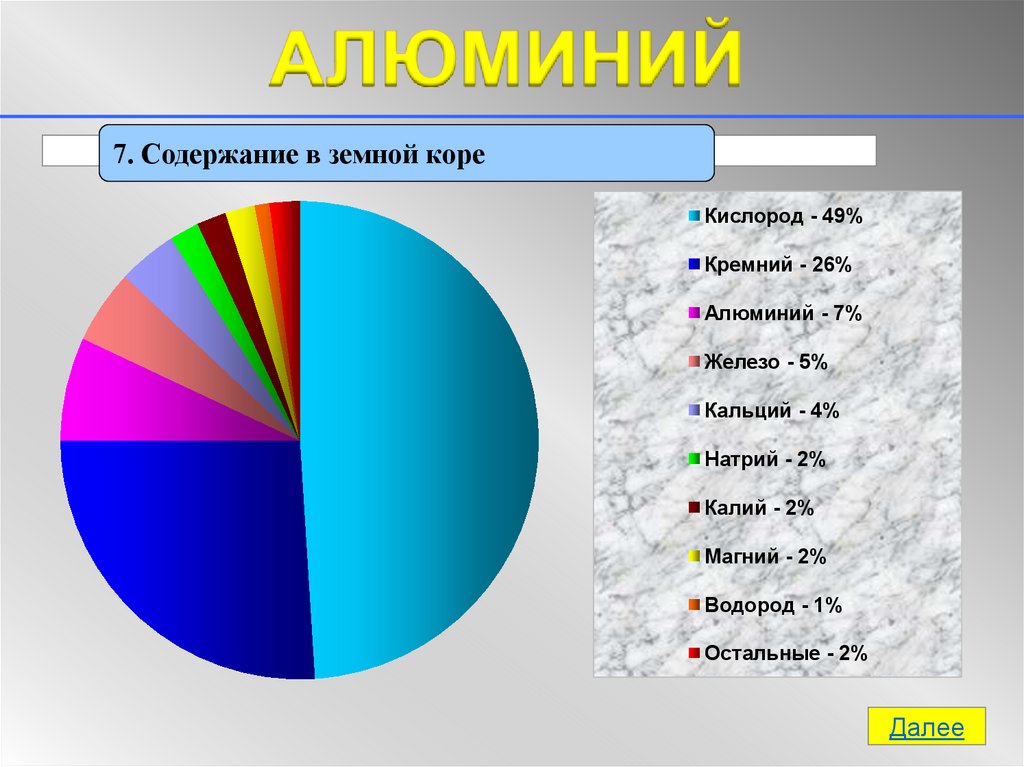
7. Содержание в земной кореКислород - 49%
Кремний - 26%
Алюминий - 7%
Железо - 5%
Кальций - 4%
Натрий - 2%
Калий - 2%
Магний - 2%
Водород - 1%
Остальные - 2%
Далее
15.
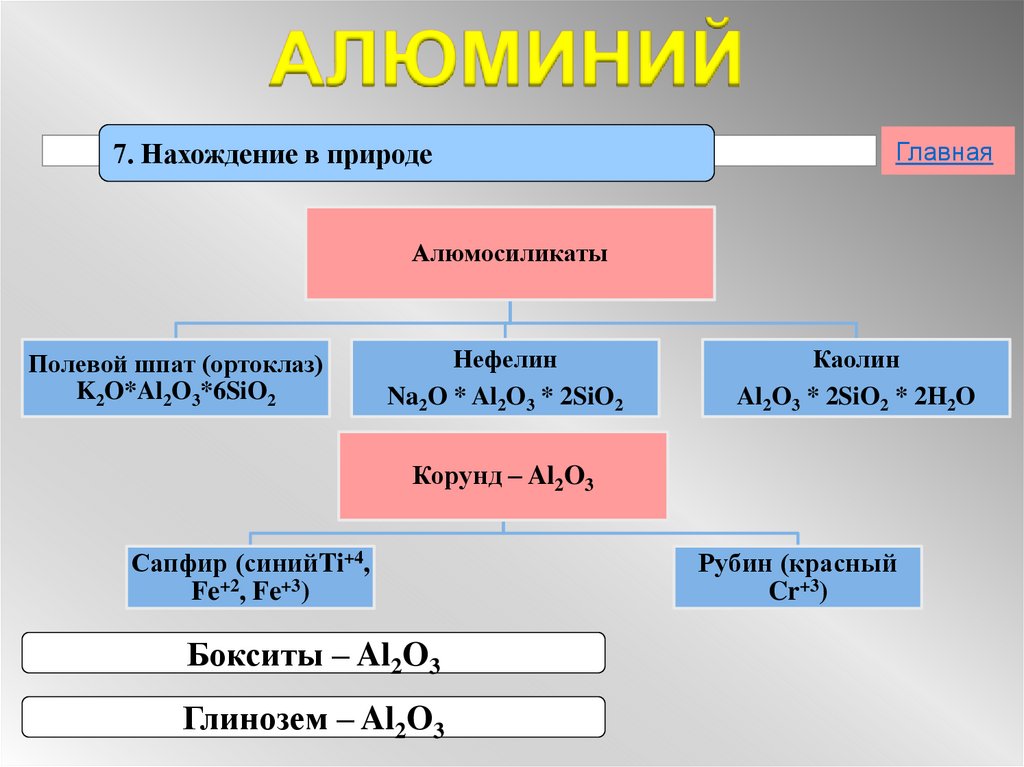
7. Нахождение в природеГлавная
Алюмосиликаты
Полевой шпат (ортоклаз)
K2O*Al2O3*6SiO2
Нефелин
Na2O * Al2O3 * 2SiO2
Каолин
Al2O3 * 2SiO2 * 2H2O
Корунд – Al2O3
Сапфир (синийTi+4,
Fe+2, Fe+3)
Бокситы – Al2O3
Глинозем – Al2O3
Рубин (красный
Cr+3)
16.
Главная8. Получение
1825 год Х. Эрстед:
AlCl3 + 3K = 3KCl + Al :
Электролиз (t пл. = 2050°С) :
2Al2O3 = 4Al +3O2
Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) :
2Al2O3 = 4Al +3O2
17.
9. ПрименениеДалее
18.
Проверь свои знания!Выполни тест по теме «Алюминий»
Результат выполнения заданий оценивается в %.
Неудачные попытки и использование подсказок
приводят к снижению оценки. Критерий оценивания:
96%-100% - «5»; 70%-95% - «4»; 50%-69% - «3»; Если
Ваш результат ниже 50%, то придется еще раз
повторить изученный материал и проверить себя.
Успехов!
Перейти к
выполнению теста












 chemistry
chemistry








