Similar presentations:
Амфотерность. Амфотерные соединения
1.
АМФОТЕРНОСТЬ2.
3.
АМФОТЕРНОСТЬспособность некоторых соединений проявлять
в зависимости от условий как кислотные, так и
основные свойства.
1814 г. Ж. Гей-Люссак, Л. Тенар.
Амфотерные - оксиды и гидроксиды, которые
проявляют и основные и кислотные свойства в
зависимости от условий
4.
5.
https://youtu.be/7rJj3WTk9VwИзучаем химию: Амфотерность
6.
Амфотерныесоединения
взаимодействуя с основаниями,
ведут себя как кислоты.
2KOH(тв.) + H2ZnO2(тв.)
=
K2ZnO2
+ 2H2O
2KOH(тв.)
+ 2H2O
+ Zn(OH)2(тв.) =
КИСЛОТНЫЕ СВОЙСТВА
K2ZnO2
7.
8.
Be(OH)2(тв.) +2NaOH(тв.) =Na2BeO2 + 2H2O(метабериллат натрия, или бериллат)
Pb(OH)2(тв.) +2NaOH(тв.) = Na2PbO2 + 2H2O
(метаплюмбат натрия, или плюмбат)
запишем в виде кислоты: H3AlO3,
выносим оттуда воду:
H3AlO3 – H2O → HAlO2 + H2O.
HAlO2 + KOH = H2O + KAlO2
(метаалюминат калия, или алюминат)
Al(OH)3(тв.) + KOH(тв.) = 2H2O + KAlO2
(метаалюминат калия)
Al(OH)3,
http://himija8en.blogspot.ru/p/blog-page_23.html
9.
образуются комплексные соединения:Al(OH)3 + KOH → K[Al(OH)4]
(тетрагидроксоалюминат калия);
Al(OH)3 + 3KOH → K3[Al(OH)6]
(гексагидроксоалюминат калия).
С
растворами
щелочей
реагируют
и
амфотерные оксиды.
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4];
Al2O3 + 6NaOH + 3H2O → 2Na3[Al(OH)6].
Продукты реакций относятся к классу солей
и являются растворимыми.
[Al(OH)4]- или [Al(OH)6]3-
10.
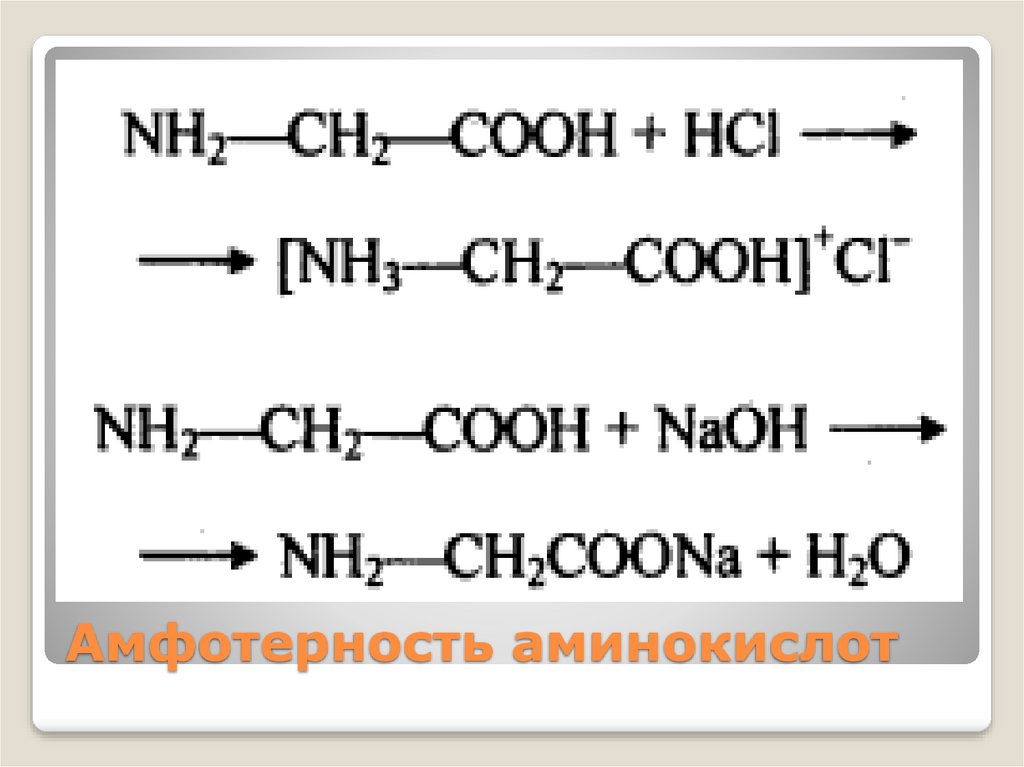
Амфотерные органические11.
Цвиттер-ион (биполярный ион— гибрид) —электронейтральная молекула, которая в своей структуре
имеет части с отрицательным и положительным заряды,
локализованные на несоседних атомах.
12.
Амфотерность аминокислот13.
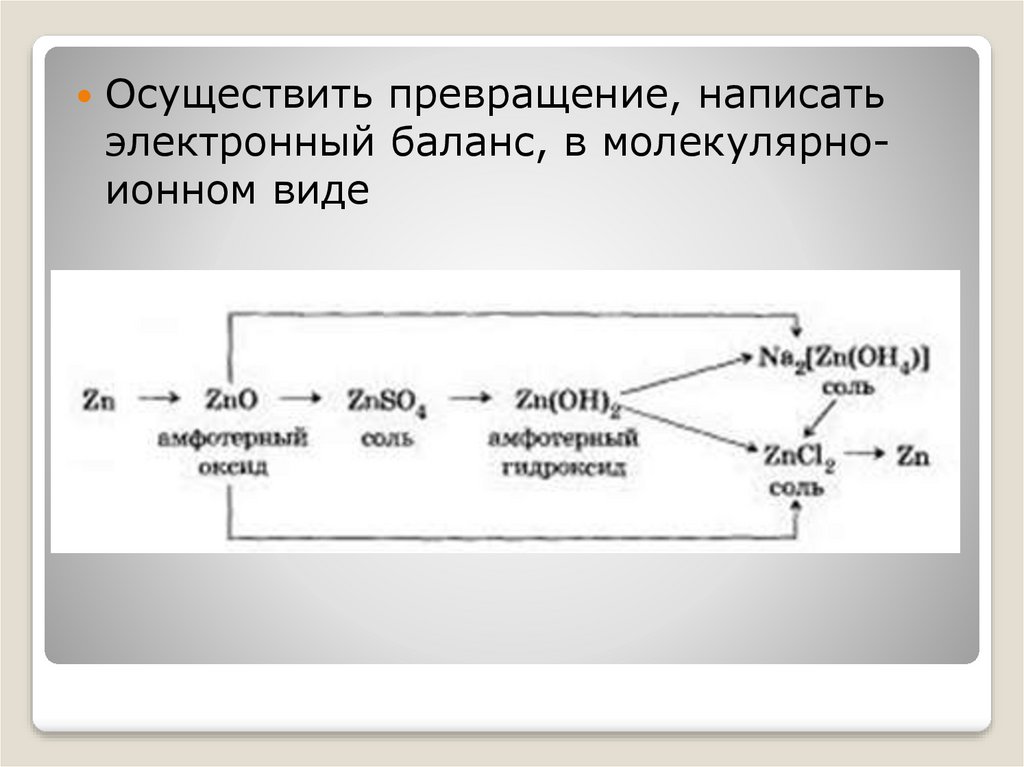
Осуществить превращение, написатьэлектронный баланс, в молекулярноионном виде













 chemistry
chemistry








