Similar presentations:
Типичные экспериментальные кинетические данные
1.
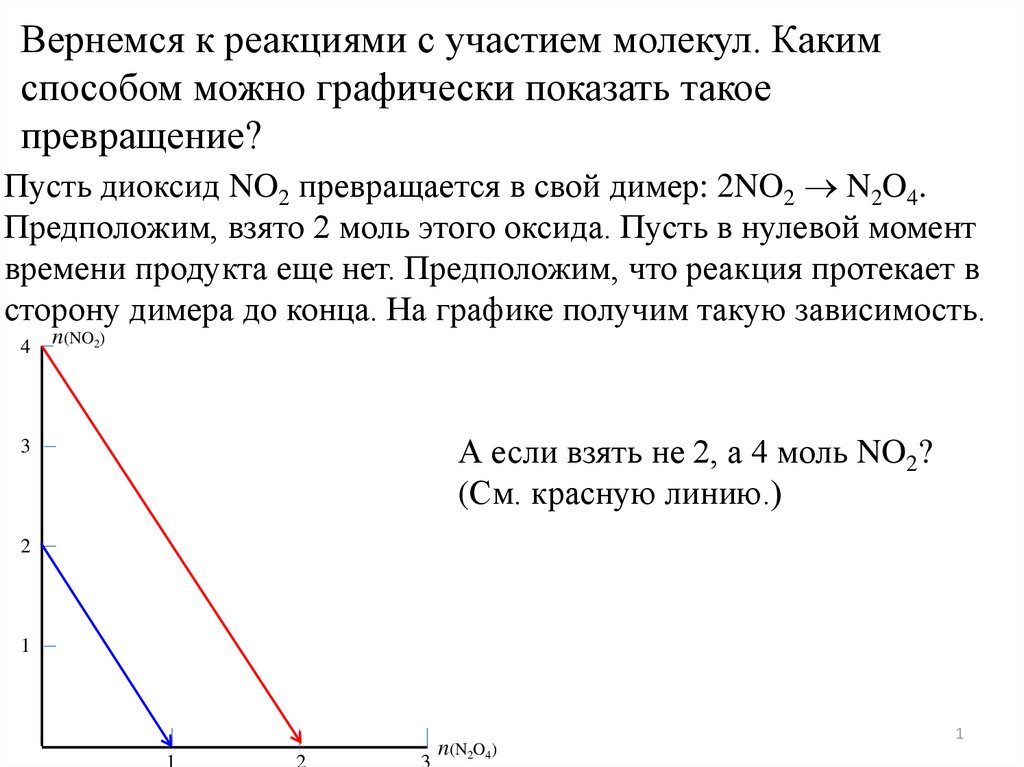
Вернемся к реакциями с участием молекул. Какимспособом можно графически показать такое
превращение?
Пусть диоксид NO2 превращается в свой димер: 2NO2 N2O4.
Предположим, взято 2 моль этого оксида. Пусть в нулевой момент
времени продукта еще нет. Предположим, что реакция протекает в
сторону димера до конца. На графике получим такую зависимость.
4
n(NO2)
А если взять не 2, а 4 моль NO2?
(См. красную линию.)
3
2
1
1
2
3
n(N2O4)
1
2.
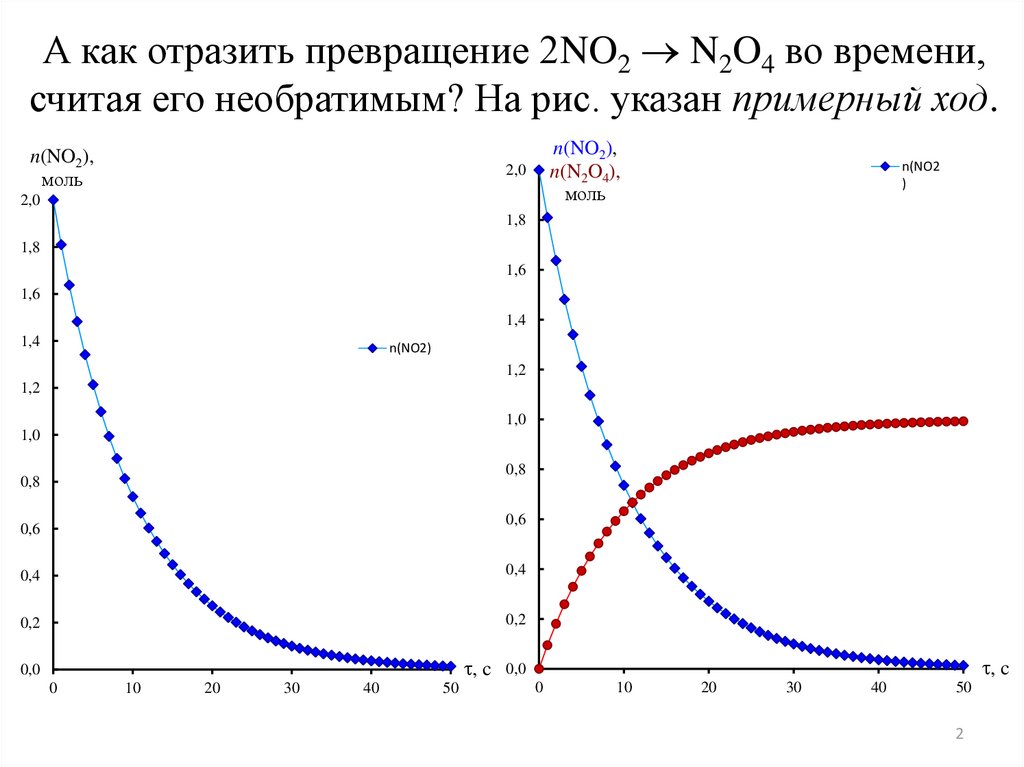
А как отразить превращение 2NO2 N2O4 во времени,считая его необратимым? На рис. указан примерный ход.
n(NO2),
моль
n(NO2),
n(N2O4),
моль
2,0
2,0
n(NO2
)
1,8
1,8
1,6
1,6
1,4
1,4
n(NO2)
1,2
1,2
1,0
1,0
0,8
0,8
0,6
0,6
0,4
0,4
0,2
0,2
t, c
0,0
0
10
20
30
40
50
t, c
0,0
0
10
20
30
40
50
2
3.
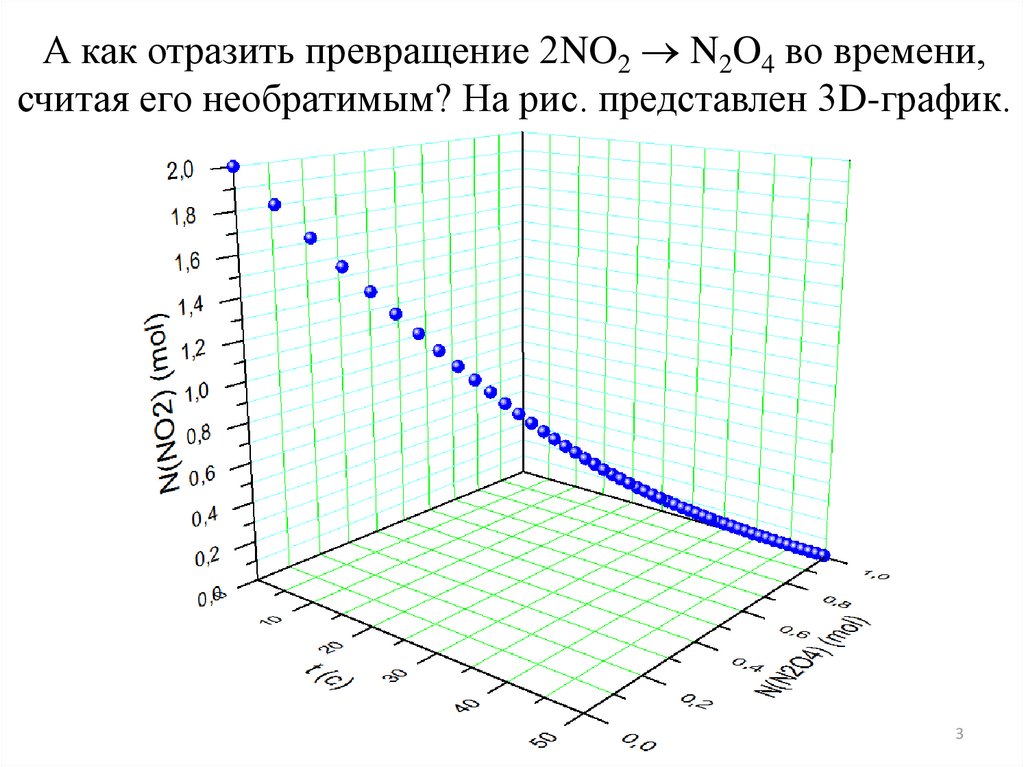
А как отразить превращение 2NO2 N2O4 во времени,считая его необратимым? На рис. представлен 3D-график.
3
4.
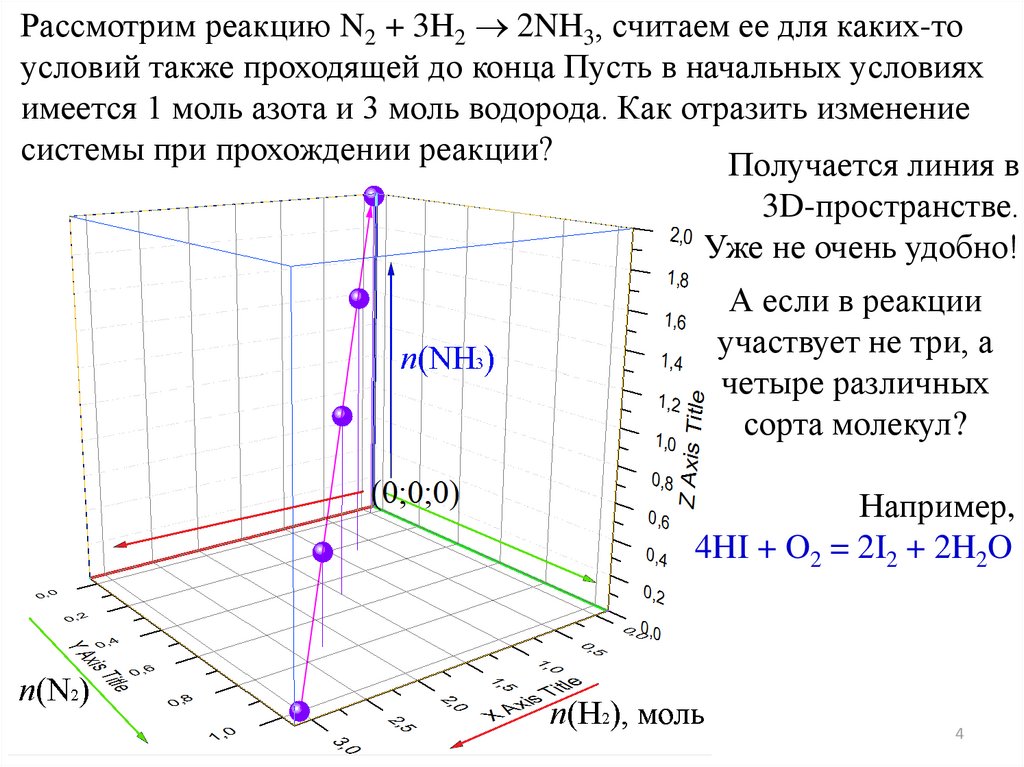
Рассмотрим реакцию N2 + 3H2 2NH3, считаем ее для каких-тоусловий также проходящей до конца Пусть в начальных условиях
имеется 1 моль азота и 3 моль водорода. Как отразить изменение
системы при прохождении реакции?
Получается линия в
3D-пространстве.
Уже не очень удобно!
А если в реакции
участвует не три, а
четыре различных
сорта молекул?
Например,
4HI + O2 = 2I2 + 2H2O
4
5.
Выход есть. Полезно введение химической переменнойПодметим, что для рассматриваемой реакции
4HI + O2 = 2I2 + 2H2O
отношение количества (т.е, числа моль) прореагировавших
или выделившихся веществ к соответствующим
стехиометрическим коэффициентам есть величина
постоянная
Так, для реакции
1A + 2B +... = 3D + 4E + ...
(она же 3D + 4E + ...− 1A − 2B − ... = 0 )
= (ni - ni )/ j; i = A, B…, j = 1, 2, …
Для нашего примера
= ¼ (n HI – nHI) = (n O2 – nO2) = ½ (nI2 – n I2) = ½ (nH2O–n H2O)
5
6.
Учение о химических процессах. Две части:1. Химическая термодинамика;
2. Химическая кинетика.
Химическая термодинамика – раздел химии о зависимости
направления и пределов превращений веществ от условий, в
которых эти вещества находятся. Рассматривается лишь начальное и
конечное состояние веществ. Не учитывается путь, по которому
протекает процесс и развитие во времени. Базовые вопросы т/д-ки:
какая теплота выделяется/поглощается; какая работа может быть
совершена; каково положение равновесия; каково направление
процесса (возможен или невозможен процесс в данном
направлении).
Химическая кинетика – раздел химии, в котором изучаются
закономерности протекания химических реакций во времени,
зависимости этих закономерностей от внешних условий, а также
механизмы химических превращений.
6
7.
Три основные части химической кинетики.1. Феноменологическая кинетика – описание зависимости
скорости реакции веществ от концентраций, температуры и
других внешних условий. Прямая задача кинетики: известны
схема (механизм) реакции и величины констант скорости.
Требуется найти скорости реакций и концентрации веществ при
известных условиях в известное время от начала реакции.
Обратная задача кинетики: Есть экспериментальные данные.
Надо найти механизм и кинетические характеристики (k, Ea, ...).
2. Теоретическая кинетика: вычисление кинетических
характеристик (k, Ea, ...) на основании теории строения вещества
и статистической физики.
3. Макрокинетика – решение кинетических задач в условиях
массо- и теплопереноса.
7
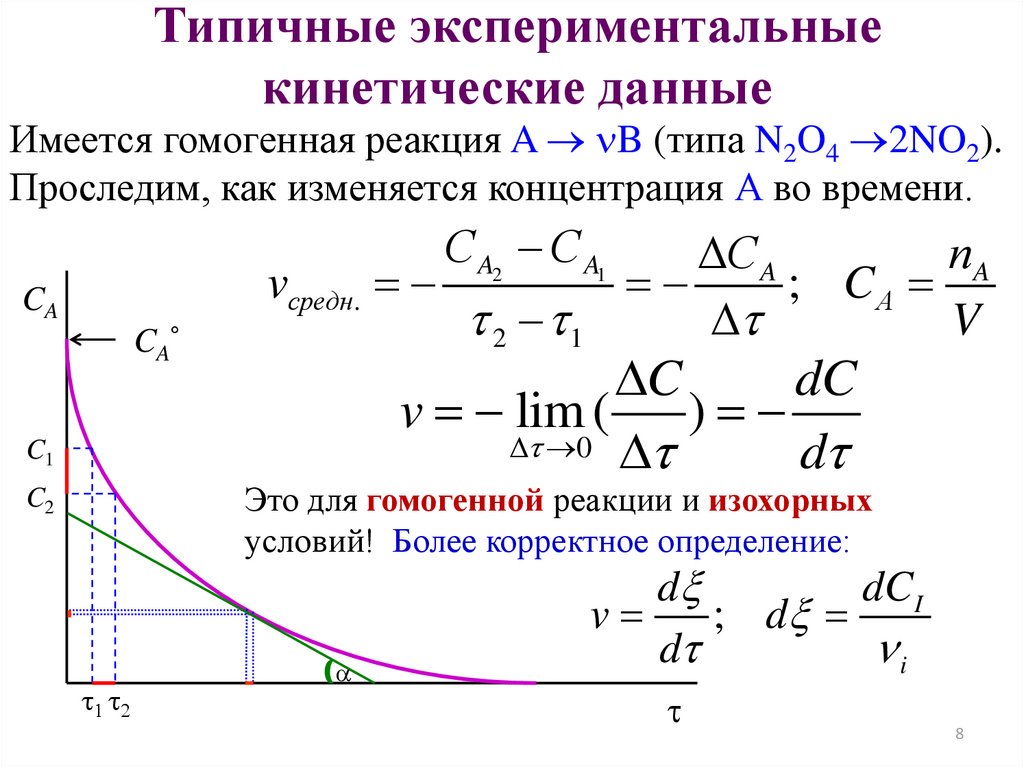
8.
Типичные экспериментальныекинетические данные
Имеется гомогенная реакция A B (типа N2O4 2NO2).
Проследим, как изменяется концентрация А во времени.
vсредн.
CA
CA
С A2 С A1
t 2 t1
С A
nA
; CA
t
V
C
dC
v lim (
)
t 0 t
dt
C1
Это для гомогенной реакции и изохорных
условий! Более корректное определение:
C2
t t
d
dCI
v
; d
dt
i
t
8



 chemistry
chemistry








