Similar presentations:
Кислоты, их классификация и свойства
1.
Приведите по два молекулярных уравненияреакций для следующих ионных:
+
2-
2H + S = H2S
+
3+
3H + Fe(OH)3 = Fe + 3H2O
Что общего в данных химических реакциях?
Происходят с участием кислот
2. Тема урока: Кислоты, их классификация и свойства
Урок химии в 8 классеУчитель: Черногорова Лариса Викторовна
МБОУ СШ № 31 г. Липецка
3. Что такое кислоты с позиции ТЭД?
Кислоты – это электролиты,+
диссоциирующие на катионы Н и анионы
кислотного остатка
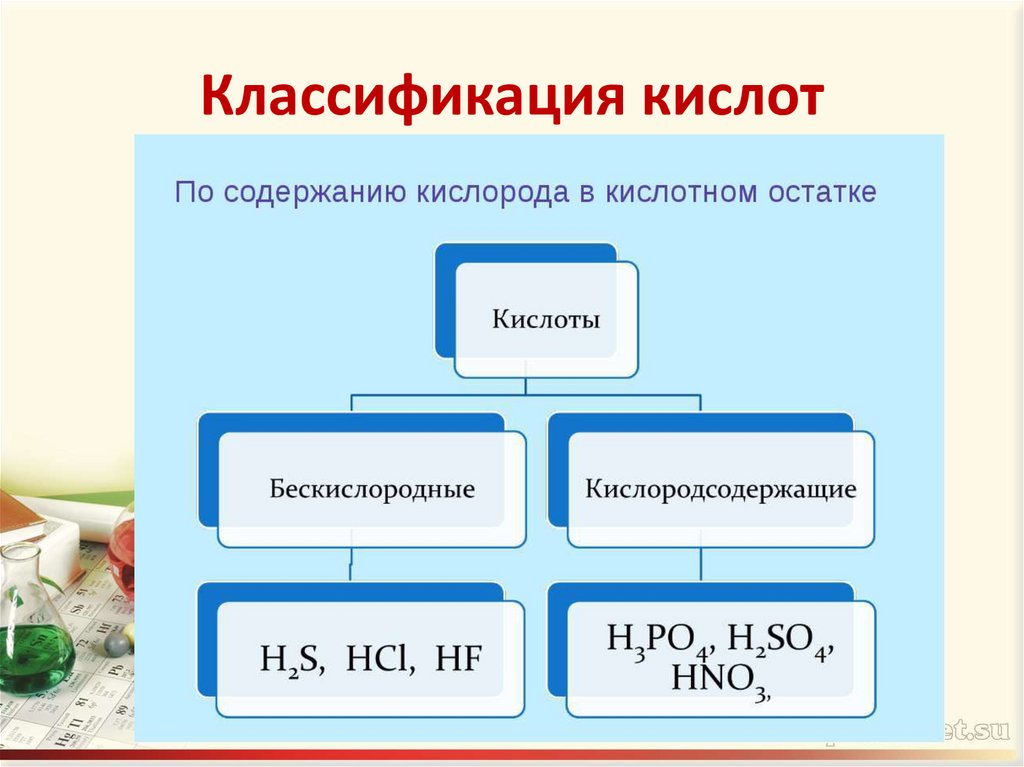
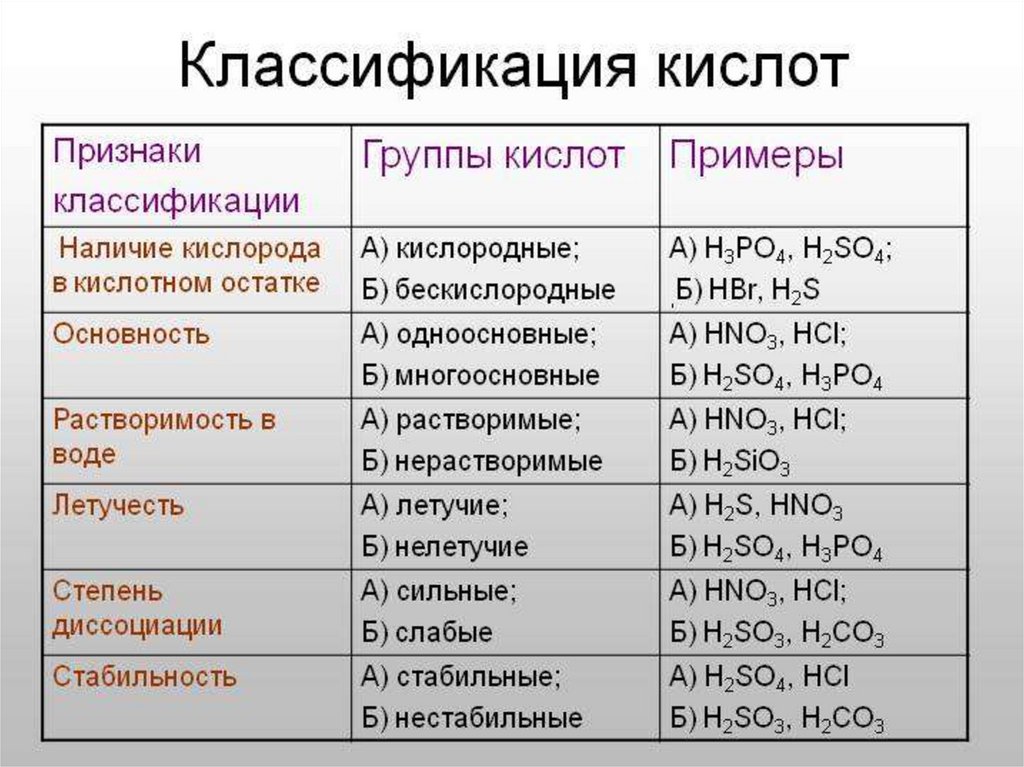
4. Классификация кислот
5.
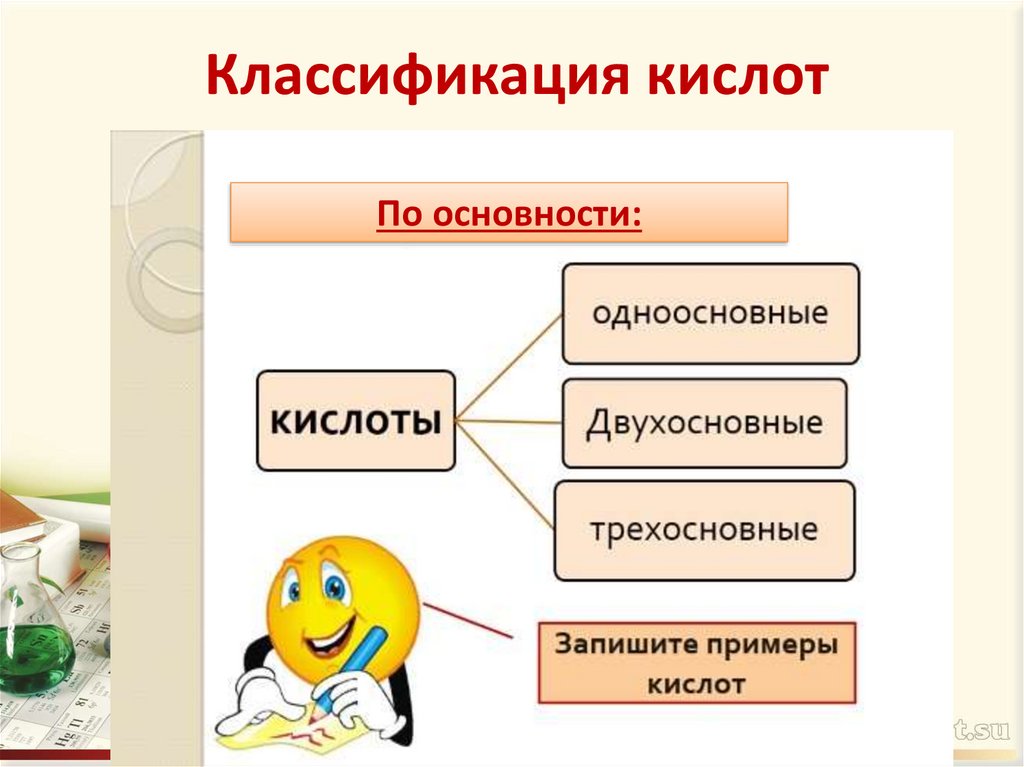
Классификация кислотПо основности:
6. Многоосновные кислоты диссоциируют ступенчато:
7.
8.
Какими бы разными ни быликислоты, все они образуют при ЭД
катионы водорода, которые
обусловливают их общие свойства:
• кислый вкус
•изменение окраски индикаторов
•взаимодействие с другими веществами
(химические свойства)
9.
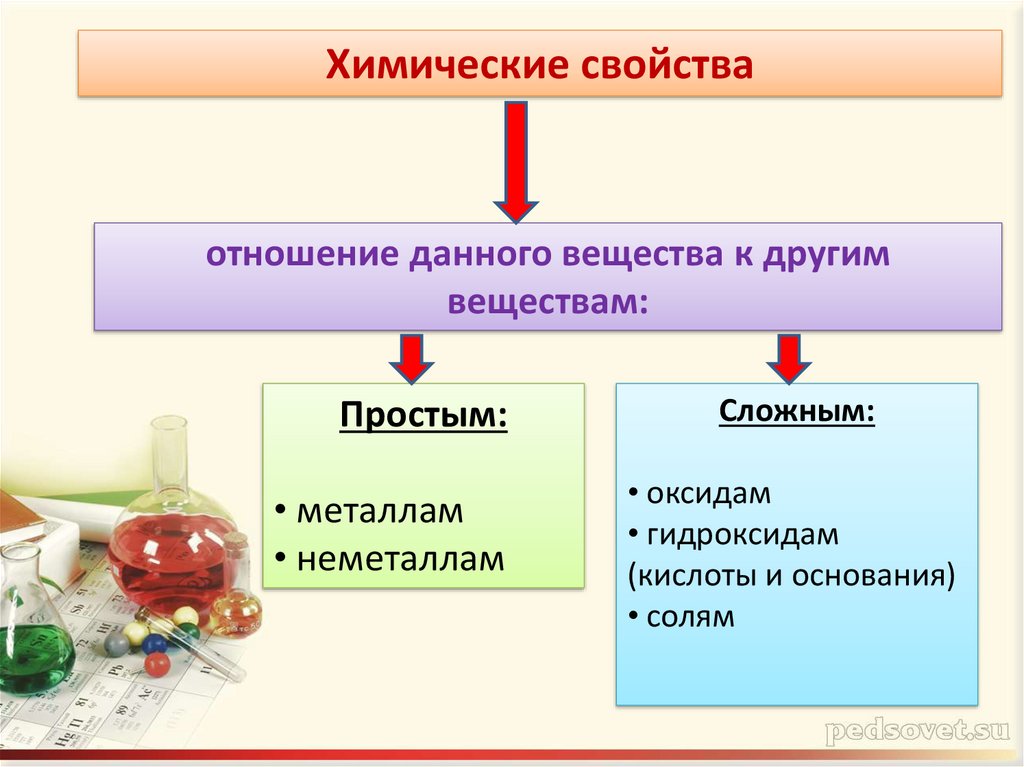
Химические свойстваотношение данного вещества к другим
веществам:
Простым:
• металлам
• неметаллам
Сложным:
• оксидам
• гидроксидам
(кислоты и основания)
• солям
10.
Взаимодействие кислот с металламиКислота + Ме → соль + Н2 (р. замещения)
1.
2.
3.
4.
Ме должен находиться в ряду напряжений до водорода;
Кислота должна быть растворимой;
Образующаяся соль должна быть растворимой;
Азотная кислота и серная концентрированная не
подчиняются данным правилам.
Zn + HCl →
Mg + H2SO4 (p-p) →
Al + H2SiO3 →
Cu + HNO3 →
11.
Взаимодействие кислот с оксидамиКислота + основный оксид → соль + вода
HCl + K2O →
H2SO4 + CaO →
HNO3 + CuO →
Кислота + амфотерный оксид → соль + вода
HCl + ZnO →
HNO3 + Al2O3 →
Реакции нейтрализации
12.
Взаимодействие кислот с основаниямиКислота + основание → соль + вода
(р. нейтрализации)
HCl + Ca(OH)2 →
H2SO4 + Cu(OH)2 →
13.
Взаимодействие кислот с солямиКислота + соль → новая кислота + новая соль
(р. обмена)
Условия протекания реакции: выпадение осадка
выделение газа
HCl + Na2CO3 →
H2SO4 + BaCl2 →
HNO3 + KCl →
14.
Домашнее заданиеУпр. № 4, №5
Шаблон презентации: http://pedsovet.su/load/420-1-0-29379










 chemistry
chemistry








