Similar presentations:
Азотная кислота
1.
2.
NaNO3 + H2SO4t
NaHSO4 + HNO3
3.
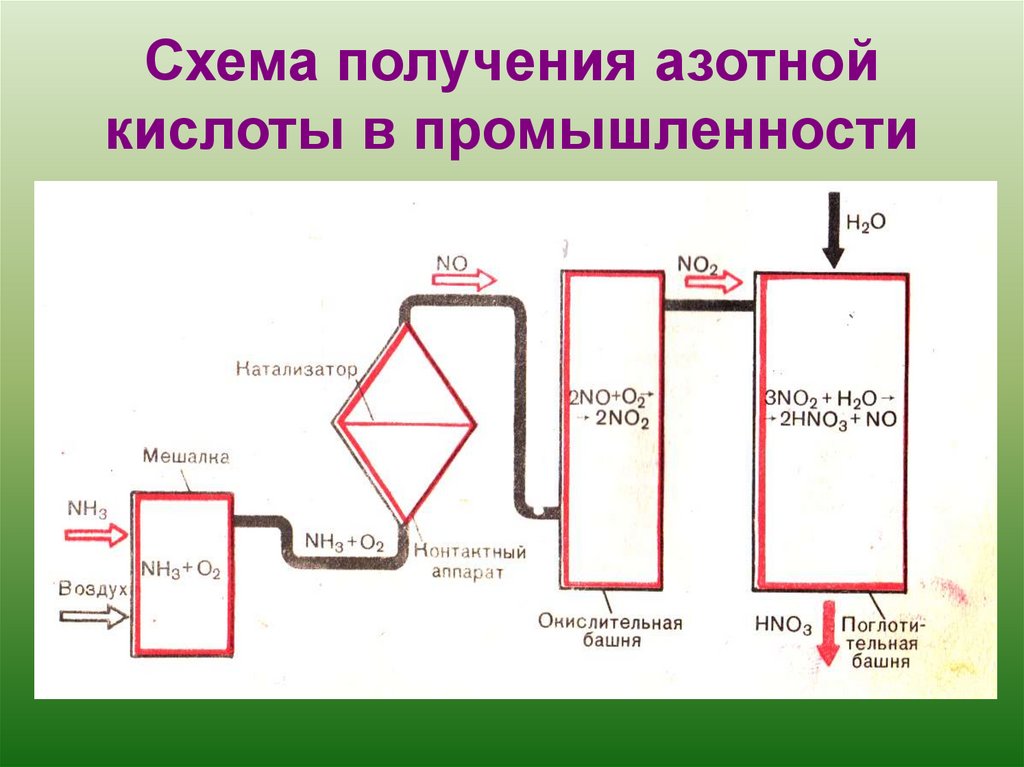
азотную кислоту получаютокислением аммиака кислородом воздуха в присутствии каталазатора.
По схеме напишите уравнения реакций получения азотной кислоты в промышленности.
4. Схема получения азотной кислоты в промышленности
5.
6.
1. Вследствие почти полной диссоциации азотнаякислота является сильной кислотой
• HNO3
H+ + NO3-
2. Реагирует с основными оксидами:
• СuO + 2HNO3
Cu(NO3)2 + H2O
3. Реагирует с основаниями:
• Fe(OH)3 + 3HNO3
Fe(NO3)3 + 3H2O
4. Реагирует с солями более слабых и более летучих кислот:
• NaCO3 + 2HNO3
2 NaNO3 + H2O + CO2
7.
1. При нагревании и под действием света концентрированная азотнаякислота разлагается:
4HNO3
t, свет 2H2O + 4 NO2 + O2
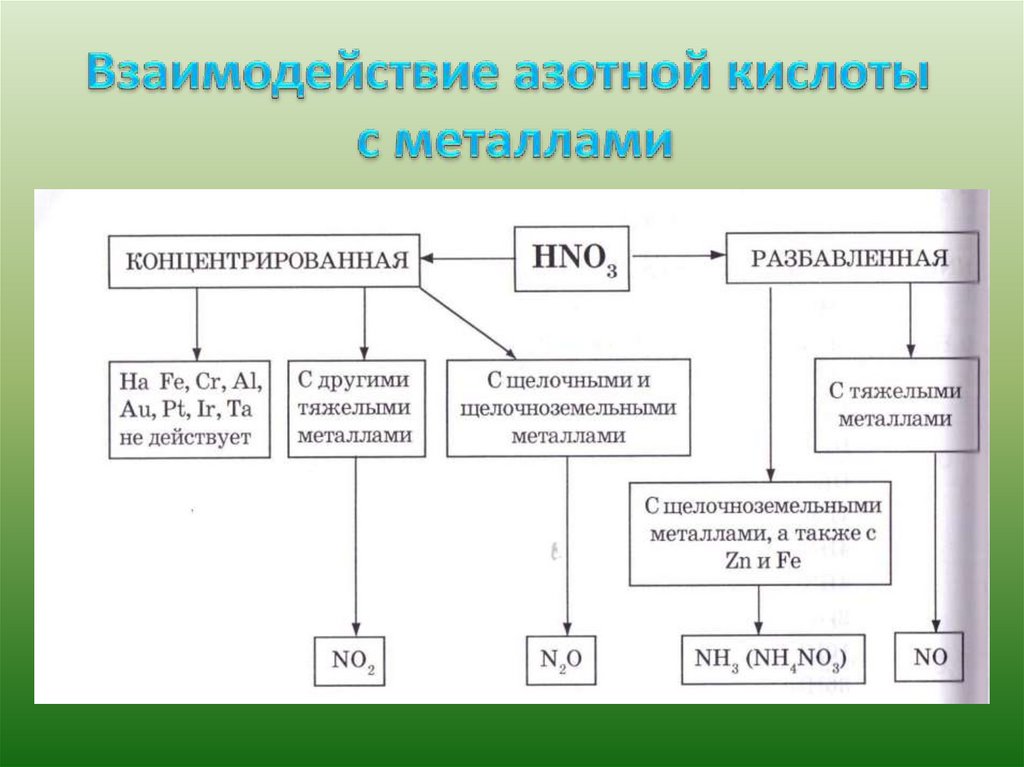
Вследствие этого азотная кислота является сильным окислителем:
а) тлеющая лучинка в нагретой б) скипидар и древесные опилки в
кислоте
концентрированной азотной кислоте концентрированной
воспламеняются.
загорается;
8.
9.
10.
11.
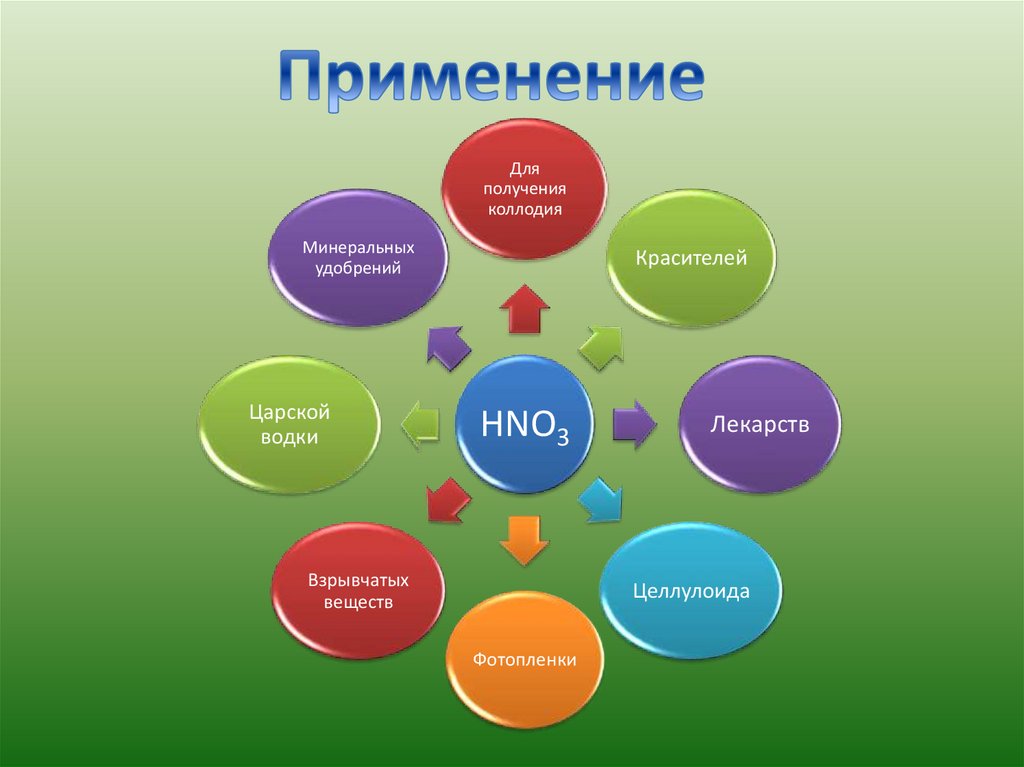
Дляполучения
коллодия
Минеральных
удобрений
Царской
водки
Красителей
HNO3
Взрывчатых
веществ
Лекарств
Целлулоида
Фотопленки
12.
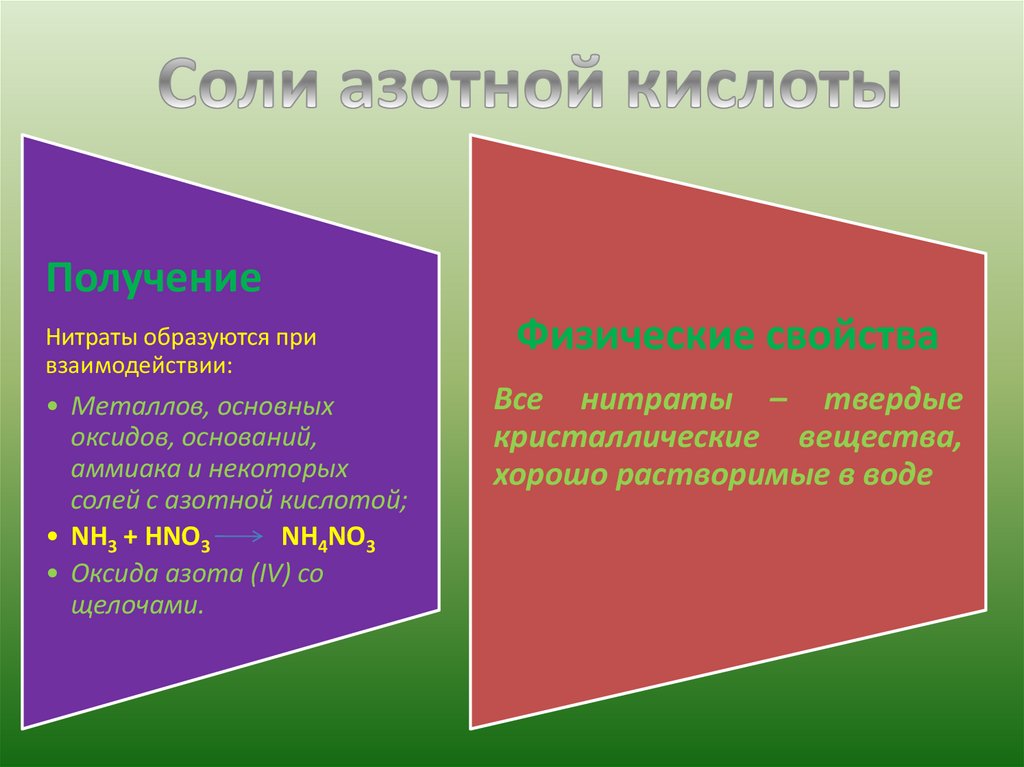
ПолучениеНитраты образуются при
взаимодействии:
• Металлов, основных
оксидов, оснований,
аммиака и некоторых
солей с азотной кислотой;
• NH3 + HNO3
NH4NO3
• Оксида азота (IV) со
щелочами.
Физические свойства
Все нитраты – твердые
кристаллические вещества,
хорошо растворимые в воде
13.
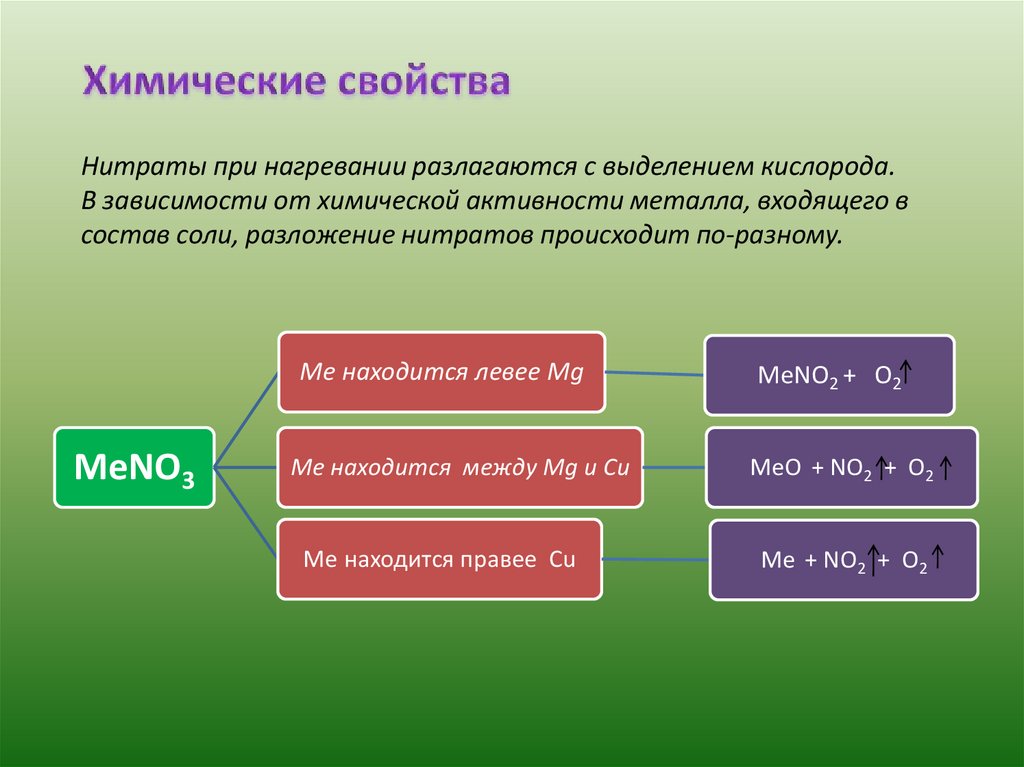
Нитраты при нагревании разлагаются с выделением кислорода.В зависимости от химической активности металла, входящего в
состав соли, разложение нитратов происходит по-разному.
Ме находится левее Mg
MeNO3
Ме находится между Mg и Сu
Ме находится правее Сu
MeNO2 + O2
MeO + NO2 + O2
Me + NO2 + O2








 chemistry
chemistry








