Similar presentations:
Кислоты. Классификация кислот
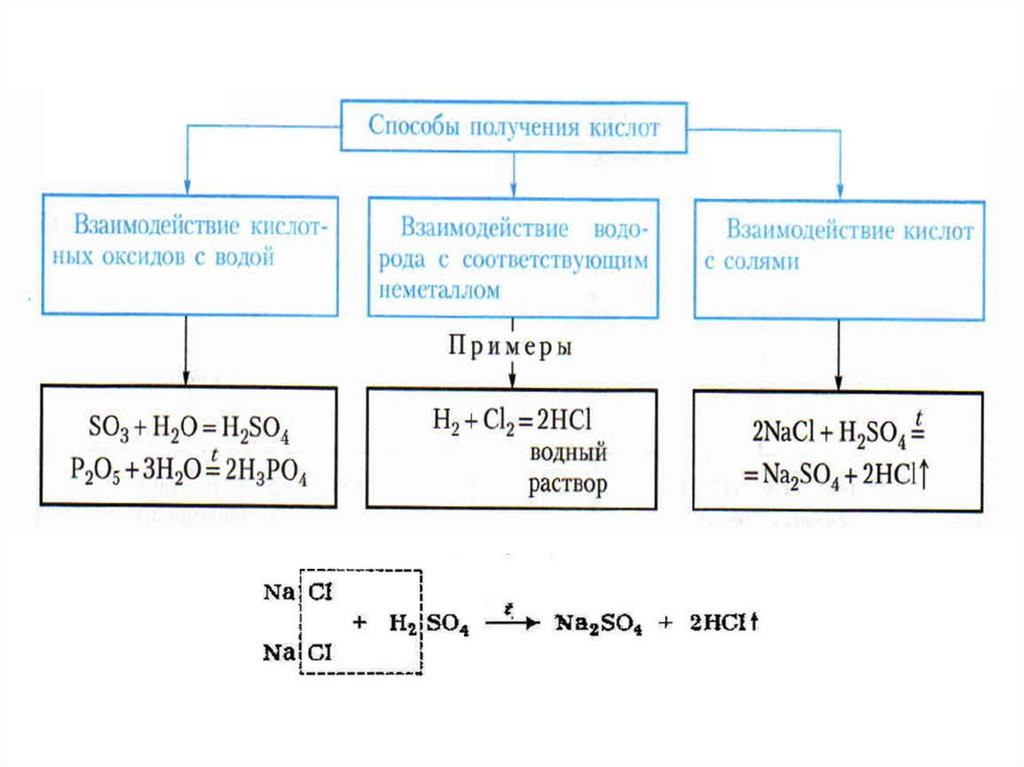
1. Кислоты
2.
3.
Кислоты — это сложные вещества, состоящие из атомов водорода,способных замещаться или обмениваться на атомы металлов, и кислотных
остатков.
Классификация кислот.
По составу кислоты делятся на кислородсодержащие и бескислородные, а по
числу атомов, водорода -- на одноосновные, двухосновные и трехосновные
4.
КЛАССИФИКАЦИЯ КИСЛОТ5.
Структурные формулы неорганических кислотсерная кислота
ортофосфорная кислота
6.
7.
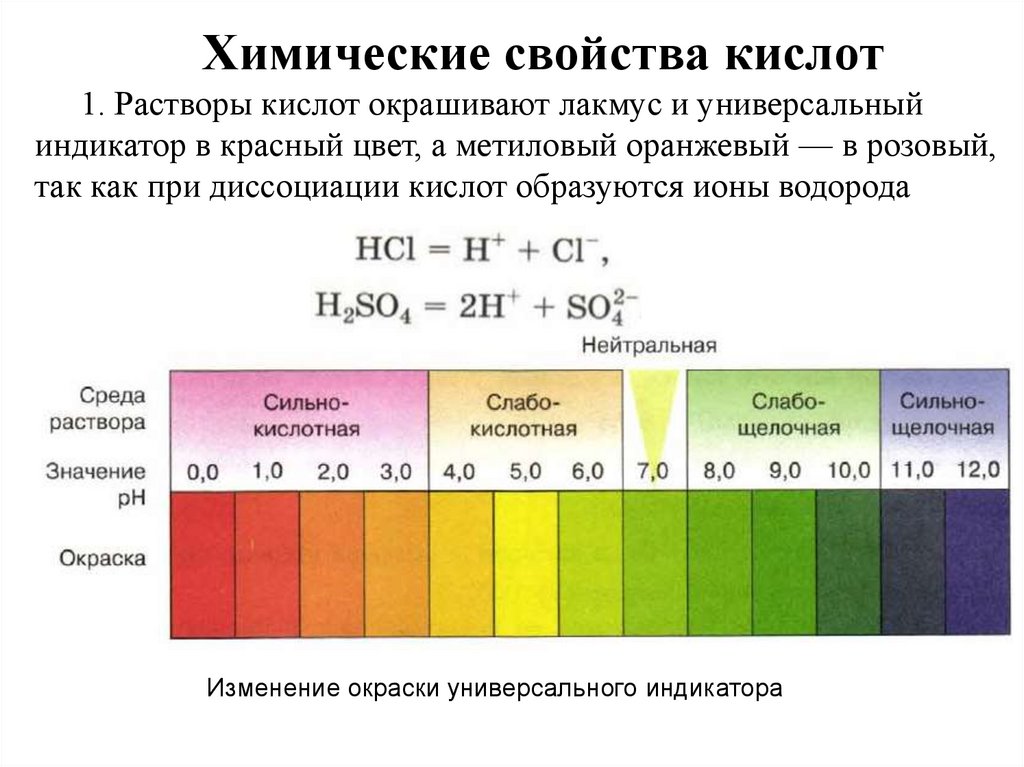
Химические свойства кислот1. Растворы кислот окрашивают лакмус и универсальный
индикатор в красный цвет, а метиловый оранжевый — в розовый,
так как при диссоциации кислот образуются ионы водорода
Изменение окраски универсального индикатора
8.
Химические свойства кислот2. Одно из важнейших химических свойств кислот — это их способность
реагировать с некоторыми металлами. В этих реакциях обычно выделяется водород и
образуются соли
Zn + 2HCI = ZnCl2 + Н2
Чтобы узнать, какие металлы вытесняют водород из кислот, можно
руководствоваться рядом активности металлов, который опытным путем (1865)
определил русский ученый Н, Н. Бекетов (1826—1911):
В этом ряду все металлы, стоящие до водорода,
способны вытеснить его из кислот. Исключением
является азотная кислота, при ее взаимодействии с
металлами вместо водорода выделяются другие газы.
9.
Взаимодействие цинкас раствором
соляной кислоты
Взаимодействие меди с
концентрированной азотной кислотой
10.
Химические свойства кислот3. Кислоты взаимодействуют с основными оксидами:
CuO + H2SО4= CuSО4 + Н2О
4. Кислоты вступают в реакции с основаниями:
NaOH + НС1 = NaCI + Н2О
5. Кислоты реагируют с солями:
ZnCl2 + H2SO4 = ZnSО4 + 2НС1
Реакции протекают согласно ряду вытесняемости кислот
Взаимодействие уксусной кислоты
с карбонатом кальция, входящим
в состав яичной скорлупы
6. Пpи нагревании некоторые кислоты разлагаются:
H2SiО3=H2О + SiO2.
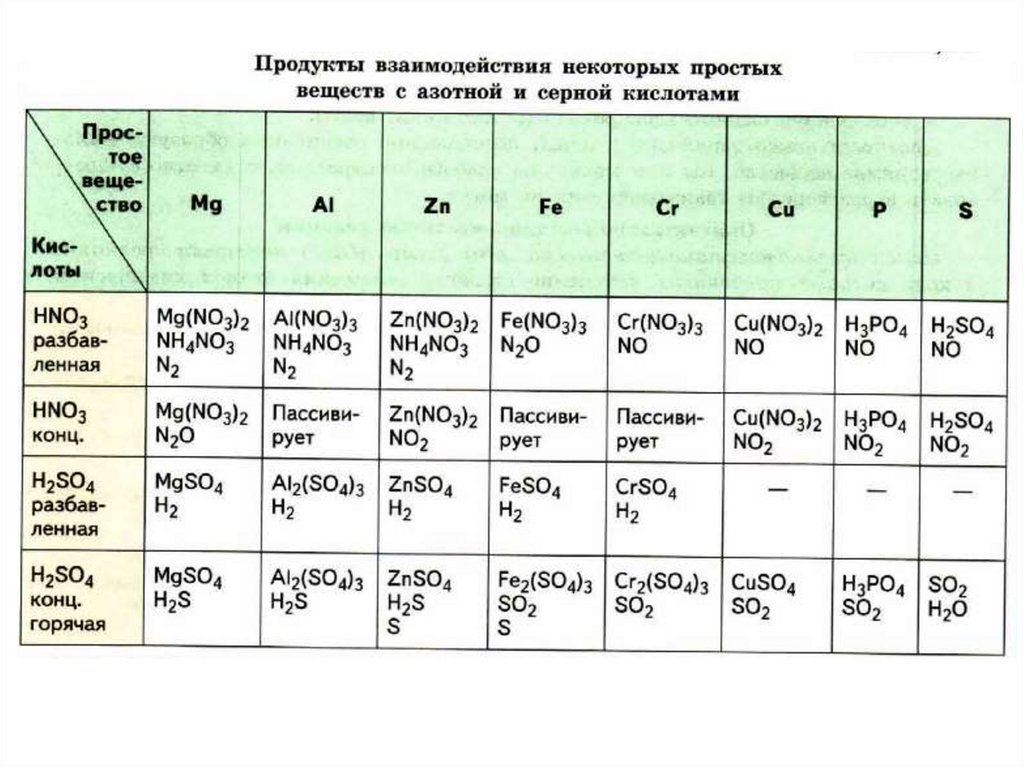
7. Взаимодействие некоторых неметаллов с кислотами-окислителями
11.
12.
8. Взаимодействие с органическими веществамиВзаимодействие сахара с концентрированной серной кислотой











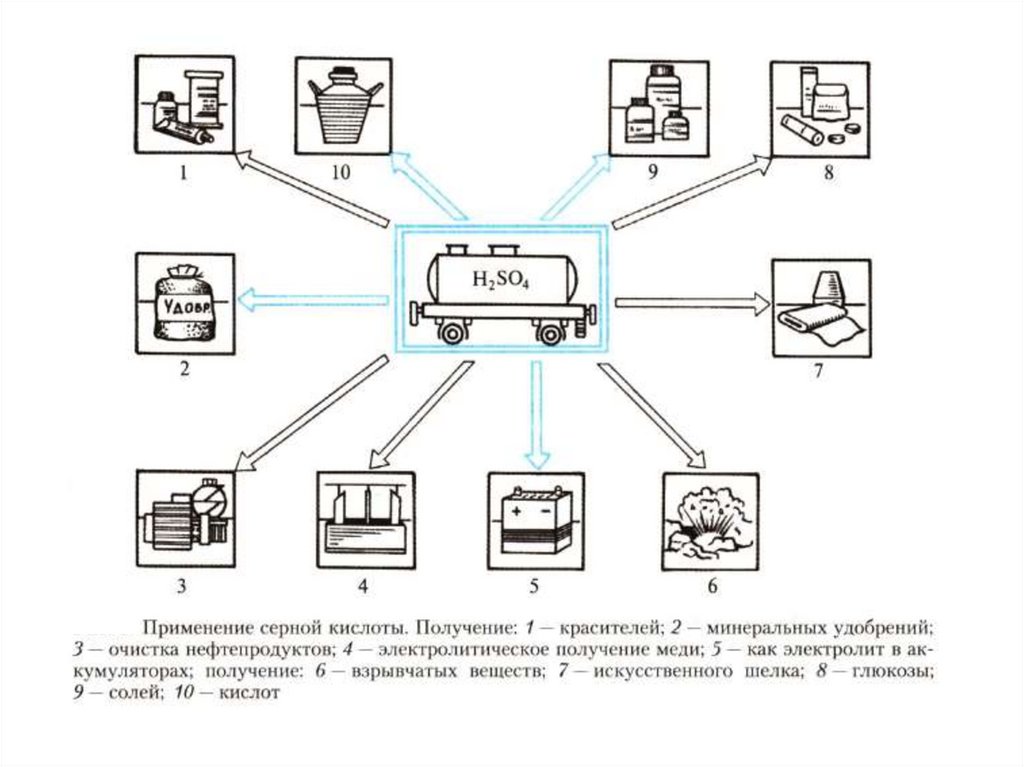

 chemistry
chemistry








